瞬时受体电位(transient receptor potential, TRP) 通道最初发现于果蝇光感受器中[1], 根据氨基酸序列同源性可分为7个亚家族: TRPC (canonical)、TRPV (vanilloid)、TRPM (melastatin)、TRPP (polycystin)、TRPML (mucolipin)、TRPA (ankyrin) 和TRPN (no mechanoreceptor potential C), 其中TRPN存在于蠕虫、果蝇和斑马鱼中, 但在哺乳动物中不表达[2]。TRPV2是TRPV通道家族的一种非选择性阳离子通道, 作为机械传感器、热传感器和脂质传感器[3], 在维持机体生理功能中发挥重要的作用。TRPV2可以被多种方式激活, 包括伤害性高温(> 52 ℃)、渗透压、机械力、化学刺激等[4]。最近, 提出了TRPV2的一种新的激活机制, 该机制依赖于H2O2、紫外线和细胞内活性氧(reactive oxygen species, ROS) 对其甲硫氨酸残基的氧化[5], 这表明该通道在应对环境和细胞氧化应激方面具有潜在的作用。生长因子、细胞因子、激素和内源性大麻素对TRPV2的刺激可诱导其从细胞质转移到细胞膜, 影响细胞增殖和死亡[6]。
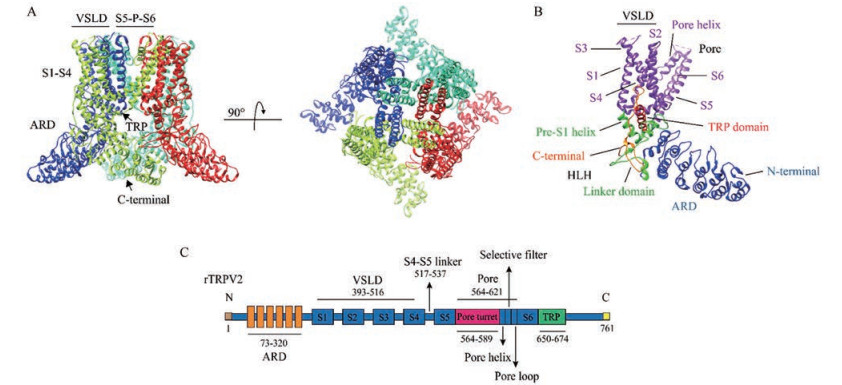
1 TRPV2通道的结构与特性TRPV2在细胞质膜中形成四聚体结构(图 1A), 其中每个亚基有一个较大的N末端细胞内结构域, 含有大约390个氨基酸, 其次是6个跨膜片段(S1~S6) 和一个C末端细胞内结构域。TRPV2的S1~S4螺旋形成电压感受结构域(voltage-sensor like domain, VSLD), S5与S6之间的短疏水肽链形成孔道区, 这两者通过螺旋接头连接, 称为S4~S5 linker。S5~S6段是TRPV2的孔和离子选择性过滤器, 而S1~S4段、N末端和C末端是调节通道门控特性的结构域[4, 7]。
|
Figure 1 Cryo-electron microscopy (Cryo-EM) structure of the transient receptor potential vanilloid ion channel subtypes 2 (TRPV2) ion channel. A: The atomic model of TRPV2 built from the EM density, showing four-fold-symmetric TRPV2 tetramer. Each protomer is presented by different color (PDB ID: 5AN8[9]); B: A view of the protomer domain of TRPV2 (PDB ID: 5AN8[9]); C: Cartoon diagram of the TRPV2 channel, and the corresponding amino acid positions of main domains. VSLD: Voltage-sensor like domain; S5-P-S6: The pore domain between S5 and S6 helix; ARD: Ankyrin repeat domain; HLH: Helix-loop-helix; N: N-terminal; C: C-terminal |
研究表明, TRPV2的三维结构与TRPV1相似。TRPV2存在着一个负责温度感知功能的连接域(linker domain), 同时又被称为膜近端域: Pro320-Leu373, 连接域定位于N端的锚蛋白重复域(ankyrin repeat domain, ARD) 和跨膜螺旋的连接处[8]。连接域的螺旋-环-螺旋(helix-loop-helix, HLH) 与S1前段螺旋(pre-S1-helix) 形成了一个“V”形摇篮(V-shaped cradle), 容纳着位于细胞膜与细胞质交界处的TRP结构域(图 1B)[9]。TRP结构域位于C末端, 夹在电压感受结构域与“V”形摇篮之间, 形成一个三明治结构, 主要负责通道的门控以及脱敏[10, 11]。在TRP结构域之后, C末端延伸至细胞质, 并缠绕在偶合结构域(包括连接域、S1前螺旋和C末端) 的β链周围, 而这个C末端的延伸环还可以与ARD的第6个重复片段相互作用[9]。Pumroy等[12]的研究表明, C末端延伸环与偶合结构域形成的界面具有高度的动态性, 在TRPV2敏化和活化的过程中, C末端经历了一个从线圈到螺旋的转变过程。该结构对于TRPV通道的功能非常重要, 因为在该区域的突变可以改变通道增敏和脱敏的特性[12]。
尽管TRPV通道的总体结构具有高度保守性, 然而孔转角(pore turret) 是TRPV通道最不保守的区域之一。TRPV2的pore turret位于S5螺旋和孔螺旋(pore helix) 之间(图 1C), 具有高度灵活性。针对pore turret截断型突变的TRPV2[9]以及树脂毒素(resiniferatoxin, RTx) 敏感型TRPV2[13]的研究表明, TRPV2的pore turret对于通道功能来说并不是必不可少的。大部分TRPV2的全长结构研究仍然难以解释该区域的构象[12], 研究人员推测该区域可能是一个垂直于脂质膜的构象[9, 13]。最近, Dosey等[14]对于TRPV2全长结构的研究表明, TRPV2的pore turret形成了一种平行于细胞膜的细胞外小叶的刚性结构, 但是多项研究都无法重现该结果[12, 15]。
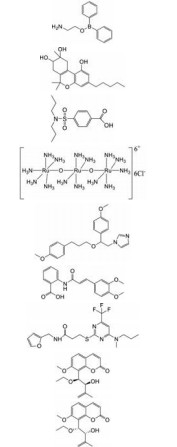
2 TRPV2通道调节剂发现的现状 2.1 调节剂的发现TRPV2调节剂的发现是该通道研究的一个热点, 但目前发现的调节剂相对较少, 大多缺乏特异性(表 1)[16]。已知的TRPV2激动剂有2-氨基乙酯二苯基硼酸(2-aminoethoxydiphenyl borate, 2-APB)、大麻素和丙磺舒(probenecid) 等。2-APB也可以激活TRPV1和TRPV3, 其次2-APB对TRPV2的作用具有物种依赖性, 人类TRPV2对2-APB不敏感[4]。鼠和人的TRPV2都可以被大麻素类化合物: (-)-反式-Δ9-四氢大麻酚[(-)-trans-Δ9-tetrahydrocannabidol, THC]、大麻二酚(cannabidiol, CBD)、大麻酚(cannabinol, CBN) 和∆9-四氢大麻酚(Δ9-tetrahydrocannabivarin, THCV) 激活。在表达鼠TRPV2的HEK-293细胞中, 效力强弱的排序为THC > CBD > THCV > CBN[17]。然而, 这些大麻素还可以激活其他TRP通道, 包括TRPV1、TRPA1和TRPM8。此外, 除了激动TRPV2, 丙磺舒也是有机阴离子转运蛋白(organic anion transporter, OAT) 的竞争性抑制剂[18]。先前报道的TRPV2抑制剂有钌红(ruthenium red)、SKF96365、曲尼司特(tranilast) 等, 但也都缺乏选择性。Ruthenium red可以抑制其他TRP通道, 包括TRPV1、TRPV3和TRPA1。SKF96365也阻断钾通道、低电压激活的T型钙通道和一些TRPCs通道[19]。Tranilast是一种抗过敏药物, 被认为是TRPV2的相对选择性抑制剂, 但它也参与其他生物途径, 一定程度限制了其用于阐明TRPV2的特定生理功能[20]。近年来, 发现了一些选择性相对较好的TRPV2抑制剂, 如SET-2和九里香素(-)-murraxocin及(+)-murraxocin[19, 21]。然而, 这些化合物抑制TRPV2的有效剂量较高, 选择性尚未得到更广泛的验证, 进一步发现高选择性的激动剂和抑制剂将为TRPV2通道的生理功能揭示、药理学应用和治疗开辟新的途径。
| Table 1 Summary of TRPV2 modulators. EC50: Half effective concentration; IC50: Half inhibitory concentration; 2-APB: 2-Aminoethoxydiphenyl borate; CBD: Cannabidiol |
近年来, 冷冻电镜的发展使多项研究能够阐明调节剂如何与TRPV2结合以及发挥作用的机制。香草酸类化合物对TRPV通道的激活是TRPV通道的标志之一, 大量的研究聚焦于阐明这类化合物的结合位点。然而, 香草酸类化合物如辣椒素和树脂毒素RTx等只能激动TRPV1, 而对高度同源的TRPV2没有作用。TRPV1的香草酸结合位点定位于通道的膜结合区域, 由VSLD的S3和S4、一个亚基的S4~S5 linker与相邻亚基的S5和S6螺旋组成[22]。Zhang等[23]发现把TRPV1香草酸结合位点附近的4个残基(Ser512、Met547、Thr550和Glu570) 对应替换到TRPV2中, 可以大大提高TRPV2对RTx的灵敏度, 而且这些突变并没有影响TRPV2的其他通道特性, 这说明TRPV2通道中存在着基本相同的香草酸激活机制。Zubcevic等[15]以RTx敏感型TRPV2作为研究对象, 进行了X射线晶体学和冷冻电镜结构研究, 结果表明在RTx的结合下, TRPV2通道形成了双重(C2) 对称构像, 尤其在上孔道区。当RTx与TRPV2结合时, RTx推动了S4~S5 linker和S5螺旋之间的π-螺旋铰链, 导致亚基旋转, 选择性过滤器拓宽。选择性过滤器的拓宽是因为S5中的Tyr542残基、孔螺旋中的Thr602残基以及S6中的Tyr627残基之间的氢键网络发生断裂, 孔螺旋得到释放并离开传导通路。然而, 在引入氢键断裂突变Thr602Ala后, TRPV2失去了对大的有机阳离子电导能力却不影响Na+的电导, 表明C2对称构象对大的阳离子渗透是非常重要的[15]。
研究发现, 来源于大麻的化合物大麻二酚CBD可以激活TRPV2[24]。Pumroy等[12]的研究表明, CBD结合的TRPV2有两种通道结构, 然而这两种构象都不是开放构象。CBD被认为是结合在相邻TRPV2亚基的S5和S6螺旋之间, 该结合位点嵌入膜中, 与疏水性和芳香族残基相连接。最近一项研究提出TRPV2的2-APB结合位点位于一个亚基的S5螺旋和两个相邻亚基的S4~S5 linker之间, 并且发现了一个关键的组氨酸残基, 即大鼠His521, 它位于S4~S5 linker的N端, 与两个芳香环配位, 可能参与稳定相邻亚基的S4~S5 linker和S5之间的相互作用[25]。
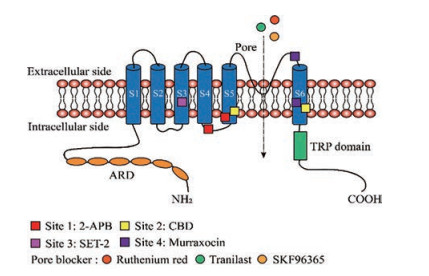
先前报道的几种TRPV2抑制剂如ruthenium red、SKF96365和tranilast等都是TRPV2孔阻断剂, 通过阻塞TRPV2的孔道区从而达到抑制TRPV2的作用(图 2)。运用结构和进化信息相结合的策略, Chai等[21]设计并合成了TRPV2的选择性抑制剂SET-2, 并阐明了SET-2与TRPV2的结合模式, 同时证明了SET-2结合于TRPV2的关键氨基酸残基Tyr466、Phe467、Glu525和Leu470, SET-2有望成为药物先导化合物以及有效工具探针。最近一项研究从九里香植物中发现两个TRPV2抑制剂: 九里香素(-)-murraxocin和(+)-murraxocin。分子对接和定点突变实验表明, Thr604、Ile605、Gly606、Met607和Tyr634可能是murraxocin抑制TRPV2的关键氨基酸[19]。
|
Figure 2 Schematic diagram of molecular structure and pharmacology of TRPV2. Different colored squares represent the TRPV2 binding sites by several compounds, and different colored balls represent the TRPV2 pore blockers |
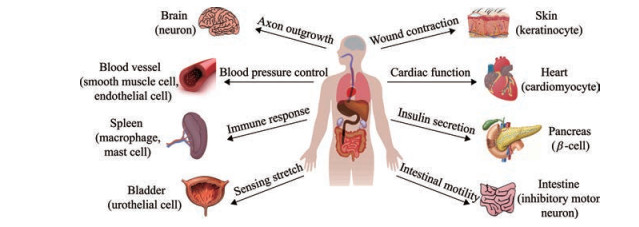
在神经系统中, TRPV2广泛分布于中枢与外周神经, 包括大脑、脊髓、三叉神经节和背根神经节(图 3)。在对大鼠脑部进行免疫染色发现, TRPV2在多个脑区神经元亚群中均具有丰富的表达[26]。在对小鼠神经发育的研究发现, TRPV2表达于感觉和运动神经元发育的早期阶段[27]。起初, TRPV2受体被认为是感觉神经元(> 52 ℃) 中的有害温度通道。然而, 缺乏TRPV2的小鼠表现出完整的热敏感性[28], 而人类TRPV2甚至是热不敏感的[4]。TRPV2在神经发生及神经突起分支中发挥重要的作用。发育中的神经元可以通过TRPV2感知膜拉伸, 随后的激活增强了轴突的生长, 其次, 通过TRPV2流入的Ca2+是增强轴突生长所必需的[27]。研究发现, 机械刺激能够激活TRPV2并促进发育中的神经元和PC12细胞的轴突生长[29]。siRNA敲除TRPV2导致神经生长因子诱导的神经突起生长减少[30]。近期一项研究表明, TRPV2调节肌动蛋白细胞骨架, 也与可溶性肌动蛋白相互作用, 证实TRPV2参与神经发生过程, 诱导神经突起起始、延伸和分支[31]。星形胶质细胞中TRPV2的阻断通过增加神经生长因子的合成和分泌, 从而改善氧糖剥夺后星形胶质细胞介导的神经保护作用[32]。小胶质细胞吞噬作用对中枢神经系统的发育至关重要, 一氧化氮(nitric oxide, NO) 通过蛋白激酶G (protein kinase G, PKG)/磷脂酰肌醇激酶(phosphoinositide 3-kinase, PI3K) 依赖性途径增加质膜上TRPV2的表达, 增强了小胶质细胞的吞噬作用[33]。
|
Figure 3 Expression and physiological function of TRPV2 channel |
TRPV2在调节免疫系统的各种类型细胞中表达, 并参与先天性和适应性免疫反应[24]。已发现该通道在CD34+造血干细胞中表达, 参与调节干细胞周期进程、生长和分化[34]。TRPV2对巨噬细胞迁移和吞噬作用至关重要。趋化肽fMet-Leu-Phe (fMLP) 能够通过诱导TRPV2通道向细胞膜的移位来促进小鼠TtT/M87巨噬细胞的迁移。这种作用被ruthenium red或转染siTRPV2阻断[35]。Link等[36]表明, 在TRPV2敲除鼠中, 巨噬细胞的吞噬作用受到损害。囊性纤维化患者的巨噬细胞吞噬功能受损可能是由于巨噬细胞中TRPV2信号传导缺陷, 导致了慢性炎症和感染[37]。肥大细胞对各种物理刺激产生反应, 包括高温、640 nm的激光和48 mW的光, 这些刺激会激活TRPV2引起肥大细胞脱颗粒[38]。然而, 有一项研究提出TRPV2不参与小鼠腹膜肥大细胞中钙依赖性促泌剂、热或渗透刺激引起的脱颗粒, 但这并不能排除在其他原发性肥大细胞中起作用的可能性[39]。此外, TRPV2在T细胞激活、增殖和效应器功能中协调Ca2+信号, 并且参与调节B细胞的发育过程[24]。
3.3 TRPV2与心血管系统TRPV2在心血管功能中发挥重要的作用。TRPV2在血管平滑肌细胞和血管内皮细胞中表达, 作为一个机械敏感通道, 参与调节血管紧张度及内皮细胞功能[40]。TRPV2也在心肌细胞中表达, 是维持心脏结构和功能的关键决定因素。Rubinstein等[41]首次报道TRPV2敲除小鼠的心脏功能下降。随后, Katanosaka等[42]发现, 在心脏特异性TRPV2敲除小鼠中, 支持与邻近肌细胞机械耦合的闰盘解体, 心室扩张, 心肌传导缺陷, 新生的心肌细胞不形成闰盘。Koch等[43]证明了在TRPV2功能性敲除小鼠中, TRPV2的缺失导致左心室肥厚显著减少, 表明TRPV2通过拉伸依赖机制调节心肌细胞肥大的发展以应对后负荷的增加。此外, TRPV2在人类心脏c-kit+祖细胞中大量表达, 参与调节细胞的增殖和迁移。慢病毒感染沉默TRPV2通过降低细胞周期蛋白cyclin D1、cyclin E、磷酸化细胞外信号调节激酶1/2 (phospho-extracellular regulated protein kinases 1/2, pERK1/2) 和磷酸化蛋白激酶B (phospho-protein kinase B, pAkt) 的表达从而抑制细胞增殖与迁移[44]。
然而在心肌病中, TRPV2质膜表达增强, 导致肌肉细胞内Ca2+持续增加, TRPV2的抑制可改善肌肉发育不良, 从而改善心脏功能和生存预后。已有研究表明, 几种新型TRPV2通道抑制剂可以抑制仓鼠营养不良性心肌细胞中异常增加的Ca2+内流, 改善心脏功能障碍及扩张型心肌病进程[45]。TRPV2抑制剂tranilast也可以有效治疗与肌营养不良相关的心肌病[46]。因此, “TRPV2抑制疗法”有望为与肌营养不良相关的心肌病开辟一种新的治疗策略。
3.4 TRPV2与内分泌系统胰腺中的TRPV2是胰岛素分泌正反馈机制和葡萄糖稳态的关键调节因子。TRPV2在小鼠胰岛细胞和胰岛素瘤β细胞系MIN6细胞中高表达[47]。在非刺激条件下, TRPV2主要位于细胞质内。利用胰岛素样生长因子1 (insulin-like growth factors-1, IGF-1) 刺激细胞后, TRPV2转移到细胞膜, 并引起钙内流, 增加的钙进入促进胰岛素分泌, 高浓度葡萄糖也诱导TRPV2移位到细胞膜[48]。此外, 抗衰老基因Klotho可能通过上调TRPV2的细胞膜水平来增强葡萄糖诱导的胰岛素分泌[49]。胰高血糖素样肽-1 (glucagon-like peptide-1, GLP-1) 是一种增加葡萄糖诱导的胰岛素分泌的激素。研究表明, 溶血磷脂酰肌醇(lysophosphatidylinositol, LPI) 诱导的TRPV2激活触发小鼠肠内分泌L细胞系GLUTag中GLP-1的分泌[50]。最近一项研究提出, TRPV2通道介导小鼠胰腺细胞肿胀诱导的胰岛素分泌。低渗刺激和葡萄糖刺激诱导的细胞肿胀激活了小鼠β细胞中的TRPV2, 从而引起膜去极化并随后激活电压依赖性Ca2+通道和胰岛素的分泌[51]。
此外, TRPV2也参与调控糖尿病的病理生理进程。一项研究检测了TRPV2的rs14039和rs4792742基因多态性对2型糖尿病(type 2 diabetes mellitus, T2DM)、桥本甲状腺炎(Hashimoto thyroiditis, HT) 以及T2DM+HT共病的影响。结果显示, TRPV2基因型rs14039显著增加了T2DM+HT和HT障碍的发展风险, 可能导致这些疾病发展的易感性。相反, rs4792742基因型对HT和T2DM+HT共病有很强的保护作用[52]。
3.5 TRPV2与癌症TRPV2在不同类型的癌症中表现出致癌活性, 与介导细胞存活、增殖、迁移、血管生成和侵袭信号通路有关[53]。TRPV2在一些类型的癌症和肿瘤细胞细胞系中过度表达。在前列腺癌中, TRPV2的激活促进了小鼠癌细胞的迁移, 其次, TRPV2的敲除降低了癌细胞的生长速度[54]。然而在胶质瘤干细胞(glioma stem cells, GSCs) 中, TRPV2的表达与小鼠肿瘤细胞的增殖呈负相关。当TRPV2被阻断或敲除时, GSC的增殖加速。相反, TRPV2的过度表达会减少增殖并促进分化[55]。大麻二酚CBD通过激活TRPV2触发GSC分化, 从而激活细胞自噬过程并抑制GSC增殖和克隆形成能力[56], 这种作用在子宫内膜癌中也被发现[57]。在膀胱癌中观察到TRPV2的过表达, CBD治疗可诱导人膀胱尿路上皮癌细胞凋亡[58]。在乳腺癌中, TRPV2高表达与三阴性乳腺癌患者较高的无复发生存率相关[59]。在食管鳞状细胞癌中, TRPV2通过影响WNT/β-catenin或基底细胞癌信号传导来调节癌症的进展, TRPV2的高表达与患者不良预后有关[60]。在肝癌中, TRPV2的表达与门静脉侵袭和肿瘤干细胞表达的减少有关[61]。在骨髓瘤中, TRPV2过表达与患者骨组织损伤和不良预后相关[62]。这些发现证实了TRPV2是癌症生物标志物, 并为探索TRPV2作为癌症新治疗靶点开辟了新的前景。
3.6 其他膀胱尿路上皮的TRPV2参与膀胱的机械感知, 可以感知尿液体积和渗透压的变化[63]。TRPV2参与肠运动的调节, 有助于体内胃肠道转运。TRPV2的激活诱导肠道抑制性运动神经元释放NO, 从而放松肠道张力[64]。TRPV2也表达于人类肾脏足细胞中, 并被认为在调节肾功能方面也发挥作用[65]。在皮肤中, TRPV2通道抑制剂SKF96365和tranilast能有效抑制TGF-β1介导的皮肤成纤维细胞的分化和收缩, 改善伤口挛缩与疤痕形成[66]。此外, TRPV2对维持小鼠棕色脂肪组织的产热功能至关重要。在棕色脂肪细胞中, 由于膜拉伸引起的TRPV2激活对于防止棕色脂肪细胞过度分化和维持生理功能可能是必需的[67], 缺乏TRPV2会损害小鼠棕色脂肪组织的产热功能[68]。因此, 调节TRPV2的功能可能是预防和抵抗人类肥胖和相关代谢紊乱的一种新的治疗方法。
4 总结与展望本文综述了TRPV2通道的结构、调节剂的发现及生理功能的最新进展。目前, TRPV2生理功能的研究仍存在许多问题。首先, TRPV2的胞内转运非常复杂, 受到各种刺激因素的主动调节, 这一特性为TRPV2的研究增加了不确定性。其次, TRPV2敲除小鼠观察到的异常表型并不多, 表现出正常的热和机械伤害感受, 但这并不排除TRPV2参与许多系统的生理功能的可能性。原因可能是TRPV家族其他成员例如TRPV1和TRPV4, 以及其他类型TRP通道的补偿作用。TRPV2敲除小鼠易受围产期致死的影响。在TRPV2敲除小鼠中观察到的胚胎异常和围产期致死增加可能是异常的神经元发育、先天免疫受损以及心脏功能下降等多方面的原因。最后, 选择性调节剂的缺乏使得TRPV2在许多系统中的生理功能较难评估。现有的工作大部分是使用基因敲除手段或者使用非特异性激动剂和抑制剂。因此, 以高通量筛选的方式发现并鉴定TRPV2的选择性调节剂非常必要。特异性调节剂的发现将有助于TRPV2功能和机制上的研究, 并为TRPV2作为各种类型疾病的新治疗靶点开辟新的前景。
作者贡献: 薛淑文负责查阅文献、撰写及修改草稿; 张凡指导手稿撰写并修改草稿; 曹征宇对论文的内容提出指导与修改意见。
利益冲突: 本论文所有作者均声明不存在利益冲突。
| [1] |
Minke B. Drosophila mutant with a transducer defect[J]. Biophys Struct Mech, 1977, 3: 59-64. DOI:10.1007/BF00536455 |
| [2] |
Nilius B, Owsianik G, Voets T, et al. Transient receptor potential cation channels in disease[J]. Physiol Rev, 2007, 87: 165-217. DOI:10.1152/physrev.00021.2006 |
| [3] |
Gorbunov AS, Maslov LN, Jaggi AS, et al. Physiological and pathological role of TRPV1, TRPV2 and TRPV4 channels in heart[J]. Curr Cardiol Rev, 2019, 15: 244-251. DOI:10.2174/1573403X15666190307112326 |
| [4] |
Kojima I, Nagasawa M. TRPV2 [M] // Nilius B, Flockerzi V. Mammalian Transient Receptor Potential (TRP) Cation Channels (Handbook of Experimental Pharmacology, volume 222). Switzerland: Springer International Publishing, 2014: 247-272.
|
| [5] |
Fricke TC, Echtermeyer F, Zielke J, et al. Oxidation of methionine residues activates the high-threshold heat-sensitive ion channel TRPV2[J]. Proc Natl Acad Sci U S A, 2019, 116: 24359-24365. DOI:10.1073/pnas.1904332116 |
| [6] |
Liberati S, Morelli MB, Amantini C, et al. Advances in transient receptor potential vanilloid-2 channel expression and function in tumor growth and progression[J]. Curr Protein Pept Sci, 2014, 15: 732-737. DOI:10.2174/1389203715666140704115913 |
| [7] |
Zubcevic L. Temperature-sensitive transient receptor potential vanilloid channels: structural insights into ligand-dependent activation[J]. Br J Pharmacol, 2020. DOI:10.1111/bph.15310 |
| [8] |
Yao J, Liu B, Qin F. Modular thermal sensors in temperature-gated transient receptor potential (TRP) channels[J]. Proc Natl Acad Sci U S A, 2011, 108: 11109-11114. DOI:10.1073/pnas.1105196108 |
| [9] |
Zubcevic L, Herzik MA, Chung BC, et al. Cryo-electron microscopy structure of the TRPV2 ion channel[J]. Nat Struct Mol Biol, 2016, 23: 180-186. DOI:10.1038/nsmb.3159 |
| [10] |
Gregorio-Teruel L, Valente P, Liu B, et al. The integrity of the TRP domain is pivotal for correct TRPV1 channel gating[J]. Biophys J, 2015, 109: 529-541. DOI:10.1016/j.bpj.2015.06.039 |
| [11] |
Ufret-Vincenty CA, Klein RM, Hua L, et al. Localization of the PIP2 sensor of TRPV1 ion channels[J]. J Biol Chem, 2011, 286: 9688-9698. DOI:10.1074/jbc.M110.192526 |
| [12] |
Pumroy RA, Samanta A, Liu Y, et al. Molecular mechanism of TRPV2 channel modulation by cannabidiol[J]. Elife, 2019, 8: e48792. DOI:10.7554/eLife.48792 |
| [13] |
Zubcevic L, Le S, Yang H, et al. Conformational plasticity in the selectivity filter of the TRPV2 ion channel[J]. Nat Struct Mol Biol, 2018, 25: 405-415. DOI:10.1038/s41594-018-0059-z |
| [14] |
Dosey TL, Wang Z, Fan G, et al. Structures of TRPV2 in distinct conformations provide insight into role of the pore turret[J]. Nat Struct Mol Biol, 2019, 26: 40-49. DOI:10.1038/s41594-018-0168-8 |
| [15] |
Zubcevic L, Hsu AL, Borgnia MJ, et al. Symmetry transitions during gating of the TRPV2 ion channel in lipid membranes[J]. Elife, 2019, 8: e45779. DOI:10.7554/eLife.45779 |
| [16] |
Cao NK, Lü HN, Wei NN, et al. Natural modulators of transient receptor potential channels[J]. Acta Pharm Sin (药学学报), 2017, 52: 673-684. |
| [17] |
De Petrocellis L, Ligresti A, Moriello AS, et al. Effects of cannabinoids and cannabinoid-enriched cannabis extracts on TRP channels and endocannabinoid metabolic enzymes[J]. Br J Pharmacol, 2011, 163: 1479-1494. DOI:10.1111/j.1476-5381.2010.01166.x |
| [18] |
Robbins N, Koch SE, Tranter M, et al. The history and future of probenecid[J]. Cardiovasc Toxicol, 2012, 12: 1-9. DOI:10.1007/s12012-011-9145-8 |
| [19] |
Zhou Q, Shi Y, Qi H, et al. Identification of two natural coumarin enantiomers for selective inhibition of TRPV2 channels[J]. FASEB J, 2020, 34: 12338-12353. DOI:10.1096/fj.201901541RRR |
| [20] |
Darakhshan S, Pour AB. Tranilast: a review of its therapeutic applications[J]. Pharmacol Res, 2015, 91: 15-28. DOI:10.1016/j.phrs.2014.10.009 |
| [21] |
Chai H, Cheng X, Zhou B, et al. Structure-based discovery of a subtype-selective inhibitor targeting a transient receptor potential vanilloid channel[J]. J Med Chem, 2019, 62: 1373-1384. DOI:10.1021/acs.jmedchem.8b01496 |
| [22] |
Gao Y, Cao E, Julius D, et al. TRPV1 structures in nanodiscs reveal mechanisms of ligand and lipid action[J]. Nature, 2016, 534: 347-351. DOI:10.1038/nature17964 |
| [23] |
Zhang F, Hanson SM, Jara-Oseguera A, et al. Engineering vanilloid-sensitivity into the rat TRPV2 channel[J]. Elife, 2016, 5: e16409. DOI:10.7554/eLife.16409 |
| [24] |
Qin N, Neeper MP, Liu Y, et al. TRPV2 is activated by cannabidiol and mediates CGRP release in cultured rat dorsal root ganglion neurons[J]. J Neurosci, 2008, 28: 6231-6238. DOI:10.1523/JNEUROSCI.0504-08.2008 |
| [25] |
Protopopova AD, Pumroy RA, de la Roche J, et al. TRPV2 interaction with small molecules and lipids revealed by cryo-EM[J]. bioRxiv, 2020. DOI:10.1101/2020.08.10.242008 |
| [26] |
Nedungadi TP, Dutta M, Bathina CS, et al. Expression and distribution of TRPV2 in rat brain[J]. Exp. Neurol, 2012, 237: 223-237. DOI:10.1016/j.expneurol.2012.06.017 |
| [27] |
Shibasaki K, Murayama N, Ono K, et al. TRPV2 enhances axon outgrowth through its activation by membrane stretch in developing sensory and motor neurons[J]. J Neurosci, 2010, 30: 4601-4612. DOI:10.1523/JNEUROSCI.5830-09.2010 |
| [28] |
Park U, Vastani N, Guan Y, et al. TRP vanilloid 2 knock-out mice are susceptible to perinatal lethality but display normal thermal and mechanical nociception[J]. J Neurosci, 2011, 31: 11425-11436. DOI:10.1523/JNEUROSCI.1384-09.2011 |
| [29] |
Sugio S, Nagasawa M, Kojima I, et al. Transient receptor potential vanilloid 2 activation by focal mechanical stimulation requires interaction with the actin cytoskeleton and enhances growth cone motility[J]. FASEB J, 2017, 31: 1368-1381. DOI:10.1096/fj.201600686RR |
| [30] |
Cohen MR, Johnson WM, Pilat JM, et al. Nerve growth factor regulates transient receptor potential vanilloid 2 via extracellular signal-regulated kinase signaling to enhance neurite outgrowth in developing neurons[J]. Mol Cell Biol, 2015, 35: 4238-4252. DOI:10.1128/MCB.00549-15 |
| [31] |
Yadav M, Goswami C. TRPV2 interacts with actin and reorganizes submembranous actin cytoskeleton[J]. Biosci Rep, 2020, 40: BSR20200118. DOI:10.1042/BSR20200118 |
| [32] |
Zhang H, Xiao J, Hu Z, et al. Blocking transient receptor potential vanilloid 2 channel in astrocytes enhances astrocyte-mediated neuroprotection after oxygen-glucose deprivation and reoxygenation[J]. Eur J Neurosci, 2016, 44: 2493-2503. DOI:10.1111/ejn.13352 |
| [33] |
Maksoud MJE, Tellios V, An D, et al. Nitric oxide upregulates microglia phagocytosis and increases transient receptor potential vanilloid type 2 channel expression on the plasma membrane[J]. Glia, 2019, 67: 2294-2311. DOI:10.1002/glia.23685 |
| [34] |
Resende RR, Adhikari A, da Costa JL, et al. Influence of spontaneous calcium events on cell-cycle progression in embryonal carcinoma and adult stem cells[J]. Biochim Biophys Acta, 2010, 1803: 246-260. DOI:10.1016/j.bbamcr.2009.11.008 |
| [35] |
Nagasawa M, Nakagawa Y, Tanaka S, et al. Chemotactic peptide fMetLeuPhe induces translocation of the TRPV2 channel in macrophages[J]. J Cell Physiol, 2007, 210: 692-702. DOI:10.1002/jcp.20883 |
| [36] |
Link TM, Park U, Vonakis BM, et al. TRPV2 has a pivotal role in macrophage particle binding and phagocytosis[J]. Nat Immunol, 2010, 11: 232-239. |
| [37] |
Lévêque M, Penna A, Le Trionnaire S, et al. Phagocytosis depends on TRPV2-mediated calcium influx and requires TRPV2 in lipids rafts: alteration in macrophages from patients with cystic fibrosis[J]. Sci Rep, 2018, 8: 4310. DOI:10.1038/s41598-018-22558-5 |
| [38] |
Zhang D, Spielmann A, Wang L, et al. Mast-cell degranulation induced by physical stimuli involves the activation of transient-receptor-potential channel TRPV2[J]. Physiol Res, 2012, 61: 113-124. |
| [39] |
Solís-López A, Kriebs U, Marx A, et al. Analysis of TRPV channel activation by stimulation of FCεRI and MRGPR receptors in mouse peritoneal mast cells[J]. PLoS One, 2017, 12: e0171366. DOI:10.1371/journal.pone.0171366 |
| [40] |
Fanntozzi I, Zhang S, Platoshyn O, et al. Hypoxia increases AP-1 binding activity by enhancing capacitative Ca2+ entry in human pulmonary artery endothelial cells[J]. Am J Physiol Lung Cell Mol Physiol, 2003, 285: 1233-1245. DOI:10.1152/ajplung.00445.2002 |
| [41] |
Rubinstein J, Lasko VM, Koch SE, et al. Novel role of transient receptor potential vanilloid 2 in the regulation of cardiac performance[J]. Am J Physiol Heart Circ Physiol, 2014, 306: 574-584. DOI:10.1152/ajpheart.00854.2013 |
| [42] |
Katanosaka Y, Iwasaki K, Ujihara Y, et al. TRPV2 is critical for the maintenance of cardiac structure and function in mice[J]. Nat Commun, 2014, 5: 3932. DOI:10.1038/ncomms4932 |
| [43] |
Koch SE, Mann A, Jones S, et al. Transient receptor potential vanilloid 2 function regulates cardiac hypertrophy via stretch-induced activation[J]. J Hypertens, 2017, 35: 602-611. DOI:10.1097/HJH.0000000000001213 |
| [44] |
Che H, Xiao GS, Sun HY, et al. Functional TRPV2 and TRPV4 channels in human cardiac c-kit (+) progenitor cells[J]. J Cell Mol Med, 2016, 20: 1118-1127. DOI:10.1111/jcmm.12800 |
| [45] |
Iwata Y, Katayama Y, Okuno Y, et al. Novel inhibitor candidates of TRPV2 prevent damage of dystrophic myocytes and ameliorate against dilated cardiomyopathy in a hamster model[J]. Oncotarget, 2018, 9: 14042-14057. DOI:10.18632/oncotarget.24449 |
| [46] |
Matsumura T, Matsui M, Iwata Y, et al. A pilot study of tranilast for cardiomyopathy of muscular dystrophy[J]. Intern Med, 2018, 57: 311-318. DOI:10.2169/internalmedicine.8651-16 |
| [47] |
Kunitoshi U, Makoto T. The role of thermosensitive TRP (transient receptor potential) channels in insulin secretion[J]. Endocr J, 2011, 58: 1021-1028. DOI:10.1507/endocrj.EJ11-0130 |
| [48] |
Hisanaga E, Nagasawa M, Ueki K, et al. Regulation of calcium-permeable TRPV2 channel by insulin in pancreatic beta-cells[J]. Diabetes, 2009, 58: 174-184. DOI:10.2337/db08-0862 |
| [49] |
Lin Y, Sun Z. Antiaging gene klotho enhances glucose-induced insulin secretion by up-regulating plasma membrane levels of TRPV2 in MIN6 β-cells[J]. Endocrinology, 2012, 153: 3029-3039. DOI:10.1210/en.2012-1091 |
| [50] |
Harada K, Kitaguchi T, Kamiya T, et al. Lysophosphatidylinositol-induced activation of the cation channel TRPV2 triggers glucagon-like peptide-1 secretion in enteroendocrine L cells[J]. J Biol Chem, 2017, 292: 10855-10864. DOI:10.1074/jbc.M117.788653 |
| [51] |
Sawatani T, Kaneko YK, Doutsu I, et al. TRPV2 channels mediate insulin secretion induced by cell swelling in mouse pancreatic β-cells[J]. Am J Physiol Cell Physiol, 2019, 316: 434-443. DOI:10.1152/ajpcell.00210.2017 |
| [52] |
Bulut Arikan F, Özdemir FA, Şen D, et al. TRPV2 polymorphisms increase or reduce the risk of type 2 diabetes-hashimoto thyroiditis comorbidity[J]. Acta Endocrinol (Buchar), 2020, 16: 15-21. DOI:10.4183/aeb.2020.15 |
| [53] |
Santoni G, Amantini C, Maggi F, et al. The TRPV2 cation channels: from urothelial cancer invasiveness to glioblastoma multiforme interactome signature[J]. Lab Invest, 2020, 100: 186-198. DOI:10.1038/s41374-019-0333-7 |
| [54] |
Monet M, Lehen'Kyi V, Gackiere F, et al. Role of cationic channel TRPV2 in promoting prostate cancer migration and progression to androgen resistance[J]. Cancer Res, 2010, 70: 1225-1235. DOI:10.1158/0008-5472.CAN-09-2205 |
| [55] |
Morelli MB, Nabissi M, Amantini C, et al. The transient receptor potential vanilloid-2 cation channel impairs glioblastoma stem-like cell proliferation and promotes differentiation[J]. Int J Cancer, 2012, 131: 1067-1077. DOI:10.1002/ijc.27588 |
| [56] |
Nabissi M, Morelli MB, Amantini C, et al. Cannabidiol stimulates Aml-1a-dependent glial differentiation and inhibits glioma stem-like cells proliferation by inducing autophagy in a TRPV2-dependent manner[J]. Int J Cancer, 2015, 137: 1855-1869. DOI:10.1002/ijc.29573 |
| [57] |
Marinelli O, Morelli MB, Annibali D, et al. The effects of cannabidiol and prognostic role of TRPV2 in human endometrial cancer[J]. Int J Mol Sci, 2020, 21: 5409. DOI:10.3390/ijms21155409 |
| [58] |
Yamada T, Ueda T, Shibata Y, et al. TRPV2 activation induces apoptotic cell death in human T-24 bladder cancer cells: a potential therapeutic target for bladder cancer[J]. Urology, 2010, 76: 509. |
| [59] |
Elbaz M, Ahirwar D, Xiaoli Z, et al. TRPV2 is a novel biomarker and therapeutic target in triple negative breast cancer[J]. Oncotarget, 2018, 9: 33459-33470. DOI:10.18632/oncotarget.9663 |
| [60] |
Kudou M, Shiozaki A, Yamazato Y, et al. The expression and role of TRPV2 in esophageal squamous cell carcinoma[J]. Sci Rep, 2019, 9: 16055. DOI:10.1038/s41598-019-52227-0 |
| [61] |
Liu LL, Fu D, Ma Y, et al. The power and the promise of liver cancer stem cell markers[J]. Stem Cells Dev, 2011, 20: 2023-2030. DOI:10.1089/scd.2011.0012 |
| [62] |
Bai H, Zhu H, Yan Q, et al. TRPV2 induced Ca2+-calcineurin-NFAT signaling regulates differentiation of osteoclast in multiple myeloma[J]. Cell Commun Signal, 2018, 16: 68. DOI:10.1186/s12964-018-0280-8 |
| [63] |
Anderson KE, Gratzke C, Hedlund P. The role of the transient receptor potential (TRP) superfamily of cation-selective channels in the management of the overactive bladder[J]. BJU Int, 2010, 106: 1114-1127. DOI:10.1111/j.1464-410X.2010.09650.x |
| [64] |
Mihara H, Boudaka A, Shibasaki K, et al. Involvement of TRPV2 activation in intestinal movement through nitric oxide production in mice[J]. J Neurosci, 2010, 30: 16536-16544. DOI:10.1523/JNEUROSCI.4426-10.2010 |
| [65] |
Ambrus L, Kelemen B, Szabó T, et al. Human podocytes express functional thermosensitive TRPV channels[J]. Br J Pharmacol, 2017, 174: 4493-4507. DOI:10.1111/bph.14052 |
| [66] |
Ishii T, Uchida K, Hata S, et al. TRPV2 channel inhibitors attenuate fibroblast differentiation and contraction mediated by keratinocyte-derived TGF-β1 in an in vitro wound healing model of rats[J]. J Dermatol Sci, 2018, 90: 332-342. DOI:10.1016/j.jdermsci.2018.03.003 |
| [67] |
Sun W, Uchida K, Takahashi N, et al. Activation of TRPV2 negatively regulates the differentiation of mouse brown adipocytes[J]. Pflugers Arch, 2016, 468: 1527-1540. DOI:10.1007/s00424-016-1846-1 |
| [68] |
Sun W, Uchida K, Suzuki Y, et al. Lack of TRPV2 impairs thermogenesis in mouse brown adipose tissue[J]. EMBO Rep, 2016, 17: 383-399. DOI:10.15252/embr.201540819 |
 2021, Vol. 56
2021, Vol. 56