2. 中国人民解放军总医院第八医学中心呼吸与危重症医学科, 北京 100193;
3. 军事科学院军事医学研究院环境医学与作业医学研究所, 天津 300050
2. Department of Respiratory and Critical Care Medicine, the Eighth Medical Center of PLA General Hospital, Beijing 100193, China;
3. Institute of Environmental and Operational Medicine, Academy of Military Medical Science, Academy of Military Science, Tianjin 300050, China
高原肺水肿(high altitude pulmonary edema, HAPE) 是从平原急进高原后由于低压缺氧环境, 导致肺动脉压生理性急剧增加、肺毛细血管容量增加和细胞膜通透性改变, 使血管中液体渗出至肺间质及肺泡而引起的特发性疾病, 是一种可危及生命的非心源性肺水肿[1]。HAPE发病主要取决于上升速度、运动强度和绝对海拔高度。如果上升速度过快, 海拔过高, 每个人都可能患HAPE[2]。据统计, 无HAPE病史的122名人员上升至4 559 m时HAPE发病率为6%[3]。另有文献[4]报道, 大量人群通过空中或陆路从平原至3 500 m高原后, HAPE发病率分别为5.7%和0.3%, 即急进高原HAPE发生率会大大增加, 所以高原肺水肿的预防措施一般为缓慢进入高原及避免剧烈运动。但是, 急进高原的情况有时无法避免, 此时需考虑采用药物预防HAPE, 如糖皮质激素(如地塞米松) 和降压药(如西地那非、硝苯地平、氨茶碱), 其中磷酸二酯酶抑制剂和钙通道阻滞剂是首选药[5]。
西地那非(sildenafil, SIL) 是一种选择性5型磷酸二酯酶抑制剂, 可抑制cGMP水解, 从而增加血管内皮细胞中的cGMP浓度, 使肺血管选择性舒张, 降低肺动脉压。SIL不溶于水, 但膜渗透性高, 属生物药剂学分类(BCS)Ⅱ类。枸橼酸西地那非(sildenafil citrate, SC) 可一定程度上增加水溶性[6]。枸橼酸西地那非片及注射液可用于预防高原肺水肿。在2019版急性高原病临床实践指南中, SIL预防HAPE的口服剂量每8 h服用50 mg, 存在给药剂量大、间隔短和外周血管舒张等全身不良反应; SIL注射液存在不便于运输和携带等问题。因此, 亟需研究SIL新剂型和给药方式以解决上述问题。
用肺吸入给药系统治疗肺部疾病有较大优势。肺吸入制剂可将药物直接递送于肺组织, 快速起效, 避免因口服带来的首过效应, 减小剂量, 降低药物在其他正常组织的分布及带来的不良反应。肺吸入给药已经成为哮喘、肺气肿和慢性阻塞性肺病等肺部疾病最有效的治疗手段[7]。研究表明, 吸入西地那非与静脉注射西地那非相比可增加肺通气灌注[8]; 西地那非的可吸入聚乳酸-羟基乙酸共聚物(PLGA) 颗粒可降低给药剂量并延长给药间隔来替代口服[9]; 体内研究表明[10], 肺吸入西地那非及其纳米制剂均可延长半衰期并提高药物的肺部浓度。本实验室前期工作中采用肺吸入给药系统治疗肺炎、肺损伤及肺癌等疾病, 均取得较好疗效[11-14]。因此, 可考虑将SIL制备成肺吸入给药制剂, 用于预防HAPE。但在肺组织生理条件下(pH = 7.3~7.4), SIL以中性分子为主, 溶解度差, 难以扩散, 影响了其吸收和快速起效[15]。
脂质体由磷脂双分子层构成, 易与细胞膜融合, 可携带药物进入细胞, 因此可降低药物剂量, 增强药效, 加快药物起效[16]。脂质体药物可以采用雾化吸入方式和粉雾剂方式[14-17]。已有研究表明, 采用硫酸铵梯度法制备得到的环丙沙星脂质体, 肺吸入脂质体组的体内药物肺部靶向率远远高于肺吸入原料药溶液组[18]; 姜黄素脂质体可提高姜黄素的肺癌细胞A549的摄取从而提高姜黄素的抗癌活性[14]。脂质体制备方法包括薄膜分散法、逆向蒸发法、乙醇注入法及pH梯度法等。硫酸铵梯度法属pH梯度法, 适用于弱碱性药物。它通过调节脂质体内外水相的pH梯度, 使弱碱性药物在外水相中中性化, 可穿透磷脂双分子层进入弱酸环境的内水相, 该过程不断进行, 可获得较高的药物包封率。
基于SIL物理化学性质及预防HAPE需求, 本文制备了西地那非脂质体(liposomal sildenafil, LS), 考察其理化性质, 在小鼠高原肺水肿模型上验证肺部给药LS和SIL的药效及作用机制, 为肺吸入药物防治高原肺部疾病提供新思路。
材料与方法动物 雄性ICR小鼠, 体重25 g, SPF级, 许可证号: SCXK (京) 2019-0010, 斯贝福(北京) 实验动物技术有限公司提供。实验期间动物自由取食、饮水。所有动物实验经军事科学院军事医学研究院伦理委员会批准且实验均按照相关指导原则和规定进行。
试剂及药物 枸橼酸西地那非(江苏亚邦爱普森药业, 批号: 121111002); 蛋黄卵磷脂(上海艾伟拓医药科技有限公司, 批号: EK16068); 胆固醇(国药集团化学试剂有限公司, 批号: 20101215); 硫酸铵(上海试四赫维化工有限公司); 苄泽-58 (Sigma公司, 84F-0366); 透析袋MD44 (索莱宝公司, 批号: 408D0213); 三乙胺(天津博迪化工股份有限公司); 磷酸(北京百灵威科技有限公司, 批号: LN40T42); 磷酸氢二钠(国药集团化学试剂有限公司, 批号: 20150313); 小鼠肿瘤坏死因子-α (TNF-α) 和白细胞介素-1β (IL-1β) ELISA试剂盒(上海酶联生物科技有限公司); 甲醇及乙腈为色谱纯, 其余试剂为分析纯。本文用水均为去离子水, 用纯水仪制备。
仪器 小动物低压氧舱(ProOx-830, 上海塔望智能科技有限公司); 高效液相色谱仪(Agilent 1260 Infinity, 美国安捷伦公司); 转棒式疲劳仪(DB093, 北京智鼠多宝生物科技有限公司); 条件恐惧箱、动物行为学视频分析系统主控器(DigBehv, 上海吉量软件科技公司); 指夹式脉搏血氧仪(MD300C, 北京超思电子技术股份有限公司); 小动物喉镜(HRH-HAG5)、小鼠操作台(HRH-HAG6) (北京慧荣和科技有限公司); 旋转蒸发器(RE-52A, 上海振捷实验设备有限公司); 纳米激光粒度仪(Zetasizer Nano ZS, 英国马尔文公司); 酶标仪(ELx800, 美国伯腾仪器有限公司); 倒置荧光显微镜(BDS200-FL, 重庆奥特光学显微镜公司); 纯水仪(型号: Heal Force Super NW, 上海康雷仪器有限公司)。
西地那非脂质体处方优化 用硫酸铵梯度法制备LS, 具体方法如下。选取影响脂质体包封率的3种因素优化LS处方工艺, 包括①蛋黄卵磷脂与胆固醇的质量比(w/w) 为3∶1、5∶1和7∶1; ②药物和蛋黄卵磷脂的摩尔比(mol/mol) 为1∶3、1∶6和1∶9; ③硫酸铵溶液浓度为0.1、0.2和0.3 mol·L-1。用正交设计法设计LS处方(表 1), 以LS包封率作为优化指标, 筛选出LS最优处方。
| Table 1 Factors and levels for the orthogonal design of liposomal sildenafil (LS) formulations. SIL: Sildenafil |
西地那非脂质体的制备 取蛋黄卵磷脂150 mg、胆固醇30 mg和苄泽58 (Brij-58) 7.5 mg溶于10 mL乙醇, 于500 mL茄形瓶中50 ℃水浴减压旋转蒸发, 除尽有机溶剂, 得到均匀脂质膜, 加入0.3 mol·L-1硫酸铵溶液10 mL, 在37 ℃用100 r·min-1恒温振荡, 水化后形成脂质体混悬液, 超声10 min后过0.22 μm滤器10次, 得到硫酸铵脂质体。将其放入截留分子量3 500 Da的透析袋中, 在500 mL 0.9% NaCl水溶液(pH 10) 中透析2次, 每次1 h, 得硫酸铵梯度脂质体。在脂质体混悬液中加入SC 15 mg, 于40 ℃水浴中振荡30 min, 得到LS。
包封率测定 用高效液相色谱法(HPLC) 测定LS中SIL的含量, 色谱条件为Kromasil C18柱(150 mm × 4.6 mm, 5 μm); 柱温30 ℃; 流动相是甲醇/乙腈/0.05 mol·L-1磷酸三乙胺溶液(pH 4.0, 25∶17∶58, v/v/v); 检测器是二极管阵列检测器; 检测波长290 nm; 流速1 mL·min-1; 样品体积20 μL。SIL甲醇溶液作为贮备液。
用LH-20葡聚糖凝胶柱分离LS, 取适量加入甲醇中, 破坏脂质体结构和溶解SIL, 测定LS包封的SIL量(WLS/en), 以及未分离的LS中SIL总量(WLS/total), 按公式(1) 计算LS包封率(EE)。
| $ \mathrm{EE}(\%)=W_{\mathrm{LS} / \mathrm{en}} / W_{\mathrm{LS} / \mathrm{total}} \times 100 \% $ | (1) |
粒径与电位测定和电镜观察 取适量LS用水稀释后采用纳米激光粒度仪测定粒径分布和zeta电位。取少量LS混悬液于铜网支持碳膜上, 用2%磷钨酸溶液(pH 7.0) 染色, 空气中干燥, 用透射电镜(TEM, H-7650, 日本HITACHI公司) 观察脂质体形态。
体外释放实验 分别取SC (1 mg)、LS (0.67 mL, 含1 mg SC) 分散于3 mL人工肺液(表 2)[19], 置于透析袋(截留分子量3 500 Da), 放入盛有100 mL人工肺液的三角瓶中[20], 在37 ℃和100 r·min-1振摇。分别于5、30 min和1、2、3、4、5、6、12、24和48 h取释放液1 mL, 用0.22 μm滤器过滤, 立刻补充相同温度的人工肺液1 mL。用HPLC测定释放液中SIL: 色谱柱为Kromasil C18柱(150 mm × 4.6 mm, 5 μm); 柱温25 ℃; 流动相是乙腈/10 mmol·L-1磷酸氢二钠溶液(pH 7.5, 50∶50, v/v); 检测器为二极管阵列检测器; 检测波长220 nm; 流速0.8 mL·min-1; 样品体积20 μL。分别用零级方程[式(2)]、一级方程[式(3)] 和Higuchi方程[式(4)] 对SC及LS的体外释放机制进行拟合。
| $ M_{t} / M_{\infty}=\mathrm{k}_{\mathrm{z}} \times \mathrm{t} $ | (2) |
| $ \ln \left(1-M_{t} / M_{\infty}\right)=-\mathrm{k}_{\mathrm{f}} \times \mathrm{t} $ | (3) |
| $ M_{t} / M_{\infty}=\mathrm{k}_{\mathrm{h}} \times \mathrm{t}^{1 / 2} $ | (4) |
| Table 2 Formula of 1 000 mL simulated lung fluids[19] |
其中, Mt为t时的药物累积释放量; M∞为最大药物累积释放量; Mt/M∞为t时药物累积释放百分率; kz、kf及kh分别为零级拟合方程、一级拟合方程和Higuchi拟合方程系数。
西地那非预防高原肺水肿的药效学实验 将30只小鼠随机分为6组, 每组5只, 其中a组(healthy) 和b组(model) 不经任何处理; c组(blank liposomes) 小鼠肺部给予空白脂质体50 μL; d组(p.o. SIL) 小鼠灌胃给予SIL生理盐水混悬液(浓度0.375 g·L-1, 剂量3 mg·kg-1, 含SIL 75 μg) 0.2 mL; e组(i.t. SIL) 小鼠肺部给予SIL生理盐水混悬液(浓度1.5 g·L-1, 剂量3 mg·kg-1, 含SIL 75 μg) 50 μL; f组(i.t. LS) 小鼠肺部给予LS (含SIL 75 μg) 50 μL。小鼠给药后放入鼠笼中, 内置盛水容器, 可自主活动及取食, 放入小动物低压氧舱, 减压操作, 调节仪器程序为5 min升至模拟5 000 m高度, 在5 000 m高度维持40 min, 然后消耗15 min降至0 m高度, 在低压氧舱内的总时间控制为1 h。
西地那非对于不同高原时间的药效学实验 将65只小鼠随机分为13组, 每组5只, 其中正常组(healthy) 不经任何处理, 模型组(model)、西地那非组(SIL) 及西地那非脂质体组(LS) 根据动物在低压氧舱内的总时间各分成4组, 以组类型和时间点作为组名称, 如Model-1 h组、SIL-12 h组和LS-48 h组。模型组小鼠给予生理盐水; SIL组小鼠给予SIL生理盐水混悬液(浓度1.5 g·L-1, 剂量3 mg·kg-1, 含SIL 75 μg), 混悬液粒径为89.75 ± 43.22 nm (n = 3), 多分散系数(PDI) 为0.512 ± 0.025 (n = 3); LS组小鼠给予LS (含SIL 75 μg)。用喉镜插入小鼠口腔, 暴露气管, 将自制肺部给药针插入气管经气管喷入给药[7], 每只小鼠给药体积为50 μL。小鼠给药后放入鼠笼中, 内置盛水容器, 可自主活动及取食, 放入小动物低压氧舱, 减压操作, 调节仪器程序为5 min升至模拟5 000 m高度, 在5 000 m高度维持一定时间, 然后消耗15 min降至0 m高度, 在低压氧舱内的总时间分别控制为1、12、24和48 h。小鼠出舱后立即置于转棒疲劳仪的直径为93 mm的转棒上, 20 s内将转速升高至38 r·min-1后使其连续运动3 min, 期间小鼠掉落后立即将小鼠以头部朝前的方式放置于转棒疲劳仪上。
血氧饱和度检测 运动结束后的小鼠立即用指夹式脉搏血氧仪检测小鼠尾部经皮血氧饱和度(SpO2)。指夹式脉搏血氧仪利用光电传感器, 测量时将小鼠尾部置于光传导区, 通过测定光传导强度, 计算SpO2, 测量SpO2可间接了解机体的缺氧情况。
肺部外观及病理检查 小鼠摘眼球取血, 脱颈处死并解剖使暴露气管和胸腔, 摘除全肺, 拍照。右上叶肺固定于10%甲醛溶液中24 h, 石蜡包埋、切片、脱蜡后用苏木精-伊红(hematoxylin and eosin, H & E) 染色, 在显微镜下观察组织病理形态。
免疫组化检测 取小鼠肺组织石蜡切片脱蜡至水, 置于盛满柠檬酸抗原修复缓冲液(pH 6.0) 的修复盒中于微波炉内进行抗原修复, 自然冷却后将切片置磷酸盐缓冲液(PBS, pH 7.4) 中, 在脱色摇床上晃动洗涤3次, 每次5 min, 再用3%牛血清白蛋白(BSA) 均匀覆盖组织, 室温封闭30 min, 加一抗、二抗, 切片滴加二氨基联苯胺显色, 阳性为棕黄色, 苏木素复染3 min细胞核, 水洗, 1%盐酸酒精短暂分化、水洗, 再加氨水、水洗, 切片经脱水处理, 中性树胶封片, 显微镜下观察和照相, 通过Image J图像分析软件分析计算缺氧诱导因子-1α (HIF-1α) 的平均光密度值(average optical density, AOD)。
TNF-α、IL-1β和还原型谷胱甘肽(GSH)含量测定 眼球取血后, 室温放置2 h, 1 000×g 4 ℃离心20 min, 取上清分装, 即得血清, 贮存于-80 ℃冰箱。取肺右中右下叶, 称重后加入10倍量的生理盐水(0 ℃), 高速组织研磨仪研磨, 条件为60 Hz, 4 min, 每研磨1 min停10 s, 研磨后于4 ℃, 5 000 ×g离心10 min, 取上清分装, 即得组织匀浆, 贮存于-80 ℃冰箱。用ELISA试剂盒测定血清及组织匀浆中的TNF-α、IL-1β和GSH的水平。
旷场实验 将条件恐惧箱切断电刺激后, 选择自发运动模式, 即可作为旷场评估小动物的焦虑以及探索和运动能力[21]。行为测试箱的箱体大小为25 cm × 25 cm × 50 cm, 将小鼠置于敞箱底面的中心方格内, 场箱顶部正中固定一个摄像头, 进行摄像和计时, 用计算机记录小鼠5 min内的总路程及不动时间。单次实验结束后, 清理每只动物尿液和粪便, 并用75%的酒精擦拭箱底, 待气味散尽后进行下一组动物实验, 以免小鼠气味对后续实验造成影响。实验过程中尽量保持安静, 尽可能地减少外界环境对小鼠造成干扰。
统计学分析 采用SPSS 18.0软件对数据进行统计学分析(单因素方差分析, LSD), 实验数据以均数±标准差(x ± s) 表示, P < 0.05表示具有差异, P < 0.01表示具有显著性差异。
结果 1 西地那非脂质体的最优处方通过包封率优化脂质体处方(表 3), B1处方(药脂比为1∶9) 的包封率接近100%, 证明药脂比是影响包封率的重要因素。通过正交设计确定LS的最优处方为A2B1C3, 即蛋黄卵磷脂与胆固醇的质量比为5∶1, 药脂比为1∶9, 硫酸铵溶液浓度为0.3 mol·L-1; 该处方制备的LS包封率为103%, 载药量为5.41%。影响LS包封率最主要的因素为药脂比, 其次是磷脂和胆固醇之比, 胆固醇用量增加, 包封率增加, 胆固醇能增加脂质双分子层膜的坚固性, 可防止已包封于脂质体内的药物渗漏。
| Table 3 Entrapment efficiencies of LS according to the orthogonal design of formulations (n = 3, x ± s) |
LS是呈现淡蓝色乳光的混悬液。TEM显示LS是均匀的球形囊泡, 脂质体内部为黑色, 边缘为白色(图 1A)。水动力学直径为116.97 ± 9.13 nm (n = 3, 图 1B), PDI为0.426 ± 0.019 (n = 3), zeta电位为-30.93 ± 0.90 mV (n = 3, 图 1C)。

|
Figure 1 TEM images (A), particle size distribution (B), and zeta potential (C) of LS. Arrows indicate LS |
LS在人工肺液中累计释放率大, 前期快速释放, 后期缓慢释放, 至48 h基本完全释放。SC在pH为7.68的溶液中, 基本以SIL分子形式存在[22], SIL溶解度较低, 呈现混悬液状态, 有部分沉淀, 因此前期释放缓慢。24 h后, LS与SC释放速度基本一致(图 2)。根据方程拟合结果显示, LS、SC的释放过程更接近于一级释放, r分别为0.991 2和0.996 0。

|
Figure 2 Sildenafil (SIL) release profiles of sildenafil citrate (SC) and liposomal sildenafil (LS) in simulated lung fluids. n = 3, x ± s |
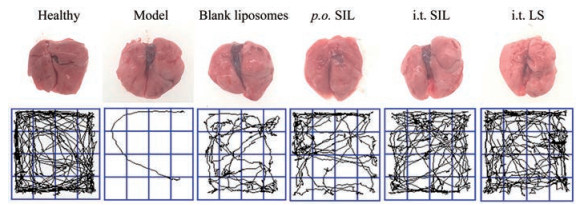
正常肺组织无出血, 模型组小鼠及空白脂质体组小鼠肺部出现水肿, 口服西地那非组小鼠肺部水肿比肺吸入组小鼠严重(图 3)。
|
Figure 3 Appearance of lung tissues and motion trail in 5 min of the open-field testing |
旷场实验可通过摄像头记录小鼠运动轨迹(图 3), 也可用视频软件记录小鼠在一定时间下的运动总路程及不动时间(图 4)。正常组小鼠运动较为活跃; 模型组和空白脂质体组小鼠在旷场箱内的自主活动减少, 长期蜷缩在一处位置, 其5 min的总路程减少, 不动时间增加; 经过药物干预, 口服西地那非组小鼠5 min的总路程及不动时间与模型组及空白脂质体组均无统计学差异; 肺吸入组小鼠运动能力明显改善, 运动轨迹更加杂乱, 其5 min内的运动总路程显著升高, 不动时间降低, 接近于正常组小鼠。

|
Figure 4 Dead time (A) and total distance (B) in 5 min of healthy mice (a), high altitude pulmonary edema (HAPE) mice without treatment (b), HAPE mice treated with blank liposomes (c), p.o. SIL (d), i.t. SIL (e), and i.t. LS (f). n = 5, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 |
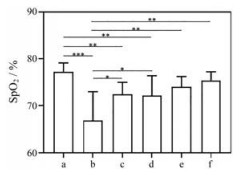
SpO2是血液中氧合血红蛋白的容量占全部血红蛋白容量的百分比, 即血液中氧的浓度, SpO2是反映人体氧转运能力指标, 也是人体对低氧适应能力的重要标志[23]。模型组、空白脂质体组及口服西地那非组小鼠SpO2显著降低, 肺吸入组小鼠比模型组显著升高, 且与正常组无统计学差异(图 5)。结果表明, 肺吸入给药可在降低给药剂量的同时保证血氧饱和度维持正常水平。
|
Figure 5 The level of percutaneous oxygen saturation (SpO2) of the mice tails. The meanings of a-f are referred to Figure 4. n = 5, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 |
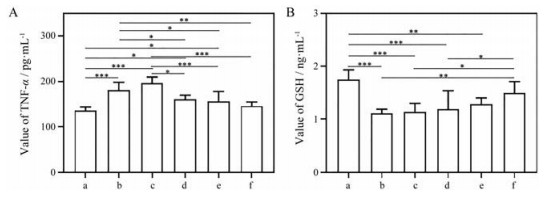
SIL具有良好的抗炎作用[24]。高原肺水肿常伴发炎症。NF-κB是炎症诱导因子, 在低氧性炎症中起关键作用[1]。HAPE发生时, NF-κB介导炎性细胞因子TNF-α等产生, 发生炎症反应[1]。GSH是一种能够直接清除活性氧(ROS)、维持细胞内氧化还原平衡的内源性抗氧化剂[25]。模型组和空白脂质体组小鼠肺组织内的TNF-α水平升高, GSH水平降低; 药物干预后, 口服SIL组小鼠肺组织内的TNF-α水平降低, GSH水平与模型组无统计学差异; 肺吸入组小鼠肺组织内的TNF-α水平显著降低, 且与正常组无统计学差异, 其中LS组效果最强(图 6A); 肺吸入LS组小鼠肺组织内的GSH水平比模型组显著降低, 比口服SIL组小鼠低, 且与正常组无统计学差异(图 6B)。结果表明, 肺吸入给药可在减少药物剂量的同时减轻小鼠肺部炎症反应及降低氧化应激水平。
|
Figure 6 Expression of tumor necrosis factor-α (TNF-α, A) and reduced glutathione (GSH, B) in the lung tissues. The meanings of a-f are referred to Figure 4. n = 5, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 |
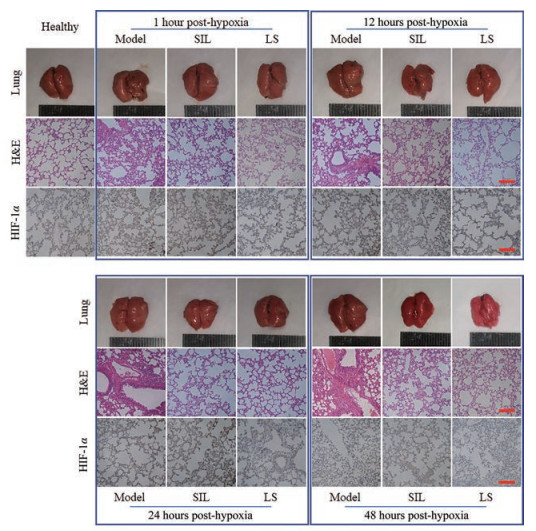
正常肺组织颜色粉红, 无出血; 模型组小鼠肺部水肿明显, 有点片状出血, 而SIL组及LS组小鼠的水肿情况比模型组轻(图 7)。小鼠肺组织病理切片H & E染色可见, 正常组小鼠肺泡壁结构完整, 肺泡腔内无分泌物, 无炎性细胞浸润; 模型组小鼠肺组织正常结构被破坏, 肺泡壁明显增厚并有大量炎性细胞浸润; SIL和LS组小鼠肺泡壁比模型组薄, 肺泡间隔比模型组清晰。
|
Figure 7 Appearance of lung tissues, the images of hematoxylin and eosin (H & E, 200×) and the expression of hypoxia-inducible factor 1α (HIF-1α, 200×). The scale bars indicate 50 μm |
本研究中, 模型组小鼠的炎症细胞因子水平最高, 给药后下降; LS组小鼠的炎性细胞因子水平均与正常组无统计学差异(图 8)。LS-1 h及LS-48 h组小鼠IL-1β分别与SIL-1 h及SIL-48 h组有差异(P < 0.05)。结果表明, LS在HAPE模型建立的前期和后期均有很好的抗炎作用, 且效果优于SIL。

|
Figure 8 Expression of interleukin-1β (IL-1β, A) and TNF-α (B) in the serum of the mice depending the time post-hypoxia. n = 3, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 |
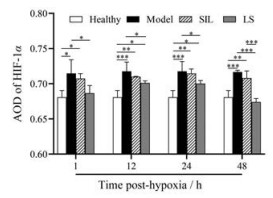
高原肺水肿是由于肺血管收缩导致肺动脉压升高以及血管通透性增加, 与氧化应激有关。低氧调节了多种基因的表达, 以改善血液运输和细胞代谢, 其中, HIF-1α是一种与缺氧适应相关的核蛋白[26]。缺氧环境产生大量ROS, 促进HIF-1蛋白稳定, 抑制HIF-1α的降解, HIF-1活化后使肺血管通透性增加, 液体渗出至肺间质导致水肿[27]。SIL及LS可促进HIF-1α的降解, 减轻肺水肿程度。本研究中, 模型组小鼠HIF-1α阳性表达的AOD值升高, 给药后下降, LS组比SIL组更显著。LS-1 h及LS-48 h组小鼠HIF-1α阳性表达的AOD值与正常组无显著性差异, LS-48 h组小鼠HIF-1α阳性表达的AOD值比SIL-48 h显著降低(图 9)。结果表明, LS在HAPE模型建立的前期及后期均有较好的抗氧化应激的能力, 且效果优于SIL。
|
Figure 9 Average optical density (AOD) of HIF-1α of the mice depending the time post-hypoxia. n = 3, x ± s. *P < 0.05, **P < 0.01, ***P < 0.001 |
HAPE的现代医学防治认为, 预防急性HAPE最安全稳妥的方法是低氧预适应、缓慢进入高原以及充足的水和能量等, 可显著降低HAPE的发生率[5]。但急进高原有时无法避免, 此时需考虑使用药物预防。HAPE发生急、危害大, 需要一种快速便捷的给药方式。目前临床上预防HAPE主要用SIL的口服片剂及注射剂, 但口服起效慢, 生物半衰期短(约3.5 h), 注射液不便于携带, 引起全身性不良反应等, 需要开发新的给药剂型和给药方式。本研究通过肺部给药SIL及LS来预防HAPE, 药物可直接到达肺部, 给药剂量降低, 减轻全身的不良反应。本文采用了雾化吸入的方式进行肺部给药, 可将脂质体制备成冻干粉, 复溶后雾化吸入给药, 也可将脂质体制备成为粉雾剂, 均可提高脂质体的稳定性, 关于这方面还需进一步的研究。
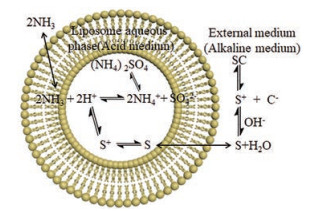
SC在中性环境中主要以SIL分子形式存在, 溶解度降低[15]。脂质体可将SIL包封于脂质体内水相, 脂质体与细胞膜融合后SIL进入细胞发挥作用。SIL是一种弱碱性药物, 可参考硫酸铵梯度法制备多柔比星脂质体的方法[28], 使其包封率为100%。硫酸铵梯度法制备LS的原理是用硫酸铵溶液作为水化溶液, 制备得到脂质体内外水相为同一浓度的硫酸铵溶液, 再通过透析将脂质体外水相的硫酸铵浓度降低, 从而在脂质体内外水相之间形成硫酸铵浓度梯度。SC在中性的外水相中与中性的SIL分子达到平衡, 而后者易插入疏水的脂质体膜外层, SIL在脂质体膜内翻转至膜内层, 与内水相的酸性环境接触, 迅速变为离子型的SIL+, 进入内水相中, 该过程重复进行, 直至所有的外水相中的SIL转移至内水相中, 从而获得高达100%的包封率。另外, 内水相的NH4+可分解成NH3和H+, NH3的跨膜速率远大于NH4+、H+及SO42-离子, NH3离开脂质体, H+被保留在脂质体内水相, 进一步降低内水相的pH, SIL变成离子态与SO42-形成硫酸盐保留于内水相(图 10)[29]。TEM显示LS是均匀的球形囊泡。脂质体外层呈白色, 是因为磷钨酸根阴离子与带有负电荷的脂质体排斥, 电子完全穿透而变亮。但LS内部为黑色, 这一点和普通脂质体不同。这是由于NH3的挥发和SIL进入内水相, 枸橼酸留在脂质体膜外, 使外水相逐渐呈弱酸性(pH 3~4), 当采用磷钨酸钠染色时, 磷钨酸根离子与氢离子结合形成中性的磷钨酸分子, 可跨脂质体膜进入内水相使其同样呈现黑色。用硫酸铵梯度法制备的多柔比星脂质体也具有同样的TEM成像特点[30]。
|
Figure 10 Schematic illustration of LS preparation process. Sildenafil is remotely loaded into the liposomes by creating an ammonium sulfate gradient between the inner aqueous phase and the outer aqueous phase of the liposome. S indicates sildenafil, SC indicates sildenafil citrate |
通过筛选磷脂与胆固醇的比例、药脂比及硫酸铵溶液浓度, 确定最优处方为磷脂胆固醇质量比为5∶1, 西地那非与磷脂的摩尔比为1∶9, 硫酸铵溶液为0.3 mol·L-1, LS的包封率可达100%。影响LS包封率的主要因素为药脂比。在硫酸铵梯度法中, SIL不断移入脂质体内水相中, 外水相也逐渐变为酸性, 当酸性达到一定程度, 外水相中SIL+较多而SIL减少, 直至前者完全占优势, 而不再跨膜。因此增加SC的量时, 部分SC不能进入脂质体内。如果提高膜外pH值可能增加载药量, 但pH值过大会破坏脂质体膜。
HAPE的发病与运动强度有关, 但低压氧舱舱体较小, 无法将跑台这种评价动物运动能力的装置放入其中。本文采用转棒疲劳仪来完善模型的建立, 小鼠在出舱后均于转棒疲劳仪连续跑3 min作为剧烈运动。采用旷场实验评价其运动能力, 其中总路程越短, 不动时间越长, 运动能力越弱。模型组和空白脂质体组小鼠运动能力显著下降, 口服SIL组小鼠及肺吸入SIL和LS组小鼠运动能力均有所提高, 但肺吸入组小鼠改善运动能力更强, 其中, LS组小鼠运动能力最接近于正常组。HAPE可导致运动时肌肉疲劳, 血管收缩影响气体交换, 肺动脉压升高影响右心室功能, 使心输出量不足, 从而影响HAPE小鼠的运动能力。LS可通过作用于NO-cGMP通路, 抑制cGMP分解, 扩张血管, 降低肺动脉压, 减少右心室后负荷, 增强HAPE小鼠运动能力[31, 32]。
TNF-α可激活中性粒细胞释放大量炎症介质, 刺激单核巨噬细胞产生多种白介素, 如IL-1β, 损伤血管内皮细胞, 导致血管通透性増加, 造成肺水肿[33]。SIL及LS可降低炎性细胞因子IL-1β和TNF-α水平, 抑制炎症反应, 减轻HAPE症状。LS降低IL-1β水平优于SIL且有显著性差异, 是由于脂质体与细胞膜相似, 可以促进药物在肺组织中的快速分散并进入细胞发挥药效, 舒张血管, 降低肺动脉压。炎性细胞因子水平在低压低氧1 h时明显升高, 而在12和24 h时下降, 48 h时升高, 可能是由于1 h处于急性缺氧期, 肺动脉压升高, 血管通透性增加, 导致大量液体及炎症细胞进入肺泡腔, 加重炎症反应[34]; 炎性因子的表达在24 h内出现一个自愈效果, 而随着时间的增加, 最终于48 h时呈现病理状态为炎性因子升高。
GSH是一种维持细胞正常代谢, 消除氧自由基的一种内源性物质, 在氧化应激反应中起到重要作用[35]。肺吸入LS组小鼠肺组织的GSH表达比口服SIL组小鼠高, 且与正常组无统计学差异。HIF-1是一种氧敏感转录因子, 有利于细胞对缺氧环境的适应, 在肺动脉高压的形成及发展过程中起着极其重要的作用[1]。在常氧下HIF-1α被降解, 低氧可抑制HIF-1α的降解, 增加其稳定性, 易进入细胞核与HIF-1β形成异二聚体[36, 37], 可引起多种靶基因表达, 影响低氧时多种生理过程, 机体抗缺氧能力增强[37]。HIF-1活化, 上调血管内皮生长因子表达, 使肺血管内皮细胞通透性增加, 导致水肿发生, 抑制该通路激活能够减轻肺水肿程度[38]。SIL及LS可显著降低肺组织中HIF-1α的表达, 从而减轻HAPE症状。
本文针对缺乏快速有效的高原肺水肿预防药物的问题, 制备了高载药量的西地那非脂质体, 并通过肺部给药手段, 直接将药物递送至肺组织, 有效预防了高原肺水肿, 作用机制包括减轻炎症反应, 降低氧化应激, 并有效改善了动物的运动能力。肺部给药西地那非脂质体是一种安全高效的预防HAPE的策略, 具有潜在的临床应用价值, 为预防HAPE提供新思路。
作者贡献: 黄粤琪负责实验设计、实验操作、数据分析和论文初稿撰写; 陈婷、王婉梅、庄波、苑天宇、刘岩和杜丽娜负责实验操作和论文修改; 魏晓阳、彭晖和金义光负责课题设计、实验指导、数据分析、论文写作与修改。
利益冲突: 本文不与任何个人或集体存在利益冲突。
| [1] |
Wu G, Xu G, Chen DW, et al. Hypoxia exacerbates inflammatory acute lung injury via the toll-like receptor 4 signaling pathway[J]. Front Immunol, 2018, 9: 1667. DOI:10.3389/fimmu.2018.01667 |
| [2] |
You HY, Li XX, Pei T, et al. Predictive value of basal exhaled nitric oxide and carbon monoxide for acute mountain sickness[J]. Wild Env Med, 2012, 23: 316-324. DOI:10.1016/j.wem.2012.04.001 |
| [3] |
Peter B, Marco M, Heimo M, et al. Pulmonary extravascular fluid accumulation in climbers[J]. Lancet, 2002, 360: 571. DOI:10.1016/S0140-6736(02)09723-4 |
| [4] |
Purkayastha SS, Ray US, Arora BS, et al. Acclimatization at high altitude in gradual and acute induction[J]. J Appl Physiol, 1995, 79: 487-492. DOI:10.1152/jappl.1995.79.2.487 |
| [5] |
Luks AM, Auerbach PS, Freer L, et al. Wilderness medical society clinical practice guidelines for the prevention and treatment of acute altitude illness: 2019 update[J]. Wild Env Med, 2019, 30: 3-18. DOI:10.1016/j.wem.2019.04.006 |
| [6] |
Jung SY, Seo YG, Kim GK, et al. Comparison of the solubility and pharmacokinetics of sildenafil salts[J]. Arch Pharm Res, 2011, 34: 451-454. DOI:10.1007/s12272-011-0313-y |
| [7] |
Jin YG, Li M. Pulmonary drug delivery systems and progress in their applications to lung disease treatment[J]. J Int Pharm Res (国际药学研究杂志), 2015, 42: 289-295, 322. |
| [8] |
Marie CA, Steve L, Arnaud M, et al. Differential effects of inhaled and intravenous sildenafil in the prevention of the pulmonary endothelial dysfunction due to cardiopulmonary bypass[J]. J Cardiovasc Pharm, 2008, 51: 11-17. DOI:10.1097/FJC.0b013e3181598279 |
| [9] |
Rashid J, Patel B, Nozik GE, et al. Inhaled sildenafil as an alternative to oral sildenafil in the treatment of pulmonary arterial hypertension (PAH)[J]. J Control Release, 2017, 250: 96-106. DOI:10.1016/j.jconrel.2017.02.003 |
| [10] |
Elham G, Alireza V, Mohammad RR, et al. Inhaled sildenafil nanocomposites: lung accumulation and pulmonary pharmacokinetics[J]. Pharm Dev Technol, 2016, 21: 961-971. DOI:10.3109/10837450.2015.1086369 |
| [11] |
Zhang GL, Xiao ZM, Yu X, et al. Comparative study of zedoary turmeric oil and curcumol dry powder inhalers for treatment of acute lung injury[J]. Acta Pharm Sin (药学学报), 2020, 55: 1312-1319. |
| [12] |
Zhang J, Li Y, Xiang ML, et al. Preparation and pharmacodynamic study of curcumin liposome dry powder inhalation[J]. Mil Med Sci (军事医学), 2013, 37: 692-695. |
| [13] |
Zhang MM, Li M, Ge YY, et al. Liposomal melatonin dry powder inhalers for the treatment of primary lung cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 555-564. |
| [14] |
Zhang TT, Chen YM, Ge YY, et al. Inhalation treatment of primary lung cancer using liposomal curcumin dry powder inhalers[J]. Acta Pharm Sin B, 2018, 8: 440-448. DOI:10.1016/j.apsb.2018.03.004 |
| [15] |
Adnan AB, Lina N, Mahmoud M, et al. Sildenafil citrate[J]. Anal Profiles Drug Subs Excip, 2001, 27: 339-376. |
| [16] |
Shen H, Wang L, Chen W, et al. Tissue distribution and tumor uptake of folate receptor-targeted epothilone folate conjugate, BMS-753493, in CD2F1 mice after systemic administration[J]. Acta Pharm Sin B, 2016, 6: 460-467. DOI:10.1016/j.apsb.2016.07.009 |
| [17] |
Zhou Y, Chen M, Chai XJ, et al. Investigation of the effect of paclitaxel liposome aerosol inhalation on bleomycin-induced pulmonary fibrosis in rats[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2019, 36: 2149-2153. |
| [18] |
Liu CM, Shi J, Dai QY, et al. In-vitro and in-vivo evaluation of ciprofloxacin liposomes for pulmonary administration[J]. Drug Dev Ind Pharm, 2015, 41: 272-278. DOI:10.3109/03639045.2013.858740 |
| [19] |
Sdraulig S, Franich R, Tinker RA, et al. In vitro dissolution studies of uranium bearing material in simulated lung fluid[J]. J Environ Radioact, 2008, 99: 527-538. DOI:10.1016/j.jenvrad.2007.08.009 |
| [20] |
Zhang L, Chen F, Zheng JT, et al. Chitosan-based liposomal thermogels for the controlled delivery of pingyangmycin: design, optimization and in vitro and in vivo studies[J]. Drug Deliv, 2018, 25: 690-702. DOI:10.1080/10717544.2018.1444684 |
| [21] |
Luis H, Margarita T, María TC, et al. Assessing anxiety in C57BL/6J mice: a pharmacological characterization of the open-field and light/dark tests[J]. J Pharmacol Toxicol Methods, 2014, 69: 108-114. DOI:10.1016/j.vascn.2013.12.005 |
| [22] |
Hu XN, Fan B. Determination of ionization equilibrium constant of sildenafil by UV spectrophotometry[J]. China Pharm (中国药房), 2006, 17: 134-136. |
| [23] |
Beal CM. Detecting natural selection in high-altitude human populations[J]. Respir Physiol Neurobiol, 2007, 158: 161-171. DOI:10.1016/j.resp.2007.05.013 |
| [24] |
Song J, Wang YY, Song P, et al. Sildenafil ameliorated meconium-induced acute lung injury in a neonatal rat model[J]. Int J Clin Exp Med, 2016, 9: 10238-10246. |
| [25] |
Zhao CY, Wang XL, Peng Y. Role of NRF2 in neurodegenerative diseases and recent progress of its activators[J]. Acta Pharm Sin (药学学报), 2015, 50: 375-384. |
| [26] |
Zhang JL, Li XY. A review of drug metabolism under hypoxia environment at high altitude[J]. Acta Pharm Sin (药学学报), 2015, 50: 1073-1079. |
| [27] |
Li YN, Xi MM, Guo Y, et al. Nadph oxidase-mitochondria axis-derived ROS mediate arsenite-induced HIF-1α stabilization by inhibiting prolyl hydroxylases activity[J]. Toxicol Lett, 2014, 224: 165-174. DOI:10.1016/j.toxlet.2013.10.029 |
| [28] |
Yechezkel B. Doxil®-the first FDA-approved nano-drug: lessons learned[J]. J Control Release, 2012, 160: 117-134. DOI:10.1016/j.jconrel.2012.03.020 |
| [29] |
Bolotin EM, Cohen R, Bar LK, et al. Ammonium sulfate gradients for efficient and stable remote loading of amphipathic weak bases into liposomes and ligandoliposomes[J]. J Liposome Res, 2008, 4: 455-479. |
| [30] |
Xu H, Zhang L, Li L, et al. Membrane-loaded doxorubicin liposomes based on ion-pairing technology with high drug loading and pH-responsive property[J]. AAPS PharmSciTech, 2017, 18: 2120-2130. DOI:10.1208/s12249-016-0693-x |
| [31] |
Wang RC, Jiang FM, Zheng QL, et al. Efficacy and safety of sildenafil treatment in pulmonary arterial hypertension: a systematic review[J]. Respir Med, 2014, 108: 531-537. DOI:10.1016/j.rmed.2014.01.003 |
| [32] |
Ghofrani HA, Reichenberger F, Kohstall MG, et al. Sildenafil increased exercise capacity during hypoxia at low altitudes and at mount everest base camp: a randomized, double-blind, placebo-controlled crossover trial[J]. Ann Intern Med, 2004, 141: 169-177. DOI:10.7326/0003-4819-141-3-200408030-00005 |
| [33] |
Liang F, Huang T, Li BX, et al. High-intensity interval training and moderate-intensity continuous training alleviate β-amyloid deposition by inhibiting NLRP3 inflammasome activation in APPswe/PS1dE9 mice[J]. Neuroreport, 2020, 31: 425-432. DOI:10.1097/WNR.0000000000001429 |
| [34] |
Gavrilovskaya IN, Gorbunova EE, Mackow NA, et al. Hantaviruses direct endothelial cell permeability by sensitizing cells to the vascular permeability factor VEGF, while angiopoietin 1 and sphingosine 1-phosphate inhibit hantavirus-directed permeability[J]. J Virol, 2008, 82: 5797-5806. DOI:10.1128/JVI.02397-07 |
| [35] |
Vasamsetti SB, Karnewar S, Gopoju R, et al. Resveratrol attenuates monocyte-to-macrophage differentiation and associated inflammation via modulation of intracellular GSH homeostasis: relevance in atherosclerosis[J]. Free Radic Biol Med, 2016, 96: 392-405. DOI:10.1016/j.freeradbiomed.2016.05.003 |
| [36] |
Wang MQ, Yan JQ, Cao XY, et al. Hydrogen sulfide modulates epithelial-mesenchymal transition and angiogenesis in non-small cell lung cancer via HIF-1α activation[J]. Biochem Pharmacol, 2020, 172: 113775. DOI:10.1016/j.bcp.2019.113775 |
| [37] |
Yang YD, Li MM, Xu G, et al. Targeting mitochondria-associated membranes as a potential therapy against endothelial injury induced by hypoxia[J]. J Cell Biochem, 2019, 120: 18967-18978. DOI:10.1002/jcb.29220 |
| [38] |
Wang XM, Huang M. Mechanisms of metabolite-triggered oncogenic signaling in cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 1755-1770. |
 2021, Vol. 56
2021, Vol. 56


