2. 深圳善康医疗健康产业有限公司, 广东 深圳 518118;
3. 蚌埠医学院药学院, 安徽 蚌埠 233030
2. Shenzhen Sciencare Medical Industries Co., Ltd., Shenzhen 518118, China;
3. College of Pharmacy, Bengbu Medical University, Bengbu 233030, China
肺癌在全世界所有恶性肿瘤中发病率和死亡率占主要地位, 我国恶性肿瘤疾病中, 肺癌的发病率和死亡率均排名第一。造成肺癌的主要致病原因包括烟雾、空气污染和电离辐射等[1]。肺癌可分为小细胞肺癌(15%~20%) 和非小细胞肺癌(80%~85%)[2]。肺癌的临床治疗方法包括手术、放疗、化疗、分子靶向治疗和免疫治疗等, 化疗通常与其他治疗手段联合使用。然而, 目前临床上最常用的化疗是将抗癌药物通过口服或静脉注射给药, 药物全身分布, 肿瘤组织中的药物浓度相对较低, 易产生严重的不良反应[3]。因此, 靶向或局部递送药物的方式受到重视, 可增加肿瘤组织内药物浓度并减少正常组织中药物浓度, 达到增效和减少不良反应的目的。
共轭亚油酸(conjugated linoleic acid, CLA) 是一类含有顺式和反式共轭双键的十八碳二烯酸异构体的总称。CLA异构体类型很多, 已经发现有25种[4], 其中以异构体cis-9, trans-11 CLA和trans-10, cis-12 CLA的研究最多[5]。cis-9, trans-11 CLA是唯一能被动物细胞吸收进入磷脂层的异构体, 也是与人类和动物营养最为相关、生物活性最强的CLA (图 1)[6]。CLA具有清除自由基、抗肿瘤[7]、抗动脉粥样硬化[8]、抗糖尿病[9]和免疫调节[10]等作用, 多作为保健品或功能食品, 对其具体的生理功能及其抗病机制研究相对较少[11]。

|
Figure 1 Structures of c9, t11-CLA and t10, c12-CLA. CLA: Conjugated linoleic acid |
肺部给药系统能够将药物直接递送到肺的深部[12]。与胃肠道和肝脏相比, 肺中肺泡表面积巨大, 毛细血管丰富, 酶促降解能力相对较弱[13], 因此肺吸入药物不仅可在肺部集中分布, 减少了药物的全身暴露, 而且可以迅速发挥药效, 被WHO推荐为肺部疾病的首选疗法[14], 包括肺炎、肺癌、急性肺损伤和特发性肺纤维化等肺部疾病[15]。基于CLA优良的抗肿瘤作用及肺部给药有利于肺癌治疗的特点, 本文将CLA制备成适合肺部给药的共轭亚油酸粉雾剂, 通过肺组织病理改变、相关蛋白通路和一系列炎症因子的测定, 考察其对大鼠原发性肺癌的治疗效果和作用机制, 为肺吸入挥发油类药物治疗肺癌提供了新的方法和思路。
材料与方法药物与试剂 共轭亚油酸(c9, t11-CLA, 批号: 20140606, 上海麦克林生物科技有限公司); 蛋黄卵磷脂PL-100M (注射用, 批号: EK16068, 艾伟拓医药科技有限公司); 大豆磷脂(批号: 20130801, 上海太伟药业有限公司); 泊洛沙姆188 (型号: WPMD507C, 德国巴斯夫股份公司); 乳糖(吸入级别, 批号: 101LX37, 粒径分布: D10 = 0.8~1.6 μm, D50 = 4.0~11.0 μm, D90 =15.0~35.0 μm, DFE Pharma公司); 甘露醇(批号: 20170427)、碳酸氢铵(批号: 20140109)、碳酸氢钠(批号: 20150609) (国药集团化学试剂有限公司); 碘化油注射液(13LU603A, 法国Guerbet公司); 3-甲基胆蒽(3-methylcholanthrene, MCA, 227590, 加拿大TRC公司); N, N-二乙基亚硝胺(DEN, 22VGQ-EC, 日本Tokyo Chemical Industry公司); 吉非替尼(批号: 20160608, 北京伊诺凯科技有限公司); 大鼠肿瘤坏死因子(tumor necrosis factor-α, TNF-α)、白介素-6 (interleukin-6, IL-6)、VEGF ELISA检测试剂盒(欣博盛生物科技有限公司); BCA (bicinchoninic acid) 蛋白浓度测定试剂盒(批号: PC0020, 北京索莱宝科技有限公司)。
仪器 高压均质机(型号: NanoDe Bee, 美国Bee公司); 纳米激光粒度仪(型号: Zeta Size Nano ZS, 英国马尔文仪器有限公司); 冷冻干燥机(型号: LGJ-30F, 北京松源华兴科技发展有限公司); 紫外分光光度计(型号: TU-1901, 北京普析通用仪器有限公司); 干法激光粒度仪(型号: BT-2001, 丹东百特仪器有限公司); 倒置荧光显微镜(型号: BDS200-FL, 重庆奥特光学仪器有限责任公司); 喉镜(型号: MJ, 江苏迈骏医疗科技有限公司); 扫描电镜(型号: S-4800, 日本HITACHI公司); 酶标仪(型号: ELX800, 美国伯滕仪器有限公司); 高速组织研磨仪(型号: KI-Ⅱ, 武汉谷歌生物科技有限公司); 超低温冰箱(型号: DW-86L828, 青岛海尔特种电器有限公司); 纯水仪(型号: Heal Force Super NW, 上海康雷仪器有限公司)。
实验动物 SD大鼠, SPF级, 雄性, 体重200 ± 20 g, 许可证号: SCXK (京) 2016-0006, 北京维通利华实验动物科技有限公司。实验期间动物自由取食、饮水。所有动物实验经军事科学院军事医学研究院伦理委员会批准且实验均按照相关指导原则和规定进行。
CLA纳米乳的制备 称取处方量的乳化剂(蛋黄卵磷脂∶泊洛沙姆188为2∶1, w/w) 加入适量的超纯水, 于50 ℃水浴锅搅拌溶解, 待其溶解完全后在水浴条件下边搅拌边加入已预热至50 ℃的CLA, 加完后加入剩余的超纯水, 继续搅拌10 min, 即得初乳。将制备好的初乳过高压均质机35 000 psi, 循环3次, 得到乳白色的乳剂。
CLA粉雾剂的制备和含量测定 通过筛选选择甘露醇为冻干保护剂, 按照冻甘露醇∶乳剂为1∶10 (w/v), 加入到共轭亚油酸纳米乳中, 待甘露醇能完全溶解后, 置于-35 ℃冷冻干燥机中, 预冻3 h, 然后梯度升温, 共计冷冻干燥40 h, 冻干粉末过180目筛, 得到共轭亚油酸粉雾剂(conjugated linoleic acid dry powder inhalers, CDPIs), 为白色疏松粉末。取适量CDPIs于量瓶中, 加入乙醇定容, 取适量乙醇溶液用0.22 μm滤膜过滤后, 在230 nm处测定吸收度值, 与共轭亚油酸对照溶液比较后得到CDPIs中药物含量。本研究发现共轭亚油酸乙醇溶液在227和230 nm处有两个吸收峰。在这两个波长下测定不同浓度共轭亚油酸乙醇溶液的吸光度值, 在1~6 μg·mL-1之间线性关系良好, R分别为0.999 4和0.999 3。
粒径、zeta电位测定和电镜观察 取少量共轭亚油酸粉雾剂用pH 7.4 PBS复溶, 在纳米激光粒度仪上测定粒径和电位(n = 3)。取5 μL复溶后的乳剂于铜网支持碳膜上, 用2%磷钨酸溶液(pH 7.0) 负染, 室温下干燥, 用透射电镜(transmission electron microscope, TEM) 观察粒子形态。取适量的共轭亚油酸粉雾剂置于双面胶上, 高压气体吹去未附着的粉末, 用40 mA电子束喷金20 min, 在扫描电镜(scanning electron microscope, SEM) 下观察粒子形态。
CLA粉雾剂粉体学考察 冻干后粉末过180目筛, 用激光粒度仪测定其几何粒径。粉末松密度和振实密度(n = 3) 测定方法: 将过筛后粉末(约1 g) 均匀转移至10 mL量筒中, 将量筒中粉末振实100次, 记录振实前后药物重量与体积, 并计算。按照公式(1) 计算空气动力学中位粒径(Da)。
| $ {D}_{a}={D}_{\mathrm{e}}\sqrt[]{\frac{{\rho }_{p}}{{\rho }_{0}\chi }} $ | (1) |
其中, De为几何中位粒径(geometric median diameter, De); ρp为有效颗粒密度, 其数值为振实密度的1.26倍[16]; ρ0为参照密度, 等于1 g·cm3; χ为动态形态因子(球形时χ = 1, 本文采用1)[17]。Da是影响药物沉积部位的最主要的因素, 一般认为Da在1~5 μm内的粒子可以到达肺深部[18]。
原发性肺癌大鼠模型的建立及给药 取适量的MCA和DEN加入碘化油注射液中, 在70 ℃加热20 h (每3 h振荡摇匀), 其中MCA为均匀混悬状态, DEN为完全溶解状态, 得到含100 mg·mL-1 MCA和10% DEN碘化油混悬液作为原发性肺癌的诱变剂。取0.1 mL上述肺癌诱变剂通过气管插管喷入大鼠肺中, 正常饲养条件下饲养45天既可得到原发性肺癌大鼠[19]。
将5只健康大鼠作为正常组, 气管喷入生理盐水0.2 mL; 将20只原发性肺癌大鼠随机分为4组, 每组5只, 即模型组、空白粉雾剂组、阳性对照组(吉非替尼混悬液组(粒径为559.2 ± 36.1 nm) 和CLA粉雾剂组。肺部给药方案为每天同一时间进行大鼠气管插管给药, 每3天给1次药, 连续给4次, 每次用量: 模型组为生理盐水0.2 mL; 空白粉雾剂组为等量的空白干粉; 阳性对照组为吉非替尼混悬液0.2 mL (10 mg·mL-1); CLA粉雾剂组为含CLA的干粉2 mg。具体给药操作步骤: 用喉镜撑开大鼠喉部, 暴露气管, 用细的软管进行气管插管, 尾端用三通阀连接至预充生理盐水或吉非替尼混悬液的1.0 mL注射器, 打开三通阀, 将生理盐水或混悬液喷入肺部; 粉末给药则先将粉末放入三通阀内, 注射器先压缩空气, 打开三通阀后, 压缩空气将粉末喷入肺部。
肺部外观及病理检查 大鼠末次给药后2天, 用10%水合氯醛麻醉并处死大鼠, 取上叶组织后立即用生理盐水(4 ℃) 洗净表面血迹及残留物, 用滤纸擦干后将其放入10%甲醛溶液中固定24 h, 石蜡包埋, 切片, 脱蜡、酒精梯度复水, 苏木精-伊红(hematoxylin and eosin, H & E) 染色后在显微镜下观察组织病理形态。
免疫组化检测 取组织石蜡切片依次经过二甲苯、无水乙醇和纯化水洗涤后, 置于pH 6.0柠檬酸抗原修复缓冲液的修复盒中于微波炉内进行抗原修复, 洗涤3次, 加入3%过氧化氢溶液, 避光孵育25 min, 加入PBS (pH 7.4) 在摇床上晃动洗涤3次, 每次5 min用以脱色。加入3% BSA均匀覆盖组织, 室温封闭30 min, 加入一抗试剂, 湿盒内4 ℃孵育过夜, 加入二抗试剂, 室温孵育50 min后同上操作。切片滴加DAB显色液, 至棕黄色后终止, 苏木精负染, 水洗, 分化、脱水等一系列处理后, 中性树胶封片于显微镜下观察拍照。
上述组织切片按照Tunel检测过程处理并染色, 在荧光显微镜下观察细胞凋亡。
TNF-α、IL-6、VEGF和总蛋白含量测定 取右肺中叶, 称重, 加入9倍质量生理盐水(4 ℃), 于高速组织研磨仪中进行组织研磨, 研磨条件为60 Hz, 4 min, 研磨后在低温高速离心机于4 ℃条件下, 10 000 r·min-1离心10 min, 取上清分装, 在-80 ℃冰箱保存。用ELISA试剂盒测定匀浆中TNF-α、IL-6和VEGF; 用BCA蛋白浓度测定试剂盒测定匀浆中总蛋白的量。
Western blot测定 取总蛋白测定时的匀浆按照4∶1的比例(v/v) 加入蛋白上样缓冲液, 沸水浴变性15 min, 然后用SDS-PAGE电泳和一系列的免疫反应后, 用Alpha软件处理系统分析凝胶图像的光密度值。
统计学分析 采用SPSS 18.0软件对数据进行统计学分析(单因素方差分析, one-way ANOVA), 比较组间差异, P < 0.05表示具有显著性差异。实验数据以均数±标准差(
本研究以磷脂和泊洛沙姆188为乳化剂[20], 以乳剂的外观、稳定性、粒径和多分散系数(polydispersity index, PDI) 为指标, 分别考察了蛋黄卵磷脂、大豆磷脂分别与泊洛沙姆188联用的乳化能力及高压均质工艺的影响。蛋黄卵磷脂和大豆卵磷脂作为乳化剂时纳米乳粒径分别为136.36 ±15.31 nm和217.30 ± 25.31 nm, PDI分别为0.30 ± 0.08和0.30 ± 0.05, 且大豆卵磷脂作为乳化剂时乳剂不稳定。经高压均质后, 以蛋黄卵磷脂和泊洛沙姆188为乳化剂制备的纳米乳粒径和PDI均减小, 分别从239.10 ± 19.03 nm和0.69 ± 0.04降至136.7 ± 14.49 nm和0.31 ± 0.04, 说明高压均质能减小粒径, 使分散更均匀, 稳定性增加。最终确定采用蛋黄卵磷脂和泊洛沙姆188为乳化剂; 高压均质工艺为35 000 psi、循环3次。
固定乳化剂的比例和种类, 以乳剂外观、稳定性、粒径、PDI和zeta电位为指标, 考察了不同浓度CLA对乳剂的影响, 当CLA浓度分别为5%、10%和15%时, 粒径分别为80.40 ± 13.85、90.84 ±10.06和175.93 ± 20.30 nm; PDI分别为0.23 ± 0.02、0.27 ± 0.01和0.31 ± 0.02; zeta电位分别为-46.77 ± 2.47、-41.73 ± 2.85和-41.53 ± 1.96 mV。当CLA浓度为15%时, 粒径明显增大; 10%和5%浓度的乳剂粒径、PDI和电位数值均没有很大区别, 为了提高载药量, 最终确定乳剂处方中CLA浓度为10%。
2 CLA粉雾剂处方和制备工艺的优化实验中筛选了乳糖和甘露醇两种冻干保护剂, 乳剂中的浓度分别为5%、10%和15% (w/v), 以冻干粉松密度、振实密度、D50和Da为指标, 筛选最优的冻干保护剂种类及其浓度(表 1)。以Da值在1~5 μm之间适合肺部吸入为最终指标, 筛选出CLA纳米乳冻干保护剂为10%甘露醇, 其最优处方制得粉雾剂Da值为3.10 ± 0.17 μm。
|
Table 1 Effects of different kinds of lyophilized protective agents on the properties of lyophilized powders. D50: Geometric median diameter; Da: Aerodynamic median diameter. n = 3, |
CLA为白色液体, 制备成乳剂后为O/W白色乳剂。乳剂粒径为90.84 ± 10.06 nm, PDI为0.27 ± 0.017, zeta电位为-41.73 ± 2.85 mV。CDPIs复溶后乳剂粒径为88.56 ± 9.08 nm, PDI为0.22 ± 0.015, zeta电位为-44.73 ± 3.85 mV。TEM显示, CLA纳米乳和CDPIs复溶后的乳剂均为球形乳滴, 其粒径接近(图 2)。

|
Figure 2 Transmission electron microscope (TEM) images of conjugated linoleic acid nanoemulsions (A) and re-dissolved conjugated linoleic acid dry powder inhalers (CDPIs) (B) |
CDPIs为白色疏松状粉末, 可全部通过180目筛, 松密度为0.15 ± 0.02 g·cm-3, 振实密度为0.30 ± 0.01 g·cm-3, Da值为3.10 ± 0.17 μm, 在1~5 μm之间, 适合肺部吸入给药。
扫描电镜(scanning electron microscope, SEM) 观察空白辅料为片状颗粒形态, 表面有大量孔洞形成; CDPIs为类球形颗粒, 表面没有孔洞, 考虑可能是共轭亚油酸吸附或嵌入在孔洞中(图 3)。

|
Figure 3 Scanning electron microscope (SEM) images of blank dry powder inhalers (DPIs) (A) and CDPIs (B) |
与正常肺组织比较, 肺癌模型组和空白粉雾剂组的大鼠肺组织有大量肺癌白色结节(图 4), 而各治疗组的肺组织外观结节较少。H & E染色表明正常大鼠肺泡结构清晰完整, 肺癌模型组和空白粉雾剂组有大量细胞增生和炎性细胞浸润, 而各治疗组病理状态明显减轻, 其中肺癌结节显著减少, 细胞增生与炎性细胞浸润现象也显著减轻, CDPIs组效果最好(图 4)。
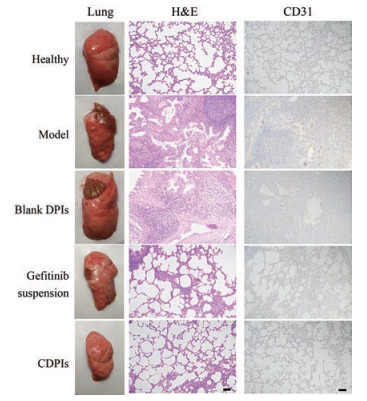
|
Figure 4 Appearance of lung tissues, the images of H & E (hematoxylin and eosin) (×100) and the expression of CD31 (×100). The scale bars indicate 100 μm |
CD31是表明血管形成的重要标记, 其增加表明肿瘤增殖活跃[21]。肺癌模型组大鼠的CD31表达高于正常组大鼠, 各治疗组CD31的表达均减少, 其中CDPIs组表达最少(图 4)。
VEGF诱导血管生成, 促进肿瘤组织生长和高密度血管化[22]。本研究中模型组的VEGF高度表达, 药物治疗后VEGF表达显著下降, 其中CDPIs组下降明显, 接近于正常组水平(图 5)。
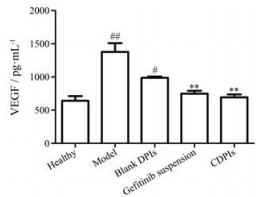
|
Figure 5 Levels of vascular endothelial growth factor (VEGF) in rat lung tissues. n = 3, |
NF-κB具有明显的抑制细胞凋亡的功能, 与肿瘤的发生、生长和转移等多个过程密切相关。NF-κB持续激活会刺激细胞生长, 导致细胞增殖失控[23]。NF-κB对肿瘤转移具有明显的促进作用, 能促进肿瘤转移相关基因细胞黏附因子-1 (ICAM-1)、血管内皮黏附因子-1 (VCAM-1) 和基质金属蛋白酶-9 (MMP-9) 等表达[24]。CLA可以通过抑制肿瘤细胞NF-κB p65的表达, 发挥抗肿瘤作用[25]。本研究中肺癌模型组NF-κB p65表达明显升高, 与正常组有明显区别(P < 0.001); 各治疗组NF-κB p65表达明显降低, 其中CDPIs组相较于阳性药组更显著, 证明CLA可明显下调NF-κB p65表达, 发挥抗肿瘤作用(图 6)。
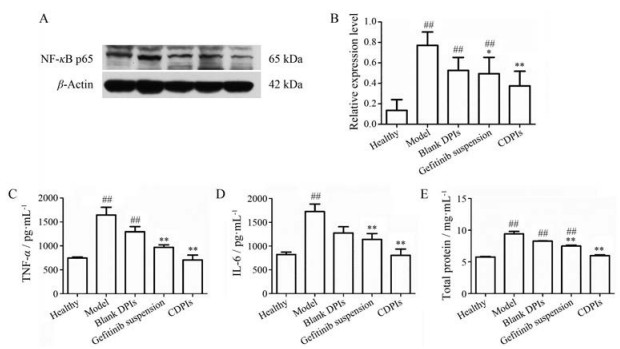
|
Figure 6 Levels of NF-κB p65 (A, B), tumor necrosis factor-α (TNF-α, C), interleukin-6 (IL-6, D), and total protein (E) in rat lung tissues. n = 3, |
肿瘤往往表现为炎症反应水平增加, 炎症因子IL-6和TNF-α是典型炎症指标[26], 总蛋白量的明显增多是炎症反应的直接标志[27]。本研究中大鼠肺癌模型组肺组织中炎症因子IL-6、TNF-α和总蛋白量明显增多(与正常组相比, 均P < 0.01), CDPIs组大鼠肺组织中TNF-α、IL-6和总蛋白含量比模型组低, 且存在显著差异(P < 0.01); 与正常组比较, 无显著差异(P > 0.05)。吉非替尼组可显著降低大鼠肺组织中TNF-α和IL-6的含量(与模型组相比P < 0.01), 与CDPIs组相当; 总蛋白含量与正常组相比显著增高, 与模型组相比显著降低, 但不如CDPIs (图 6)。
7 CLA粉雾剂可促进肿瘤细胞凋亡作用Tunel是检测细胞凋亡的常用方法[22]。正常组、模型组和空白粉雾剂组中细胞凋亡发生较少, 而阳性药组和CDPIs组细胞凋亡较明显, 其中CDPIs组的细胞凋亡明显增多, 说明CLA通过促进肿瘤细胞凋亡发挥抗肿瘤作用(图 7)。
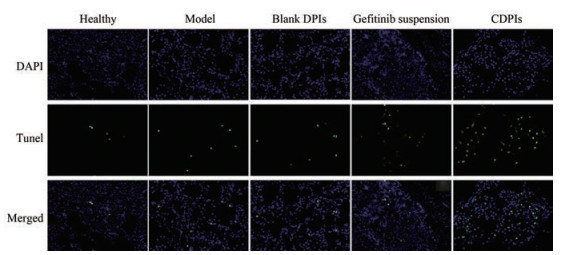
|
Figure 7 Apoptosis indicated by Tunel staining (200×). The nuclei are shown by 4', 6'-diamidino-2-phenylindole (DAPI) staining (200×). The merged images of Tunel and DAPI staining showed the apoptosis of the lung cells |
肺癌目前仍是我国恶性肿瘤发病率和死亡率最高的癌症, 临床上针对肺癌的化疗药物主要是全身给药, 带来大量的不良反应[28]。CLA具有优良的药理活性, 在北美和欧洲等国家已被批准添加到多种食物中, 被认为是一种天然来源的、非刺激的成分[29]。CLA已被证实具有抗肿瘤作用, 但其作为一种油类药物, 口服生物利用度较低, 影响了其肿瘤疾病的治疗效果[30]。为了提高CLA生物利用度, 本文选择安全性好的注射级蛋黄卵磷脂和泊洛沙姆188作为乳化剂, 制备了分散均匀、稳定性好的O/W型纳米乳剂, 使CLA能以纳米乳形态稳定、均匀地分散在水中。固定乳化剂比例和种类, 以乳剂外观、稳定性、粒径和多分散系数和zeta电位为指标, 筛选了CLA浓度; 虽然5%和10% CLA均能很好地被乳化形成稳定乳剂, 但为了保证高载药量, 确定CLA浓度为10%。
纳米乳剂是一种热力学不稳定体系[31], 在存放过程中可能发生粒径增大和药物沉淀析出, 为了提高其理化稳定性, 加入10% (w/v) 甘露醇作为冻干保护剂, 进一步制备成可吸入、适合携带和稳定性更好的粉雾剂, 通过肺部给药使药物靶向到肺部, 提高了药物溶解度和生物利用度, 并减轻局部刺激和不良反应[32]。以Da为指标, 对肺吸入给药的辅料乳糖和甘露醇进行筛选, 确定10% (w/v) 甘露醇作为冻干保护剂, 此时粉末Da值为3.10 ± 0.17 μm, 符合吸入要求(1~5 μm)。共轭亚油酸乙醇或正己烷溶液的最大吸收波长在230 nm左右, 而非共轭亚油酸在203 nm处有最大紫外吸收[33]。本研究选择了230 nm波长用于含量测定。
本文对CLA体内抗肺癌效果和作用机制进行了详细考察。NF-κB具有明显抑制细胞凋亡的功能, 与肿瘤的发生、生长和转移等多个过程密切相关。NF-κB持续激活会刺激细胞生长, 导致细胞增殖失控[34]。NF-κB对肿瘤转移具有明显的促进作用, 能促进肿瘤转移相关基因ICAM-1、VCAM-1和MMP-9等表达。在肺部给药后, CLA可通过NF-κB p65通路调节大鼠体内的肿瘤细胞的发生、生长和转移, 发挥抗癌作用[35]; CLA还可减少CD31和VEGF的表达, 抑制血管生成, 降低肿瘤组织生长和高密度血管化速度; CLA可通过调节肿瘤细胞的凋亡, 发挥抗肿瘤作用。
本研究基于CLA的性质和肺部给药的特点, 将油类药物CLA固体化, 制备成适合肺部吸入的粉雾剂, 通过肺部给药, 将药物直接递送至肺癌组织, 增加了其对肺癌的局部治疗效果。CLA粉雾剂有望成为肺癌治疗的新选择。
作者贡献: 张国立和肖志美负责实验设计、实验操作、数据分析和论文初稿撰写; 于翔负责实验设计和结果分析; 方荣震负责实验操作; 王秀负责论文写作与修改; 杜丽娜负责实验指导、数据分析和论文修改; 金义光负责课题设计、实验指导、数据分析、论文写作与修改。
利益冲突: 本文不与任何个人或集体存在利益冲突。
| [1] |
Liu R, Wei S, Chen J, et al. Mesenchymal stem cells in lung cancer tumor microenvironment: their biological properties, influence on tumor growth and therapeutic implications[J]. Cancer Lett, 2014, 353: 145-152. DOI:10.1016/j.canlet.2014.07.047 |
| [2] |
Chen Y, Li J, Chen S, et al. Nab-paclitaxel in combination with cisplatin versus docetaxel plus cisplatin as first-line therapy in non-small cell lung cancer[J]. Sci Rep, 2017, 7: 10760-10767. DOI:10.1038/s41598-017-11404-9 |
| [3] |
Zhang T, Wang R, Li M, et al. Comparative study of intratracheal and oral gefitinib for the treatment of primary lung cance[J]. Eur J Pharm Sci, 2020, 18: 105352-105361. |
| [4] |
Hunt WT, Kamboj A, Anderson HD, et al. Protection of cortical neurons from excitotoxicity by conjugated linoleic acid[J]. J Neurochem, 2010, 115: 123-130. DOI:10.1111/j.1471-4159.2010.06908.x |
| [5] |
Yuan G, Chen X, Li D. Conjugated linolenic acids and their bioactivities: a review[J]. Food Funct, 2014, 5: 1360-1368. DOI:10.1039/c4fo00037d |
| [6] |
Fuke G, Nornberg JL. Systematic evaluation on the effectiveness of conjugated linoleic acid in human health[J]. Crit Rev Food Sci Nutr, 2017, 57: 1-7. DOI:10.1080/10408398.2012.716800 |
| [7] |
Dubey KKD, Sharma G, Kumar A. Conjugated linolenic acids: implication in cancer[J]. J Agric Food Chem, 2019, 67: 6091-6101. DOI:10.1021/acs.jafc.9b01379 |
| [8] |
Bruen R, Fitzsimons S, Belton O. Atheroprotective effects of conjugated linoleic acid[J]. Br J Clin Pharmacol, 2017, 83: 46-53. DOI:10.1111/bcp.12948 |
| [9] |
Wang W, Li Q, Pan J. Inhibitory effect of conjugated linoleic acid on obesity of mice[J]. Food Sci (食品科学), 2016, 37: 211-216. |
| [10] |
Villacorta L, Minarrieta L, Salvatore SR, et al. In situ generation, metabolism and immunomodulatory signaling actions of nitro-conjugated linoleic acid in a murine model of inflammation[J]. Redox Biol, 2018, 15: 522-531. DOI:10.1016/j.redox.2018.01.005 |
| [11] |
Liu L, Miao J, Zheng Z. Review on the physiological function of conjugated linoleic acid[J]. J Food Safe Qual (食品安全质量检测学报), 2020, 11: 2552-2556. |
| [12] |
Yang MY, Chan JGY, Chan HK. Pulmonary drug delivery by powder aerosols[J]. J Control Release, 2014, 193: 228-240. DOI:10.1016/j.jconrel.2014.04.055 |
| [13] |
Li M, Zhu L, Liu B, et al. Tea tree oil nanoemulsions for inhalation therapies of bacterial and fungal pneumonia[J]. Colloids Surf B Biointerf, 2016, 141: 408-416. DOI:10.1016/j.colsurfb.2016.02.017 |
| [14] |
Kuzmov A, Minko T. Nanotechnology approaches for inhalation treatment of lung diseases[J]. J Control Release, 2015, 219: 500-518. DOI:10.1016/j.jconrel.2015.07.024 |
| [15] |
Zhang G, Xiao Z, Yu X, et al. Comparative study of zedoary turmeric oil and curcumol dry powder inhalers for treatment of acute lung injury[J]. Acta Pharm Sin (药学学报), 2020, 55: 1312-1319. |
| [16] |
Xu C, Wang Y, Guo Z, et al. Pulmonary delivery by exploiting doxorubicin and cisplatin coloaded nanoparticles for metastatic lung cancer therapy[J]. J Control Release, 2019, 10: 153-163. |
| [17] |
Cheng S, Kourmatzis A, Mekonnen T, et al. Does upper airway deformation affect drug deposition?[J]. Int J Pharm, 2019, 572: 118773-118782. DOI:10.1016/j.ijpharm.2019.118773 |
| [18] |
Jin Y, Li M. Pulmonary drugs delivery systems and progress in their applications to lung disease treatment[J]. J Int Pharm Res (国际药学研究杂志), 2015, 42: 289-322. |
| [19] |
Zhang T, Chen Y, Ge Y, et al. Inhalation treatment of primary lung cancer using liposomal curcumin dry powder inhalers[J]. Acta Pharm Sin B, 2018, 8: 440-448. DOI:10.1016/j.apsb.2018.03.004 |
| [20] |
Huang C, Wu Y, Huang B, et al. Formulation design, absorption mechanism and bioavailability of nanoemulsions for enhancing oral absorption of raloxifene[J]. Acta Pharm Sin (药学学报), 2018, 53: 1726-1735. |
| [21] |
Zeng Y, Liu P, Yang X, et al. The dietary c9, t11-conjugated linoleic acid enriched from butter reduces breast cancer progression in vivo[J]. J Food Biochem, 2020, 44: 13163-13173. |
| [22] |
Zhang M, Li M, Ge Y, et al. Liposomal melatonin dry powder inhalers for the treatment of primary lung cancer[J]. Acta Pharm Sin (药学学报), 2019, 54: 555-564. |
| [23] |
Kadirareddy RH, GhantaVemuri S, Palempalli UMD. Probiotic conjugated linoleic acid mediated apoptosis in breast cancer cells by downregulation of NF-κB[J]. Asian Pac J Cancer Prev, 2016, 17: 3395-3403. |
| [24] |
Ricci M, Miola M, Multari C, et al. PPARs are mediators of anti-cancer properties of superparamagnetic iron oxide nanoparticles (SPIONs) functionalized with conjugated linoleic acid[J]. Chem Biol Interact, 2018, 25: 9-14. |
| [25] |
Ma N, Chang G, Huang J, et al. cis-9, trans-11-Conjugated linoleic acid exerts an anti-inflammatory effect in bovine mammary epithelial cells after Escherichia. coli stimulation through NF-κB signaling pathway[J]. J Agric Food Chem, 2018, 67: 193-200. |
| [26] |
Queiroz MP, Lima MDS, Barbosa MQ, et al. Effect of conjugated linoleic acid on memory and reflex maturation in rats treated during early life[J]. Front Neurosci, 2019, 13: 1-12. DOI:10.3389/fnins.2019.00001 |
| [27] |
Haghighatdoost F, Gh BFNM. Effect of conjugated linoleic acid on blood inflammatory markers: a systematic review and meta-analysis on randomized controlled trials[J]. Eur J Clin Nutr, 2018, 72: 1071-1082. DOI:10.1038/s41430-017-0048-z |
| [28] |
Moon HS. Biological effects of conjugated linoleic acid on obesity-related cancers[J]. Chem Biol Interact, 2014, 5: 189-195. |
| [29] |
Hartigh LJD. Conjugated linoleic acid effects on cancer, obesity, and atherosclerosis: a review of pre-clinical and human trials with current perspectives[J]. Nutrients, 2019, 11: 370-398. DOI:10.3390/nu11020370 |
| [30] |
Li Q, Xue F, Qu J, et al. Nano-in-micro delivery system prepared by co-axial air flow for oral delivery of conjugated linoleic acid[J]. Mar Drugs, 2018, 17: 15-25. DOI:10.3390/md17010015 |
| [31] |
Li M, Zhang T, Zhu L, et al. Liposomal andrographolide dry powder inhalers for treatment of bacterial pneumonia via anti-inflammatory pathway[J]. Int J Pharm, 2017, 528: 163-171. DOI:10.1016/j.ijpharm.2017.06.005 |
| [32] |
Hu Y, Li M, Zhang M, et al. Inhalation treatment of idiopathic pulmonary fibrosis with curcumin large porous microparticles[J]. Int J Pharm, 2018, 551: 212-222. DOI:10.1016/j.ijpharm.2018.09.031 |
| [33] |
Chen H, Qi H, Shi Y. Research process on analytical methods of conjugated linoleic acids[J]. Chin J Pharm Anal (药物分析杂志), 2014, 34: 1519-1523. |
| [34] |
Tan J, Wan L, Chen X, et al. Conjugated linoleic acid ameliorates high fructose-induced hyperuricemia and renal inflammation in rats via NLRP3 inflammasome and TLR4 signaling pathway[J]. Mol Nutr Food Res, 2019, 63: e1801402. DOI:10.1002/mnfr.201801402 |
| [35] |
Olson JM, Haas AW, Lor J, et al. A comparison of the anti-inflammatory effects of cis-9, trans-11 conjugated linoleic acid to celecoxib in the collagen-induced arthritis model[J]. Lipids, 2017, 52: 151-159. DOI:10.1007/s11745-016-4228-8 |
 2021, Vol. 56
2021, Vol. 56


