2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850
2. Institute of Radiation Medicine, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China
空气中存在的可吸入颗粒物, 会伴随呼吸过程进入肺中, 一部分颗粒沉积在气管支气管, 还有一部分会深入肺泡中, 有可能引起诸多疾病, 如支气管炎、肺气肿和哮喘等。颗粒尺寸是决定颗粒进入呼吸系统深度的重要因素[1]。一些细小的颗粒可以吸入并沉积在肺泡引起感染和炎症, 甚至形成肿瘤病灶[2]; 此外, 有些病毒和病菌也可直接入侵肺泡引发疾病, 如吸入性炭疽病是由一定数量1~5 μm的病原体侵入引发[3]。因此肺部颗粒运动机制有助于人们预防和治疗呼吸系统疾病。其中, 肺吸入给药是一种治疗呼吸系统疾病的重要方法。作为一种非侵入性治疗途径, 吸入给药可有效治疗肺炎、肺气肿、间质性肺疾病和囊性纤维化等疾病, 其中肺泡区是吸入性药物沉积和吸收的功能靶点[4]。在某些情况下(如深部肺吸入治疗), 吸入给药过程中药物液滴或颗粒主要在肺泡区沉积吸收, 液滴或颗粒的大小和吸入方式需要进行特殊设计, 如果在上呼吸道过度沉积则会导致严重不良反应, 如戊烷脒[5]。因此, 研究肺部颗粒运动机制具有重要的科学意义和临床应用价值。但目前的研究进展尚不完善, 原因是肺部的复杂结构。
肺是进行气体交换的复杂器官。人肺中的肺泡空间约占肺内总体积的90%, 肺泡数量达2.74~7.9亿之多[6]。肺部结构复杂, 目前直接进行实验研究仍存在很多技术困难。近年来, 计算流体力学(computational fluid dynamics, CFD) 方法发展迅速, 在处理复杂几何边界上占据独特优势, 计算流体力学方法逐渐成为肺部颗粒运动机制的主要数值模拟方法。本文对肺部颗粒运动机制的生物学、物理学和数值模拟模型进行了总结和评述, 对当前出现的新兴方法的应用前景进行了展望, 本文的归纳和总结工作可为肺部颗粒运动机制模型研究及应用提供参考。
1 生物学研究模型对于可吸入药物在肺部的分布和沉积, 目前应用的生物学方法包括体内成像法和药代动力学方法[7], 以此构建生物学研究模型。将成像技术与药代动力学相结合是测量药物靶向沉积的有效手段。
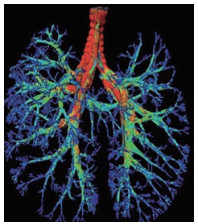
1.1 体内成像法二维伽玛相机[8]广泛应用于体内成像的研究中, 可以直接提供吸入药物的剂量和沉积位置信息, 但将二维成像与实际肺部结构对应存在一定困难; 三维成像方法主要有单光子发射计算机断层成像和正电子发射断层成像, 可以提供准确的高度特异性数据。最近, Sun等[9]通过先进的显微光学切片断层成像系统结合全肺染色技术获得了高精度可视化小鼠肺部解剖结构, 并应用荧光微光学技术, 首次同时揭示了小鼠肺部的复杂结构以及肺内可吸入颗粒物的区域特定分布模式和与结构相关的沉积, 有助于填补体外与体内分析结构的空白, 这种全面高分辨率的3D检测, 为评估颗粒运动分布提供了一种新颖策略(图 1)。
|
Figure 1 The airway tree created by micro-optical sectioning tomography coupled with whole lung Nissl-staining. (Adapted from Ref. 9 with permission. Copyright © 1999-2021 John Wiley & Sons, Inc.) |
药代动力学方法以定量血液或血浆中药物浓度为主要依据来评估药物在肺部的吸收效果[10, 11], 但不能提供肺内准确的沉积位置信息。妥布霉素经静脉注射和雾化给药后, 用药代动力学方法分别分析了两种给药途径的局部肺间质间隙液、上皮衬层液和血浆中妥布霉素的浓度和分布[12], 雾化给药方式实现了肺部的药物蓄积, 证明雾化给药方式的药效更佳。该方法可以获得准确的体内药物数据, 但需要进一步的研究来讨论其他参数对于实验的影响, 以验证结果的准确性。
2 物理学研究模型物理学研究模型是在体外建立实物模型模拟肺部某些结构, 结合生理数据进行实验研究。虽然生物学研究模型可以提供最准确的实验结果, 但成本高、耗时长且存在辐射对人体有害, 无法进行多种条件分析和机制性研究。相比之下, 通过模拟肺组织或制作微流控芯片构建物理学研究模型进行实验, 成本低、操作简单, 气流和颗粒运动可以精准控制。
2.1 实物实体建模法目前, 模拟肺组织构建的物理模型小部分是直接实验开展研究[13], 大部分是为了进行计算机仿真模型的验证[14]。用3D打印技术基于支气管数值模拟模型制作物理模型, 使用磁共振测速仪测量肺内速度场, 验证CFD模拟结果的准确性(图 2), 并证明了气管壁面的剪切力散度可以预测该区域表面的颗粒沉积量[15]。基于立体蚀刻技术和根据电子计算机断层扫描(computed tomography, CT) 的图像建立带有肺泡附着的肺泡管物理模型, 并使用粒子图像测速法分析流场, 认为非相似和壁面运动的肺泡流会促进颗粒混合和沉积[16]。物理模型模拟了真实腺泡区的几何形状, 有助于了解真实腺泡变形对流场的影响, 为研究者们提供了一个新颖的实验思路。

|
Figure 2 The experimental and numerical models. (Adapted from Ref. 15 with permission. Copyright © 2020 Elsevier Ltd.). LUL: Left upper lobe; LLL: Left lower lobe; RUL: Right upper lobe; RML: Right middle lobe; RLL: Right lower lobe |
微流控芯片可以提供操作性更好的平台, 进行肺部颗粒运动机制研究和药物检测[17]。研究肺泡流动时, 构建包含一个肺泡的微流控芯片, 利用注射泵控制肺泡内流体流动和肺泡壁的扩张, 实现动态模拟。采用粒子成像测速仪观察流型和流速, 并与数值模拟结果比较, 表明肺泡内存在复杂的混沌流动[18]。
3 数值模拟模型数值模拟模型是利用计算机编程建模, 将实际问题转变成数值计算, 结合实验数据进行模拟研究。相比于生物学研究模型和物理学研究模型, 数值模拟模型具有更大的优势, 可以解决生物学研究和物理学研究中无法解决的难题。
3.1 呼吸道数值模型呼吸道的结构十分复杂, 模拟呼吸道的数值模型主要包括Weibel模型、基于现代成像技术的真实模型和计算机合成模型, 相比之下, 这些模型可以更好地揭示肺部颗粒运动机制, 为评估颗粒污染和优化雾化给药提供理论依据。
3.1.1 Weibel模型Weibel模型是由各种样式的圆柱体组合构成的对称分叉的支气管结构, 是由Weibel创立的最早肺部模型[19], 目前一些研究的呼吸道模型是基于Weibel模型构建[20-22]。在Weibel模型的基础上, 将球形肺泡附加在导管上, 建立一个完整的人体气道模型[23], 便于模拟人体腺泡区的气流场。尽管Weibel模型方便计算, 但研究中无法考虑气道分支模式的不对称性, 数值模拟存在局限。
3.1.2 基于现代成像技术的真实模型现代医学成像技术的发展, 已经可以构建包含解剖复杂细节的呼吸道模型。计算机断层扫描成像和磁共振成像是目前主要使用的成像方式[24-27]。CT扫描模型可以研究不同吸入流速在真实的人体气道模型中的流动现象[28], 研究结果有助于医生了解人体气道的复杂气流运动。
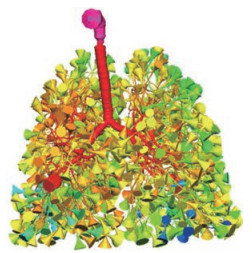
3.1.3 计算机合成模型Weibel模型过于理想化, 而基于现代成像技术的真实模型包含的参数过多, 不便于模拟研究。计算机合成模型相比于Weibel模型更真实, 与基于现代成像技术的真实模型相比研究设计上更为灵活多变, 使用计算机合成模型进行实验的研究越来越多[29]。由4种算法开发的Kitaoka模型与经典Weibel模型的仿真结果进行比较, 表明Kitaoka模型在模拟不同条件下颗粒沉积有更大的潜力[30]。截断的基于CT扫描的准3D模型继续延伸, 在气管的出口创建囊喇叭模型代表肺泡, 合成准3D全肺模型[31] (图 3)。结果表明, 合成的准3D全肺模型可以有效地应用于多个呼吸周期循环的颗粒运输和沉积模拟。
|
Figure 3 Construction diagram of lung model. (Adapted from Ref. 31 with permission. Copyright © 2021 Society for Computational Design and Engineering) |
计算机合成模型中也包括局部肺模型, 由呼吸性细支气管、肺泡导管和肺泡囊组成的理想腺泡区模型用来研究腺泡流, 发现混沌腺泡流的不可逆性会影响深肺区的颗粒运动[32]。此研究使用的肺泡模型可以实现壁面运动, 模拟呼吸的扩张和收缩过程, 为肺部腺泡区域颗粒运动研究提供了一种很好的思路。
3.2 流体描述模型胸外呼吸道是呼吸系统的入口, 包括鼻道、口、喉和咽。研究胸外区的气流特性是利用呼吸道模型开展模拟研究的首要步骤。呼吸过程中, 胸外区的气流是湍流, 目前在模拟胸外区流动特性的研究中, 常用的模型有直接数值模拟(direct numerical simulation, DNS) 模型、平均雷诺纳维斯托克斯(Reynolds-averaged navier-stokes, RANS) 模型和大涡模拟(large eddy simulation, LES) 模型。
3.2.1 DNS模型DNS模型可以数值模拟所有的湍流类型, 是目前最精准的湍流模型, 但计算成本较高, 目前采用DNS模型进行的肺泡颗粒运动研究较少。
3.2.2 RANS模型RANS模型在肺部颗粒运动研究中最为常用[33, 34], 根据求解额外雷诺应力项的方法不同, 分成不同的具体求解公式。RANS模型用来模拟湍流, 匹配数值计算结果与实验数据, 分析不同湍流模型的精度、效率和耗时[35], 总的来说, RANS模型的应用面广, 计算效率更高。
3.2.3 LES模型LES模型明确考虑了瞬时湍流涨落对粒子轨迹的影响, 因此可以表征湍流的各向异性, 较适合模拟气道中的过渡流[36]。LES模型在肺部颗粒运动研究中的应用已经越来越多[14, 15, 27, 37]。综合湍流精度和计算成本考虑, LES模型是最佳的湍流模型。
3.3 颗粒描述模型 3.3.1 球型在肺部颗粒运动的数值模拟研究中, 球型颗粒是最常用的颗粒模型[38-40]。在空气中自然漂浮的可吸入微颗粒大多数近似为球型, 在雾化给药过程中, 大多数研究依旧使用传统球型颗粒, 其他形状的颗粒性质尚不完全清楚。
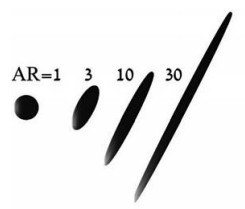
3.3.2 椭球型椭球型颗粒的空气动力学特性, 使颗粒在深肺区域的沉积能力更强[41]。因为细长的球体往往与呼吸气流的方向保持一致, 在重力作用下具有更大的阻力抵抗沉降, 在空气中停留的时间更长[42]。模拟不同尺寸和长宽比的细长颗粒在腺泡内沉积的情况(图 4), 结果证明4~6 μm的长颗粒沉积效率较高[5]。在雾化给药的设计研究中, 椭球型纤维是目前最有潜力的颗粒形状, 其性质和运动力学有很大研究价值。
|
Figure 4 Schematic of particles with varying aspect ratio for a fixed volume. (Adapted from Ref. 5 with permission. Copyright © 2019 Elsevier B.V.). AR: Aspect ratio |
颗粒在肺部的运动是由颗粒的受力决定的, 不同大小的颗粒受力情况不尽相同。目前的研究主要分为微米级颗粒和纳米级颗粒。
3.4.1 微米级颗粒目前的肺部颗粒运动的数值模拟研究中, 主要的研究对象是微米级颗粒。微米级颗粒的运动主要受到气流和自身重力的影响。重力的大小与颗粒的质量成正比, 气流对于颗粒运动的影响很大程度上取决于颗粒的物理特性和局部流场[43]。重力是影响颗粒沉积的主要因素, 颗粒的总体运动方向与重力方向基本一致, 运动速率与重力大小成正比。
3.4.2 纳米级颗粒纳米级颗粒在空气中可能与其他污染物颗粒结合, 由肺吸入造成更大的危害[2]。因此, 纳米级颗粒的研究对于环境健康风险的评估有重要意义。纳米级颗粒的运动由气流、自身重力和布朗运动的影响, 布朗运动预计对肺部纳米级颗粒运动产生重要影响。目前的研究很少有实现腺泡区纳米颗粒布朗运动的模拟, 在复杂多项力耦合方面, 仍然存在困难。
3.5 偏微分方程求解模型以上数值方法中, 主要涉及的结构和流动都需要求解偏微分方程(组)。从使用建模工具和求解方法差异的角度, 相应数值求解方法常见的有有限差分法、有限体积法、有限元法、边界元法。近年来, 光滑粒子动力学方法和格子Boltzmann方法作为新兴的数值模拟方法引起了较大的关注, 本部分重点分析格子Boltzmann方法在建立相应模型中的应用前景。
3.5.1 有限差分法模型有限差分法是一种求解偏微分方程和方程组定解问题数值解的方法, 使用有限差分法数值求解气溶胶动力学方程进行研究, 结果表明粒径大于2.5 μm的大颗粒比粒径小于2.5 μm的小颗粒在深肺区域沉积的更多[20]。有限差分法在模拟肺部颗粒运动的研究中具有形式简单, 使用灵活的优点, 但是对计算条件要求严格, 应用范围小。
3.5.2 有限体积法模型有限体积法基于积分形式的守恒方程, 着重从物理观点构造离散方程, 每一个离散方程都是有限体积上某种物理量守恒的表示式。目前在模拟肺部流场过程中, 常用的软件是Fluent, 该软件针对不同领域的现象采用不同的离散格式和数值方法, 可以高效地解决各个领域的复杂流动计算问题。
在上呼吸道3D模型中采用Fluent软件和SIMPLE算法对呼吸道内的流场进行模拟, 并改进求解椭球体纤维在瞬态流动中的运动方程, 实验证明适当等效风速的稳态模拟方法可以较准确地预测循环呼吸过程中纤维粒子的总沉积量[44]。基于现实呼吸道, 模拟单一气道路径, 使用商用软件Fluent数值模拟肺部流场, 结果表明粒径小于15 μm且吸气流量大于30 L·min-1的药物颗粒才能顺利进入下呼吸道[45]。
使用基于有限体积法的Fluent软件, 可以实现肺部定常及非定常流动模拟, 其动网格技术可以解决肺部因呼吸过程而产生的边界运动问题, 但不太适用于对精度要求高的运动模拟。
3.5.3 有限元法模型有限元法是一种应用广泛的求解偏微分方程边值问题近似解的数值技术, 在研究肺部颗粒运动机制中常用的有限元软件有ANSYS、SDRC/I-DEAS和COMSOL等[46]。目前在模拟肺部流场过程中, 常用的软件是CFX, 采用了混合有限元的有限体积法, 精度高且物理模型丰富, 在处理流动物理现象简单而几何形状复杂的问题有很大优势。
在肺腺泡模型中通过在移动网格上使用非定常不可压缩层流求解器和商业CFX、PA软件求解三维NS方程来模拟肺泡流动, 结果证明近肺端的肺泡流以回流为主, 在远肺端以层流为主[23]。在研究磁场和流体力学耦合的实验中, 使用基于有限元方法的COMSOL软件进行建模和分析, 研究证明磁场的存在大大增强了磁性药物靶向沉积在肿瘤区域的沉积率[47]。
利用有限元方法可以耦合不同力学对于肺部流场的影响, 商用化软件成熟, 应用领域广泛, 但是在实验过程中的计算量较大, 计算速度较慢, 对于运动颗粒的模拟比较困难, 不太适合包含大规模肺泡的颗粒运动模拟。
3.5.4 边界元法模型边界元法与有限元法划分单元的基本思想不同, 边界元法是只在定义域的边界上划分单元, 用满足控制方程的函数去逼近边界条件。边界元法离散方便、精度高, 便于处理无限域, 但需要计算相当数量的奇异积分, 计算量较大, 目前还没有肺部颗粒运动研究应用边界元法。
3.5.5 光滑粒子动力学方法模型光滑粒子动力学方法的基本思想是将视作连续的流体(或固体) 用相互作用的质点组来描述, 各个物质点上承载各种物理量, 包括质量、速度等, 通过求解质点组的动力学方程和跟踪每个质点的运动轨道, 求得整个系统的力学行为。光滑粒子动力学方法容易处理不同介质的交界面, 适合求解动态大变形问题, 目前还没有在肺部颗粒运动研究中应用。
3.5.6 格子Boltzmann方法模型格子Boltzmann方法(lattice Boltzmann method, LBM) 是一种介于微观粒子与宏观参量之间的数值模拟方法, 相比于其他流场求解的方法, LBM可以更好地处理流场中的流固耦合问题, 在低雷诺数下的肺部颗粒运动模拟中具有巨大优势, 可以讨论更多实际问题对于肺部流场的影响。
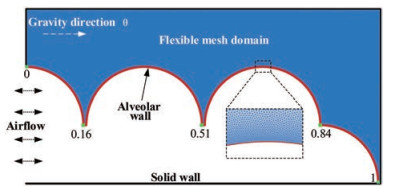
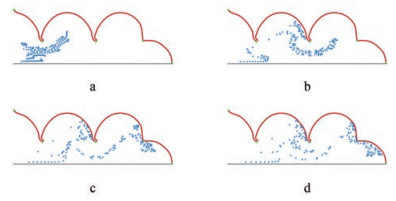
目前, 还没有使用LBM构建模型解决肺部颗粒运动机制的数值模拟, 但是综合以往LBM的应用[48-53], 作者认为利用该方法在可涨缩的肺泡中模拟颗粒的沉积是切实可行的, 以此探究各种生理因素及颗粒性质对于颗粒运动的影响, 这是值得研究的方向。本课题组建立了一个响应真实呼吸过程的末端肺腺泡模型(图 5)。选取腺泡区的部分末端腺泡进行数值建模, 构建的肺泡模型直径为400 μm, 末端肺腺泡区域由直径为200 μm的肺泡管与周围肺泡构成。该模型中的肺泡膜是连续可移动的壁面, 位置从0到1在图中标识。肺泡所处的弹性组织由一系列非结构化网格来模拟, 网格在肺泡边界形变时发生移动, 并对肺泡边界产生弹力, 以模拟肺组织对肺泡的弹性支撑作用。利用该模型进行10个呼吸周期的运动模拟, 分别将第1、4、7和10周期结束时的颗粒位置信息输出可视化, 颗粒在末端腺泡的分布结果有助于揭示肺部腺泡区颗粒运动机制(图 6)。
|
Figure 5 Model of terminal pulmonary acini |
|
Figure 6 Particle distribution diagram. a: T = 1; b: T = 4; c: T = 7; d: T = 10. T: Term |
目前, 在三维呼吸道模型中构建气流和颗粒耦合模型的方法主要有两种: 欧拉方法和拉格朗日方法。在欧拉方法中, 将颗粒视为连续相, 适用于较黏稠的悬浮液[54]; 拉格朗日方法中将颗粒视为离散相, 适用于分散相较稀薄的分散体系, 比如肺部颗粒运动。拉格朗日方法根据是否考虑颗粒间相互作用进一步分为离散粒子法和离散元法, 两种方法各有其应用情形[55]。
3.6.1 离散粒子法在肺部的流场中, 如果颗粒作为分散相足够稀薄, 对于流场没有影响, 可以忽略粒子间的相互作用, 那么可以采用离散粒子法研究颗粒在肺部的运动。目前的研究中, 大部分研究采用了离散粒子法[56-59], 因为研究中颗粒的密度远小于空气密度, 颗粒在肺部的运动主要受到自身重力和空气动力的影响。
3.6.2 离散元法在有些研究中, 颗粒浓度高, 存在多颗粒接触, 有必要考虑颗粒与颗粒、流体和壁面间的相互作用。离散元法将单个颗粒视为离散的元素, 明确考虑了颗粒与颗粒、颗粒与流体、颗粒与壁面之间的相互作用[60, 61]。目前, 离散元法广泛应用于雾化吸入产品的设计和评估[62, 63], 在肺部颗粒运动机制的研究中应用存在局限。
4 总结与展望近年来, 随着先进医学成像技术的发展, 数值模拟模型与实验数据相结合, 在肺部颗粒运动机制的研究中发挥了巨大作用。利用有限元法处理肺部呼吸道复杂几何形状和边界条件时较为方便, 并且有像ANSYS等大量成熟商用有限元软件帮助研究者们研究, 因此在目前肺部颗粒运动机制的计算流体力学研究中, 有限元方法占据主导地位。
使用数值模拟模型研究肺部颗粒运动存在诸多优点。首先, 呼吸道的几何参数、入口气流的压力、流速和管壁生理特性都可以根据真实的实验数据进行设置, 结果更为真实、准确; 其次, 数值模拟模型利用高性能计算平台进行调试运行, 节省时间和成本, 便于操作; 最后, 数值模拟结果可以快速进行可视化, 有专业的数据分析方法。这些因素令越来越多的研究者们使用数值模拟模型研究肺部颗粒运动机制。
根据数值模拟模型的研究成果, 可以开发更加高效地雾化给药装置, 根据患者的实际条件可针对性提供治疗方案, 减少雾化给药对于肺部产生的不良反应。然而, 目前的数值模拟模型并不能真实模拟全肺的呼吸运动, 主要研究领域在气管支气管区域, 在研究颗粒运动的实验中存在局限性。模拟肺泡区域的颗粒模型比较欠缺, 还需进一步研究考虑肺泡真实形态变化, 边界流动及气流流动规律的颗粒模型。目前肺部颗粒研究的方法较多较杂, 大部分不能针对一个特定的问题开展研究, 因此还需根据肺组织的不同形态特征建立标准的模型, 以研究颗粒的运动及沉积规律。目前缺乏相对系统的“全肺颗粒运动模型”, 这受限于肺组织的各结构特征尺度存在的巨大差异, 但在理论上可以逐级建模, 构建“全肺颗粒模型”。肺部的本质特征是可变形多孔介质, LBM对于复杂变形边界及多孔介质中的物质传递有较好的应用。因此, 该方法在未来有望成为研究肺部颗粒运动机制的主要方法, 值得关注。
作者贡献: 许都昌负责全文的撰写和文献整理; 赖开澄对文中的图片整理提供了帮助; 金义光参与了论文的构思和修改; 徐远清负责对论文进行整体的指导和修改。
利益冲突: 所有作者均声明无任何利益冲突。
| [1] |
Liu X, Rua D, Wokovich A, et al. Particle size distribution analysis of OTC aerosol or powder drug products with potential for inadvertent inhalation exposure to consumers[J]. J Pharm Sci, 2019, 108: 1506-1511. DOI:10.1016/j.xphs.2018.10.066 |
| [2] |
Islam MS, Paul G, Ong HX, et al. A review of respiratory anatomical development, air flow characterization and particle deposition[J]. Int J Env Res Pub Health, 2020, 17: 380. DOI:10.3390/ijerph17020380 |
| [3] |
Inglesby TV, Henderson DA, Bartlett JG, et al. Anthrax as a biological weapon: medical and public health management[J]. JAMA, 1999, 281: 1735-1745. DOI:10.1001/jama.281.18.1735 |
| [4] |
Patton JS, Byron PR. Inhaling medicines: delivering drugs to the body through the lungs[J]. Nat Rev Drug Discov, 2007, 6: 67-74. DOI:10.1038/nrd2153 |
| [5] |
Shachar-Berman L, Ostrovski Y, Koshiyama K, et al. Targeting inhaled fibers to the pulmonary acinus: opportunities for augmented delivery from in silico simulations[J]. Eur J Pharrm Sci, 2019, 137: 105003. DOI:10.1016/j.ejps.2019.105003 |
| [6] |
Ochs M, Nyengaard JR, Jung A, et al. The number of alveoli in the human lung[J]. Am J Resp Crit Care, 2004, 169: 120-124. DOI:10.1164/rccm.200308-1107OC |
| [7] |
Jaafar-Maalej C, Andrieu V, Elaissari A, et al. Assessment methods of inhaled aerosols: technical aspects and applications[J]. Expert Opin Drug Deliv, 2009, 6: 941-959. DOI:10.1517/17425240903117244 |
| [8] |
Dolovich M, Labiris R. Imaging drug delivery and drug responses in the lung[J]. Proc Am Thorac Soc, 2004, 1: 329-337. DOI:10.1513/pats.200404-030MS |
| [9] |
Sun X, Zhang X, Ren X, et al. Multiscale co-reconstruction of lung architectures and inhalable materials spatial distribution[J]. Adv Sci, 2021, 8: 2003941. DOI:10.1002/advs.202003941 |
| [10] |
Xiroudaki S, Ianni F, Sabbatini S, et al. Preparation, characterization and pharmacokinetics of an inhalable dry powder formulation of a new hydrophobic antibiotic derivative for the treatment of lung infections[J]. J Aerosol Med Pulm Drug Deliv, 2020, 33: 14-15. |
| [11] |
Pan LL, Zhong DF. Metabolism and pharmacokinetics of drugs applied for the treatment of corona virus disease 2019(COVID-19)[J]. Acta Pharm Sin (药学学报), 2020, 55: 2570-2579. DOI:10.1007/s12291-020-00919-0 |
| [12] |
Dhanani JA, Diab S, Chaudhary J, et al. Lung pharmacokinetics of tobramycin by intravenous and nebulized dosing in a mechanically ventilated healthy ovine model[J]. Anesthesiology, 2019, 131: 344-355. DOI:10.1097/ALN.0000000000002752 |
| [13] |
Su WC, Chen Y, Xi J. Estimation of the deposition of ultrafine 3D printing particles in human tracheobronchial airways[J]. J Aerosol Sci, 2020, 149: 105605. DOI:10.1016/j.jaerosci.2020.105605 |
| [14] |
Lizal F, Elcner J, Jedelsky J, et al. The effect of oral and nasal breathing on the deposition of inhaled particles in upper and tracheobronchial airways[J]. J Aerosol Sci, 2020, 150: 105649. DOI:10.1016/j.jaerosci.2020.105649 |
| [15] |
Farghadan A, Poorbahrami K, Jalal S, et al. Particle transport and deposition correlation with near-wall flow characteristic under inspiratory airflow in lung airways[J]. Comput Biol Med, 2020, 120: 103703. DOI:10.1016/j.compbiomed.2020.103703 |
| [16] |
Sera T, Kamiya N, Fukushima T, et al. Visualizing the flow patterns in an expanding and contracting pulmonary alveolated duct based on microcomputed tomography images[J]. J Biomech Eng, 2021, 143: 074501. DOI:10.1115/1.4050285 |
| [17] |
Elias-Kirma S, Artzy-Schnirman A, Das P, et al. In situ-like aerosol inhalation exposure for cytotoxicity assessment using airway-on-chips platforms[J]. Front Bioeng Biotech, 2020, 8: 91. DOI:10.3389/fbioe.2020.00091 |
| [18] |
Lv H, Dong J, Qiu Y, et al. Microflow in a rhythmically expanding alveolar chip with dynamic similarity[J]. Lab Chip, 2020, 20: 2394-2402. DOI:10.1039/C9LC01273G |
| [19] |
Weibel ER, Cournand AF, Richards DW. Morphometry of the Human Lung[M]. Berlin: Springer, 1963.
|
| [20] |
Deng Q, Deng L, Miao Y, et al. Particle deposition in the human lung: health implications of particulate matter from different sources[J]. Environ Res, 2019, 169: 237-245. DOI:10.1016/j.envres.2018.11.014 |
| [21] |
Manshadi MK, Saadat M, Mohammadi M, et al. Magnetic aerosol drug targeting in lung cancer therapy using permanent magnet[J]. Drug deliv, 2019, 26: 120-128. DOI:10.1080/10717544.2018.1561765 |
| [22] |
Hofmann W. Regional deposition: deposition models[J]. J Aerosol Med Pulm Drug Deliv, 2020, 33: 239-248. DOI:10.1089/jamp.2020.29031.wh |
| [23] |
Kolanjiyil AV, Kleinstreuer C. Modeling airflow and particle deposition in a human acinar region[J]. Comput Math Methods Med, 2019, 2019: 5952941. |
| [24] |
Usmani OS, Mignot B, Kendall I, et al. Predicting lung deposition of extrafine inhaled corticosteroid-containing fixed combinations in patients with chronic obstructive pulmonary disease using functional respiratory imaging: an in silico study[J]. J Aerosol Med Pulm Drug Deliv, 2021, 34: 204-211. DOI:10.1089/jamp.2020.1601 |
| [25] |
Usmani OS, Scichilone N, Mignot B, et al. Airway deposition of extrafine inhaled triple therapy in patients with COPD: a model approach based on functional respiratory imaging computer simulations[J]. Int J Chronic Obstr, 2020, 15: 2433. |
| [26] |
Meerburg JJ, Andrinopoulou ER, Bos AC, et al. Effect of inspiratory maneuvers on lung deposition of tobramycin inhalation powder: a modeling study[J]. J Aerosol Med Pulm Drug Deliv, 2020, 33: 61-72. DOI:10.1089/jamp.2019.1529 |
| [27] |
Islam MS, Saha SC, Gemci T, et al. Euler-lagrange prediction of diesel-exhaust polydisperse particle transport and deposition in lung: anatomy and turbulence effects[J]. Sci Rep, 2019, 9: 12423. DOI:10.1038/s41598-019-48753-6 |
| [28] |
Kumar B, Srivastav VK, Jain A, et al. Study of numerical schemes for the CFD simulation of human airways[J]. Int J Eng Sci, 2019, 11: 32-40. |
| [29] |
Su WC, Chen Y, Xi J. A new approach to estimate ultrafine particle respiratory deposition[J]. Inhal Toxicol, 2019, 31: 35-43. DOI:10.1080/08958378.2019.1576808 |
| [30] |
Kim Y, Tong Z, Chan H, et al. CFD modelling of air and particle flows in different airway models[J]. J Aerosol Sci, 2019, 134: 14-28. DOI:10.1016/j.jaerosci.2019.04.015 |
| [31] |
Kannan RR, Singh N, Przekwas A, et al. A quasi-3D model of the whole lung: airway extension to the tracheobronchial limit using the constrained constructive optimization and alveolar modeling, using a sac-trumpet model[J]. J Comput Des Eng, 2021, 8: 691-704. |
| [32] |
Ciloglu D. A numerical study of the aerosol behavior in intra-acinar region of a human lung[J]. Phys Fluids, 2020, 32: 103305. DOI:10.1063/5.0024200 |
| [33] |
Bass K, Boc S, Hindle M, et al. High-efficiency nose-to-lung aerosol delivery in an infant: development of a validated computational fluid dynamics method[J]. J Aerosol Med Pulm Drug Deliv, 2019, 32: 132-148. DOI:10.1089/jamp.2018.1490 |
| [34] |
Guo Y, Wei J, Ou C, et al. Deposition of droplets from the trachea or bronchus in the respiratory tract during exhalation: a steady-state numerical investigation[J]. Aerosol Sci Tech, 2020, 54: 869-879. DOI:10.1080/02786826.2020.1772459 |
| [35] |
Issakhov A, Bulgakov R, Zhandaulet Y. Numerical simulation of the dynamics of particle motion with different sizes[J]. Eng Appl Comp Fluid, 2019, 13: 1-25. |
| [36] |
Koullapis P, Nicolaou L, Kassinos SC. In silico assessment of mouth-throat effects on regional deposition in the upper tracheobronchial airways[J]. J Aerosol Sci, 2018, 117: 164-188. DOI:10.1016/j.jaerosci.2017.12.001 |
| [37] |
Nicolaou L, Checkley W. Differences between cigarette smoking and biomass smoke exposure: an in silico comparative assessment of particulate deposition in the lungs[J]. Environ Res, 2021, 197: 111116. DOI:10.1016/j.envres.2021.111116 |
| [38] |
Zhao J, Feng Y, Bezerra M, et al. Numerical simulation of welding fume lung dosimetry[J]. J Aerosol Sci, 2019, 135: 113-129. DOI:10.1016/j.jaerosci.2019.05.006 |
| [39] |
Gurumurthy A, Kleinstreuer C. Helical fluid-particle flow dynamics for controlling micron-particle deposition in a representative human upper lung-airway model[J]. J Aerosol Sci, 2021, 151: 105656. DOI:10.1016/j.jaerosci.2020.105656 |
| [40] |
Ou C, Jian H, Deng Q. Particle deposition in human lung airways: effects of airflow, particle size, and mechanisms[J]. Aerosol Air Qual Res, 2020, 20: 2846-2858. DOI:10.4209/aaqr.2020.02.0067 |
| [41] |
Farkas Á, Lizal F, Elcner J, et al. Numerical simulation of fibre deposition in oral and large bronchial airways in comparison with experiments[J]. J Aerosol Sci, 2019, 136: 1-14. DOI:10.1016/j.jaerosci.2019.06.003 |
| [42] |
Shachar-Berman L, Ostrovski Y, De Rosis A, et al. Transport of ellipsoid fibers in oscillatory shear flows: implications for aerosol deposition in deep airways[J]. Eur J Pharrm Sci, 2018, 113: 145-151. DOI:10.1016/j.ejps.2017.09.023 |
| [43] |
Haber S, Yitzhak D, Tsuda A. Gravitational deposition in a rhythmically expanding and contracting alveolus[J]. J Appl Physiol, 2003, 95: 657-671. DOI:10.1152/japplphysiol.00770.2002 |
| [44] |
Kiasadegh M, Emdad H, Ahmadi G, et al. Transient numerical simulation of airflow and fibrous particles in a human upper airway model[J]. J Aerosol Sci, 2020, 140: 105480. DOI:10.1016/j.jaerosci.2019.105480 |
| [45] |
Fernández-Tena A, Barrio-Perotti R, Blanco-Marigorta E, et al. In silico prototype of a human lung with a single airway to predict particle deposition[J]. Int J Numer Meth Bio, 2020, 36: e333. |
| [46] |
Buess A, Sobac B, Mauroy B, et al. Energy dissipation in an asymmetric tracheobronchial tree: a CFD analysis[C]//Proceedings of the 27th Canadian Congress of Applied Mechanics. Sherbrooke: Université de Sherbrooke, 2019.
|
| [47] |
Sabz M, Kamali R, Ahmadizade S. Numerical simulation of magnetic drug targeting to a tumor in the simplified model of the human lung[J]. Comput Meth Prog Bio, 2019, 172: 11-24. DOI:10.1016/j.cmpb.2019.02.001 |
| [48] |
Ma J, Wang Z, Young J, et al. An immersed boundary-lattice Boltzmann method for fluid-structure interaction problems involving viscoelastic fluids and complex geometries[J]. J Comput Phys, 2020, 415: 109487. DOI:10.1016/j.jcp.2020.109487 |
| [49] |
Sui Y, Chew Y, Roy P, et al. Inertia effect on the transient deformation of elastic capsules in simple shear flow[J]. Compu Fluids, 2009, 38: 49-59. DOI:10.1016/j.compfluid.2007.11.006 |
| [50] |
Tian FB. Deformation of a capsule in a power-law shear flow[J]. Comput Math Methods Med, 2016, 2016: 7981386. |
| [51] |
Wang Z, Wei Y, Qian Y. A bounce back-immersed boundary-lattice Boltzmann model for curved boundary[J]. Appl Math Model, 2020, 81: 428-440. DOI:10.1016/j.apm.2020.01.012 |
| [52] |
Wei Q, Xu YQ, Tang XY, et al. An IB-LBM study of continuous cell sorting in deterministic lateral displacement arrays[J]. Acta Mech Sin, 2016, 32: 1023-1030. DOI:10.1007/s10409-016-0566-2 |
| [53] |
Zhu L, Yu X, Liu N, et al. A deformable plate interacting with a non-Newtonian fluid in three dimensions[J]. Phys Fluids, 2017, 29: 083101. DOI:10.1063/1.4996040 |
| [54] |
Dehbi A. A CFD model for particle dispersion in turbulent boundary layer flows[J]. Nucl Eng Des, 2008, 238: 707-715. DOI:10.1016/j.nucengdes.2007.02.055 |
| [55] |
Ohsaki S, Mitani R, Fujiwara S, et al. Numerical simulation of particle motions in cascade impactor and human respiratory system[C]//Proceedings of the MATEC Web of Conferences. Les Ulis: EDP Sciences, 2021.
|
| [56] |
Koullapis P, Hofemeier P, Sznitman J, et al. An efficient computational fluid-particle dynamics method to predict deposition in a simplified approximation of the deep lung[J]. Eur J Pharm Sci, 2018, 113: 132-144. DOI:10.1016/j.ejps.2017.09.016 |
| [57] |
Ahookhosh K, Saidi M, Aminfar H, et al. Dry powder inhaler aerosol deposition in a model of tracheobronchial airways: validating CFD predictions with in vitro data[J]. Int J Pharm, 2020, 587: 119599. DOI:10.1016/j.ijpharm.2020.119599 |
| [58] |
Beni HM, Aghaei F, Kamalipour S. Experimental tracking and numerical mapping of novel coronavirus micro-droplet deposition through nasal inhalation in the human respiratory system[J]. Biomech Model Mechanobiol, 2021, 20: 1087-1100. DOI:10.1007/s10237-021-01434-8 |
| [59] |
Feng Y, Zhao J, Hayati H, et al. Tutorial: understanding the transport, deposition, and translocation of particles in human respiratory systems using computational fluid-particle dynamics and physiologically based toxicokinetic models[J]. J Aerosol Sci, 2021, 151: 105672. DOI:10.1016/j.jaerosci.2020.105672 |
| [60] |
Sommerfeld M, Cui Y, Schmalfuß S. Potential and constraints for the application of CFD combined with Lagrangian particle tracking to dry powder inhalers[J]. Eur J Pharrm Sci, 2019, 128: 299-324. DOI:10.1016/j.ejps.2018.12.008 |
| [61] |
Ostrovski Y, Dorfman S, Mezhericher M, et al. Targeted drug delivery to upper airways using a pulsed aerosol bolus and inhaled volume tracking method[J]. Flow Turbul Combust, 2019, 102: 73-87. DOI:10.1007/s10494-018-9927-1 |
| [62] |
Magramane S, Pápay Z, Turbucz B, et al. Formulation and characterization of pulmonary drug delivery systems[J]. Acta Pharm Hung, 2019, 89: 63-83. |
| [63] |
Walenga RL, Babiskin AH, Zhao L. In silico methods for development of generic drug-device combination orally inhaled drug products[J]. CPT Pharm Sys Pharmcol, 2019, 8: 359-370. DOI:10.1002/psp4.12413 |
 2021, Vol. 56
2021, Vol. 56


