肺部给药是一种非侵入式给药方式。与口服给药比较, 肺部具有大的吸收比表面积, 且肺泡上皮细胞层薄(0.1~0.2 µm), 药物透过距离短, 小分子能迅速被身体吸收, 生物利用度较高。此外, 肺部的代谢酶活性低, 对蛋白质类和多肽类药物的降解作用小[1, 2]。与注射给药相比, 肺部给药更方便, 患者顺应性高。肺部给药方式可将药物直接递送于肺部组织, 特别适合肺部疾病的治疗, 同时可能减少全身毒副作用。因此肺部给药常用于治疗哮喘和慢性阻塞性肺疾病等肺部疾病。因为肺部组织的生理特点和快速吸收特点, 肺部给药也可用于治疗肺外疾病, 如糖尿病[3]。
对于有效的肺部药物递送, 颗粒的物理特性至关重要, 给药颗粒的几何直径(geometric diameter, Dg) 和空气动力学直径(aerodynamic diameter, Da) 是两个最关键的因素[4]。Dg是由动态光散射法测得颗粒的质量相当几何直径的平均值[4, 5], 而Da是静止空气中与实际粒子作相同重力沉降速度的单位密度(1 g·cm-3) 球体粒子的直径, 相当于在空气中受重力作用以相同速度降落的水滴的直径[5], 决定颗粒随气流进入肺部后的行为, 还决定了颗粒在肺部的沉积位置[4, 6]。通常, Da为1~5 µm的颗粒被认为适合沉积在肺深处[2]。然而传统吸入颗粒的密度大(ρ > 1 g·cm-3), 要求Dg < 3 µm才能有效沉积于肺部, 而Dg < 5 µm的颗粒容易受范德华力和静电力的作用出现团聚, 并容易被肺泡巨噬细胞吞噬, 从而降低了药物的局部作用[7]。此外, 传统的吸入制剂需要频繁给药, 患者依从性差, 并因缺乏缓控释作用而容易导致肺局部毒性[8, 9]。有研究表明, 在聚合物微球制备过程中加入适量致孔剂, 制成具有大Dg (> 5 µm) 和低密度(ρ < 0.4 g·cm-3) 高分子多孔微球(porous polymer microspheres, PPMS) (图 1)[10], 不仅分散性好、不易团聚, 而且能逃避巨噬细胞的吞噬, 将药物成功递送至肺部, 此外, 因具有合适的Da (1~5 µm) 能实现药物在肺部的有效沉积, 生物利用度高[5, 7]。Zhu等[11]制备了一种载有冬凌草甲素的可吸入聚乳酸-羟基乙酸共聚物[poly(lactide-co-glycolide), PLGA] 大多孔微粒用于治疗原发性非小细胞肺癌(non-small cell lung cancer, NSCLC)。尽管Dg为10 µm, 但球体的Da仅为2.72 µm, 体外实验表明, 大部分冬凌草甲素能在巨噬细胞吞噬前进入肺周围环境, 更重要的是, 该微球喷入原发性NSCLC大鼠模型的肺部后能直接作用于癌细胞, 显示出良好的抗NSCLC效果。
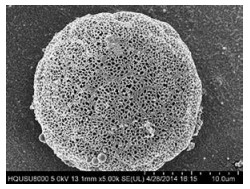
|
Figure 1 Scanning electron microscopy (SEM) image of poly(L-lactide) (PLLA) porous microspheres. (Quoted from Ref. 10. The image by Wang Y et al. is licensed under a Creative Commons Attribution 4.0 International License, no change from original). The PLLA porous microspheres was prepared in a high-voltage electrostatic anti-solvent process with the geometric diameter (Dg) is 19.1 ± 0.4 µm, the density is 0.289 ± 0.004 g·cm-3 and the aerodynamic diameter (Da) is 4.2 ± 0.2 µm |
PPMS是具有广阔发展前景的肺部给药的载体, 通常采用具有良好生物降解性的天然或合成的聚合物制成, 如壳聚糖、明胶、PLGA、聚乳酸[poly(lactic acid), PLA][12]等, 对正常肺部组织不造成影响[13, 14], 已广泛用作小分子、核酸和蛋白质等多种类型药物的载体[15]。PPMS能保护药物不被酶水解, 使药物缓慢释放, 且微球不易吸湿、稳定性和分散性好, 通过改变制备工艺, 可获得粒径、形貌和孔隙率等均符合肺部给药要求的微球。此外, PPMS具有靶向性, 能减少药物特别是肿瘤药物对正常肺组织的毒性[16]。PPMS适用作为肺部给药载体的潜能引起了越来越多研究者的兴趣。但制备适合肺部给药的PPMS (即满足Da在1~5 µm之间、Dg > 5 µm的要求) 需要对制备材料、制备方法和致孔剂等进行工艺参数控制, 给研究者提出了具有挑战性的技术方面的要求。本文结合肺部的清除机制, 归纳总结PPMS的制备材料、方法及其质量控制等, 为PPMS的深入研究提供参考。
1 肺部清除机制肺部清除机制可以保护呼吸道免受外来物质的危害, 却也阻碍了肺部药物的输送。虽然肺部给药后药物能聚集于肺部, 但通常在肺部保留时间是短暂的, 药物在透过上皮细胞吸收前会经历肺部的清除。其中清除的方式包括黏膜纤毛清除、肺泡巨噬细胞吞噬和表面活性剂蛋白清除[9, 17, 18]。一般地, 沉积到气管、支气管里的药物被黏液黏附后随着黏膜纤毛的摆动会进入咽喉, 进而进入胃肠道被清除, 或随咳嗽排出体外[19, 20]; 沉积到肺部区域的药物多被肺泡巨噬细胞的内吞作用吞噬, 尤其是大分子蛋白质和多肽类生物药, 被吞噬的异物有的从肺泡腔经呼吸道黏液流动和纤毛运动而被咳出, 有的进入肺淋巴管内在黏液的作用下被清除出体外[17, 20]。肺泡巨噬细胞吞噬是肺部给药最主要的清除方式。此外, 由Ⅱ型肺泡细胞分泌的少量表面活性剂蛋白(surfactant proteins, SPs) 对药物和载体也有一定的降解清除作用, 其可促使某些药物黏合、凝集而更易被黏膜纤毛清除或被巨噬细胞识别吞噬[21]。
以上肺部的清除机制极大地限制了吸入药物在肺深部的滞留时长, 影响治疗效果。开发能有效沉积于肺深部又能逃避肺泡巨噬细胞吞噬的药物递送技术是提高肺部给药制剂治疗效果的必由之路。PPMS以生物相容性好的高分子聚合物为载体材料, 将药物包裹于微球内, 为开发有效逃避肺泡巨噬细胞吞噬而实现药物在肺部有效沉积的缓控释吸入制剂提供了一个新的途径。
2 肺部给药用PPMS的制备材料PPMS的材料选择是肺部给药制剂的关键。PPMS的制备材料应不会对正常肺部组织造成影响, 且具有良好的生物相容性和可降解性, 并能持续释放有些成分的性能。常用的制备PPMS的材料有天然高分子材料, 如壳聚糖、海藻酸钠、环糊精、明胶等; 合成高分子材料, 如PLGA、PLA、聚-L-丙交酯[poly(L-lactide), PLLA] 等[12]。天然高分子材料来源广泛, 生物相容性和生物降解性好, 能在机体生理环境下通过水解或酶解等多种方式降解成对人体无毒的物质, 且易于通过改性获得多种衍生物及不同性能的新材料。以N-[(2-羟基)-丙基-3-三甲基铵] 壳聚糖氯化物(N-[(2-hydroxyl)-propyl-3-trimethyl ammonium] chitosan chloride, HTCC) 为载体制备的包含环孢菌素A的多孔微球, 表现出良好生物相容性和肺部安全性, 且可以有效抑制哮喘大鼠模型的肺部炎症, 多孔HTCC微球是一类有前途的肺部药物递送的载体[22]。在合成的高分子材料中, PLGA和PLA是FDA批准使用的可生物降解的药用辅料[23, 24]。PLGA由于具有长期的临床应用、良好的降解特性和持续释药的性能, 已被广泛研究作为药物、蛋白质和各种其他大分子(DNA、RNA和肽) 的递送载体[23]。在所有已上市的微球产品中, PLGA是最常用的载体材料, 迄今为止, FDA共批准12种长效PLGA微球产品用于治疗内分泌失调、癌症、牙周炎和骨关节炎等[25]。尽管目前还没有用于肺部给药的PPMS相关产品成功上市, 但PPMS用于肺部给药有巨大潜能。以PLGA为载体制备的负载多柔比星的多孔微球具有良好的雾化特性和高包封率, 向C57BL/6小鼠肺部吹入此微球, 观察到微球在小鼠肺部停留长达14天, 并极大地降低了小鼠体内由B16F10细胞植入引起的转移性肺肿瘤的重量和数量, 且未对小鼠健康的肺组织产生明显的毒性作用, 以PLGA为载体的多孔微球通过吸入给药治疗肺癌具有巨大的潜力[7]。近年来, 采用脂质体作为基质制备多孔微球亦备受关注。此类脂质体微球(lipid microsphere, LM) 被证明可以提高难溶性药物的溶解度, 保护活性化合物免于生物降解或转化, 并能改变药物的生物分布使之远离敏感器官(心脏、肾脏和肌肉), 降低各种药物的毒性等[26], 是新型的药物靶向治疗载体。有研究者在Ca2+的交联作用下采用乳化-相分离法制备包载两性霉素B脂质体的海藻酸钠多孔微球, 测得Dg为8.0 µm, 药物包封率大于80%, 符合肺部给药的要求[27]。但LM的粒径因制备工艺的不同而差异明显[28], 用于肺部给药用的LM还需进一步工艺研究。表 1[23, 26, 29-33]总结了常用PPMS制备材料的概况。
| Table 1 Preparation materials of porous polymer microspheres (PPMS). PLGA: Poly(lactide-co-glycolide); PLA: Poly(lactic acid) |
为了保证肺部给药的有效性, PPMS的制备方法至关重要。PPMS是在微球制备的过程中加入适宜的致孔剂制备而成, 常用的制备方法有乳化-溶剂挥发法[34]、喷雾干燥法[35]、超临界流体法[36]、相分离法[37]、喷雾冷冻干燥技术[38]以及基于纳米粒的多孔微球制备技术[39]等。此外, 亦有学者采用微流控技术[40]和高压静电抗溶剂法[10]制备PPMS。这些方法各自存在需要克服的障碍, 尚未达到兼顾多孔微球的包封率、释放、溶剂无残留和形态大小等要求, 需要进一步收集具体药物、设备和处方的参数, 形成完善的标准操作程序后, 方能达到生产的要求。
3.1 双重乳化-溶剂挥发法乳化-溶剂挥发法是制备微球最经典的方法。PPMS由于使用致孔剂, 需要用内水相将其溶解, 故而改良的双重乳化-溶剂(W1/O/W2) 挥发法成了制备PPMS最流行的方法, 其原理如图 2所示。首先将聚合物和药物溶解在二氯甲烷(dichloromethane, DCM) 等非极性有机溶剂中形成油相, 将致孔剂水溶液(内水相) 在高剪切均质器的条件下分散于油相中制成W1/O初乳, 随后将制备好的W1/O乳液注入含聚乙烯醇[poly(vinyl alcohol), PVA] 的去离子水中(外水相), 在高剪切均质器条件下均质化形成W1/O/W2乳剂, 再在一定条件下除去挥发性有机溶剂, 得到多孔微球[34, 41]。该方法通过加入致孔剂来形成微球内部及表面的多孔结构, 有效地克服了传统方法所得微球孔道结构不理想和微球成形性差等缺点。常用的致孔剂有渗透性致孔剂, 如牛血清蛋白、羟丙基-β-环糊精等; 泡腾致孔剂, 如碳酸氢铵和碳酸氢钠等[42, 43]。Alipour等[34]通过改良的W1/O/W2挥发法, 以碳酸氢铵作为致孔剂, 制备负载紫杉醇的大孔颗粒(paclitaxel-loaded large porous particles, PTX-LPPs) 用于治疗肺癌。发现该颗粒具有良好的雾化性能, 于大鼠气管内给予PTX-LPPs后测得的生物利用度为(51 ± 7.1)%, 而且肺组织中紫杉醇浓度较高, 药效持续时间较长。但采用W1/O/W2挥发法制备PPMS需要使用致孔剂和有机溶剂, 这些必须完全除去以避免对机体造成任何可能的损害。
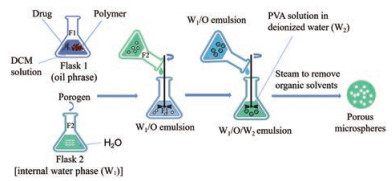
|
图 2 Preparation of PPMS by double emulsification-solvent evaporation method. DCM: Dichloromethane; PVA: Poly(vinyl alcohol) |
采用喷雾干燥法制备PPMS的步骤如图 3所示。将聚合物和待包封的药物全部溶解或悬浮在有机溶液中, 加入制备好的致孔剂水性溶液, 搅拌均匀后喷至惰性气流中形成无数的小液滴, 再控制温度使有机溶剂迅速蒸发, 高温下致孔剂分解使颗粒产生孔隙, 形成多孔微球[35, 44]。有研究采用喷雾干燥法制备负载利福平的多孔颗粒, 显示Da为4.8 ± 0.1 µm, 载药率为(91.8 ± 0.1)%, 实验研究发现, 小鼠喷雾给药的剂量为口服给药剂量一半时便能达到与口服给药相同的全身浓度, 并且喷雾给药组具有更短的达峰时间, 即使全身浓度低于检测限后, 肺中利福平的浓度仍可用于全身吸收或杀死细菌[35]。喷雾干燥法制备PPMS具有快速、方便和步骤参数简单等优势而更适合于工业化大批量的生产[23], 对亲水性及疏水性药物均适用, 但不适用于制备易高温变性的蛋白质和多肽类微球[32]。近年来出现的新型雾化器(喷嘴) 能够通过两个独立的通道供给液体进料, 从而实现连续生产, 并能简化制造工艺, 降低蛋白质和多肽类药物制备过程中变性的风险[45]。

|
Figure 3 Preparation of PPMS by spray drying method |
采用相分离法制备PPMS的步骤如图 4所示。将待包封的药物与聚合物溶解在有机溶剂(DCM) 中, 在连续超声的条件下, 将聚合物相添加到非溶剂物质中(矿物油), 使聚合物溶解度突然降低而从混合溶液中析出, 连续搅拌除去有机溶剂, 孔隙随溶剂扩散而形成, 最后经一定方法固化、洗涤和干燥, 得到多孔微球[46]。有研究者通过挥发溶剂使Pluronic F127相与聚合物相发生分离, 制备负载棕榈酰化exendin-4 (Ex4-C16) 的多孔微球, 测得Dg为16.2 ± 2.3 µm, Da为4.3 ± 0.5 µm[47]。将该多孔微球喷入小鼠肺中, 发现其能有效地沉积在小鼠的整个肺部, 此外, 这种吸附有Ex4-C16 (每只小鼠约100 µg) 的多孔微球在非禁食的2型糖尿病db/db小鼠中显示出持久的降血糖功效[47]。相分离法对亲水性药物成球性好, 但共聚物与表面活性剂对微球粒径大小、分布、包封率及体外释放性能影响较大, 需要进一步研究。
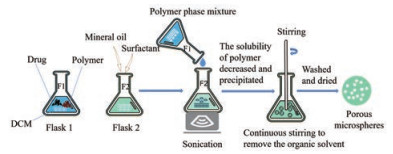
|
Figure 4 Preparation of PPMS by phase separation method |
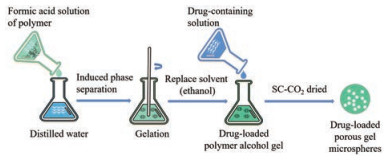
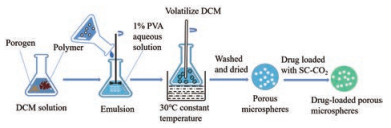
超临界二氧化碳流体法(supercritical carbon dioxide, SC-CO2) 在制备PPMS领域具有较明显的优势, CO2可以轻松地从介质中去除, 避免了耗能的溶剂去除步骤[48]。Lin等[49]使用SC-CO2技术制备载有胰岛素的PLLA多孔微球用于治疗糖尿病, 发现该微球无溶剂残留且能有效地沉积在气管和肺上叶的支气管中。SC-CO2可以在制备PPMS的过程中作为致孔剂[50]、干燥剂[51]及携带剂[52]等, 发挥多种作用。SC-CO2作为致孔剂时, 可通过悬浮聚合的方法制备PPMS (图 5)。将单体、引发剂、稳定剂和交联剂在氮气气氛中与水介质充分混合制备预乳液, 剧烈搅拌下, 混合物形成单体微滴并悬浮在水介质中, 将该预乳液转移到高压反应器中, 在一定温度下用磁耦合机械搅拌器搅拌, 最后让反应体系冷却至室温并释放压力后得到多孔微球[36]。在高压下, CO2部分溶于单体液滴, 从而被困在液滴内, 当压力释放时, 气态CO2从聚合物颗粒中逸出, 形成多孔表面。在聚合过程中SC-CO2发挥了致孔剂的作用, 可通过改变反应器内CO2的压力来控制微球的直径和孔径[36]。SC-CO2作为干燥剂时, 制备步骤(图 6) 是先将溶于甲酸的聚合物注入蒸馏水中形成非溶剂-溶剂(水-甲酸) 诱导相分离, 形成聚合物水凝胶, 其次溶剂(乙醇) 置换形成聚合物醇凝胶, 可同时在溶剂置换步骤加入药物使负载在凝胶上, 最后经SC-CO2干燥得到载药凝胶多孔颗粒[53, 54]。SC-CO2亦可作为携带剂, 将药物分子负载到PPMS上(图 7)。首先将致孔剂和聚合物载体溶于DCM中, 随后注入浓度为1%的PVA水溶液中, 在高速分散器下形成乳液, 之后置于30 ℃恒温水浴槽中, 搅拌5 h以挥发除去DCM, 待微球固化后用清水洗涤并干燥得到PPMS, 最后用SC-CO2携带药物分子进入微球孔隙, 制成载药PPMS[55]。采用SC-CO2制备PPMS能减少有机溶剂的残留, 避免毒性反应, 安全性较高, 而且条件温和, 特别适合对热不稳定的药物, 如蛋白质等[56], 在制备可吸入性生物大分子多孔微球用于肺部给药的研究上具有广阔的应用前景。
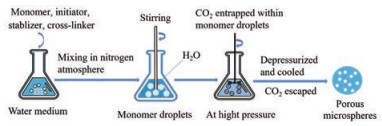
|
Figure 5 Supercritical carbon dioxide (SC-CO2) is used as a porogen in preparation of PPMS |
|
Figure 6 SC-CO2 is used as a desiccant in preparation of PPMS |
|
Figure 7 SC-CO2 is used as a carrier in preparation of PPMSS |
喷雾冷冻干燥技术(spray freeze drying, SFD) 是将溶液分散到冷冻介质中并通过升华干燥, 得到高孔隙率的具有球形的冻干颗粒的新型药物粒子化技术[57], 是传统喷雾干燥与冷冻干燥技术的结合, 包括雾化、冷冻和升华干燥3个步骤(图 8)[58]。SFD适用于热敏药物, 如肽或蛋白质类药物的生产[57], 并能最大限度地减少药物和赋形剂之间出现结晶或相分离的可能性[58]。此外, 冻结的样品经减压干燥后能快速生成粒径可控、表面膨松且流动性好的具有微孔结构的球形颗粒, 区别于喷雾干燥的团聚型产品和冷冻干燥的干饼状产品, 更适用于肺部给药[59]。Poursina等[38]采用SFD生产可吸入的鲑鱼降钙素微颗粒, 尽管颗粒的Dg为15~16 µm, 但颗粒呈高度多孔的球形, 这使得颗粒的密度非常小, 且颗粒的微细粒子分数(fine particle fraction, FPF) > 40%, 表现出良好的吸入性能。PPMS的粒径、形态及表面结构由SFD过程的工艺参数, 如喷嘴结构、喷液速度、药液性质(组成、浓度、黏度) 及雾化压力等因素决定, 因此在实际应用过程中可以通过优化雾化器装置、控制雾化的压力、喷液流速和药液黏度等以制备适用于肺部给药的颗粒[58, 60]。SFD允许生产具有不同粒径和密度的可流动颗粒, 尤其适用于制备肺部给药PPMS, 但是由于SFD工艺的多样性和复杂性, 运行SFD设置需要高水平的专业知识, 目前仍多处于实验室研究阶段[58], 用于规模化生产还有必要对其生产工艺进行进一步研究。

|
Figure 8 Preparation of PPMS by spray freeze drying (SFD) |
肺部吸入纳米粒(nanoparticle, NP) 技术在提高难溶性药物溶解度、增加药物的肺部靶向性并降低毒副作用等方面具有潜在的优势, 但由于NP的极低质量和内聚性, 粒子容易在吸入后被呼出且流动性差, 存在一定局限性[61]。为提高NP在肺部的沉积, 利用颗粒工程技术, 在产生高Péclet数的喷雾干燥条件下, 使NP通过物理力(如范德华力) 结合, 或嵌入赋形剂基质中, 进一步干燥使水蒸气逸出而形成多孔微粒[62]。这些纳米多孔微粒增大了NP的粒径(> 5 µm), 降低NP被巨噬细胞吞噬的可能, 改善了NP在肺部的沉积[62]。在一项研究中, 装载环丙沙星的聚乙二醇化邻苯二甲酰壳聚糖(polyethylene glycol grafted onto phthaloyl chitosan, PEG-g-PHCs) NP被包裹在可吸入和可膨胀的藻酸盐水凝胶微球中, 通过气管吹入大鼠肺部, 发现可溶胀微粒在肺组织的浓度高于对照组(乳糖与微粉化环丙沙星的混合物), 且在肺组织中停留长达7 h, 表明藻酸盐水凝胶微球改善了PEG-g-PHCs NP在肺部的沉积[39]。基于NP的多孔微球制备技术研究甚少, 用于肺部给药的纳米多孔微球仍需要更深入的研究。
3.7 其他制备方法除了上述PPMS制备方法外, 亦有学者采用微流控技术和高压静电抗溶剂法制备PPMS。郝浏智课题组[40]采用微流控技术成功制备负载ACS14的PLGA多孔微球, 测得其Dg > 5 µm, 而Da < 5 µm, FPF均大于50%, 将该多孔微球喷入大鼠肺部, 发现微球可以有效沉积于大鼠肺部, 并对肺动脉高压的模型大鼠起到一定的治疗作用。Wang等[10]采用高压静电抗溶剂一步法制备得到的PLLA多孔微球, 密度ρ < 0.4 g·cm-3, Dg为10~30 µm, Da为1~5 µm, FPF为56.3%, 满足肺部给药的要求。
4 肺部给药PPMS的质量控制肺部给药PPMS的质量控制主要涉及PPMS的理化性能和载药性能参数, 如PPMS的Dg、形态、孔隙率、体外释放、载药量和包封率等[46], 还与肺部给药的特征参数, 如Da和递送剂量均一性等有关, 这些参数对PPMS的安全性和生物利用度起重要作用。
4.1 PPMS的Dg和粒径分布颗粒的Dg及粒径分布(particle size distribution, PSD) 的均匀性被认为是表征吸入性能的关键[1]。通常使用动态光散射(dynamic light scattering, DLS)[4, 63]和扫描电子显微镜(scanning electron microscopy, SEM)[63]对PPMS的Dg和PSD进行表征。PPMS的Dg及粒径分布与制备过程的工艺参数, 如制备温度、压力、喷嘴直径、均质速度及制备材料的浓度等有关[64, 65]。一般地, PPMS的Dg随着温度的升高、压力和均质速度的增大而变小, 随着制备材料浓度的升高、喷嘴直径的变宽而变大[64, 65]。肺部给药颗粒的Dg太小则容易被肺泡巨噬细胞吞噬, 太大则难以离开吸入器, 因此, 在制备PPMS的过程中应对上述影响Dg的工艺参数进行合理设计, 使Dg控制在5~30 µm内才适合肺部递送[5]。
4.2 PPMS的表面形态颗粒的形态会对颗粒沉积产生重要影响。研究表明, 球形颗粒产生的FPF明显高于不规则颗粒[66]。PPMS的表面形态可以直接用显微镜或SEM观察[67, 68], 也可通过真空金溅射后采用显微镜或SEM观察, 喷金后可增强电子发射, 图像分辨率会提高[69]。PPMS的表面形态与制备材料的性质及发泡剂的浓度有关, 原因可能是不同材料在密度及溶解后有机相的黏度存在差异, 导致气泡的聚集和逸出的速度不同, 而发泡剂主要影响PPMS多孔性, 若发泡剂的浓度过低, 则孔道不明显; 若发泡剂的浓度过高, 则PPMS的整体结构会塌陷[65]。因此, 在制备过程中要对制备材料的性质进行评估及控制发泡剂的浓度在适当的范围内。
4.3 PPMS的比表面积和孔隙率PPMS的比表面积和孔隙率会对微球的释药速度和空气动力学性能产生影响。PPMS的比表面积和孔隙率可以在77 K的温度下, 通过BET (Brunauer-Emmett-Teller) 和BJH (Barrett-Joyner Halenda) 进行分析[70-72]。对于多孔微球, 比表面积随着孔隙率增大而变大, 因此可以通过控制多孔微球的孔隙率来获得合适的比表面积, 但目前还没有一个通用的办法可以很好地控制孔隙率。在许多研究中, 通过选择合适的致孔剂或调节其浓度在一定程度上可影响微球的孔隙率[73]。
4.4 PPMS的Da及肺部沉积药物颗粒的空气动力学性质极大地影响药物在肺部的吸收, 通常将PSD控制在适当范围内以优化颗粒在呼吸道内的沉积[66]。但对于多孔微球, PSD不是决定其空气动力学行为的唯一因素, Da更能表征吸入PPMS的空气动力学性能, Da与微球的Dg和密度(ρp) 有关, 三者的关系如公式(1) 所示[66, 74]。
| $ \mathrm{Da}=\mathrm{Dg} \sqrt{\frac{\rho_{\mathrm{p}}}{\rho^{*} \chi}} $ | (1) |
其中, ρp是颗粒的实际密度, ρ*为球形校准颗粒的参考密度(1.0 g·cm-3), χ为形态校正因子(球形粒子χ= 1)。由公式可见, 粒子的Dg、密度和形态均会对Da产生影响。Da决定颗粒在肺部的沉积部位, 通常认为Da为1~5 µm的粒子能沉积在细支气管[10, 14]。PPMS的肺部沉积可以通过测定微粒的体内外沉积来表征。PPMS的体内沉积可通过向清醒大鼠肺内吹入载药PPMS, 分别采用荧光显微镜和CT图像分析PPMS在组织切片和整个肺部的沉积情况[11]。体外沉积则常采用八级安德森级联撞击器法(andersen cascade impactor, ACI) 来分析[4, 75, 76]。将载药PPMS装入3号羟丙甲纤维素胶囊中, 以28.3 L·min-1的流速通过ACI抽吸30 s, 采用HPLC法测定每个隔室中药物的含量, 可吸入颗粒为直径 < 4.7 µm的颗粒(2~7级), 按公式(2) 计算载药PPMS体外肺沉积率[4]:
| $ \text { 体外肺沉积率 }(\%)=\frac{2 \sim 7 \text { 级的颗粒含量 }}{\text { 所有级别的颗粒总量 }} \times 100 \% $ | (2) |
载药量和包封率是反映微球制剂中药物含量的重要指标, 可作为综合评价指标对制备工艺进行筛选。PPMS的药物含量可通过将载药微球溶解在甲醇溶液中, 采用HPLC法测定[67], 载药量和包封率按公式(3) 和(4) 分别计算[77]:
| $ \text { 载药量 }=\frac{W_{1}}{W_{2}} \times 100 \% $ | (3) |
| $ \text { 包封率 }=\frac{W_{1}}{W_{3}} \times 100 \% $ | (4) |
其中, W1为多孔微球中的药物含量; W2为多孔微球的总重量; W3为投药总量。微球制剂的包封率要求不得低于80%。
4.6 肺部给药PPMS的体外释放吸附在PPMS表面的药物通过扩散的作用快速释放, 造成突释效应, 可能会导致人体内的药物浓度突然升高出现急性中毒反应, 因此必须要关注突释这一指标。可通过体外释放实验观察PPMS的突释效应。缓释制剂的体外长期释放测定通常是模拟药物在体内的真实释药情况[78], 常用的测试方法有: 样品分离法、膜透析法和流通池法[79]。改进的USP4装置法(也称流通池法) 被证明是一种适用于微球的体外释放测试方法, 其不仅可以最大程度地减少微球的聚集, 而且可以避免采样过程中微球的损失, 已被美国药典收载[80]。Rawat等[80]同时采用样品分离法与流通池法对PLGA微球进行体外释放度检测。结果发现, 流通池法能减少取样时微球的损失, 并能准确测定微球的累积释放百分比, 更接近真实释药情况。在实际操作时, 不同介质中药物的释放存在差异。由于肺部给药制剂进入肺部后主要受肺液的影响, 因此用于肺部给药用的PPMS的体外释放应该选择人工肺液作为释放介质, 使实验更接近药物在肺部的实际释放情况, 可得到好的体内外相关性结果。
由于PPMS制剂的释放周期长, 实时释放测试需要较长的时间, 这会影响产品批量释放的时间, 进而对产品的保质期产生负面影响, 因此有必要建立体外释放度的加速试验方法来快速有效地考察PPMS的体外释放行为[79]。几种因素(包括温度、pH、表面活性剂和酶) 可以加快微球的降解和药物扩散的速度, 从而加速药物从PPMS中释放[79]。理想情况下同一处方的长期和加速释放试验的释放机制相同[79]。虽然PPMS的体外释放试验是在模拟体内环境的情况下进行, 但由于肺中存在各种代谢酶, PPMS在肺内可能会以更快和持续的方式释放药物[16]。
4.7 PPMS的分散性、流动性和水分含量分散性和流动性是吸入颗粒的两个重要的理化特性, 主要受颗粒水分含量的影响[67]。PPMS的水分含量可通过卡尔费休体积滴定技术进行分析[67]。当具有引湿性的固体颗粒进入相对湿度约为99.5%肺部后, 会吸收水分使粒径增大, 影响药物分散, 因此制备PPMS的材料应选择吸湿性低的材料或在严格控制湿度的环境中生产[81]。PPMS的水分含量亦会对颗粒的流动性产生影响。良好的流动性确保了递送剂量的准确性, 是给药颗粒能有效递送到肺部的保证。流动特性可根据卡尔指数、豪斯纳比指数和休止角进行评估[67]。
4.8 其他质量控制除上述PPMS的质量控制项目外, 肺部给药PPMS还应对残留物质、递送剂量均一性及微生物限度进行检测。采用乳化溶剂挥发法、相分离法等制备的PPMS存在一定程度的有机溶剂残留问题, 如DCM等, 对呼吸道黏膜有一定的刺激性, 因此必须对PPMS产品的溶剂残留量进行控制, 通常采用气相色谱法对残留有机溶剂进行检测[82]。递送剂量均一性及微生物限度可参照《中国药典》吸入粉雾剂的标准进行检测。
5 总结与展望具有较大粒径(Dg为5~30 µm) 的PPMS由于密度低(ρ < 0.4 g·cm-3), 从而具有良好空气动力学性能(Da < 5 µm), 能有效逃避肺泡巨噬细胞的吞噬, 肺部有效沉积率高, 且PPMS能延长药物在肺部的滞留时间, 提高药物的治疗效果。此外, PPMS可生物降解, 降解产物与人体代谢物相同, 对人体不产生毒副作用。PPMS是有巨大潜能的肺部给药的载体。但PPMS用于肺部给药尚存在不少需要解决的问题: ① PPMS制备过程中通常需要加入致孔剂, 这可能会带来一些不可避免的弊端, 如致孔剂产生的孔隙通常不均匀且无法控制, 容易导致批次间和批次内的差异, 且在去除致孔剂时容易因高温导致包封的药物降解, 如何解决致孔剂导致的孔隙不均匀问题以及在去除致孔剂时不对包封的药物产生影响, 需要根据不同制备工艺进行具体研究解决; ②如何在PPMS制备过程中准确地控制多孔微球的Dg和孔径, 使其既能有效包埋药物, 又具有良好的空气动力学性能, 以达到最佳的肺部靶向效果, 需要根据具体处方和工艺进行深入研究; ③ PPMS制备过程中需要加入有机溶剂, 如双重乳化挥发法。如何避免有机溶剂残留问题, 以及这些有机溶剂对肺部的影响, 需要根据不同有机溶剂种类研究收集具体的操作参数; ④当所使用的药物和聚合物容易降解, 无法对成品进行灭菌时, 生产过程中需全程无菌操作, 生产成本高, 质量控制难度大, 难以保证产品质量的稳定可靠; ⑤目前尚无与肺部给药PPMS质量参数相关的质量控制标准, 一定程度上减缓了药物的研发进度, 因此必须要对PPMS关键质量参数进行控制, 研究这些关键质量参数与药物质量的内在联系; ⑥可生物降解的聚合物虽无毒副作用, 但对于需要长期给药的患者, 聚合物的累积可能会在肺部产生毒性, PPMS的长期用药安全性有待进一步考察。解决这些问题给药学研究人员提出了更为细致的研究课题, 相信通过不断努力, 该技术会不断发展以至于成熟, 用于肺部给药的PPMS制剂指日可待。
作者贡献: 曾安娜归纳总结所收集到的文献, 起草并撰写文章; 王雪寒参与本课题的研究, 对本文提出了相应观点; 吕爱平管理指导了本课题的研究并审阅了本文; 杨智钧负责指导了相关的技术研究, 审阅并修改了本文。
利益冲突: 本文所有作者均声明不存在利益冲突。
| [1] |
Sato H, Tabata A, Moritani T, et al. Design and characterizations of inhalable poly(lactic-co-glycolic acid) microspheres prepared by the fine droplet drying process for a sustained effect of salmon calcitonin[J]. Molecules, 2020, 25: 1311. DOI:10.3390/molecules25061311 |
| [2] |
Jain H, Bairagi A, Srivastava S, et al. Recent advances in the development of microparticles for pulmonary administration[J]. Drug Discov Today, 2020, 25: 1865-1872. DOI:10.1016/j.drudis.2020.07.018 |
| [3] |
Xia Y, Su Y, Wang Q, et al. Preparation, characterization, and pharmacodynamics of insulin-loaded fumaryl diketopiperazine microparticle dry powder inhalation[J]. Drug Deliv, 2019, 26: 650-660. DOI:10.1080/10717544.2019.1631408 |
| [4] |
Meenach SA, Kim YJ, Kauffman KJ, et al. Synthesis, optimization, and characterization of camptothecin-loaded acetalated dextran porous microparticles for pulmonary delivery[J]. Mol Pharm, 2012, 9: 290-298. DOI:10.1021/mp2003785 |
| [5] |
Gharse S, Fiegel J. Large porous hollow particles: lightweight champions of pulmonary drug delivery[J]. Curr Pharm Des, 2016, 22: 2463-2469. DOI:10.2174/1381612822666160128145356 |
| [6] |
Haddrell AE, Davies JF, Miles RE, et al. Dynamics of aerosol size during inhalation: hygroscopic growth of commercial nebulizer formulations[J]. Int J Pharm, 2014, 463: 50-61. DOI:10.1016/j.ijpharm.2013.12.048 |
| [7] |
Kim I, Byeon HJ, Kim TH, et al. Doxorubicin-loaded highly porous large PLGA microparticles as a sustained-release inhalation system for the treatment of metastatic lung cancer[J]. Biomaterials, 2012, 33: 5574-5583. DOI:10.1016/j.biomaterials.2012.04.018 |
| [8] |
Otterson GA, Villalona-Calero MA, Hicks W, et al. Phase Ⅰ/Ⅱ study of inhaled doxorubicin combined with platinum-based therapy for advanced non-small cell lung cancer[J]. Clin Cancer Res, 2010, 16: 2466-2473. DOI:10.1158/1078-0432.CCR-09-3015 |
| [9] |
Loira-Pastoriza C, Todoroff J, Vanbever R. Delivery strategies for sustained drug release in the lungs[J]. Adv Drug Deliv Rev, 2014, 75: 81-91. DOI:10.1016/j.addr.2014.05.017 |
| [10] |
Wang Y, Zhu LH, Chen AZ, et al. One-step method to prepare PLLA porous microspheres in a high-voltage electrostatic anti-solvent process[J]. Materials, 2016, 9: 368. DOI:10.3390/ma9050368 |
| [11] |
Zhu L, Li M, Liu X, et al. Inhalable oridonin-loaded poly(lactic-co-glycolic) acid large porous microparticles for in situ treatment of primary non-small cell lung cancer[J]. Acta Pharm Sin B, 2017, 7: 80-90. DOI:10.1016/j.apsb.2016.09.006 |
| [12] |
Lu XY, Lv HX. Research advances in materials for microspheres as drug delivery system[J]. J China Pharm Univ (中国药科大学学报), 2018, 49: 528-536. |
| [13] |
Mao S, Xu J, Cai C, et al. Effect of WOW process parameters on morphology and burst release of FITC-dextran loaded PLGA microspheres[J]. Int J Pharm, 2007, 334: 137-148. DOI:10.1016/j.ijpharm.2006.10.036 |
| [14] |
Rashid J, Patel B, Nozik-Grayck E, et al. Inhaled sildenafil as an alternative to oral sildenafil in the treatment of pulmonary arterial hypertension (PAH)[J]. J Control Release, 2017, 250: 96-106. DOI:10.1016/j.jconrel.2017.02.003 |
| [15] |
Wang C, Yang J, Han H, et al. Disulfiram-loaded porous PLGA microparticle for inhibiting the proliferation and migration of non-small-cell lung cancer[J]. Int J Nanomedicine, 2017, 12: 827-837. DOI:10.2147/IJN.S121948 |
| [16] |
Zhang H, Hao LZ, Pan JA, et al. Microfluidic fabrication of inhalable large porous microspheres loaded with H2S-releasing aspirin derivative for pulmonary arterial hypertension therapy[J]. J Control Release, 2021, 329: 286-298. DOI:10.1016/j.jconrel.2020.11.060 |
| [17] |
Geiser M. Update on macrophage clearance of inhaled micro- and nanoparticles[J]. J Aerosol Med Pulm Drug Deliv, 2010, 23: 207-217. DOI:10.1089/jamp.2009.0797 |
| [18] |
Jiaravuthisan P, Maeda A, Takakura C, et al. A membrane-type surfactant protein D (SP-D) suppresses macrophage-mediated cytotoxicity in swine endothelial cells[J]. Transpl Immunol, 2018, 47: 44-48. DOI:10.1016/j.trim.2018.02.003 |
| [19] |
Ridley C, Thornton DJ. Mucins: the frontline defence of the lung[J]. Biochem Soc Trans, 2018, 46: 1099-1106. DOI:10.1042/BST20170402 |
| [20] |
Janssen WJ, Stefanski AL, Bochner BS, et al. Control of lung defence by mucins and macrophages: ancient defence mechanisms with modern functions[J]. Eur Respir J, 2016, 48: 1201-1214. DOI:10.1183/13993003.00120-2015 |
| [21] |
Guagliardo R, Pérez-Gil J, De Smedt S, et al. Pulmonary surfactant and drug delivery: focusing on the role of surfactant proteins[J]. J Control Release, 2018, 291: 116-126. DOI:10.1016/j.jconrel.2018.10.012 |
| [22] |
Yang TT, Wen BF, Liu K, et al. Cyclosporine A/porous quaternized chitosan microspheres as a novel pulmonary drug delivery system[J]. Artif Cells Nanomed Biotechnol, 2018, 46: 552-564. DOI:10.1080/21691401.2018.1463231 |
| [23] |
Makadia HK, Siegel SJ. Poly Lactic-co-glycolic acid (PLGA) as biodegradable controlled drug delivery carrier[J]. Polymers (Basel), 2011, 3: 1377-1397. DOI:10.3390/polym3031377 |
| [24] |
Tyler B, Gullotti D, Mangraviti A, et al. Polylactic acid (PLA) controlled delivery carriers for biomedical applications[J]. Adv Drug Deliv Rev, 2016, 107: 163-175. DOI:10.1016/j.addr.2016.06.018 |
| [25] |
Kim Y, Sah H. Protein loading into spongelike PLGA microspheres[J]. Pharmaceutics, 2021, 13: 137. DOI:10.3390/pharmaceutics13020137 |
| [26] |
Singh MR, Pradhan K, Singh D. Lipid matrix systems with emphasis on lipid microspheres: potent carriers for transcutaneous delivery of bioactives[J]. Curr Drug Deliv, 2012, 9: 243-254. DOI:10.2174/156720112800389124 |
| [27] |
Xu W, Yu Y, Chen YP, et al. Preparation and process optimization of amphotericin B liposome-encapsulated microspheres[J]. Chin J Antibio (中国抗生素杂志), 2018, 43: 893-900. |
| [28] |
Feng DY, Yuan H, Du YZ, et al. Research progress of lipid microsphere drug delivery system[J]. Mod Med Health (现代医药卫生), 2012, 28: 1037-1039. |
| [29] |
Riaz S, Fatima N, Rasheed A, et al. Metabolic engineered biocatalyst: a solution for PLA based problems[J]. Int J Biomater, 2018, 2018: 1963024. |
| [30] |
Muxika A, Etxabide A, Uranga J, et al. Chitosan as a bioactive polymer: processing, properties and applications[J]. Int J Biol Macromol, 2017, 105: 1358-1368. DOI:10.1016/j.ijbiomac.2017.07.087 |
| [31] |
Shan L, Tao EX, Meng QH, et al. Formulation, optimization, and pharmacodynamic evaluation of chitosan/phospholipid/β-cyclodextrin microspheres[J]. Drug Des Devel Ther, 2016, 10: 417-429. |
| [32] |
Dhamecha D, Movsas R, Sano U, et al. Applications of alginate microspheres in therapeutics delivery and cell culture: past, present and future[J]. Int J Pharm, 2019, 569: 118627. DOI:10.1016/j.ijpharm.2019.118627 |
| [33] |
Zhang QZ, Yin MM, Yu ML, et al. Research progress of gelatin microspheres[J]. Acta Agrol Sin (农药学学报), 2021. DOI:10.16801/j.issn.1008-7303.2021.0068 |
| [34] |
Alipour S, Montaseri H, Tafaghodi M. Inhalable, large porous PLGA microparticles loaded with paclitaxel: preparation, in vitro and in vivo characterization[J]. J Microencapsul, 2015, 32: 661-668. DOI:10.3109/02652048.2014.944949 |
| [35] |
Garcia Contreras L, Sung J, Ibrahim M, et al. Pharmacokinetics of inhaled rifampicin porous particles for tuberculosis treatment: insight into rifampicin absorption from the lungs of guinea pigs[J]. Mol Pharm, 2015, 12: 2642-2650. DOI:10.1021/acs.molpharmaceut.5b00046 |
| [36] |
Kamrupi IR, Pokhrel B, Kalita A, et al. Synthesis of macroporous polymer particles by suspension polymerization using supercritical carbon dioxide as a pressure-adjustable porogen[J]. Adv Polym Technol, 2012, 31: 154-162. DOI:10.1002/adv.20246 |
| [37] |
Gokmen MT, Du Prez FE. Porous polymer particles-a comprehensive guide to synthesis, characterization, functionalization and applications[J]. Prog Polym Sci, 2012, 37: 365-405. DOI:10.1016/j.progpolymsci.2011.07.006 |
| [38] |
Poursina N, Vatanara A, Rouini MR, et al. The effect of excipients on the stability and aerosol performance of salmon calcitonin dry powder inhalers prepared via the spray freeze drying process[J]. Acta Pharm, 2016, 66: 207-218. DOI:10.1515/acph-2016-0012 |
| [39] |
Du J, El-Sherbiny IM, Smyth HD. Swellable ciprofloxacin-loaded nano-in-micro hydrogel particles for local lung drug delivery[J]. AAPS PharmSciTech, 2014, 15: 1535-1544. DOI:10.1208/s12249-014-0176-x |
| [40] |
Hao LZ. Study of Microfluidic-Based ACS 14-Loaded Porous Microspheres for Pulmonary Hypertension Therapy by Pulmonary Administration (微流控技术制备负载ACS14肺部给药多孔微球用于治疗肺动脉高压的研究)[D]. Fujian: Huaqiao University, 2019.
|
| [41] |
Rosca ID, Watari F, Uo M. Microparticle formation and its mechanism in single and double emulsion solvent evaporation[J]. J Control Release, 2004, 99: 271-280. DOI:10.1016/j.jconrel.2004.07.007 |
| [42] |
Nie L, Zhang G, Hou R, et al. Controllable promotion of chondrocyte adhesion and growth on PVA hydrogels by controlled release of TGF-β1 from porous PLGA microspheres[J]. Colloids Surf B Biointerfaces, 2015, 125: 51-57. DOI:10.1016/j.colsurfb.2014.11.010 |
| [43] |
Hao YY, Tian L, Yang Y, et al. The research progress of porous microspheres used for pulmonary drug delivery system[J]. Pharm Biotechnol (药物生物技术), 2017, 24: 450-453. |
| [44] |
Naikwade SR, Bajaj AN, Gurav P, et al. Development of budesonide microparticles using spray-drying technology for pulmonary administration: design, characterization, in vitro evaluation, and in vivo efficacy study[J]. AAPS PharmSciTech, 2009, 10: 993-1012. DOI:10.1208/s12249-009-9290-6 |
| [45] |
Wan F, Yang M. Design of PLGA-based depot delivery systems for biopharmaceuticals prepared by spray drying[J]. Int J Pharm, 2016, 498: 82-95. DOI:10.1016/j.ijpharm.2015.12.025 |
| [46] |
Ghosh Dastidar D, Saha S, Chowdhury M. Porous microspheres: synthesis, characterisation and applications in pharmaceutical & medical fields[J]. Int J Pharm, 2018, 548: 34-48. DOI:10.1016/j.ijpharm.2018.06.015 |
| [47] |
Kim H, Park H, Lee J, et al. Highly porous large poly(lactic-co-glycolic acid) microspheres adsorbed with palmityl-acylated exendin-4 as a long-acting inhalation system for treating diabetes[J]. Biomaterials, 2011, 32: 1685-1693. DOI:10.1016/j.biomaterials.2010.10.045 |
| [48] |
Parilti R, Riva R, Howdle SM, et al. Sulindac encapsulation and release from functional poly(HEMA) microparticles prepared in supercritical carbon dioxide[J]. Int J Pharm, 2018, 549: 161-168. DOI:10.1016/j.ijpharm.2018.07.060 |
| [49] |
Lin XF, Kankala RK, Tang N, et al. Supercritical fluid-assisted porous microspheres for efficient delivery of insulin and inhalation therapy of diabetes[J]. Adv Healthc Mater, 2019, 8: e1800910. DOI:10.1002/adhm.201800910 |
| [50] |
Szumski M, Buszewski B. Preparation of monolithic capillary chromatographic columns using supercritical fluid as a porogen solvent[J]. Chromatographia, 2014, 77: 1009-1017. DOI:10.1007/s10337-014-2651-7 |
| [51] |
García-González CA, Uy JJ, Alnaief M, et al. Preparation of tailor-made starch-based aerogel microspheres by the emulsion-gelation method[J]. Carbohydr Polym, 2012, 88: 1378-1386. DOI:10.1016/j.carbpol.2012.02.023 |
| [52] |
Gorle BSK, Smirnova I, Arlt W. Adsorptive crystallization of benzoic acid in aerogels from supercritical solutions[J]. J Supercrit Fluids, 2010, 52: 249-257. DOI:10.1016/j.supflu.2010.01.006 |
| [53] |
Ratanajiajaroen P, Ohshima M. Preparation of highly porous β-chitin structure through nonsolvent-solvent exchange-induced phase separation and supercritical CO2 drying[J]. J Supercrit Fluids, 2012, 68: 31-38. DOI:10.1016/j.supflu.2012.04.002 |
| [54] |
García-González CA, Alnaief M, Smirnova I. Polysaccharide-based aerogels-promising biodegradable carriers for drug delivery systems[J]. Carbohydr Polym, 2011, 86: 1425-1438. DOI:10.1016/j.carbpol.2011.06.066 |
| [55] |
Tang C. Preparation of drug-loaded porous microparticles using supercritical solution impregnation for pulmonary drug delivery[J]. J Dalian Univ (大连大学学报), 2017, 38: 69-72,76. |
| [56] |
Della Porta G, Falco N, Giordano E, et al. PLGA microspheres by supercritical emulsion extraction: a study on insulin release in myoblast culture[J]. J Biomater Sci Polym Ed, 2013, 24: 1831-1847. DOI:10.1080/09205063.2013.807457 |
| [57] |
Serim TM, Kožák J, Rautenberg A, et al. Spray freeze dried Lyospheres® for nasal administration of insulin[J]. Pharmaceutics, 2021, 13: 852. DOI:10.3390/pharmaceutics13060852 |
| [58] |
Wanning S, Süverkrüp R, Lamprecht A. Pharmaceutical spray freeze drying[J]. Int J Pharm, 2015, 488: 136-153. DOI:10.1016/j.ijpharm.2015.04.053 |
| [59] |
Wang J, Zhu ZZ, Zhang XH. Spray freeze drying technology and its application in inhalation preparations[J]. Chin J Pharm Ind (中国医药工业杂志), 2018, 49: 1083-1090. |
| [60] |
Ishwarya SP, Anandharamakrishnan C, Stapley AGF. Spray-freeze-drying: a novel process for the drying of foods and bioproducts[J]. Trends Food Sci Technol, 2015, 41: 161-181. DOI:10.1016/j.tifs.2014.10.008 |
| [61] |
Jin YQ, Qiu Y, Cao K, et al. Inhalable nanocarrier-based drug delivery systems for lung cancer therapy[J]. Chin J Pharm Ind (中国医药工业杂志), 2018, 49: 1644-1652. |
| [62] |
Mangal S, Gao W, Li T, et al. Pulmonary delivery of nanoparticle chemotherapy for the treatment of lung cancers: challenges and opportunities[J]. Acta Pharmacol Sin, 2017, 38: 782-797. DOI:10.1038/aps.2017.34 |
| [63] |
Applin SI, Schmitz RC, Tiemsin PI, et al. Further insight into the mechanism of poly(styrene-co-methyl methacrylate) microsphere formation[J]. J Polym Sci A Polym Chem, 2017, 55: 2249-2259. DOI:10.1002/pola.28612 |
| [64] |
López-Iglesias C, López ER, Fernández J, et al. Modeling of the production of lipid microparticles using PGSS® technique[J]. Molecules, 2020, 25: 4927. DOI:10.3390/molecules25214927 |
| [65] |
Qin FH, Cai Y, Zhao DJ. Preparation of porous rifampicin-loaded PLGA microspheres[J]. Anhui Med (安徽医药), 2015, 19: 1241-1245. |
| [66] |
Sou T, Bergström CAS. Contemporary formulation development for inhaled pharmaceuticals[J]. J Pharm Sci, 2021, 110: 66-86. DOI:10.1016/j.xphs.2020.09.006 |
| [67] |
Vishwa B, Moin A, Gowda DV, et al. Pulmonary targeting of inhalable moxifloxacin microspheres for effective management of tuberculosis[J]. Pharmaceutics, 2021, 13: 79. DOI:10.3390/pharmaceutics13010079 |
| [68] |
Bianco A, Burg SL, Parnell AJ, et al. Control of the porous structure of polystyrene particles obtained by nonsolvent induced phase separation[J]. Langmuir, 2017, 33: 13303-13314. DOI:10.1021/acs.langmuir.7b02802 |
| [69] |
Ren L, Xu J, Zhang Y, et al. Preparation and characterization of porous chitosan microspheres and adsorption performance for hexavalent chromium[J]. Int J Biol Macromol, 2019, 135: 898-906. DOI:10.1016/j.ijbiomac.2019.06.007 |
| [70] |
Cao SS, Zhao ZY, Jin X, et al. Unique double-shelled hollow silica microspheres: template-guided self-assembly, tunable pore size, high thermal stability, and their application in removal of neutral red[J]. J Mater Chem, 2011, 21: 19124-19131. DOI:10.1039/c1jm13011k |
| [71] |
Si T, Wang Y, Wei W, et al. Effect of acrylic acid weight percentage on the pore size in poly(N-isopropyl acrylamide-co-acrylic acid) microspheres[J]. React Funct Polym, 2011, 71: 728-735. DOI:10.1016/j.reactfunctpolym.2011.04.003 |
| [72] |
Lee CH, Jin ES, Lee JH, et al. Immobilization and stabilization of enzyme in biomineralized calcium carbonate microspheres[J]. Front Bioeng Biotechnol, 2020, 8: 553591. DOI:10.3389/fbioe.2020.553591 |
| [73] |
Hao DX, Gong FL, Wei W, et al. Porogen effects in synthesis of uniform micrometer-sized poly(divinylbenzene) microspheres with high surface areas[J]. J Colloid Interface Sci, 2008, 323: 52-59. DOI:10.1016/j.jcis.2008.03.039 |
| [74] |
Carvalho TC, Peters JI, Williams RO 3rd. Influence of particle size on regional lung deposition——what evidence is there?[J]. Int J Pharm, 2011, 406: 1-10. DOI:10.1016/j.ijpharm.2010.12.040 |
| [75] |
Nishimura S, Takami T, Murakami Y. Porous PLGA microparticles formed by "one-step" emulsification for pulmonary drug delivery: the surface morphology and the aerodynamic properties[J]. Colloids Surf B Biointerfaces, 2017, 159: 318-326. DOI:10.1016/j.colsurfb.2017.08.004 |
| [76] |
Chen AZ, Yang YM, Wang SB, et al. Preparation of methotrexate-loaded, large, highly-porous PLLA microspheres by a high-voltage electrostatic antisolvent process[J]. J Mater Sci Mater Med, 2013, 24: 1917-1925. DOI:10.1007/s10856-013-4942-1 |
| [77] |
State Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Volume 4. Beijing: China Medical Science and Technology Press, 2020: 474.
|
| [78] |
Wang S, Hua YB, Gao X, et al. Research progress of in vitro-in vivo correlation of injectable polylactide-polyglycolide microspheres[J]. Acta Pharm Sin (药学学报), 2021, 56: 158-168. |
| [79] |
Shen J, Lee K, Choi S, et al. A reproducible accelerated in vitro release testing method for PLGA microspheres[J]. Int J Pharm, 2016, 498: 274-282. DOI:10.1016/j.ijpharm.2015.12.031 |
| [80] |
Rawat A, Burgess DJ. USP apparatus 4 method for in vitro release testing of protein loaded microspheres[J]. Int J Pharm, 2011, 409: 178-184. DOI:10.1016/j.ijpharm.2011.02.057 |
| [81] |
Zhu WH, Wu WZ. Powder characteristics and formulation patterns of dry powder inhalers[J]. Chin J Pharm Ind (中国医药工业杂志), 2018, 49: 722-729. |
| [82] |
Wang YJ, Sun XZ, Xu L, et al. Research progress and prospect of microsphere product[J]. Biochemistry (生物化工), 2017, 3: 80-83. |
 2021, Vol. 56
2021, Vol. 56


