2. 江苏康缘药业股份有限公司, 江苏 连云港 222001;
3. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. Jiangsu Kanion Parmaceutical Co., Ltd., Lianyungang 222001, China;
3. State KeyLaboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
口服、外用和吸入是最古老的3种给药途径。相比于口服或注射等全身性给药, 肺部吸入药物通过特殊给药装置直接进入呼吸道发挥治疗作用, 已经在哮喘和慢性阻塞性肺病(COPD) 治疗方面展示出了明显优势。肺部吸入药物的早期发展与草药有关, 例如, 首个β受体激动剂类吸入药物异丙肾上腺素为麻黄活性成分麻黄碱的类似物; 首个上市的M胆碱受体拮抗剂异丙托溴铵为曼陀罗和华山参中活性成分阿托品的衍生物[1]。到20世纪70年代, 短效β受体激动剂(SABA)、短效M胆碱受体拮抗剂(SAMA)、吸入皮质类固醇(ICS) 在哮喘和COPD的治疗方面取得了长足的进展, 代表性药物包括沙丁胺醇、异丙托溴铵和二丙酸倍氯米松等。这些1960~1970年研发的吸入药物通常称为第一代吸入药物, 其作用时间较短, 每日需用药4~6次。到20世纪90年代, 医药企业研发了第二代长效吸入药物, 实现了每日2次的给药频率, 代表性药物有福莫特罗、色托溴铵、丙酸氟替卡松和布地奈德等, 第二代吸入药物代表了当前吸入疗法的金标准。2012年至今, 吸入药物已发展至第三代, ICS、长效β效受体激动剂(LABA) 和长效M胆碱受体拮抗剂(LAMA) 的联合疗法使每日1次的超长效吸入产品成为可能, 代表性药物有糠酸氟替卡松、维兰特罗、芜地溴铵等[2]。
从第一代到第三代哮喘和COPD的吸入药物的发展趋势来看, 主要进展在于延长吸入药物的作用时间, 而作用机制方面没有发生显著改变, 药物的作用特点是控制症状, 但不能延缓疾病进程, 且COPD患者对ICS不敏感, 因此现有吸入药物仍难以满足临床用药需求[3]。除了哮喘和COPD外, 其他肺部疾病的治疗也存在问题。吸入给药能够在呼吸道感染部位保持较高的局部药物浓度, 从而降低耐药性的风险, 但现有抗感染吸入制剂都是基于已上市全身用药改变给药途径, 给药后通常会从肺部迅速吸收进入体循环, 需要高剂量给药; 现有的肺动脉高压治疗药物只能对血管进行调控, 且药物难以在病灶蓄积, 无法实现有效治疗[4]; 目前可用于治疗肺纤维化和肺癌的药物均采用全身给药方式, 毒副作用大, 患者依从性差, 有效的吸入药物尚待进一步研发。
吸入药物的研发存在诸多挑战。药物设计除需要考虑其在肺部的安全性和有效性外, 还需充分评价其肺部生物药剂学特性, 以保证吸入药物能在肺组织中较长时间地维持药效浓度。口服药物的新药发现可以遵循Lipinski五原则[5], 结合生物药剂学分类系统及配套的体内外评价方法指导药物设计, 从而满足生物药剂学特性的要求。与之不同, 吸入药物设计目前尚缺乏系统的理论和实践经验的指导。吸入药物在肺部的过程非常复杂, 理想的理化性质需要平衡其在肺部的溶出、渗透、吸收、代谢和肺组织滞留。因此, 针对候选药物的缺陷进行个性化结构修饰以满足吸入治疗的要求是目前可以选择的吸入药物开发途径。第二代和第三代的吸入药物大多是通过在原药物基础上进行个性化结构修饰而研发的。
前药(prodrug) 技术通过药物分子结构修饰赋予药物溶解度增加、稳定性增强和渗透性改变等特点, 进入人体后经酶或化学作用释放活性成分, 发挥药效, 可解决原药在吸收和分布、长效释放、释药部位特异性和毒性等方面的问题。如表 1所示, 目前已有多个吸入前药产品批准上市。例如, 辛酸拉尼米韦(4) 在肺组织中经S-甲酰谷胱甘肽水解酶和酰基蛋白硫代酯酶1催化水解为活性形式拉尼米韦, 发挥抗流感病毒作用。单剂吸入后可在肺部维持局部抗病毒作用至少5日, 实现单次给药治疗流感[6-8]。本文旨在对近20年前药技术在肺部吸入递送领域的研究进行综述, 为新型吸入药物的开发提供思路。
| 表 1 Marketed inhalation prodrugs |
肺内有40种不同的细胞类型, 每种类型都可能有不同的酶活性谱。内源性化合物的代谢一般发生在内皮细胞内, 而外源性代谢系统主要位于肺上皮细胞内。大多数外源代谢活性与Clara细胞(无纤毛细支气管细胞) 和肺泡Ⅱ型细胞有关[9], 这些细胞中存在多种生物代谢酶, 是清除吸入异物的一道防线。
肺部的常见酶与肝脏中常见酶有一定差异。肺常见的细胞色素P450 (CYP) 亚型为CYP1B1、CYP2B6、CYP2E1、CYP2J2、CYP3A5和CYP1A1, 最丰富的肝脏CYP3A4酶在肺组织中的表达程度较低, 而CYP3A5的异构体被认为在肺组织中更重要[10]。除CYP家族外, 肺部还表达其他生物转化酶, 如磺基转移酶、尿苷二磷酸(UDP) 葡萄糖醛酸基转移酶、谷胱甘肽S-转移酶、酯酶、肽酶、环氧合酶和黄素单加氧酶[11]。广泛的生物转化酶能够代谢不同的底物。
肺部代谢特性对药物在肺部的药效和作用时间具有显著的影响。吸入药物在肺部沉积后, 药物气溶胶与肺内呼吸道黏液接触, 药物在此处的局部溶解决定了其之后的肺部过程。溶解后的药物会迅速扩散到肺上皮细胞, 或被巨噬细胞吞噬清除[12]。进入肺上皮细胞后, 可能经历药物代谢, 或在特定细胞器中滞留、或与其靶受体结合, 影响药物的肺组织亲和力和滞留时间[13-15]。由于肺部酯酶丰富, 酯化药物或蛋白质类药物很容易经历水解反应; 某些药物, 如布地奈德, 还可在细胞内与脂肪酸发生酯化-水解循环[16]; 明确肺部的代谢过程可指导吸入药物的研发, 包括吸入前药的设计。
2 前药的概念与分类前体药物也称前药, 最早由Albert于1958年提出, “前药是经生物转化后才显示药理作用的化合物”[17]。其本质上分为两类, 即载体连接的前药和生物前药。在载体连接的前药中, 活性物质(母药) 通过共价键与载体部分相连。该载体基团可以产生改进的物理化学或药代动力学特性, 并且一般能够通过水解在体内较容易的去除。载体可以是小分子基团(酯、酰胺、亚胺)、大分子聚合物[聚乙二醇(PEG)] 或者具有靶向性(抗体) 等等。生物前体药物则不含载体基团, 是通过自身官能团的代谢修饰被激活[18]。
依据前药设计的功能和目的, 可将前药的应用分为三大类[19-22]: 一是从改善药物理化性质的角度出发, 通过药物修饰可以改变药物的溶解性, 提高药物的稳定性, 减轻药物对人体带来的局部刺激和疼痛等; 二是从改善药效学角度出发, 前药递送在体内活化成活性成分, 可以减轻原有药物毒性; 三是从改善药物代谢动力学特性角度出发, 前药设计可以促进药物吸收, 调控药物代谢, 或延长药物作用时间, 靶向特定器官、组织递送等。
3 肺部吸入前药根据前药的功能和肺吸入药物开发的需求, 总结出前药技术在吸入药物研发中的应用, 主要包括改善理化性质、减毒、长效和靶向四大类。值得注意的是, 每种前药的设计和合成可同时改善多种功能, 某一方面性质的改变可能会引起相关的多种功能变化, 分类的依据着重在前药的修饰带来的直接作用效果。
3.1 改善理化性质部分药物自身溶解特性不适用于肺部吸入递送。利用前药手段可以改变药物原有理化性质(图 1), 满足吸入制剂制备条件, 从而便于肺部给药及提高患者顺应性。以全氟碳化合物为介质的液体通气法是将药物直接输送到严重受伤的肺部的一种给药方法。将烟酸的活泼氢用氟化碳链取代制成一系列烟酸酯(7) 前药, 显著提高了药物在全氟溴辛烷中的溶解度[23]。烟酸酯对酯酶敏感, 经水解后可迅速释放母体药物。异丙酚是一种强效抗惊厥药物, 大剂量腹腔注射会引起急性毒性作用, 肺部给药为其递送提供了可能。然而异丙酚是一种黏稠且与水不相溶的油, 不适用于肺部递送。制备成异丙酚半琥珀酸酯(8) 前药后可配制成水溶液, 滴入肺部时具有良好的耐受性且起效迅速。以较低剂量向肺内递送可实现等效的癫痫发作保护, 而无急性毒性[24]。水溶性是药物开发过程中较重要的特性, 将药物与水溶性聚合物, 如PEG偶联, 可提高药物溶解性, 用于雾化吸入递送。PEG化已应用于多种肺部递送前药的设计, 如强的松龙[25]、紫杉醇[26, 27]等。

|
Figure 1 Prodrugs to improve physicochemical properties |
载药量低是吸入药物载体存在的一大难题。亲脂性前药可以显著增加纳米粒载药量。氯霉素和甲砜霉素的亲脂性棕榈酸酯(9, 10) 前药分别用于制备聚乳酸-羟基乙酸共聚物纳米粒或纯前药纳米粒, 喷雾干燥后得到可吸入干粉, 微粒载药量达到14%~34% (原药纳米粒载药量仅为1%~5%)[28]。此外, 环丙沙星的聚合物前药[29]、PEG修饰的抗体片段[30]等都通过前药手段得到了较高的药物载量。
3.2 减毒作用部分药物由于毒性较大在多次或高剂量给药过程中会产生严重的毒副作用, 对身体器官造成损伤, 减轻药物毒副作用是药物递送的关键。克服肺部疾病不良反应的潜在方法之一是通过吸入局部递送活性化合物来减少全身吸收, 前药则可以通过修饰进一步降低药物毒性(图 2)。将两种手段结合, 可以达到良好的减毒增效目的。
|
Figure 2 Prodrugs to reduce local and systemic toxicity. G4 PAMAM: Generation 4 polyamidoamine |
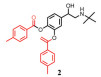
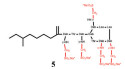
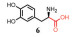
由于肠外或吸入给药会引起毒性, 用于治疗革兰阴性菌感染的多黏菌素E通常被作为一种非活性前体药物—多黏菌素E甲磺酸钠(CMS) (5) 给予[31]。CMS是通过带负电荷的甲磺酸盐部分掩蔽黏菌素上的伯胺产生的, 其在体内会迅速水解成一系列中间的甲烷磺化衍生物, 最终生成黏菌素。CMS气溶胶给药后的抗菌效果显著优于静脉给药[32, 33], 欧洲已批准CMS干粉吸入剂(Colobreathe) 上市[34]。此外, 国内外临床上已有雾化吸入CMS治疗囊性纤维化及呼吸机相关性肺部感染的应用, 但其临床安全性及使用剂量有待考证[35, 36]。
抗菌肽(AMPs) 是一种有广谱抗菌活性的阳离子两亲性肽, 抗菌活性基于其与细菌细胞膜的相互作用。但AMPs对人体生物膜的选择性较低, 容易导致相关的宿主毒性。前药Pro-AMPs通过添加低聚谷氨酸前体部分来减少静电荷, 从而降低抗菌活性和细胞毒性, 并通过嗜中性粒细胞弹性蛋白酶(NE) 不稳定的三丙氨酸接头连接[37]。经雾化吸入后可被支气管中的NE激活, 由此将AMPs的潜在毒性限制在支气管内空间, 用于治疗囊性纤维性病变[38]。
顺铂对各种癌症具有广谱活性, 但静脉注射顺铂有严重的肾毒性和慢性神经毒性。吸入顺铂前药毒性较低且对肺实质损伤较小, 肺部滴注透明质酸(HA)-顺铂缀合物(11) 可使药物高度分布于肺组织, 在其他器官中含量极低, 且炎症的发生明显减少[39]。紫杉醇的全身给药同样会导致消化系统和免疫系统等的全身毒性。向原位人非小细胞肺癌的小鼠气管内滴注聚(L-谷氨酸)-紫杉醇, 前药毒性远低于紫杉醇, 小鼠存活率显著提高, 抗肿瘤疗效增强[40]。另一项研究中, 在健康小鼠气管内滴注PEG-紫杉醇前药(20), 紫杉醇的最大耐受剂量增加高达100倍[26, 27]。
磷酸肌醇3-激酶(PI3K) 途径参与了免疫细胞以及肺成纤维细胞的异常激活, 是重度哮喘和特发性肺纤维化的潜在治疗靶标。然而, PI3K抑制剂的全身靶标毒性限制了其更广的应用。CL27c (12) 是一种细胞渗透性酯前药[41], 该化合物在纯化蛋白质的PI3K酶促测定中无活性, 一旦进入细胞质就会被非特异性酯酶代谢成CL27e, 实现高效PI3K抑制。模型小鼠吸入CL27c可以显著减少炎症, 改善肺功能并减少致死率, 全身毒性可忽略不计。
甲型流感病毒的感染始于病毒包膜上的血凝素糖蛋白与细胞膜唾液酸的结合, 游离的唾液酸单体由于高浓度下的细胞毒性而无法在体内阻止血凝素的黏附。鼻腔递送唾液酸偶联的聚酰胺-胺(PAMAM) 树枝状大分子(13) 前药对病毒的抑制效力显著提高, 可以有效预防流感病毒感染[42, 43]。
阿伦磷酸盐因与磷脂酰胆碱结构相似, 竞争性地取代引发黏膜损伤的黏膜磷脂酰胆碱, 而显示出“黏膜损伤”特性, 造成呼吸系统损伤, 不适合肺部递送。阿伦磷酸钠与低分子量聚乙二醇(510 Da) 偶联(14) 可以抑制肺部给药后的肺黏膜毒性[44]。
抗结核病药物吡嗪酰胺(15) 是一种前体药物, 口服后在肝脏代谢成活性物质吡嗪酸。然而, 吡嗪酰胺的肝毒性导致其递送剂量有限, 尝试通过吸入给药将其直接递送至肺部起效。例如用于异烟肼和吡嗪酰胺共同给药的壳聚糖纳米粒干粉吸入制剂[45], 或通过喷干手段制备的可吸入性苯达喹啉、莫西沙星和吡嗪酰胺三联组合粉剂等。研究表明这些可吸入性干粉安全无毒, 有助于输送高剂量的药物至呼吸道以治疗结核病[46, 47]。
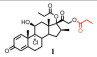
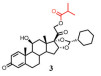
此外, 雾化吸入非活性前药, 如环索奈德(3)[48]可以减少口咽部的局部不良反应发生率, 因为沉积在该区域的非活性药物将在激活发生之前被吞咽。
3.3 长效作用对于肺部局部作用的药物, 肺部驻留时间和局部药物浓度直接决定了其在肺部的疗效。药物透过呼吸道黏液后, 游离且易溶解的小分子在肺上皮细胞中迅速扩散并在数分钟内渗透入血, 肺部驻留时间较短。而一些与靶分子、靶细胞解离缓慢, 或易与非靶肺组织结合的药物则具有较强的肺部亲和性, 在肺部驻留时间较长。药物在肺部的长时间驻留有利于维持较高的肺部药物浓度, 实现长效, 降低给药频率, 提高患者依从性。而药物的吸收过程导致药物在肺部的清除和疗效的终止, 以及全身不良反应的开始[49]。因此, 延缓吸收、延长肺部驻留时间和改善药物在肺部的药代动力学是提高药物在肺部疗效的关键。
3.3.1 酯化前药酯化是一种延长药物肺部驻留的常用手段(图 3), 可以提高药物亲脂性, 从而降低溶出速率及跨膜转运速率, 延缓吸收清除; 促进药物与脂肪酸可逆性结合, 提高药物的肺部亲和性, 延长肺部驻留。环索奈德(3)[50, 51]和二丙酸倍氯米松(1)[52, 53]是具有高效抗炎作用的吸入用糖皮质激素, 吸入后在肺内脂酶作用下水解成活性代谢物发挥药效。这些活性代谢物亲脂性极高, 能与脂肪酸可逆性结合, 在细胞内的酯化增加了这些药物在气道中的滞留时间, 从而延长了作用时间。
|
Figure 3 Esterified prodrugs to prolong lung retention |
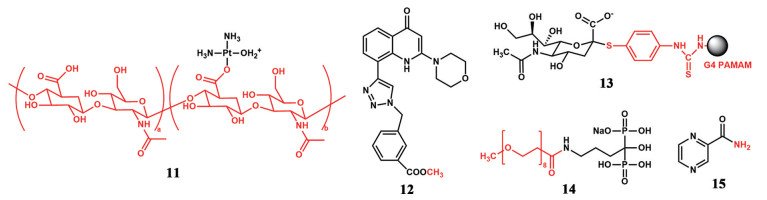
地塞米松棕榈酸酯(DXP) (16) 是地塞米松的亲脂性前药。通过将DXP与1, 2-二棕榈酰-sn-甘油3-磷酸胆碱(DPPC) 和透明质酸喷雾干燥得到大的多孔颗粒。棕榈酸酯部分有利于DXP插入双层DPPC, 调节药物从多孔颗粒中的释放。DXP也因其亲脂性减缓了从肺部的吸收清除。通过吹气法向大鼠气管内给予DXP粉末后, 在24 h的肺上皮衬里液中可检测到相当浓度的地塞米松[54]。
曲前列环素(TRE) 半衰期短, 需要每天连续输注或多次给药, 且吸入后短暂的高药物浓度会引起全身和局部的不良反应。将曲前列环素的羧基氢用长短不一的烷基链取代, 合成了一系列烷基前药TPD (C2TR~C16TR)。与吸入曲前列环素溶液相比, TPD脂质纳米粒有延长舒血管作用, 尤其是十六烷基曲前列环素(C16TR) 在动物研究中具有良好的耐受性, 比吸入TRE所需剂量更少, 不良反应更小[55-57]。C16TR又名曲前列环素棕榈酸酯(17), 作为吸入型长效肺血管扩张药, 已制成混悬液和干粉给药, 并进行了临床前开发和生物学特性研究[58, 59]。
美罗培南因其分子量小且易溶, 肺部给药后会经由肺上皮快速吸收进入全身循环, 肺部驻留时间短。使用疏水苯甲酸酯和甲醛桥化学掩蔽美罗培南的亲水性羧酸和胺官能团, 合成美罗培南的一种新型不溶性前药MRPD (18)。体内研究表明气管滴注给予MRPD黏液穿透晶体可在豚鼠肺中产生持续较高水平的美罗培南[60]。
此外, 与姜黄素相比, 姜黄素乙酸酯(19) 前药经肺给药后肺部驻留时间延长7.2倍, 同时在野百合碱诱导的肺动脉高血压大鼠模型中有更好的药效[61]。前言中提到的上市药物辛酸拉尼米韦(4) 也是酯化前药延长肺部驻留的证明[8]。
3.3.2 大分子前药药物与大分子化合物的偶联也是一种延长吸入性小分子在肺内驻留的常用策略(图 4)。在大分子前药递送系统中, 药物共价结合到大分子上, 如合成聚合物、白蛋白或细胞等。这一策略的一个潜在优势是药物的分布取决于大分子载体, 而不是药物[62]。通常, 大分子渗透性较差, 穿过血管内皮的速度慢, 或可能与肺组织结合, 从而导致其从肺部吸收到血液的速度变慢, 在肺组织和空隙中更长时间的滞留。研究表明, 大分子在肺组织中的驻留时间与其分子量有关。在一定范围内, 分子量越大, 驻留时间越长[63, 64]。
|
Figure 4 Macromolecular prodrugs to prolong lung retention. PTX: Paclitaxel; IFN: Interferon; PEG: Polyethylene glycol; HSA: Human serum albumin; Sulfo-SMCC: Sulfosuccinimidyl 4-(N-maleimidomethyl)-cyclo-hexane-1-carboxylate |
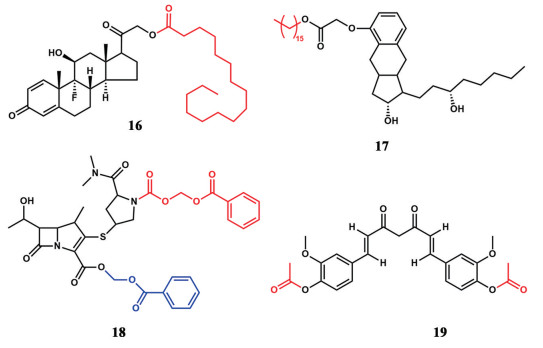
PEG化是肺部递送最常见的大分子前药手段。单取代和双取代强的松龙-聚乙二醇水解酯(2 kDa) 缀合物透过离体大鼠肺上皮的吸收半衰期分别比游离药物溶液延长约4倍和8倍[25]。紫杉醇与PEG (20 kDa和6 kDa) 缀合物(20) 在肺部和静脉给药均表现出比商业制剂紫杉醇(Taxol) 更好的抗肿瘤效果。且由于20 kDa的缀合物在肺部停留时间更长, 在小鼠肺癌模型中气管滴注单剂量下抗肿瘤功效显著强于6 kDa[26, 27]。PEG化还常被用于吸入性蛋白质疗法治疗肺部疾病, 如提高干扰素α2的驻留率(21)[65]。双臂PEG (40 kDa) 与抗白介素(IL)-17A和IL-13的Fab'片段进行偶联, 载药量超过50%, 偶联物(22) 在肺内持续存在超过2天[30]。
甲基强的松龙通过戊二酸偶联到PAMAM树枝状大分子上, 结合物(23) 可在肺内驻留7天, 并改善了小鼠过敏性肺炎的治疗效果[66]。多柔比星与PAMAM缀合(24)[67, 68]或与PEG化的聚赖氨酸偶联[69, 70], 肺部给药后树枝状大分子在肺部持续释放多柔比星, 提高了抗肿瘤的治疗效果。透明质酸-顺铂缀合物(11) 在体外表现出顺铂的释放延长。与静脉给药相比, 肺部给药后大鼠在24和96 h的肺部暴露分别增加了5.7倍和1.2倍[39]。该缀合物的干粉吸入剂在小鼠气管内单次给药对肺癌有效[71]。槲皮素多丙烯酸酯(25) 与仲二胺反应, 生成槲皮素共轭聚(β-氨基酯) 纳米凝胶, 可作吸入用。在生理条件下酯水解后观察到槲皮素在48 h内均匀释放, 有持续的抗氧化活性[72]。人血清白蛋白(HSA) 与多柔比星和辛醛偶联(26), 并吸附诱导凋亡蛋白TRAIL, 制成可吸入纳米粒(TRAIL/Dox HSA-NP)[73], 雾化后均匀地沉积在小鼠肺内, 药物长效释放。多柔比星和TRAIL的协同凋亡效应提高了抗肿瘤功效。葡聚糖-布地奈德偶联物(27)[74]中葡聚糖以其较长的肺部驻留时间可以充当共价结合药物的缓释储库, 实现布地奈德在肺内的长效释放。
3.3.3 其他一氧化氮(NO) 是一种有效的血管扩张药, 气相吸入可减轻肺动脉高压和急性呼吸窘迫综合征。过量NO到达肺动脉后会被血红蛋白等迅速清除, 临床效果短暂。脯氨酸可用于亲水性小分子前药PROLI/NO (28) 的合成(图 5)[75]。使用聚环氧乙烷-乳酸共聚物来封装PROLI/NO, 可产生稳定的可吸入形式的NO[76]。
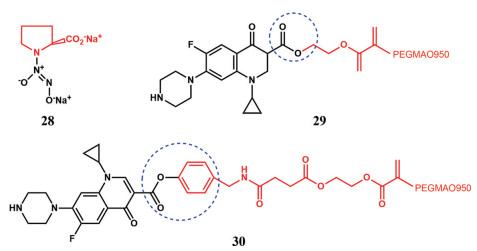
|
Figure 5 Other prodrugs to prolong lung retention. PEGMAO950: Polyethylene glycol methacrylate |
值得注意的是, 药物在肺内的长效释放并不完全等于缓慢释放。过于缓慢的药物释放有可能因为始终不能达到有效药物浓度而无法起效。因此, 药物在肺内驻留后, 活性成分的肺内释放动力学也值得关注。一种可吸入的环丙沙星大分子前药, 活性药物分别由2种不同的酯键[烷基酯(29) 和酚酯(30)] 连接至聚合物主链, 由此产生不同化学键介导的水解动力学(图 5)。与缓慢释放的烷基酯前药相比, 快速释放的酚酯前药在肺部产生更有效的药物水平。前者在24 h内的释放药物水平始终较低, 需要反复给药, 因此没有观察到抗菌活性[77]。
3.4 靶向作用靶向释药可以控制药物在特定部位或特定条件下释放并发挥药效, 从而提高给药效率, 减少不良反应。肺部给药本身就是一种靶向肺器官的药物递送途径, 前药技术则可进一步通过主动靶向或定点生物激活来实现靶向作用[62]。对于主动靶向前药, 药物通常连接到可以识别靶向特异性标记(如抗原或受体)的载体上, 并通过特异性结合反应有选择地传递至其作用部位。在特定部位的生物激活中, 前体药物可以广泛分布, 但仅在所需部位活化。一般来说, 这种定点生物激活可以通过利用靶部位的特殊的生理条件或内源性酶来实现。
3.4.1 主动靶向前药针对巨噬细胞表面存在大量甘露糖受体这一特性, 在吸入前药或制剂设计中可以添加甘露糖来靶向肺泡巨噬细胞(图 6)。环丙沙星与细胞内蛋白酶可裂解的缬氨酸-瓜氨酸二肽接头或可水解的酚酯接头合成前药单体, 与甘露糖单体经可逆加成-断裂链转移(RAFT) 聚合得到前药Drugamers (31: 二肽接头, 32: 酚酯接头)[29, 78]。亲水性甘露糖残基可提高药物溶解性并靶向和增强巨噬细胞摄取和胞内递送, 并在细胞内通过酶解或水解实现高浓度持续释药。肺部给药安全性良好, 单剂量给予Drugamers可在肺泡巨噬细胞区维持7天的有效抑菌浓度[79]。对肺炎性兔热病、弗朗西斯氏菌感染及肺类鼻疽的治疗效果显著优于游离环丙沙星。

|
Figure 6 Prodrugs for actively targeted delivery |
针对肿瘤细胞表面的特异性受体可以实现肿瘤部位的靶向。表皮生长因子受体(EGFR) 在人类肿瘤特别是非小细胞肺癌中过度表达。顺铂通过配体交换反应负载到明胶纳米粒上, 用生物素化表皮生长因子(bEGF) 对明胶-顺铂(GP-Pt) 纳米复合物(33) 的表面进行修饰。吸入GP-Pt-bEGF可以靶向表皮生长因子受体高表达的细胞, 从而在肺部肿瘤部位中获得高顺铂剂量[80]。
3.4.2 生物激活前药针对靶区内不同于其他组织的特殊生理条件, 可以实现定点生物激活释药(图 7)。利用酸敏感键控制药物在酸性环境, 如肿瘤微环境或巨噬细胞内的释放。多柔比星通过酸敏感的腙键(34)[67]、顺式乌头酸苷(24/35)[68, 81]或4-(肼基磺酰基) 苯甲酸接头(36)[69, 70]与聚合物大分子连接。缀合物在体外酸性条件下快速释放, 肺部递送后相比于游离药物有更强的抗肿瘤功效。异烟肼的酸敏感前药异烟酸辛基酰肼(37) 负载于甘露糖修饰的固体脂质纳米粒中以实现异烟肼在巨噬细胞内的pH敏感释放。雾化给药到肺部后表现出更高的细胞内抗生素功效, 有望用于潜伏性结核感染的治疗[82]。转移性肿瘤具有高水平的活性氧, 如过氧化氢, 前药可以被肿瘤细胞内过氧化氢激活并引发潜在的抗转移瘤治疗。一种过氧化氢激活的治疗药物ProDrug 7 (38) 以硼酸酯作为触发单元, 香豆素用作荧光基团以监测活性成分羟基喜树碱的释放, 气管内给药后在转移性肺癌的小鼠模型中显示出有效的抗肿瘤活性[83]。

|
Figure 7 Biologically activated prodrugs for targeted drug release. DOX: Doxorubicin; PEI: Polyethylenimine |
因为肺部代谢功能相对较弱, 可减少多肽、蛋白类药物的水解, 近年来肺部给药也逐渐用于多肽、疫苗等的全身治疗。药物经肺部吸收入血进入体循环发挥全身药效, 肺部的吸收则决定了药物的治疗效果。PAMAM树枝状大分子是一种合适的吸收促进剂, 对吸收的促进作用从0代到3代递增, 可显著增加大鼠肺对胰岛素和降钙素的吸收, 而不会对呼吸组织造成任何膜损伤[84]。PEG化用来保护多肽免受肺局部蛋白水解的影响, 从而增加肺部给药后完整分子的系统吸收(图 8)。对降钙素第18位的赖氨酸进行特异性PEG化修饰(39), 可使大鼠肺匀浆中的多肽稳定性增加3个数量级[85]。对胰高血糖素样肽第34位的赖氨酸进行位点特异性修饰(40) 可使其在肺部的蛋白水解中更稳定, 并更好地进入体循环[86]。PEG化对胰岛素的肺吸收影响研究[87]显示, 一旦进入血液, PEG化的蛋白质将提供持续的血浆蛋白浓度。但在多蛋白位点上的PEG化和使用大分子量PEG会使系统吸收的程度降低, 这可能与前述较大分子量的PEG修饰后会延长肺部驻留、减缓吸收有关。
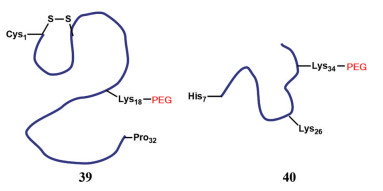
|
图 8 Prodrugs for pulmonary delivery of peptides and proteins. Cys: Cysteine; Lys: Lysine; Pro: Proline; His: Histidine |
吉西他滨(图 9, 41) 必须被脱氧胞苷激酶在细胞核内磷酸化才能转化为活性形式, 发挥细胞毒作用。体内研究已经证明雾化吉西他滨在原发性或转移性肺癌动物模型中的安全性和抗肿瘤作用[88, 89]。人体雾化吸入后肺部药物浓度可达给药总量的(42 ± 16)%[90]。舒林酸进入人体后代谢为有活性的硫化物, 吸入磷酸舒林酸(42) 可以抑制75%的肺癌发生并增加小鼠存活率[91]。罗氟司特(43) 是一种选择性磷酸二酯酶4 (PDE-4) 抑制剂, 已被批准每日1次口服用于慢性阻塞性肺病的治疗。罗氟司特在体内被细胞色素酶CYP1A2和CYP3A4催化为其活性代谢产物罗氟司特N-氧化物[92]。已证明CYP1A2存在于肺部, 尽管CYP3A4存在证据不足, 但也有类似的同功酶CYP3A5存在。基于此, 罗氟司特也存在吸入递送至肺部并被激活的潜力。在小鼠模型中, 吸入罗氟司特已被证明可以适度改善哮喘[93], 并探索了用于肺部给药的罗氟司特配方[94]。左旋多巴(6) 是多巴胺的前体药物。左旋多巴吸入粉(Inbrija) 被欧盟批准用于帕金森病关闭期的间歇性治疗。其通过呼吸致动吸入器给药, 可使左旋多巴绕过胃肠道, 通过肺系统迅速进入血液, 直达大脑[95]。

|
Figure 9 Inhaled bioprecursors |
前药技术是挽救药物分子缺陷的一种手段, 并已经成为药物研发过程中不可或缺的一部分。通过药物修饰可以在早期获得理想的理化性质及生物药剂学特性, 有助于加快临床前优化的速度。
前药设计可以满足新型吸入药物开发的不同要求, 通过酯化修饰或与大分子化合物偶联可以延缓药物从肺部的吸收, 延长肺部驻留时间; 利用靶部位的特殊结构或生理条件, 通过靶头或特定化学键修饰可以实现肺内主动靶向给药或定点生物响应释药; 通过个性化修饰可以获得适于肺部给药的理化性质以及降低药物的全身及肺部毒性。表 2总结了前药技术在肺部吸入药物研发中的应用, 其中, 酯化修饰和与大分子载体偶联是最常用的吸入药物修饰手段。酯化修饰可以提高药物的亲脂性, 提高药物与肺部的亲和力, 且酯键在肺内容易被水解而释放药物, 有助于药物发挥疗效。而与大分子偶联后前药的肺部分布特性主要取决于大分子载体, 而不是药物, 因此可以通过对大分子的设计控制药物的体内行为, 从而保护不稳定的药物, 调控肺部药代动力学特性, 延长肺部滞留时间。常用的载体大分子包括聚乙二醇、聚酰胺-胺、聚乙烯亚胺、聚赖氨酸、透明质酸和壳聚糖。此外, 可通过甘露糖修饰实现肺泡巨噬细胞靶向, 通过酸敏感键, 如腙键或顺式乌头酸苷接头等实现肿瘤部位或巨噬细胞内的靶向释药。
| 表 2 The applications of prodrug design in inhaled medicines |
但前药技术在吸入药物的应用中还存在较多问题和不确定性。首先, 吸入前药需要肺内代谢酶的激活。但与肠道及肝脏相比, 肺内酶的表达水平普遍较低, 药物代谢酶的表达模式也不同[11], 不能以药物在肝肠的代谢为标准来评价前药在肺内代谢的可行性; 肺组织病变是否会影响肺内酶活性以及对前药的代谢能力也尚未可知。其次, 大分子载体在肺内的积聚和清除也是大分子前药研发值得关注的问题, 应考虑到可能与该辅料相关的不良反应。例如聚乙二醇作为一种半抗原可能诱导免疫反应, 且其不可生物降解, 一般通过肾脏清除但清除时间长, 同时可能产生有害的副产物等[96]。第三, 吸入前药成药性评价存在技术挑战。由于肺部代谢所存在的种属差异, 可吸入前药的临床前体内动物实验结果和临床试验的相关性不明确。如PDE-4抑制剂tofimilast、AWD-12-281和UK-500001尽管在临床前评价中展示了良好前景, 但临床试验结果显示无效[97]。
作者贡献: 廖永红负责论文选题, 指导与审阅; 陈韡亚负责文献查阅和写作; 杨飞飞负责论文指导与修改。
利益冲突: 所有作者声明本文无任何利益冲突。
| [1] |
Williams DM, Rubin BK. Clinical pharmacology of bronchodilator medications[J]. Respir Care, 2018, 63: 641-654. DOI:10.4187/respcare.06051 |
| [2] |
Strong P, Ito K, Murray J, et al. Current approaches to the discovery of novel inhaled medicines[J]. Drug Discov Today, 2018, 23: 1705-1717. DOI:10.1016/j.drudis.2018.05.017 |
| [3] |
Chu EK, Drazen JM. Asthma: one hundred years of treatment and onward[J]. Am J Respir Crit Care Med, 2005, 171: 1202-1208. DOI:10.1164/rccm.200502-257OE |
| [4] |
Jiang XH, Xing XY, Wang XC, et al. Drugs and drug delivery strategies for treatment of pulmonary arterial hypertension[J]. Acta Pharm Sin (药学学报), 2021, 56: 1332-1342. |
| [5] |
Lipinski CA. Lead- and drug-like compounds: the rule-of-five revolution[J]. Drug Discov Today Technol, 2004, 1: 337-341. |
| [6] |
Yamashita M. Laninamivir and its prodrug, cs-8958:long-acting neuraminidase inhibitors for the treatment of influenza[J]. Antivir Chem Chemother, 2010, 21: 71-84. DOI:10.3851/IMP1688 |
| [7] |
Ikematsu H, Kawai N. Laninamivir octanoate: a new long-acting neuraminidase inhibitor for the treatment of influenza[J]. Expert Rev Anti Infect Ther, 2011, 9: 851-857. DOI:10.1586/eri.11.112 |
| [8] |
Koyama K, Ogura Y, Nakai D, et al. Identification of bioactivating enzymes involved in the hydrolysis of laninamivir octanoate, a long-acting neuraminidase inhibitor, in human pulmonary tissue[J]. Drug Metab Disposition, 2014, 42: 1031-1038. DOI:10.1124/dmd.114.057620 |
| [9] |
Taylor G. The absorption and metabolism of xenobiotics in the lung[J]. Adv Drug Del Rev, 1990, 5: 37-61. DOI:10.1016/0169-409X(90)90006-E |
| [10] |
Hukkanen J, Pelkonen O, Hakkola J, et al. Expression and regulation of xenobiotic-metabolizing cytochrome p450(cyp) enzymes in human lung[J]. Crit Rev Toxicol, 2002, 32: 391-411. DOI:10.1080/20024091064273 |
| [11] |
Enlo-Scott Z, Bäckström E, Mudway I, et al. Drug metabolism in the lungs: opportunities for optimising inhaled medicines[J]. Expert Opin Drug Metab Toxicol, 2021, 17: 611-625. DOI:10.1080/17425255.2021.1908262 |
| [12] |
Bo O, Bondesson E, Borgstrm L, et al. Pulmonary drug metabolism, clearance, and absorption[M]//Smyth H, Hickey A. Controlled Pulmonary Drug Delivery. New York: Springer, 2011: 21-50.
|
| [13] |
Cooper AE, Ferguson D, Grime K. Optimisation of DMPK by the inhaled route: challenges and approaches[J]. Curr Drug Metab, 2012, 13: 457-473. DOI:10.2174/138920012800166571 |
| [14] |
MacIntyre AC, Cutler DJ. The potential role of lysosomes in tissue distribution of weak bases[J]. Biopharm Drug Dispos, 1988, 9: 513-526. DOI:10.1002/bod.2510090602 |
| [15] |
Barnes PJ. The pharmacological properties of tiotropium[J]. Chest, 2000, 117: 63S-66S. DOI:10.1378/chest.117.2_suppl.63S |
| [16] |
Brattsand R, Miller-Larsson A. The role of intracellular esterification in budesonide once-daily dosing and airway selectivity[J]. Clin Ther, 2003, 25: 28-41. |
| [17] |
Albert A. Chemical aspects of selective toxicity[J]. Nature, 1958, 182: 421-423. DOI:10.1038/182421a0 |
| [18] |
Testa B. Prodrug research: futile or fertile?[J]. Biochem Pharmacol, 2004, 68: 2097-2106. DOI:10.1016/j.bcp.2004.07.005 |
| [19] |
Abet V, Filace F, Recio J, et al. Prodrug approach: an overview of recent cases[J]. Eur J Med Chem, 2017, 127: 810-827. DOI:10.1016/j.ejmech.2016.10.061 |
| [20] |
Zhao Y, Yang CY, Zhang Q, et al. Research progress on metabolism and efficacy of small molecular prodrug nanosystems responsive to tumor redox microenvironment[J]. Acta Pharm Sin (药学学报), 2021, 56: 476-486. |
| [21] |
Niu C, Wang DG, Zhang TH, et al. Synthesis and anti-inflammatory activity of curcumin succinate prodrugs[J]. Acta Pharm Sin (药学学报), 2018, 53: 2085-2092. |
| [22] |
Li Z, Wang J, Zhou Y, et al. Lead compound optimization strategy (3)- structure modification strategies for improving water solubility[J]. Acta Pharm Sin (药学学报), 2014, 49: 1238-1247. |
| [23] |
Hsu CH, Jay M, Bummer PM, et al. Chemical stability of esters of nicotinic acid intended for pulmonary administration by liquid ventilation[J]. Pharm Res, 2003, 20: 918-925. DOI:10.1023/A:1023899505837 |
| [24] |
Dhir A, Zolkowska D, Murphy RB, et al. Seizure protection by intrapulmonary delivery of propofol hemisuccinate[J]. J Pharmacol Exp Ther, 2011, 336: 215-222. DOI:10.1124/jpet.110.173591 |
| [25] |
Bayard FJC, Thielemans W, Pritchard DI, et al. Polyethylene glycol-drug ester conjugates for prolonged retention of small inhaled drugs in the lung[J]. J Control Release, 2013, 171: 234-240. DOI:10.1016/j.jconrel.2013.07.023 |
| [26] |
Luo T, Loira-Pastoriza C, Patil HP, et al. Pegylation of paclitaxel largely improves its safety and anti-tumor efficacy following pulmonary delivery in a mouse model of lung carcinoma[J]. J Control Release, 2016, 239: 62-71. DOI:10.1016/j.jconrel.2016.08.008 |
| [27] |
Luo T, Magnusson J, Préat V, et al. Synthesis and in vitro evaluation of polyethylene glycol-paclitaxel conjugates for lung cancer therapy[J]. Pharm Res, 2016, 33: 1671-1681. DOI:10.1007/s11095-016-1908-2 |
| [28] |
Nurbaeti SN, Brillault J, Tewes F, et al. Sustained-release microparticle dry powders of chloramphenicol palmitate or thiamphenicol palmitate prodrugs for lung delivery as aerosols[J]. Eur J Pharm Sci, 2019, 138: 105028. DOI:10.1016/j.ejps.2019.105028 |
| [29] |
Su FY, Srinivasan S, Lee B, et al. Macrophage-targeted drugamers with enzyme-cleavable linkers deliver high intracellular drug dosing and sustained drug pharmacokinetics against alveolar pulmonary infections[J]. J Control Release, 2018, 287: 1-11. DOI:10.1016/j.jconrel.2018.08.014 |
| [30] |
Koussoroplis SJ, Paulissen G, Tyteca D, et al. Pegylation of antibody fragments greatly increases their local residence time following delivery to the respiratory tract[J]. J Control Release, 2014, 187: 91-100. DOI:10.1016/j.jconrel.2014.05.021 |
| [31] |
Boisson M, Gregoire N, Couet W, et al. Colistin in critically ill patients[J]. Minerva Anestesiol, 2013, 79: 200-208. |
| [32] |
Sys W, Li J, Porter CJH, et al. Population pharmacokinetics of colistin methanesulfonate in rats: achieving sustained lung concentrations of colistin for targeting respiratory infections[J]. Antimicrob Agents Chemother, 2013, 57: 5087-5095. DOI:10.1128/AAC.01127-13 |
| [33] |
Landersdorfer CB, Nguyen TH, Lieu LT, et al. Substantial targeting advantage achieved by pulmonary administration of colistin methanesulfonate: insights from a large animal model[J]. Antimicrob Agents Chemother, 2016, 61: e01934-16. |
| [34] |
Conole D, Keating GM. Colistimethate sodium dry powder for inhalation: a review of its use in the treatment of chronic pseudomonas aeruginosa infection in patients with cystic fibrosis[J]. Drugs, 2014, 74: 377-387. DOI:10.1007/s40265-014-0181-0 |
| [35] |
Boisson M, Grégoire N, Cormier M, et al. Pharmacokinetics of nebulized colistin methanesulfonate in critically ill patients[J]. J Antimicrob Chemother, 2017, 72: 2607-2612. DOI:10.1093/jac/dkx167 |
| [36] |
Valachis A, Samonis G, Kofteridis DP. The role of aerosolized colistin in the treatment of ventilator-associated pneumonia: a systematic review and metaanalysis[J]. Crit Care Med, 2015, 43: 527-533. DOI:10.1097/CCM.0000000000000771 |
| [37] |
Forde E, Humphreys H, Greene CM, et al. Potential of host defense peptide prodrugs as neutrophil elastase-dependent anti-infective agents for cystic fibrosis[J]. Antimicrob Agents Chemother, 2014, 58: 978-985. DOI:10.1128/AAC.01167-13 |
| [38] |
Forde É, Kelly G, Sweeney L, et al. Vibrating mesh nebulisation of pro-antimicrobial peptides for use in cystic fibrosis[J]. Pharmaceutics, 2019, 11: 239. DOI:10.3390/pharmaceutics11050239 |
| [39] |
Xie Y, Aillon KL, Cai S, et al. Pulmonary delivery of cisplatin-hyaluronan conjugates via endotracheal instillation for the treatment of lung cancer[J]. Int J Pharm, 2010, 392: 156-163. DOI:10.1016/j.ijpharm.2010.03.058 |
| [40] |
Zou Y, Fu H, Ghosh S, et al. Antitumor activity of hydrophilic paclitaxel copolymer prodrug using locoregional delivery in human orthotopic non-small cell lung cancer xenograft models[J]. Clin Cancer Res, 2004, 10: 7382-7391. DOI:10.1158/1078-0432.CCR-04-0334 |
| [41] |
Campa CC, Silva RL, Margaria JP, et al. Inhalation of the prodrug PI3K inhibitor CL27c improves lung function in asthma and fibrosis[J]. Nat Commun, 2018, 9: 5232. DOI:10.1038/s41467-018-07698-6 |
| [42] |
Landers JJ, Cao Z, Lee I, et al. Prevention of influenza pneumonitis by sialic acid-conjugated dendritic polymers[J]. J Infect Dis, 2002, 186: 1222-1230. DOI:10.1086/344316 |
| [43] |
Reuter JD, Myc A, Hayes MM, et al. Inhibition of viral adhesion and infection by sialic-acid-conjugated dendritic polymers[J]. Bioconjug Chem, 1999, 10: 271-278. DOI:10.1021/bc980099n |
| [44] |
Katsumi H, Takashima M, Sano J, et al. Development of polyethylene glycol-conjugated alendronate, a novel nitrogen-containing bisphosphonate derivative: evaluation of absorption, safety, and effects after intrapulmonary administration in rats[J]. J Pharm Sci, 2011, 100: 3783-3792. DOI:10.1002/jps.22620 |
| [45] |
Changsan N, Sinsuebpol C. Dry powder inhalation formulation of chitosan nanoparticles for co-administration of isoniazid and pyrazinamide[J]. Pharm Dev Technol, 2021, 26: 181-192. DOI:10.1080/10837450.2020.1852570 |
| [46] |
Eedara BB, Tucker IG, Das SC. Phospholipid-based pyrazinamide spray-dried inhalable powders for treating tuberculosis[J]. Int J Pharm, 2016, 506: 174-183. DOI:10.1016/j.ijpharm.2016.04.038 |
| [47] |
Rangnekar B, Momin MAM, Eedara BB, et al. Bedaquiline containing triple combination powder for inhalation to treat drug-resistant tuberculosis[J]. Int J Pharm, 2019, 570: 118689. DOI:10.1016/j.ijpharm.2019.118689 |
| [48] |
Kai R, Kanniess F, Biberger C, et al. Comparison of the oropharyngeal deposition of inhaled ciclesonide and fluticasone propionate in patients with asthma[J]. J Clin Pharmacol, 2013, 45: 146-152. |
| [49] |
Loira-Pastoriza C, Todoroff J, Vanbever R. Delivery strategies for sustained drug release in the lungs[J]. Adv Drug Del Rev, 2014, 75: 81-91. DOI:10.1016/j.addr.2014.05.017 |
| [50] |
Derendorf H. Pharmacokinetic and pharmacodynamic properties of inhaled ciclesonide[J]. J Clin Pharmacol, 2013, 47: 782-789. |
| [51] |
Korenblat PE. Ciclesonide and the treatment of asthma[J]. Expert Opin Pharmacother, 2010, 11: 463-479. DOI:10.1517/14656560903575647 |
| [52] |
Edsbäcker S, Johansson CJ. Airway selectivity: an update of pharmacokinetic factors affecting local and systemic disposition of inhaled steroids[J]. Basic Clin Pharmacol Toxicol, 2010, 98: 523-536. |
| [53] |
Shao J, Wang Y, Hochhaus G. Semi-mechanistic PK/PD model to assess pulmonary targeting of beclomethasone dipropionate and its active metabolite[J]. Eur J Pharm Sci, 2021, 159: 105699. DOI:10.1016/j.ejps.2021.105699 |
| [54] |
N'Guessan A, Fattal E, Chapron D, et al. Dexamethasone palmitate large porous particles: a controlled release formulation for lung delivery of corticosteroids[J]. Eur J Pharm Sci, 2018, 113: 185-192. DOI:10.1016/j.ejps.2017.09.013 |
| [55] |
Leifer FG, Konicek DM, Chen KJ, et al. Inhaled treprostinil-prodrug lipid nanoparticle formulations provide long-acting pulmonary vasodilation[J]. Drug Res, 2018, 68: 605-614. DOI:10.1055/s-0044-100374 |
| [56] |
Chapman RW, Li Z, Corboz MR, et al. Inhaled hexadecyl-treprostinil provides pulmonary vasodilator activity at significantly lower plasma concentrations than infused treprostinil[J]. Pulm Pharmacol Ther, 2018, 49: 104-111. DOI:10.1016/j.pupt.2018.02.002 |
| [57] |
Corboz MR, Zhang J, LaSala D, et al. Therapeutic administration of inhaled INS1009, a treprostinil prodrug formulation, inhibits bleomycin-induced pulmonary fibrosis in rats[J]. Pulm Pharmacol Ther, 2018, 49: 95-103. DOI:10.1016/j.pupt.2018.01.012 |
| [58] |
Chapman RW, Corboz MR, Malinin VS, et al. An overview of the biology of a long-acting inhaled treprostinil prodrug[J]. Pulm Pharmacol Ther, 2021, 65: 102002. |
| [59] |
Corboz MR, Li Z, Malinin V, et al. Preclinical pharmacology and pharmacokinetics of inhaled hexadecyl-treprostinil (c16tr), a pulmonary vasodilator prodrug[J]. J Pharmacol Exp Ther, 2017, 363: 348-357. DOI:10.1124/jpet.117.242099 |
| [60] |
Ong W, Nowak P, Cu Y, et al. Sustained pulmonary delivery of a water-soluble antibiotic without encapsulating carriers[J]. Pharm Res, 2016, 33: 563-572. DOI:10.1007/s11095-015-1808-x |
| [61] |
Hu X, Yang FF, Wei XL, et al. Curcumin acetate nanocrystals for sustained pulmonary delivery: preparation, characterization and in vivo evaluation[J]. J Biomed Nanotechnol, 2017, 13: 99-109. DOI:10.1166/jbn.2017.2326 |
| [62] |
Rautio J, Meanwell NA, Di L, et al. The expanding role of prodrugs in contemporary drug design and development[J]. Nat Rev Drug Discov, 2018, 17: 559-587. DOI:10.1038/nrd.2018.46 |
| [63] |
Ryan GM, Kaminskas LM, Kelly BD, et al. Pulmonary administration of PEGylated polylysine dendrimers: absorption from the lung versus retention within the lung is highly size-dependent[J]. Mol Pharm, 2013, 10: 2986-2995. DOI:10.1021/mp400091n |
| [64] |
Gursahani H, Riggs-Sauthier J, Pfeiffer J, et al. Absorption of polyethylene glycol (PEG) polymers: the effect of PEG size on permeability[J]. J Pharm Sci, 2009, 98: 2847-2856. DOI:10.1002/jps.21635 |
| [65] |
Mcleod VM, Chan LJ, Ryan GM, et al. Optimal PEGylation can improve the exposure of interferon in the lungs following pulmonary administration[J]. J Pharm Sci, 2015, 104: 1421-1430. DOI:10.1002/jps.24353 |
| [66] |
Napagolla R, Guru BR, Kurtoglu YE, et al. In vivo efficacy of dendrimer-methylprednisolone conjugate formulation for the treatment of lung inflammation[J]. Int J Pharm, 2010, 399: 140-147. DOI:10.1016/j.ijpharm.2010.07.030 |
| [67] |
Zhong Q, Bielski ER, Rodrigues LS, et al. Conjugation to poly (amidoamine) dendrimers and pulmonary delivery reduce cardiac accumulation and enhance antitumor activity of doxorubicin in lung metastasis[J]. Mol Pharm, 2016, 13: 2363-2375. DOI:10.1021/acs.molpharmaceut.6b00126 |
| [68] |
Zhong Q, da Rocha SR. Poly(amidoamine) dendrimer-doxorubicin conjugates: in vitro characteristics and pseudosolution formulation in pressurized metered-dose inhalers[J]. Mol Pharm, 2016, 13: 1058-1072. DOI:10.1021/acs.molpharmaceut.5b00876 |
| [69] |
Kaminskas LM, McLeod VM, Ryan GM, et al. Pulmonary administration of a doxorubicin-conjugated dendrimer enhances drug exposure to lung metastases and improves cancer therapy[J]. J Control Release, 2014, 183: 18-26. DOI:10.1016/j.jconrel.2014.03.012 |
| [70] |
Kaminskas LM, Kelly BD, McLeod VM, et al. Characterisation and tumour targeting of PEGylated polylysine dendrimers bearing doxorubicin via a pH labile linker[J]. J Control Release, 2011, 152: 241-248. DOI:10.1016/j.jconrel.2011.02.005 |
| [71] |
Ishiguro S, Cai S, Uppalapati D, et al. Intratracheal administration of hyaluronan-cisplatin conjugate nanoparticles significantly attenuates lung cancer growth in mice[J]. Pharm Res, 2016, 33: 2517-2529. DOI:10.1007/s11095-016-1976-3 |
| [72] |
Gupta P, Authimoolam SP, Hilt JZ, et al. Quercetin conjugated poly(β-amino esters) nanogels for the treatment of cellular oxidative stress[J]. Acta Biomater, 2015, 27: 194-204. DOI:10.1016/j.actbio.2015.08.039 |
| [73] |
Choi SH, Byeon HJ, Choi JS, et al. Inhalable self-assembled albumin nanoparticles for treating drug-resistant lung cancer[J]. J Control Release, 2015, 197: 199-207. DOI:10.1016/j.jconrel.2014.11.008 |
| [74] |
Waters RC, Hochhaus G. Characterization of a dextran-budesonide prodrug for inhalation therapy[J]. Eur J Pharm Sci, 2019, 129: 58-67. DOI:10.1016/j.ejps.2018.11.038 |
| [75] |
Saavedra JE, Southan GJ, Davies KM, et al. Localizing antithrombotic and vasodilatory activity with a novel, ultrafast nitric oxide donor[J]. J Med Chem, 1996, 39: 4361-4365. DOI:10.1021/jm960616s |
| [76] |
Jeh HS, Lu S, George SC. Encapsulation of PROLI/NO in biodegradable microparticles[J]. J Microencapsul, 2004, 21: 3-13. DOI:10.1080/02652040310001619767 |
| [77] |
Das D, Chen J, Srinivasan S, et al. Synthetic macromolecular antibiotic platform for inhalable therapy against aerosolized intracellular alveolar infections[J]. Mol Pharm, 2017, 14: 1988-1997. DOI:10.1021/acs.molpharmaceut.7b00093 |
| [78] |
Chen J, Su FY, Das D, et al. Glycan targeted polymeric antibiotic prodrugs for alveolar macrophage infections[J]. Biomaterials, 2019, 195: 38-50. DOI:10.1016/j.biomaterials.2018.10.017 |
| [79] |
Chavas TEJ, Su FY, Srinivasan S, et al. A macrophage-targeted platform for extending drug dosing with polymer prodrugs for pulmonary infection prophylaxis[J]. J Control Release, 2020, 330: 284-292. |
| [80] |
Tseng CL, Su WY, Yen KC, et al. The use of biotinylated-EGF-modified gelatin nanoparticle carrier to enhance cisplatin accumulation in cancerous lungs via inhalation[J]. Biomaterials, 2009, 30: 3476-3485. DOI:10.1016/j.biomaterials.2009.03.010 |
| [81] |
Xu C, Wang P, Zhang J, et al. Pulmonary codelivery of doxorubicin and siRNA by pH-sensitive nanoparticles for therapy of metastatic lung cancer[J]. Small, 2015, 11: 4321-4333. DOI:10.1002/smll.201501034 |
| [82] |
Ma C, Wu M, Ye W, et al. Inhalable solid lipid nanoparticles for intracellular tuberculosis infection therapy: macrophage-targeting and pH-sensitive properties[J]. Drug Deliv Transl Res, 2021, 11: 1218-1235. DOI:10.1007/s13346-020-00849-7 |
| [83] |
Kim EJ, Bhuniya S, Lee H, et al. An activatable prodrug for the treatment of metastatic tumors[J]. J Am Chem Soc, 2014, 136: 13888-13894. DOI:10.1021/ja5077684 |
| [84] |
Dong Z, Hamid KA, Gao Y, et al. Polyamidoamine dendrimers can improve the pulmonary absorption of insulin and calcitonin in rats[J]. J Pharm Sci, 2011, 100: 1866-1878. DOI:10.1002/jps.22428 |
| [85] |
Youn YS, Kwon MJ, Na DH, et al. Improved intrapulmonary delivery of site-specific PEGylated salmon calcitonin: optimization by PEG size selection[J]. J Control Release, 2008, 125: 68-75. DOI:10.1016/j.jconrel.2007.10.008 |
| [86] |
Lee KC, Chae SY, Kim TH, et al. Intrapulmonary potential of polyethylene glycol-modified glucagon-like peptide-1s as a type 2 anti-diabetic agent[J]. Regul Pept, 2009, 152: 101-107. DOI:10.1016/j.regpep.2008.09.008 |
| [87] |
CLKM Leach, Bueche B, Fishburn S, et al. Modifying the pulmonary absorption and retention of proteins through PEGylation[J]. Respir Drug Deliv, 2004, 1: 69-78. |
| [88] |
Gagnadoux F, Leblond V, Vecellio L, et al. Gemcitabine aerosol: in vitro antitumor activity and deposition imaging for preclinical safety assessment in baboons[J]. Cancer Chemother Pharmacol, 2006, 58: 237-224. DOI:10.1007/s00280-005-0146-9 |
| [89] |
Rodriguez CO, Crabbs TA, Wilson DW, et al. Aerosol gemcitabine: preclinical safety and in vivo antitumor activity in osteosarcoma-bearing dogs[J]. J Aerosol Med Pulm Drug Deliv, 2010, 23: 197-206. DOI:10.1089/jamp.2009.0773 |
| [90] |
Lemarie E, Vecellio L, Hureaux J, et al. Aerosolized gemcitabine in patients with carcinoma of the lung: feasibility and safety study[J]. J Aerosol Med Pulm Drug Deliv, 2011, 24: 261-270. DOI:10.1089/jamp.2010.0872 |
| [91] |
Cheng KW, Wong CC, Alston N, et al. Aerosol administration of phospho-sulindac inhibits lung tumorigenesis[J]. Mol Cancer Ther, 2013, 12: 1417-1428. DOI:10.1158/1535-7163.MCT-13-0006-T |
| [92] |
Jadwiga W, Peter C, Klaus R. Roflumilast: a review of its use in the treatment of COPD[J]. Int J Chron Obstruct Pulmon Dis, 2016, 11: 81-90. |
| [93] |
Murad HA, Habib HS, Rafeeq MM, et al. Co-inhalation of roflumilast, rather than formoterol, with fluticasone more effectively improves asthma in asthmatic mice[J]. Exp Biol Med, 2017, 242: 516-526. DOI:10.1177/1535370216685006 |
| [94] |
Suzuki ÉY, Amaro MI, de Almeida GS, et al. Development of a new formulation of roflumilast for pulmonary drug delivery to treat inflammatory lung conditions[J]. Int J Pharm, 2018, 550: 89-99. DOI:10.1016/j.ijpharm.2018.08.035 |
| [95] |
Paik J. Levodopa inhalation powder: a review in parkinson's disease[J]. Drugs, 2020, 80: 821-828. DOI:10.1007/s40265-020-01307-x |
| [96] |
Abbina S, Parambath A. PEGylation and its alternatives: a summary[M]//Parambath A. Engineering of Biomaterials for Drug Delivery Systems. Woodhead Publishing, 2018: 363-376.
|
| [97] |
Giembycz MA. Can the anti-inflammatory potential of PDE4 inhibitors be realized: guarded optimism or wishful thinking?[J]. Br J Pharmacol, 2008, 155: 288-290. DOI:10.1038/bjp.2008.297 |
 2021, Vol. 56
2021, Vol. 56