2. 国家中医药管理局"中药配方颗粒质量与疗效评"重点研究室, 四川新绿色药业科技发展有限公司, 四川 彭州 611930
2. Key Laboratory of Quality Control and Efficacy Evaluation of Traditional Chinese Medicine Formula Granules, Sichuan New Green Medicine Science and Technology Development Co., Ltd., Pengzhou 611930, China
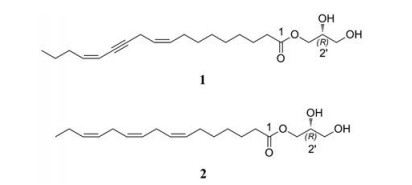
川芎(Ligusticum chuanxiong Hort.) 为伞形科多年生草本植物[1], 其药用部位是根茎, 具有活血行气、祛风止痛的功效[2], 主要化学成分为苯酞和生物碱[3, 4]。川芎为临床常用品种, 临床需求量大, 而采收加工时占全株鲜重75%以上的茎叶作为非药用部位丢弃, 造成了严重的资源浪费[5]。川芎茎叶古称蘼芜, 应用古已有之, 《神农本草经》记载“主咳逆, 定惊气, 辟邪恶, 除蛊毒、鬼痊, 去三虫, 久服通神”[6]。现代研究表明, 川芎茎叶中的苯酞类成分含量与根茎接近, 占挥发油总量的39.95%, 有一定的药用开发价值[7]。为实现川芎资源的综合开发利用, 本课题组近年来对川芎茎叶中的化学成分进行了系统研究, 从中分离得到多个结构新颖的苯酞类成分[8, 9]。本文报道从川芎茎叶中又分离得到的2个脂肪酸单甘油酯。其中化合物1为新化合物, 命名为14, 15-dehydrocrepenynic acid monoglyceride, 另1个为已知化合物(R)-α-(7'Z, 10'Z, 13'Z)-hexadecatrienoic acid monoglyceride (2) (图 1)。两个化合物均为首次从川芎中分离得到。对化合物1、2进行肿瘤细胞毒活性测试, 发现其对人乳腺癌细胞MCF-7增殖有一定的抑制作用, 其IC50分别为30.75和36.82 μmol·L-1。
|
Figure 1 Structures of compounds 1 and 2 |
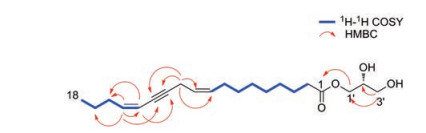
14, 15-dehydrocrepenynic acid monoglyceride (1)黄色油状液体, [α]D25-22.9 (c 0.12, MeOH)。HR-ESI-MS推断其分子式为C21H34O4 (m/z 351.252 4 [M+H]+), 不饱和度为5。1H NMR谱中显示1个端甲基[δH 0.92 (3H, t, J = 7.4 Hz, H-18)]、6个与sp3杂化碳原子相连的CH2 [δH 1.62 (2H, m, H-3), δH 1.42 (2H, m, H-17), δH 1.31 (8H, overlap, H-4, 5, 6, 7)]、3个与sp2杂化碳原子相连的CH2 [δH 2.34 (2H, t, J = 7.5 Hz, H-2), δH 2.25 (2H, qd, J = 7.4, 1.5 Hz, H-16), δH 2.05 (2H, m, H-8)]、1个与sp杂化碳原子相连的CH2 [δH 3.08 (2H, m, H-11)]、4个烯烃质子[δH 5.45 (2H, overlap, H-9, H-10), δH 5.43 (1H, m, H-14), δH 5.82 (1H, dt, J = 10.7, 7.4 Hz, H-15)] 和5个与氧相连的烷基质子[δH 4.20 (dd, J = 11.7, 4.6 Hz, H-1'a), δH 4.14 (dd, J = 11.7, 6.2 Hz, H-1'b), δH 3.93 (m, H-2'), δH 3.69 (dd, J = 11.5, 3.9 Hz, H-3'a), δH 3.59 (dd, J = 11.4, 5.8 Hz, H-3'b)] (表 1)。13C NMR显示21个碳信号, 其中有1个酯羰基信号(δC 174.6), 结合DEPT显示1个甲基(δC 14.0)、12个亚甲基(δC 65.4, 63.6, 34.4, 32.3, 29.5, 29.3, 29.3, 29.3, 27.3, 25.1, 22.4, 18.2)、5个次甲基(δC 143.0, 131.9, 124.6, 109.5, 70.5) 和2个季碳(δC 92.6, 77.4), 推测此化合物为不饱和脂肪酸脂。1H-1H COSY (图 2) 的相关信号提示C-2-C-3-C-4-C-5-C-6-C-7-C-8-C-9和C-14-C-15-C-16-C-17-C-18的碳链连接顺序。HMBC显示H-14 (δH 5.43) 与C-12 (δC 92.6)、C-16 (δC 32.3) 相关, H-15 (δH 5.82) 与C-13 (δC 77.4)、C-14 (δC 109.5)、C-16 (δC 32.3)、C-17 (δC 22.4) 相关, 提示C≡C-CH=CH-CH2-CH3的结构片段; H-11 (δH 3.08) 与C-9 (δC 131.9)、C-10 (δC 124.6)、C-12 (δC 92.6)、C-13 (δC 77.4) 相关, 提示C≡C-CH2-CH=CH-的结构片段; H-1' (δH 4.20、δH 4.14) 与C-1 (δC 174.6) 相关, H-3' (δH 3.69、δH 3.59) 与C-1' (δC 65.4)、C-2' (δC 70.5) 相关, 提示单甘油酯的结构片段。将该化合物的波谱数据与14, 15-dehydrocrepenynic acid[10, 11]比较, 发现其结构与后者相似, 区别在于多了一组典型的甘油酯信号, 包括1个与酰氧基相连的CH2 (δH 4.20, dd, J = 11.7, 4.6 Hz; δH 4.14, dd, J = 11.7, 6.2 Hz; δC 65.4)、1个与羟基相连的CH (δH 3.59, dd, J = 11.4, 5.8 Hz; δC 70.5) 和1个与羟基相连的CH2 (δH 3.93, m; δH 3.69, dd, J = 11.5, 3.9 Hz; δC 63.6)。综上, 推测此化合物为14, 15-dehydrocrepenynic acid的单甘油酯化合物。C-14-C-15的相对构型通过耦合常数确定, H-15 (1H, dt, J = 10.7, 7.4 Hz) 的氢信号提示其为Z构型。H-9和H-10的氢信号重叠, 无法使用耦合常数确定C-9-C-10的双键构型。有文献报道, 使用13C NMR的化学位移来确定共轭亚油酸的构型, 与C-9烯烃相连亚甲基的化学位移为δ 27.46或δ 32.86, 提示C-9烯烃为Z构型或E构型[12, 13]。化合物1中C-8化学位移为δ 27.3, 提示C-9-C-10为Z构型。由于化合物量的限制, 采用旋光值比较的方法代替Mosher反应确定化合物的绝对构型。其比旋光值与类似物化合物2接近([α]D25-22.6 (c 0.11, MeOH)), 手性应与其一致, 确定C-2'为R构型。
| Table 1 NMR data of compound 1 (600 MHz for 1H NMR, 151 MHz for 13C NMR, CDCl3, J in Hz) |
|
Figure 2 Key 1H-1H COSY (—) and HMBC (H→C) correlations for compound 1 |
采用MTT法测定两个化合物对人神经母细胞瘤细胞(SH-SY5Y)、鼠乳腺癌细胞(MDA-MB-231)、人乳腺癌细胞(MCF-7) 和人结肠癌细胞(HCT116) 的体外抗肿瘤活性, 结果见表 2。结果显示14, 15-dehydrocrepenynic acid monoglyceride (1) 和(R)-α-(7'Z, 10'Z, 13'Z)-hexadecatrienoic acid monoglyceride (2) 对人乳腺癌细胞MCF-7增殖具有一定的抑制作用, 其IC50分别为30.75和36.82 μmol·L-1。
| Table 2 The IC50 of compounds 1-2 for cytotoxicity on MDA-MB-231, SH-SY5Y, HCT116 and MCF-7 |
Bruker Avance III 600-NMR spectrometer (德国Bruker公司); LTQ Orbitray Velos Pro质谱仪(高分辨静电场轨道阱质谱)和Ultimate 3000超高效液相色谱仪(美国Thermo Fisher公司); LC50型中高压制备液相(赛谱锐思北京科技有限公司); COSMOS色谱柱(10 mm×250 mm, 5 μm); RE-52A旋转蒸发仪(上海亚荣生化仪器厂); 优普UPT系列超纯水(成都优普电子产品有限公司); 可调式移液器(美国Thermo Fisher公司); 细胞培养箱(上海一恒科学仪器有限公司); 多功能酶标仪(美国Thermo Fisher公司)。C18色谱硅胶(日本富士硅化学株式会社); Sephadex LH-20色谱填料(瑞士Pharmacia公司); MCI树脂(日本三菱化学公司); 硅胶GF254薄层板、200~300目正相柱色谱硅胶(青岛海洋化工厂); 色谱纯甲醇(美国TEDIA公司); 氘代氯仿(美国CIL公司); 其他试剂为分析纯(成都市科隆化学品有限公司); DMEM高糖培养基、培养皿、96孔板(美国康宁公司); 胎牛血清(北京全式金生物技术有限公司); 胰蛋白酶、四甲基偶氮唑盐(德国Biofroxx公司)。
人结肠癌细胞(HCT116)、人神经母瘤细胞(SH-SY5Y)、人乳腺癌细胞(MCF-7)、鼠乳腺癌细胞(MDA-MB-231) 均购自中国科学院上海细胞研究所。
川芎茎叶采自四川眉山, 经胡昌江教授鉴定为川芎Ligusticum chuanxiong Hort. 的茎叶, 样品标本(CX-1804) 现存于成都中医药大学中药化学1001研究室。
1 提取分离自然阴干的川芎茎叶(20 kg), 粗粉碎, 加10倍量95%乙醇渗漉提取, 提取液减压浓缩得到浸膏3 kg。浸膏加温水分散, 石油醚萃取5或6次, 合并萃取液, 减压回收溶剂后得石油醚部位0.5 kg。取石油醚部位0.5 kg, 经MCI柱色谱, 90%甲醇等度洗脱, 除去色素, 其浓缩液经硅胶柱色谱, 石油醚-乙酸乙酯(99∶1~1∶99) 梯度洗脱, 得到7个组分A~G。G组分再经硅胶柱色谱, 石油醚-丙酮(98∶2~1∶99) 梯度洗脱, 得到G1~G4共4个组分。G2经Sephadex LH-20凝胶柱, 二氯甲烷-甲醇(2∶3) 等度洗脱, 得到G2.1~G2.3共3个组分。G2.2经反相C18柱色谱以甲醇-水(66∶34) 等度洗脱, 得到化合物1 (5.9 mg) 和化合物2 (10.4 mg)。
2 结构鉴定化合物1 黄色油状液体。[α]D25-22.9 (c 0.12, MeOH)。IR/cm-1: 3 707, 3 662, 2 970, 2 870, 1 701, 1 054, 1 004; (-)HR-ESI-MS m/z 349.236 9 [M-H]- (Calcd. for C24H33O4-, 349.238 4); (+)HR-ESI-MS m/z 351.252 4 [M+H]+ (Calcd. for C24H35O4+, 351.253 0)。1H NMR和13C NMR数据见表 1。
化合物2 黄色油状液体。[α]D25-22.6 (c 0.11, MeOH)。HR-ESI-MS m/z 325.2 [M+H]+。1H NMR (600 MHz CDCl3) δ 5.37 (6H, overlap, H-7, 8, 10, 11, 13, 14), 4.21 (1H, dd, J = 11.7, 4.5 Hz, H-1'a), 4.15 (1H, dd, J = 11.6, 6.2 Hz, H-1'b), 3.93 (1H, tt, J = 6.0, 4.2 Hz, H-2'), 3.69 (1H, dd, J = 11.5, 5.8 Hz, H-3'a), 3.60 (1H, dd, J = 11.5, 5.8 Hz, H-3'b), 2.81 (4H, dt, J = 6.7, 4.4 Hz, H-9, H-12), 2.36 (2H, t, J = 7.6 Hz, H-2), 2.08 (4H, overlap, H-6, H-15), 1.36 (4H, overlap, H-4, H-5), 0.98 (3H, t, J = 7.5 Hz, H-16); 13C NMR (151 MHz, CDCl3) δ 174.5 (C-1), 132.3 (C-14), 130.1 (C-7), 128.6 (C-10), 128.4 (C-11), 128.3 (C-13), 127.3 (C-8), 70.5 (C-2'), 65.4 (C-1'), 63.6 (C-3'), 34.3 (C-2), 29.5 (C-5), 29.0 (C-4), 27.3 (C-6), 25.9 (C-9), 25.8 (C-12), 25.1 (C-3), 20.8 (C-15), 14.5 (C-16)。以上波谱数据与文献报道一致[14], 故鉴定化合物2为(R)-α-(7'Z, 10'Z, 13'Z)-hexadecatrienoic acid monoglyceride。
3 体外抑制肿瘤细胞增殖活性采用MTT法进行肿瘤细胞增殖抑制活性测定, 分别将人神经母瘤细胞(SH-SY5Y)、鼠乳腺癌细胞(MDA-MB-231)、人乳腺癌细胞(MCF-7) 和人结肠癌细胞(HCT116) 培养于含10%胎牛血清的细胞培养液中, 取对数生长期细胞以每毫升2.5×104个细胞将细胞悬浮液接种到96孔板中, 每孔100 μL, 置37 ℃、5% CO2培养箱中培养1或2天, 使细胞稳定。分别加入不同浓度受试化合物(3.125、6.25、12.5、25、50和100 μmol·L-1) 于96孔板中, 并设阴性对照组, 继续培养48 h。每孔加入MTT (5 mg·mL-1) 20 μL, 继续置于37 ℃、5% CO2培养箱中避光孵育, 2 h后加入DMSO溶液80 μL, 置摇床上振荡直至MTT反应的产物甲瓒结晶全部溶解。使用多功能酶标仪于570 nm波长下测定吸光度OD值。将OD值带入公式计算细胞抑制率和IC50。实验重复3次。抑制率的计算公式为:
细胞抑制率= [(阴性对照组OD值-实验组OD值)/阴性对照组OD值] × 100%
作者贡献: 闫洪玲是本文的第一作者, 负责成分分离、结构鉴定和论文撰写; 陈瑶测定了两个化合物的体外抗肿瘤活性; 唐飞、郭晨婉协助提取分离工作; 冯健与胡昌江负责药材的采收、粉碎及鉴定, 并提供试验所需试剂耗材; 谭玉柱与鲁军是本文的通讯作者, 设计和组织了整个研究。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Han W. Advances in chemical constituents and pharmacological effects of Ligusticum chuanxiong[J]. Mod Chin Med (中国现代中药), 2017, 19: 1341-1349. |
| [2] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China: Vol Ⅰ (中华人民共和国药典: 第一部)[M]. Beijing: China Medical Science Press, 2015.
|
| [3] |
Chen Z, Zhang C, Gao F, et al. A systematic review on the Rhizome of Ligusticum chuanxiong Hort. (Chuanxiong)[J]. Food Chem Toxicol, 2018, 119: 309-325. DOI:10.1016/j.fct.2018.02.050 |
| [4] |
Yuan X, Han B, Feng ZM, et al. Three butylphthalide derivatives from the Rhizome of Ligusticum chuanxiong[J]. Acta Pharm Sin (药学学报), 2020, 55: 2674-2678. |
| [5] |
Chen SL, Jiang GH. Security and pharmacological effects for overground parts of Chuanxiong[J]. J Chengdu Univ Tradit Chin Med (成都中医药大学学报), 2009, 32: 63-65. |
| [6] |
(Wei) Wu P, (Qing) Sun XY, Feng XJ, Ed. Shen Nong Ben Cao Jing (神农本草经)[M]. Beijing: Scientific and Technical Documentation Press, 1996: 23.
|
| [7] |
Liu JR, Liu SY, Liu HM, et al. Comparison on volatile oil content and chemical constituents among different parts of Ligusticum chuanxiong and pieces with different processing methods[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2020, 26: 101-107. |
| [8] |
Tang F, Tan YZ, Ao H, et al. Discovery of phthalides with vasodilating activity in stems and leaves of Ligusticum chuanxiong[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 1190-1195. |
| [9] |
Tang F, Yan YM, Yan HL, et al. Chuanxiongdiolides R4 and R5, phthalide dimers with a complex polycyclic skeleton from the aerial parts of Ligusticum chuanxiong and their vasodilator activity[J]. Bioorg Chem, 2021, 107: 104523. DOI:10.1016/j.bioorg.2020.104523 |
| [10] |
Mittermeier VK, Dunkel A, Hofmann T. Discovery of taste modulating octadecadien-12-ynoic acids in golden chanterelles (Cantharellus cibarius)[J]. Food Chem, 2018, 269: 53-62. DOI:10.1016/j.foodchem.2018.06.123 |
| [11] |
Jiang MY, Wang F, Dong ZJ, et al. A new hydroxyl acetylenic fatty acid from the basidiomycete Craterellus aureus (Cantharellaceae)[J]. Plant Divers (植物分类与资源学报), 2008, 30: 614-616. |
| [12] |
Jie MS, Pasha MK, Alam MS. Synthesis and nuclear magnetic resonance properties of all geometrical isomers of conjugated linoleic acids[J]. Lipids, 1997, 32: 1041-1044. DOI:10.1007/s11745-997-0134-9 |
| [13] |
Davis AL, McNeill GP, Caswell DC. Analysis of conjugated linoleic acid isomers by 13C NMR spectroscopy[J]. Chem Phys Lipids, 1997, 97: 155-165. |
| [14] |
Ogihara T, Amano N, Mitsui Y, et al. Determination of the absolute configuration of a monoglyceride antibolting compound and isolation of related compounds from radish leaves (Raphanus sativus)[J]. J Nat Prod, 2017, 80: 872-878. DOI:10.1021/acs.jnatprod.6b00746 |
 2021, Vol. 56
2021, Vol. 56


