芋螺毒素是由海洋软体动物芋螺毒腺所分泌的含有10~40个氨基酸残基的活性多肽, 大部分芋螺毒素具有多对二硫键及独特的空间结构, 可特异性作用于钠、钾、钙等多种离子通道及乙酰胆碱受体[1]。根据作用靶点的不同, 芋螺毒素被分为α、δ、ε、γ、κ、λ、μ、ρ等若干个家族[2]。其中α-芋螺毒素是研究最早且最广泛的一类, α-芋螺毒素能特异性地阻断烟碱型乙酰胆碱受体(nicotinic acetylcholine receptors, nAChRs), 具有高活性以及高选择性的特点, 可作为研究配体-受体相互作用的有效分子工具, 具有较大的药物开发价值, 是潜在的药源分子库[3]。
α-芋螺毒素PnIA提取于金翎芋螺的毒液, 对α6/α3β2β3、α6/α3β4、α3β4及α7 nAChRs均有阻断作用[4]。为了提高其选择性与活性, 众多研究者通过修饰改造设计合成了一系列突变体, 其中[A10L]PnIA是将PnIA第十位的丙氨酸替换为亮氨酸得到的突变体, 可特异性阻断α7和α3β2 nAChRs, IC50值分别为12.6和99.3 nmol·L-1[5]。研究表明, α7 nAChR与阿尔兹海默症、肺癌等多种疾病相关, α3β2 nAChR则与疼痛相关, 这使得α7和α3β2 nAChRs成为了非常具有潜力的药物靶标[6, 7]。而α-芋螺毒素[A10L]PnIA对这两种nAChRs亚型均有较强的阻断活性且选择性很好, 因此, α-芋螺毒素[A10L]PnIA具有较高的研究价值。
天然活性多肽因其生物活性高, 代谢产物不良反应小等特点而受到研究者的广泛关注, 但多肽在药物应用中也有其自身的局限性, 例如稳定性差, 半衰期短等, 在实际应用中容易受到限制[8]。对多肽进行结构修饰和改造可以在很大程度上改善其成药性, 常见的改造方法有非天然氨基酸修饰、末端结构修饰、环化修饰等, 其中环化修饰是多肽改善稳定性和提高活性的重要策略[9]。天然存在的环肽作为一种重要的生物活性物质, 大部分都具有抗菌、抗癌、免疫抑制等作用, 很多人工合成的环肽也被证实具有相似的临床应用[10]。多肽的环化方式可以分为多肽自身成环及连接子辅助成环。多肽自身成环包括自然化学连接、直接偶联等, 其中直接偶联需要侧链全保护的多肽通过偶联试剂进行环化, 产率较低且工艺复杂。而自然化学连接是侧链未保护多肽N末端的半胱氨酸和C末端的硫酯反应形成环肽, 与直接偶联相比, 操作更为便捷且条件非常温和, 在pH值为7的水溶液中即可反应[11]。连接子辅助成环主要包括氨基酸连接子辅助成环及小分子连接子辅助成环, 前者借助不同长度的氨基酸连接子对侧链保护的多肽进行环化, Li等[12]使用该方法成功环化α-芋螺毒素TxIB, 但反应产率低, 且反应过程较为复杂。与氨基酸连接子辅助成环相比, 小分子连接子辅助成环具有反应活性好, 产率高等优势。Lautrette等[13]通过一系列亲核试剂对含两个赖氨酸的线性肽进行环化。目前该方法可应用到最多具有14个氨基酸残基的多肽, 多肽的氨基酸残基侧链无需保护, 是一种操作简单、条件温和、产率高、具有广泛应用前景的环化新方法。但该方法并未应用于含有半胱氨酸残基的多肽中, 且其在多于14个氨基酸残基多肽中的应用性并不清楚。因此本课题选取了具有两对二硫键和16个氨基酸残基的α-芋螺毒素[A10L]PnIA作为环化对象, 探索该环化方法在富含二硫键以及具有更多氨基酸残基的天然多肽中的实际应用。本课题共合成了4个三聚氯氰连接子, 尝试了3种不同的合成路线, 最终完成了[A10L]PnIA的环化。通过双电极电压钳技术, 评价了产率最高的环化产物对7种重要nAChR亚型的阻断活性以及选择性。最后通过圆二色谱初步推断环化后多肽的空间构象变化。
结果与讨论 1 连接子的合成以三聚氯氰分别与间苯二甲胺、哌嗪、乙二胺和1, 6-己二胺反应, 合成了4种连接子linker1~4 (图 1), 连接子的结构通过质谱确定。linker1: [M+H]+ m/z 431.01; linker2: [M+H]+ m/z 384.7; linker3: [M+H]+ m/z 411.01; linker4: [M+H]+ m/z 356.85, 分别与产物理论相对分子质量429.98、382.03、410.01、355.99相对应。

|
Figure 1 Structures and synthesis of four linkers. Reagents and conditions: Linker1: a. K2CO3, MeCN, 0 ℃-rt; Linker 2-4: b. NaOH, H2O/CH2Cl2, 0-5 ℃ |
为了进行首尾环化, 在[A10L]PnIA首尾各增加一个赖氨酸(K-[A10L]PnIA-K, 图 2A)。最初设计3种环化方案, 方案1 (图 2B) 通过Fmoc固相合成法合成了树脂肽resin-K-[A10L]PnIA-K, 在树脂上环化后再切割树脂, 最后进行环肽的氧化折叠。由于脱树脂条件剧烈, 未得到预期环化产物。方案2 (图 2C) 通过Fmoc固相合成法合成了具有两对保护基的线性肽, 先进行环化, 再去除保护基并进行氧化折叠, 但脱保护基的同时脱除了连接子。方案3 (图 2D) 通过Fmoc固相合成法合成了只含有一对保护基的线性肽, 先通过两步氧化法合成K-[A10L]PnIA-K的两对二硫键, 构建其活性空间结构, 再利用连接子进行环化, 合成预期环肽, 该方案可行。
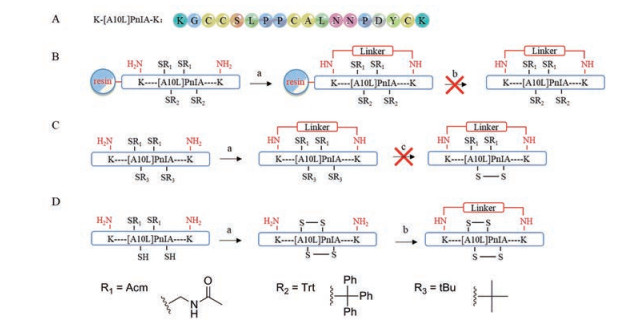
|
Figure 2 Sequence and cyclization protocols of K-[A10L]PnIA-K. Sequence of K-[A10L]PnIA-K (A); three cyclization protocols of K-[A10L]PnIA-K (B-D). Reagents and conditions: a. Linker, DIEA, DMF, rt; b. K3[Fe(CN)6], Tris-HCl, pH 7.5; I2, H2O/MeCN, N2 |
经制备型HPLC纯化后的线性肽纯度大于95%, 进行两步氧化折叠及纯化, 得到具有两对二硫键的K-[A10L]PnIA-K, 经分析型HPLC分析, 纯度大于90%, 经质谱分析, [M+2H]2+ m/z 982.42、[M+3H]3+ m/z 655.35, 由此计算可得Mr = 1 962.84, 与理论相对分子质量1 963.39相符(图 3A)。通过连接子将[A10L]PnIA首尾环化, 经制备型HPLC纯化后, 最终得到4个环肽c[A10L]PnIA-1~4, HPLC纯度分析高于90%, 经质谱分析并计算环肽c[A10L]PnIA-1~4相对分子质量分别为2 322.64、2 272.62、2 303.22、2 246.92, 与理论相对分子质量2 322.47、2 272.41、2 302.48、2 246.37相符(图 3B~E)。环肽c[A10L]PnIA-1~4环化产率分别为52.00%、43.47%、32.45%、28.92% (图 3F)。
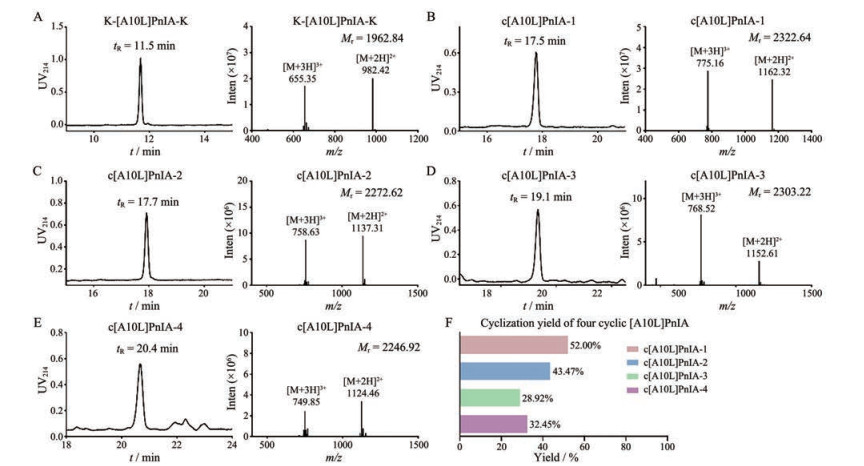
|
Figure 3 HPLC and MS analysis of oxidation and cyclization products of K-[A10L]PnIA-K. HPLC and MS analysis of product of K-[A10L]PnIA-K(A-E); yields of c[A10L]PnIA-1-4(F) |
α-芋螺毒素具有由两对二硫键控制的精确的三维立体活性构象, 通常对其结构的改造往往会带来活性的丧失, 因此判断环化方法是否可行的另一主要依据为改造后α-芋螺毒素的活性是否得到保持。本课题通过双电极电压膜片钳技术, 评价了环肽c[A10L]PnIA-1对多种nAchRs亚型的阻断活性与选择性。如图 4所示, 10 μmol·L-1 c[A10L]PnIA-1分别对α2β2、α4β4、α6β4、α4β2、Mα1β1δε nAchRs进行阻断活性评价(图 4A), 其反应率分别为84.09%、98.06%、87.41%、65.69%和59.71% (图 4B), 对应的阻断率分别为15.91%、1.94%、12.59%、34.31%、40.29%, 表明10 μmol·L-1 c[A10L]PnIA-1对这5种nAchRs亚型均无显著阻断作用。将不同浓度的c[A10L]PnIA-1对主受体α7及α3β2进行阻断活性评价(图C), 阻断作用较强, 其IC50值分别为63.0 nmol·L-1 (95% CI: 54.4~73.2 nmol·L-1) 和653.8 nmol·L-1 (95% CI: 580.4~736.5 nmol·L-1) (图 4D), 与本体[A10L]PnIA的IC50值(12.6与99.3 nmol·L-1) 相比, 分别升高了5倍和7倍。结果表明, c[A10L]PnIA-1保持了其本体对α7及α3β2受体的特异性阻断作用, 且活性保持较好。
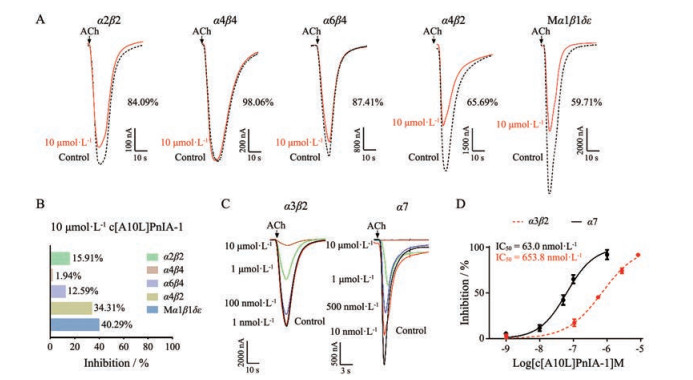
|
Figure 4 Response and inhibition of c[A10L]PnIA-1 (10 μmol·L-1) on different nAChR subtypes (A-B); response and dose-inhibition curves of c[A10L]PnIA-1 on α7 and α3β2 nAChR subtypes (C-D) |
分析本体肽[A10L]PnIA及环肽c[A10L]PnIA-1的圆二色谱图, 两条肽在208 nm处均出现负峰, 这说明他们的二级结构中均包含1个α螺旋(图 5)。谱图整体差别不大, 说明与[A10L]PnIA本体相比, 环肽c[A10L]PnIA-1二级结构无明显改变。
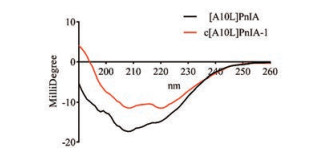
|
Figure 5 CD spectrum of [A10L]PnIA and c[A10L]PnIA-1 |
本文基于双三聚氯氰骨架合成了4种小分子连接子用于α-芋螺毒素[A10L]PnIA的环化合成, 探索了3种环化路线, 最终通过先氧化折叠线性肽再环化的合成路线合成了4个环肽c[A10L]PnIA-1~4。通过双电极电压膜片钳技术评价了环肽c[A10L]PnIA-1对7种nAChR亚型的抑制活性, 结果表明该环肽对于两个主受体α7与α3β2 nAChR亚型的IC50值分别有5倍和7倍的升高, 且选择性没有改变。圆二色谱结果表明c[A10L]PnIA-1与本体肽的二级结构相似。总之, 该环化方法具有反应快速且产率高的优点, 改造后的芋螺毒素活性构象变化小, 活性能够得到较好保持, 有望进一步应用于富含二硫键的α-芋螺毒素的环化研究。
实验部分
多肽纯化采用Waters 2535制备型高效液相色谱仪, 纯度分析采用Waters e2695分析型高效液相色谱仪(美国Waters公司); 受体抑制活性评价采用双电极电压钳系统(Axon 900A, 美国Molecular Device公司), Digidata 1440A数模转换器, Axon 900A放大器(美国Molecular Device公司), Sutter Nanoject Ⅱ显微注射仪(美国Drummond Scientific公司); 冷冻干燥采用Alpha 1-4 L冷冻干燥机(德国Christ公司); 圆二色谱测定采用MOS-500圆二色谱仪(法国Biologic公司)。三聚氯氰、间苯二甲胺、无水N, N-二甲基甲酰胺(DMF)、N, N-二异丙基乙胺(DIEA)、三氟乙酸(色谱级, TFA)、乙腈(色谱级, MeCN)、苯酚、甲酸等试剂均购置于上海阿拉丁生化科技股份有限公司; 非洲爪蟾(Xenopus laevis) 购自美国Nasco公司。
1 连接子的合成连接子的合成路线见图 1, 具体合成方法见参考文献[14-17]。
2 环肽的合成两步氧化法。第一步氧化采用铁氰化钾氧化法, 将线性肽K-[A10L]PnIA-K水溶液(10 mmol溶于4 mL水) 缓慢滴加到搅拌条件下的铁氰化钾反应液(100 mL, 20 mmol·L-1 K3[Fe(CN)6], 0.1 mol·L-1 Tris-HCl; pH 7.5) 中, 室温下敞口空气氧化45 min, 得到具有一对二硫键的第一步氧化产物, 制备型HPLC纯化后进行第二步氧化。第二步氧化采用碘氧化法, 将第一步纯化产物在氮气保护下缓慢加入到碘反应液(100 mL, 7.5 mmol·L-1, I2溶于H2O-TFA-MeCN, 体积比20∶1∶8) 中, 搅拌反应10 min, UPLC检测反应完成后, 加入VC饱和溶液终止反应, 制备型HPLC纯化后通过质谱检测其相对分子质量, 得到第二步氧化产物, 冷冻干燥后密封置于-80 ℃保存用于下一步环化反应。
环化方法。将等体积DIEA-DMF溶液(20 mmol·L-1) 缓慢加入氧化折叠后的K-[A10L]PnIA-K的DMF溶液中(1 mmol·L-1), 涡旋20 s使其充分混匀后加入等体积的连接子DMF溶液(2 mmol·L-1), 涡旋20 s后置于室温下2 h。UPLC监测反应情况, 反应结束后, 经制备型HPLC纯化, 质谱检测其相对分子质量, 确定目标环化产物。最终得到4个环肽, 冷冻干燥后密封置于-80 ℃保存。
3 nAChR抑制活性评价将环化产率最高的环肽c[A10L]PnIA-1通过双电极电压钳技术检测其对不同nAChRs亚型的抑制活性与选择性。取冻干环肽c[A10L]PnIA-1 (10 mmol·L-1) 溶于少量ND96溶液(96.0 mmol·L-1 NaCl, 1.0 mmol·L-1 MgCl2, 2.0 mmol·L-1 KCl, 1.8 mmol·L-1 CaCl2, 5 mmol·L-1 HEPES, pH 7.1~7.5) 中, 以此浓度为母液, 10倍梯度稀释得到10 mmol·L-1~10 nmol·L-1的环肽c[A10L]PnIA-1用于活性检测。
将含α3、β2和α7 nAChR亚基基因的质粒经过体外转录获得相应的cRNA, 挑选状态良好, 大小合适的非洲爪蟾卵母细胞, 把α3与β2的cRNA混合, 通过显微注射将混合α3β2与α7 cRNA分别注入不同的非洲爪蟾卵母细胞内, 每颗蛙卵注射50.6 μL RNA。17 ℃下, 在含抗ND96 (青霉素10 μg·mL-1、链霉素10 μg·mL-1、庆大霉素100 μg·mL-1) 中培养3~5天, 通过Axon 900A双电极电压钳系统检测α7与α3β2受体的表达情况。将配好的不同浓度的环肽c[A10L]PnIA-1溶液加入蛙卵槽中, 测定不同浓度的环肽c[A10L]PnIA-1与α7、α3β2受体间的相互作用。双电极电压钳条件: 电压-70 mV, 灌流速度2 mL·min-1, 电阻不高于1.5 MΩ, 记录时间为1 min (2 s ND96冲洗, 2 s乙酰胆碱刺激, 56 s ND96冲洗)。每个浓度点至少重复测定3次。利用GraphPad Prism 6.0绘制环肽c[A10L]PnIA-1对α7及α3β2的浓度-反应曲线。
4 圆二色谱结构测定通过MOS-500圆二色谱仪对[A10L]PnIA本体及环肽c[A10L]PnIA-1进行分析, 肽浓度均为0.1 mg·mL-1。测试参数为: 灵敏度100 mdeg; 扫描范围190~240 nm; 扫描速度100 nm·min-1; 响应时间2 s。每个样品均先测试蒸馏水背景, 再测试待测样品。
作者贡献: 作者任茅茅负责化合物的设计、合成、活性测定与稿件撰写; 作者张宝建负责化合物结构的分析与鉴定; 作者孙鑫和杨芳负责化合物的分离纯化; 作者长孙东亭、董帅和罗素兰负责实验设计、过程指导、稿件撰写与修改。
利益冲突: 本文作者声明无任何利益冲突。
| [1] |
Jin AH, Muttenthaler M, Dutertre S, et al. Conotoxins: chemistry and biology[J]. Chem Rev, 2019, 119: 11510-11549. DOI:10.1021/acs.chemrev.9b00207 |
| [2] |
Olivera BM, Cruz LJ. Conotoxins, in retrospect[J]. Toxicon, 2001, 39: 7-14. DOI:10.1016/S0041-0101(00)00157-4 |
| [3] |
Giribaldi J, Dutertre S. alpha-Conotoxins to explore the molecular, physiological and pathophysiological functions of neuronal nicotinic acetylcholine receptors[J]. Neurosci Lett, 2018, 679: 24-34. DOI:10.1016/j.neulet.2017.11.063 |
| [4] |
Armishaw C, Jensen AA, Balle T, et al. Rational design of alpha-conotoxin analogues targeting alpha7 nicotinic acetylcholine receptors: improved antagonistic activity by incorporation of proline derivatives[J]. J Biol Chem, 2009, 284: 9498-9512. DOI:10.1074/jbc.M806136200 |
| [5] |
Luo S, Nguyen TA, Cartier GE, et al. Single-residue alteration in alpha-conotoxin PnIA switches its nAChR subtype selectivity[J]. Biochemistry, 1999, 38: 14542-14548. DOI:10.1021/bi991252j |
| [6] |
Bouzat C, Lasala M, Nielsen BE, et al. Molecular function of alpha7 nicotinic receptors as drug targets[J]. J Physiol, 2018, 596: 1847-1861. DOI:10.1113/JP275101 |
| [7] |
Xu M, Zhu X, Yu J, et al. The crystal structure of Ac-AChBP in complex with alpha-conotoxin LvIA reveals the mechanism of its selectivity towards different nAChR subtypes[J]. Protein Cell, 2017, 8: 675-685. DOI:10.1007/s13238-017-0426-2 |
| [8] |
He J, Liang J, Xuan M, et al. Effective strategies for improving the stability of peptides in vivo[J]. Acta Pharm Sin (药学学报), 2020, 55: 25-32. |
| [9] |
Peng J, Wang J, Dai W, et al. Lead compound optimization strategy (7)-modification strategies for peptides[J]. Acta Pharm Sin (药学学报), 2020, 55: 427-445. |
| [10] |
Reguera L, Rivera DG. Multicomponent reaction toolbox for peptide macrocyclization and stapling[J]. Chem Rev, 2019, 119: 9836-9860. DOI:10.1021/acs.chemrev.8b00744 |
| [11] |
Chow H, Zhang Y, Matheson E, et al. Ligation technologies for the synthesis of cyclic peptides[J]. Chem Rev, 2019, 119: 9971-10001. DOI:10.1021/acs.chemrev.8b00657 |
| [12] |
Li X, Wang S, Zhu X, et al. Effects of cyclization on activity and stability of alpha-conotoxin TxIB[J]. Mar Drugs, 2020, 18: 180. DOI:10.3390/md18040180 |
| [13] |
Lautrette G, Touti F, Lee HG, et al. Nitrogen arylation for macrocyclization of unprotected peptides[J]. J Am Chem Soc, 2016, 138: 8340-8343. DOI:10.1021/jacs.6b03757 |
| [14] |
Chen Y, Wang D, Huang Z, et al. Synthesis, structure, and functionalization of homo heterocalix[2] arene[2] triazines: versatile conformation and cavity structures regulated by the bridging elements[J]. J Org Chem, 2010, 75: 3786-3796. DOI:10.1021/jo100571c |
| [15] |
Gajjar DG, Patel RM, Patel HN, et al. Designing, characterization, and thermal behavior of triazine-based dendrimers[J]. J Polym Eng, 2015, 35: 41-52. DOI:10.1515/polyeng-2014-0123 |
| [16] |
Lin X, Liu X, Xu D, et al. Synthesis and characterization of a four-arm initiating core containing 1, 3, 5-triazine[J]. Fine Chem (精细化工), 2007(02): 194-198. |
| [17] |
Bu J, Liang H, Zhang D, et al. Preparation and expansion properties of a novel UV-curable intumescent flame-retardant coating[J]. J Therm Anal Calorim, 2015, 122: 329-338. DOI:10.1007/s10973-015-4733-7 |
 2021, Vol. 56
2021, Vol. 56


