2. 北京中医药大学中药学院, 北京 100029;
3. 北京中医药大学中医药研究院, 北京 100029
2. School of Chinese Materia Medica, Beijing University of Chinese Medicine, Beijing 100029, China;
3. Research Institute of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
糖尿病视网膜病变(diabetic retinopathy, DR) 是糖尿病常见的微血管并发症之一, 目前世界上约有1.45亿人患有DR。DR患者早期症状表现为视力下降, 视野缺损, 晚期出现牵拉性视网膜脱离, 是致盲的首要因素, 严重影响患者的生活质量[1]。糖尿病视网膜病变过程与炎症、氧化应激、免疫等多种因素有关[2]。西医治疗糖尿病视网膜病变主要采取控制血糖、血压及血脂等综合疗法, 晚期则采用激光、玻璃体切除术等, 但治疗价格较贵, 多数患者无力承担, 且总体疗效并不理想[3]。
近年来, 中药广泛应用于DR的临床治疗中。骆驼蓬(Peganum hannal L., Luotuopeng, LTP) 系蒺藜科多年生草本植物, 已被列为标准的维吾尔药。骆驼蓬全草中含有多种成分, 主要有生物碱、甾体、黄酮、蒽醌和氨基酸等, 其中生物碱的含量最高, 主要包括骆驼蓬碱和去氢骆驼蓬碱。现代研究发现, 骆驼蓬具有降血糖及改善糖尿病并发症的作用[4]。文献报道, 不同剂量的骆驼蓬种子醇提取物(150和250 mg·kg-1) 降低正常大鼠和链脲佐菌素(streptozocin, STZ) 诱导的糖尿病大鼠的血糖水平, 且降糖能力与二甲双胍基本一致[5]。另外, 低剂量骆驼蓬种子的水醇提取物(30、60和120 mg·kg-1) 灌胃给药不仅降低STZ诱导的糖尿病大鼠的血糖水平, 并且促进三羧酸循环, 并降低血脂、丙二醛、谷丙转氨酶、谷草转氨酶、γ-谷氨酰转肽酶、胆红素和糖化血红蛋白等[6]。此外, 骆驼蓬子水提物灌胃给药能够减轻糖尿病大鼠肝脏汇管区炎症和局灶性坏死, 改善肾小球硬化和系膜增宽[7]。虽然骆驼蓬降血糖的报道较多, 但是它对于DR的疗效却少有研究。本课题组前期研究显示, 骆驼蓬水提物显著抑制高糖诱导的视网膜血管内皮细胞的活力和细胞迁移[8], 初步提示骆驼蓬可能具有防治DR的作用。由于骆驼蓬化学成分复杂, 靶点众多, 它治疗DR的机制尚未明确。
网络药理学是集生物信息学、网络生物学和传统药理学等多学科于一体的综合性研究方法, 涵盖了药物活性成分检索、作用靶点预测和信号通路分析等内容。它通过构建活性成分-靶点、靶点-靶点、成分-靶点-疾病和成分-靶点-通路等网络, 充分利用基因和靶点等大数据, 系统综合地阐明药物的作用机制[9]。网络药理学的优势与中药成分复杂、靶点众多的特点相吻合, 已经广泛应用于中药研究中[10]。Zhang等[11]通过网络药理学预测了芍药治疗溃疡性结肠炎的作用靶点, 并构建了活性成分-疾病-靶点网络, 发现其主要是通过肿瘤坏死因子(tumor necrosis factor, TNF) 信号通路减轻炎症反应对肠道的刺激, 为芍药治疗溃疡性结肠炎的进一步药理研究提供了参考。Yu等[12]通过网络药理学的方法, 发现银黄清肺胶囊具有多成分、多靶点、多通路的作用特点, 并预测了其慢性支气管炎的潜在作用机制。
本研究计划采用体外高糖诱导的视网膜血管内皮细胞模型, 观察骆驼蓬对内皮细胞管道形成的影响, 结合网络药理学方法和real-time PCR方法, 研究骆驼蓬治疗DR的潜在机制, 为深入开展基础实验研究及临床合理应用提供实验依据, 为DR的治疗提供新的思路, 为骆驼蓬的开发利用奠定基础。
材料与方法细胞株 猴视网膜血管内皮(RF/6A) 细胞由上海生命科学研究院研究中心提供。
药物与试剂 骆驼蓬药材(新疆维吾尔自治区省药材公司神州大药房) 经新疆医科大学张洪亮教授鉴定为蒺藜科植物骆驼蓬(Peganum harmala L.) 的种子; RPMI 1640无糖培养基(批号: 22400-089)、RPMI 1640高糖培养基(批号: A10491-01; 含有25 mmol·L-1葡萄糖) (Gibco公司); 胎牛血清(Hyclone公司, 批号: GYG0116); 基质胶(康宁公司, 356234); TRIzol (Thermo公司, 批号: 15596018); 反转录试剂盒(批号: 4897030001)、PCR试剂盒(批号: 4913914001) (罗氏公司)。
主要仪器及设备 3111 CO2细胞培养箱(美国Thermo公司); LD5-2B台式低速离心机(中国时代北利公司); IX71型荧光倒置显微镜(日本奥林巴斯株式会社); 荧光定量PCR仪(美国ABI公司); 万分之一电子天平(JY6001, 上海精科公司天平厂)。
骆驼蓬水提物的制备 取适量骆驼蓬子, 粉碎, 置于提取容器中, 加入10倍量水, 回流提取, 过滤, 得到药渣; 药渣加8倍量水, 重复上述步骤, 得到骆驼蓬水提物。将水提物放入蒸发皿中, 然后置于70 ℃水浴锅上浓缩制成浸膏; 然后将浸膏转移至真空管干燥箱中60 ℃干燥, 干燥后放入粉碎机中粉碎即得到骆驼蓬水提物粉末; 准确称取10.0 mg骆驼蓬水提物粉末, 加入0.1 mL高压灭菌水配制为100 g·L-1原液, 经0.22 μm微孔滤膜除菌, 得滤液4 ℃保存备用。
细胞培养和内皮管道形成实验 RF/6A细胞培养于完全培养基中(含10%胎牛血清+ 90%基础培养基+ 1%青霉素和链霉素), 置于温度为37 ℃、5% CO2的培养箱中培养。
每天于显微镜下观察细胞生长状况, 当细胞融合度达到85%左右时, 将细胞用于实验。首先, 将细胞培养皿中原有培养基弃去, 加入PBS清洗2次; 然后加入胰酶消化细胞, 当细胞间隙变大、细胞变圆时, 立即用完全培养基终止消化; 将细胞转移至1.5 mL离心管中, 并离心。分别准备4种培养基, 包括正常组培养基(葡萄糖浓度为5.5 mmol·L-1)、模型组培养基(葡萄糖浓度为25 mmol·L-1)、骆驼蓬高剂量组培养基(葡萄糖浓度为25 mmol·L-1 + 骆驼蓬200 mg·L-1) 与骆驼蓬低剂量组培养基(葡萄糖浓度为25 mmol·L-1 + 骆驼蓬150 mg·L-1)。用各组对应培养基将细胞浓度调整为每毫升2×105个。将基质胶置于碎冰融化, 融化后用基础培养基以1∶1的比例稀释基质胶; 将稀释后的基质胶加入96孔板中, 并置于37 ℃培养箱中放置; 30 min后取出96孔板, 置于超净台中; 每孔加入含有不同培养基的细胞悬液200 μL, 每组3孔。将96孔板置于37 ℃培养箱中孵育5 h, 取出于倒置荧光显微镜下拍照, 并用Image J软件分析管道形成总长度。
骆驼蓬活性成分筛选及其作用靶点的筛选与预测 利用TCMID (http://119.3.41.228:8000/tcmid/)、BATMAN-TCM (http://bionet.ncpsb.org/batman-tcm/) 筛选骆驼蓬的主要有效成分。筛选方法: 在TCMID、BATMAN-TCM数据库选择“herb or herb list”选项, 然后输入“LUO TUO PENG”, 并设定score ≥ 20、P < 0.05进行筛选[13]。
通过SuperPred (http://prediction.charite.de/index.phpsite=home)、Binding DB (http://www.bindingdb.org/bind/searchby_smiles.jsp)、BATMAN-TCM数据库(http://bionet.ncpsb.org/batman-tcm/) 筛选骆驼蓬药效成分的作用靶点。筛选方法: ①在SuperPred数据库输入每一个活性成分的“pubchem-name”或“smiles”然后点击“start”开始预测活性成分的靶点; ②在Binding DB数据库输入活性成分的“smiles”, 然后点击“search”进行检索。
DR相关靶点获取 以“diabetic retinopathy”为关键词在OMIM数据库(http://www.omim.org/)、TTD数据库(http://systemsdock.unit.Oist.jp/iddp/home/index)、pharmGkb数据库(https://www.pharmgkb.org/)、DiGSeE数据库(http://210.107.182.61/geneSearch/)、GAD数据库(http://geneticassociationdb.nih.gov/) 进行检索, 得到DR相关靶点。
靶点名称矫正 在Uniprot (http://www.uniprot.org/) 数据库输入上述筛选获得的靶点, 得到相应的基因名称, 对蛋白名进行校正, 优先选择Swiss-prot收录并且匹配程度高的基因名称。
骆驼蓬治疗DR的潜在作用靶点筛选 为明确骆驼蓬与DR潜在靶点间的相互作用, 利用Venn在线软件(版本2.1.0, http://bioinfogp.cnb.csic.es/tools/venny/) 将骆驼蓬靶点与DR靶点取交集, 通过Venn图展现骆驼蓬靶点与DR靶点间的交集靶点。
蛋白相互作用 (protein-protein interaction, PPI) 网络构建 将骆驼蓬治疗DR的潜在作用靶点上传至String在线平台数据库, 物种设置为“人” (“homo sapiens”), 最低相互作用评分设置为最高等置信度“highest confidence (0.900)”, 其余参数保持默认设置, 构建蛋白质相互作用网络模型, 获得PPI网络。使用度值(degree) 评价靶点的重要程度, 从而预测骆驼蓬治疗DR的潜在靶点。
KEGG通路分析与GO分类富集分析 将骆驼蓬治疗DR的潜在作用靶点导入David数据库(https://david.ncifcrf.gov), 限定研究物种为人类, 选择Gene Ontology (GO) 下的分子功能(molecular function, MF)、生物过程(biological process, BP) 和细胞组成(cellular component, CC) 3个部分进行GO富集分析, 选择Pathway分析下的KEGG pathway, 设定显著性为P < 0.05, 寻找潜在作用靶点显著富集的主要功能注释与体内通路。导出文件, 并利用Excel和Omicshare平台绘制条形图和气泡图。
“药物成分-通路-作用靶点”网络图 将活性成分、通路、靶点上传至Cytoscape 3.7.1软件, 绘制“成分-通路-靶点”可视化网络图。网络中, 节点(node) 表示化学成分、交集基因和通路。若某一靶点为某化合物的潜在作用靶点, 则以边(edge) 相连, 该靶点参与某一通路时, 将靶点与作用通路也以边相连。通过构建网络揭示骆驼蓬治疗DR多成分、多靶点、多通路的特点。
qRT-PCR实验 向每组细胞中加入TRIzol提取总RNA。通过逆转录酶合成cDNA。实时定量PCR反应条件为: 55 ℃、5 min, 95 ℃、10 min; 95 ℃、15 s, 60 ℃、30 s, 循环40次。溶解曲线确定产物的特异性, 使用2-△△Ct方法计算目的基因的相对表达量。引物序列见表 1。
| Table 1 Primers for qRT-PCR. ERK2: Extracellular signal-regulated kinase 2; AKT1: Serine/threonine-protein kinase 1; PIK3CA: Phosphoinositide 3 kinase catalytic alpha polypeptide |
统计学方法 所有数据用均数±标准差(x±s) 表示, 采用SPSS 20.0统计软件进行数据分析, 当数据符合正态分布时, 组间比较采用单因素方差(one-way ANOVA) 分析。若方差齐, 组间差异比较采用LSD法; 若方差不齐, 组间差异比较采用Tamhane法。以P < 0.05表示差异有统计学意义。
结果 1 骆驼蓬对视网膜血管内皮细胞管道形成的影响与正常组相比, 模型组内皮细胞管道形成总长度显著增加; 与模型组相比, 骆驼蓬给药后, 内皮细胞管道形成总长度显著减少。结果见图 1A、B。
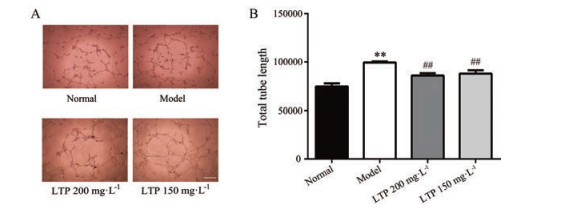
|
Figure 1 the effect of Peganum harmala L. (Luotuopeng, LTP) on the tube formation of the retinal vascular endothelial cells. A: RF/6A was treated with different concentrations of LTP and the tube formation was observed (scale bar: 100 μm); B: Quantitative results of tube formation. n ≥ 3, x±s. **P < 0.01 vs normal group; ##P < 0.01 vs model group |
在TCMID和BATMAN-TCM数据库中得到骆驼蓬的活性成分共21个。然后通过SuperPred、Binding DB、BATMAN-TCM 3个数据库筛选骆驼蓬活性成分的可能靶点, 对筛选结果合并去重后, 得到骆驼蓬17个药效成分的作用靶点共611个(表 2)。另外, 4个活性成分未能在数据库中找到相应靶点。
| Table 2 Active components of Peganum hannal L. |
通过对OMIM数据库、TTD数据库、pharmGkb数据库、DiGSeE数据库、GAD数据库进行检索, 得到DR相关靶点共301个, 包括血管内皮生长因子A (vascular endothelial growth factor A, VEGFA)、细胞外调节蛋白激酶2 (extracellular signal-regulated kinase 2, ERK2)、磷脂酰肌醇3-激酶催化亚基α (phosphoinositide 3 kinase catalytic alpha polypeptide, PIK3CA) 等。
4 骆驼蓬治疗DR的潜在靶点预测及PPI网络构建利用Venn在线软件将骆驼蓬活性成分的611个作用靶点与DR的301个靶点取交集, 得到44个共同靶点(涉及11个活性成分)。将获得的44个药物-疾病共同靶点上传至STRING在线数据库平台得到PPI网络(图 2)。设置置信度大于0.4, 剔除1个游离的靶点, 得到关键靶点蛋白43个, 370条边代表了蛋白之间的相互作用。

|
Figure 2 Protein-protein interaction (PPI) network of the targets of Peganum hannal L. in the treatment of DR |
利用DAVID数据库进行GO和KEGG富集分析, 并通过Excel和Omicshare平台将分析结果转化为条形图和气泡图。
在分子功能分析中(图 3) 富集靶点较多的有蛋白结合(protein binding)、酶结合(enzyme binding)、特定蛋白结合(identical protein binding); 丝氨酸苏氨酸蛋白激酶1 (serine/threonine-protein kinase 1, AKT1)、ERK2、AP-1转录因子(AP-1 transcription factor subunit, JUN) 等基因参与其中。
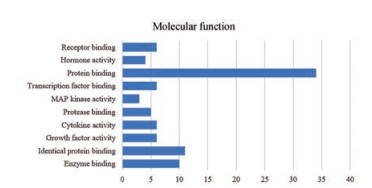
|
Figure 3 The count of genes and molecular function |
在细胞组分分析(图 4) 中富集靶点较多的有细胞外间隙(extracellular space)、细胞外区域(extracellular region)、质膜(plasma membrane)、细胞外的外泌体(extracellular exosome); 肿瘤坏死因子(tumor necrosis factor, TNF)、ERK2、血管紧张素转化酶(angiotensin I-converting enzyme, ACE) 等基因参与其中。
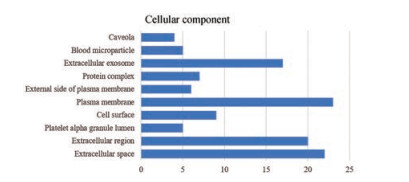
|
Figure 4 The count of genes and cellular component |
在生物功能分析(图 5) 中富集靶点较多的有基因表达的正向调控(positive regulation of gene expression)、炎症反应(inflammatory response)、转录的正向调控(positive regulation of transcription; DNA-templated); 雄激素受体(androgen receptor, AR)、TNF、转化生长因子B1 (transforming growth factor-beta 1, TGFB1)、低氧诱导因子-1A (hypoxia inducible factor-1A, HIF1A) 等基因参与其中。
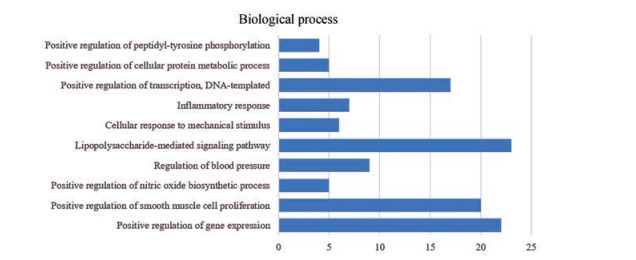
|
Figure 5 The count of genes and biological process |
KEGG通路富集分析共得到90条通路, 其中排名靠前的通路主要涉及2型糖尿病、VEGF信号通路(VEGF signaling pathway)、脂肪细胞的脂质代谢等; 富集靶点较多的通路有MAPK信号通路(MAPK signaling pathway)、TNF信号通路(TNF signaling pathway)、TLR信号通路(Toll-like receptor signaling pathway) 等; AKT1、ERK2、丝裂原活化蛋白激酶8 (mitogen-activated protein kinase 8, MAPK8)、PIK3CA等基因参与其中(图 6)。

|
Figure 6 Enrichment of KEGG pathway |
将骆驼蓬的11个药效成分、交集靶点以及排名靠前的通路导入Cytoscape 3.7.1软件, 构建“成分-通路-靶点”作用关系网络图(图 7), 网络中共有65个节点, 572条相互作用的边。作用于PIK3CA、AKT1、ERK2、MAPK8、TNF、JUN、ACE、AR、TGFB1和HIF1A的有效化学成分较多; 涉及的通路主要包括炎症通路、糖尿病相关通路、MAPK信号通路、TNF信号通路、VEGF信号通路和TLR信号通路等。作用于上述靶点和通路的化学成分有去甲骆驼蓬碱(harmalol)、哈尔酚(harmol) 和去氢骆驼蓬碱(harmine) 等。
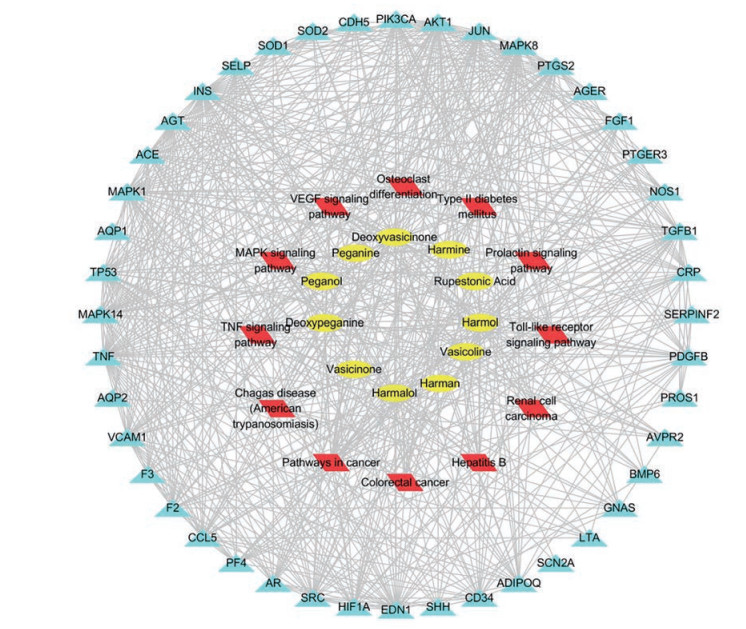
|
Figure 7 components-pathways-targets network of Peganum hannal L. Yellow: Active ingredients; Red: Pathways; Blue: Targets |
与正常组相比, 模型组ERK2、PIK3CA和AKT1的mRNA表达水平均升高; 而与模型组相比, 200 mg·L-1骆驼蓬给药组ERK2、PIK3CA和AKT1的mRNA表达水平均降低(P < 0.05)。结果见图 8A~C。
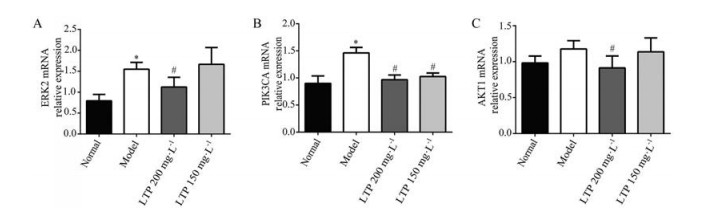
|
Figure 8 mRNA expression of ERK2, PIK3CA, and AKT1 in the retinal vascular endothelial cells was examined by PCR. n ≥ 3, x±s. *P < 0.05 vs normal group; #P < 0.05 vs model group |
DR的特征性病变是视网膜新生血管的形成。血管形成的过程为内皮细胞分裂增生形成突起的幼芽, 随着内皮细胞向前移动及后续细胞的增生而形成一条细胞索, 数小时后便可出现管腔, 形成新生的毛细血管, 进而彼此吻合构成毛细血管网[14]。内皮细胞管道形成实验是衡量血管生成的一种经典的体外实验, 因此本课题采用内皮细胞管道形成实验观察骆驼蓬对DR的影响, 借助网络药理学的方法筛选骆驼蓬治疗DR的靶点与通路, 并通过qRT-PCR方法验证网络药理学结果, 揭示骆驼蓬治疗DR的药效及其分子机制。
管道形成实验结果显示, 与正常组相比, 模型组管道长度显著增加; 而与模型组相比, 骆驼蓬组显著降低管道长度。此结果提示, 高糖促进视网膜血管形成, 而骆驼蓬抑制高糖诱导的血管生成, 提示骆驼蓬具有治疗DR的潜力。
本文采用网络药理学方法预测了骆驼蓬治疗DR的可能作用靶点和通路, 并选取关键靶点进行了分子水平的验证。网络药理学结果提示, 骆驼蓬治疗DR的关键靶点包括PIK3CA、AKT1和ERK2等44个靶点, 涉及VEGF信号通路和MAPK信号通路等。qRT-PCR结果显示, 骆驼蓬显著减少高糖作用下的视网膜血管内皮细胞中ERK2、PIK3CA和AKT1的mRNA表达水平。本研究表明, 骆驼蓬可能通过靶向ERK2、PIK3CA和AKT1发挥治疗DR的药效。
DR会导致体内多条信号通路激活, 包括炎症、血管异常新生及代谢紊乱等。PI3K是一种胞内磷脂酰肌醇激酶, 由PIK3CA编码。PI3K信号通路调控内皮细胞增殖和血管生成的过程, 参与DR的发生发展。研究显示, 当视网膜血管内皮细胞处于高糖或缺氧条件时, PI3K通路会被激活。此外, PI3K通过调节VEGF的表达参与血管新生; 过表达PI3K的鸡胚模型中血管新生显著增加, 且VEGF表达水平显著升高; 而在加入PI3K抑制剂后, 血管新生显著减少, 且VEGF表达显著降低[15]。AKT1是丝氨酸/苏氨酸激酶, 具有调节细胞代谢和调控细胞周期等多种生物学功能, 参与炎症性疾病、糖尿病及癌症等多种疾病的发生发展。文献报道, 高糖条件下人视网膜内皮细胞中AKT1表达显著升高, 且通过触发细胞内相关信号通路影响内皮细胞的血管生成[16]。ERK是一种细胞外信号调节激酶, 分为ERK1和ERK2, 两者具有相似的结构和相近的功能, 常以ERK1/2并称。ERK1/2被激活后进入细胞核促进某些基因的转录和表达, 是多数生长因子和细胞因子调控细胞增殖的重要途径; 糖尿病发生后, 该信号通路通过释放VEGF参与DR的发生发展[17]。如在高糖条件下培养的小鼠周细胞内ERK1/2活性显著增强; ERK1/2信号通路激活诱导内皮细胞增生, 促进新生血管的形成; 抑制ERK1/2的磷酸化则减轻牛视网膜内皮细胞中VEGF诱导的血管新生; 抑制ERK1/2亦可抑制小鼠早产儿视网膜病变(retinopathy of prematurity, ROP) 模型中血管通透性的增加[18-21]。此外, PI3K、AKT1和ERK2在血管生成过程中相互联系。PI3K在VEGF受体下游的信号转导中处于核心地位, 激活后促进AKT1磷酸化, 加速内皮细胞发生迁移、增殖, 形成新生微血管腔, 最终形成稳定的血管[22]。ERK2是MAPK信号通路的重要成员, 激活后通过VEGF信号通路参与DR的发生发展[23]。
本研究发现, 在骆驼蓬的化学成分中, 一种化学成分可以对应多个靶点, 参与多条信号通路; 如去氢骆驼蓬碱对应的靶点有AKT1、ERK2和HIF1A等, 调控MAPK信号通路和VEGF信号通路等。文献报道, 去氢骆驼蓬碱抑制胱硫醚β合酶敲除小鼠及双特异性酪氨酸-(Y)-磷酸化调节激酶[dual-specificity tyrosine-(Y)-phosphorylation regulated kinase 1A, DYRK1A] 转基因小鼠大脑组织中AKT和ERK的磷酸化[24]。盐酸去氢骆驼蓬碱显著抑制肿瘤细胞的增殖、迁移和侵袭, 同时降低肿瘤细胞中HIF1A的表达水平[25]。另外, 多个化学成分也可以对应一个共同靶点, 如去甲骆驼蓬碱、去氢骆驼蓬碱和哈尔酚共同作用于ERK2; 去氢骆驼蓬碱和哈尔酚共同作用于PI3K和AKT1。文献报道, 骆驼蓬β咔啉类生物碱(包括去甲骆驼蓬碱、去氢骆驼蓬碱和哈尔酚) 显著抑制人胃癌SGC-7901细胞的生长和促进SGC-7901细胞凋亡, 并且显著降低胃癌细胞中ERK mRNA和蛋白表达水平[26]。去氢骆驼蓬碱和哈尔酚延缓昆虫Sf9细胞生长, 导致细胞边界模糊, 促进自噬体形成以及自噬体与溶酶体的结合, 并且显著抑制Sf9细胞中PI3K和AKT的蛋白表达[27]。
在骆驼蓬的化学成分中, 去氢骆驼蓬碱最受关注, 它具有治疗糖尿病及其并发症的作用。文献报道, 去氢骆驼蓬碱显著降低db/db小鼠的血糖水平, 提高葡萄糖耐受能力, 改善胰岛素耐受, 并且促进脂肪酸氧化和能量代谢[28]。去氢骆驼蓬碱通过增强脑源性神经营养因子/酪氨酸激酶受体B信号通路减轻STZ诱导的糖尿病大鼠学习和记忆功能障碍, 并且通过抑制NOD样受体家族3炎症小体的激活发挥神经保护作用[29]。此外, 去氢骆驼蓬碱亦是一种潜在的血管新生抑制剂。首先, 体外实验显示去氢骆驼蓬碱能够抑制原代人脐静脉血管内皮细胞的增殖、迁移、管腔结构的形成以及诱导内皮细胞发生凋亡[30]。其次, 大鼠动脉环实验和小鼠角膜微囊袋实验证明去氢骆驼蓬碱抑制新生血管的形成[31]。再次, 肿瘤异位移植实验表明, 去氢骆驼蓬碱抑制肺癌的生长, 其机制可能是抑制肿瘤血管新生和肿瘤细胞的增殖[32]。去氢骆驼蓬碱激活内皮细胞p53信号通路, 诱导细胞凋亡及细胞周期阻滞, 抑制血管新生的发生并最终控制肿瘤的生长[33]。而本文运用网络药理学方法证实, 去氢骆驼蓬碱对DR有关的多条通路、多个靶点均有调控作用。综合文献及本课题的研究结果, 作者推测去氢骆驼蓬碱可能是骆驼蓬发挥治疗DR作用的关键活性成分。
本研究系统揭示了骆驼蓬可能通过靶向PI3K、AKT1和ERK2等发挥治疗DR的作用, 并且去氢骆驼蓬碱是其关键效应成分, 为骆驼蓬治疗DR的临床应用及科学研究提供了扎实的依据。后期课题组将采用动物模型对去氢骆驼蓬碱治疗DR的药效进行深入研究, 为DR的治疗提供新的选择。
作者贡献: 李宏丽负责实验设计及论文初稿撰写; 孙惠惠和宋星卓负责细胞的培养等实验; 刘汉莹、田婧鋆参与实验操作以及文献的整理; 季青璇、王析瑞、蒋坤秀负责文献的调研; 韩静为本文的通讯作者, 负责实验进程的把关、实验设计及稿件修改等工作。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Mendonca HR, Carpi-Santos R, da Costa Calaza K, et al. Neuroinflammation and oxidative stress act in concert to promote neurodegeneration in the diabetic retina and optic nerve: galectin-3 participation[J]. Neural Regen Res, 2020, 15: 625-635. DOI:10.4103/1673-5374.266910 |
| [2] |
Rübsam A, Parikh S, Fort PE. Role of inflammation in diabetic retinopathy[J]. Int J Mol Sci, 2018, 19: 942. DOI:10.3390/ijms19040942 |
| [3] |
Mansour SE, Browning DJ, Wong K, et al. The evolving treatment of diabetic retinopathy[J]. Clin Ophthalmol, 2020, 14: 653-678. DOI:10.2147/OPTH.S236637 |
| [4] |
Moloudizargari M, Mikaili P, Aghajanshakeri S, et al. Pharmacological and therapeutic effects of Peganum harmala and its main alkaloids[J]. Pharmacogn Rev, 2013, 7: 199-212. DOI:10.4103/0973-7847.120524 |
| [5] |
Singh AB, Chaturvedi JP, Narender T, et al. Preliminary studies on the hypoglycemic effect of Peganum harmala L. seeds ethanol extract on normal and streptozotocin induced diabetic rats[J]. Indian J Clin Biochem, 2008, 23: 391-393. DOI:10.1007/s12291-008-0086-3 |
| [6] |
Komeili G, Hashemi M, Bameri-Niafar M. Evaluation of antidiabetic and antihyperlipidemic effects of Peganum harmala seeds in diabetic rats[J]. Cholesterol, 2016, 2016: 7389864. |
| [7] |
Abedi Gaballu F, Abedi Gaballu Y, Moazenzade Khyavy O, et al. Effects of a triplex mixture of Peganum harmala, Rhus coriaria, and Urtica dioica aqueous extracts on metabolic and histological parameters in diabetic rats[J]. Pharm Biol, 2015, 53: 1104-1109. DOI:10.3109/13880209.2014.960943 |
| [8] |
Wang ZL, Song YL, Xing W, et al. Effects and mechanism of Luotuopeng's aqueous extract on the high glucose induced-retinal vascular endothelial cells[J]. J Beijing Univ Tradit Chin Med (北京中医药大学学报), 2018, 41: 738-743. |
| [9] |
Song YL, Wang ZL, Xing W, et al. Pharmacological mechanism of Compound Xueshuantong in treatment of diabetic retinopathy based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2018, 53: 1442-1448. |
| [10] |
Hao DC, Xiao PG. Network pharmacology: a Rosetta Stone for traditional Chinese medicine[J]. Drug Dev Res, 2014, 75: 299-312. DOI:10.1002/ddr.21214 |
| [11] |
Zhang Y, Li X, Xu X, et al. Mechanisms of Paeonia lactiflora in treatment of ulcerative colitis: a network pharmacological study[J]. Med Sci Monit, 2019, 25: 7574-7580. DOI:10.12659/MSM.917695 |
| [12] |
Yu G, Zhang Y, Ren W, et al. Network pharmacology-based identification of key pharmacological pathways of Yin-Huang-Qing-Fei capsule acting on chronic bronchitis[J]. Int J Chron Obstruct Pulmon Dis, 2016, 12: 85-94. DOI:10.2147/COPD.S121079 |
| [13] |
Zhang G, Jiang X, Liu Y, et al. Therapeutic efficiency of an external Chinese herbal formula of mammary precancerous lesions by BATMAN-TCM online bioinformatics analysis tool and experimental validation[J]. Evid Based Complement Alternat Med, 2019, 2019: 2795010. |
| [14] |
Cao L, Song Y, Wu Y, et al. Effects of ginsenoside Rg3 on human retinal capillary endothelial cells cultured in normal and high glucose conditions[J]. Int Eye Sci (国际眼科杂志), 2013, 13: 1965-1969. |
| [15] |
Zhou M, Song X, Huang Y, et al. Wogonin inhibits H2O2-induced angiogenesis via suppressing PI3K/Akt/NF-κB signaling pathway[J]. Vascul Pharmacol, 2014, 60: 110-119. DOI:10.1016/j.vph.2014.01.010 |
| [16] |
Karar J, Maity A. PI3K/AKT/mTOR pathway in angiogenesis[J]. Front Mol Neurosci, 2011, 4: 51. |
| [17] |
Ye X, Xu G, Chang Q, et al. ERK1/2 signaling pathways involved in VEGF release in diabetic rat retina[J]. Invest Ophthalmol Vis Sci, 2010, 51: 5226-5233. DOI:10.1167/iovs.09-4899 |
| [18] |
Hoshi S, Nomoto K, Kuromitsu J, et al. High glucose induced VEGF expression via PKC and ERK in glomerular podocytes[J]. Biochem Biophys Res Commun, 2002, 290: 177-184. DOI:10.1006/bbrc.2001.6138 |
| [19] |
Muñoz-Chápuli R, Quesada AR, Angel Medina M. Angiogenesis and signal transduction in endothelial cells[J]. Cell Mol Life Sci, 2004, 61: 2224-2243. |
| [20] |
Ojima T, Takagi H, Suzuma K, et al. Ephrin A1 inhibits vascular endothelial growth factor-induced intracellular signaling and suppresses retinal neovascularization and blood-retinal barrier breakdown[J]. Am J Pathol, 2006, 168: 331-339. DOI:10.2353/ajpath.2006.050435 |
| [21] |
Bullard LE, Qi X, Penn JS. Role for extracellular signal-responsive kinase-1 and -2 in retinal angiogenesis[J]. Invest Ophthalmol Vis Sci, 2003, 44: 1722-1731. DOI:10.1167/iovs.01-1193 |
| [22] |
Claesson-Welsh L, Welsh M. VEGFA and tumour angiogenesis[J]. J Intern Med, 2013, 273: 114-127. DOI:10.1111/joim.12019 |
| [23] |
Fish JE, Cantu Gutierrez M, Dang LT, et al. Dynamic regulation of VEGF-inducible genes by an ERK/ERG/p300 transcriptional network[J]. Development, 2017, 144: 2428-2444. |
| [24] |
Abekhoukh S, Planque C, Ripoll C, et al. Dyrk1A, a serine/threonine kinase, is involved in ERK and Akt activation in the brain of hyperhomocysteinemic mice[J]. Mol Neurobiol, 2013, 47: 105-116. DOI:10.1007/s12035-012-8326-1 |
| [25] |
Tan B, Li Y, Zhao Q, et al. The impact of harmine hydrochloride on growth, apoptosis and migration, invasion of gastric cancer cells[J]. Pathol Res Pract, 2020, 216: 152995. DOI:10.1016/j.prp.2020.152995 |
| [26] |
Fan Y, Patima A, Chen Y, et al. Cytotoxic effects of β-carboline alkaloids on human gastric cancer SGC-7901 cells[J]. Int J Clin Exp Med, 2015, 8: 12977-12982. |
| [27] |
Cui G, Shu B, Veeran S, et al. Natural β-carboline alkaloids regulate the PI3K/Akt/mTOR pathway and induce autophagy in insect Sf9 cells[J]. Pestic Biochem Physiol, 2019, 154: 67-77. DOI:10.1016/j.pestbp.2018.12.005 |
| [28] |
Waki H, Park KW, Mitro N. The small molecule harmine is an antidiabetic cell-type-specific regulator of PPARγ expression[J]. Cell Metabolism, 2007, 5: 357-370. DOI:10.1016/j.cmet.2007.03.010 |
| [29] |
Liu P, Li H, Wang Y, et al. Harmine ameliorates cognitive impairment by inhibiting NLRP3 inflammasome activation and enhancing the BDNF/TrkB signaling pathway in STZ-induced diabetic rats[J]. Front Pharmacol, 2020, 11: 535. DOI:10.3389/fphar.2020.00535 |
| [30] |
Dai FJ. Study on the Effect and Mechanism of Small Molecules in Angiogenesis Related Diseases (小分子化合物在血管新生相关疾病中的功能与机理研究)[D]. Shanghai: East China Normal University, 2014.
|
| [31] |
Cai HR, Huang X, Zhang XR. Harmine suppresses bladder tumor growth by suppressing vascular endothelial growth factor receptor 2-mediated angiogenesis[J]. Biosci Rep, 2019, 39: BSR20190155. DOI:10.1042/BSR20190155 |
| [32] |
Shen J, Wang B, Zhang T, et al. Suppression of non-small cell lung cancer growth and metastasis by a novel small molecular activator of RECK[J]. Cell Physiol Biochem, 2018, 45: 1807-1817. DOI:10.1159/000487872 |
| [33] |
Dai F, Chen Y, Song Y, et al. A natural small molecule harmine inhibits angiogenesis and suppresses tumour growth through activation of p53 in endothelial cells[J]. PLoS One, 2012, 7: e52162. DOI:10.1371/journal.pone.0052162 |
 2021, Vol. 56
2021, Vol. 56


