肾脏是机体中重要的排泄器官, 亦是易受毒性物质蓄积和攻击的部位, 如药源性急性肾损伤会在数小时至数天之内引起肾功能急剧下降, 且有很高的比例可因肾衰竭造成死亡或进展为慢性肾病[1]。顺铂(cis-diamminedichloroplatinum, CDDP) 是一种广泛应用的一线化疗药物, 对多种实体肿瘤如非小细胞肺癌、乳腺癌、卵巢癌和头颈部恶性肿瘤等均有良好的治疗作用, 但是由于其显著的肾毒性限制了其使用剂量, 影响其临床疗效[2]。由CDDP引起的严重急性或慢性肾损伤比例可达所有使用CDDP化疗患者的40%, 而所有发生急性肾损伤的患者中有19%是由CDDP引起的, 由此可见, CDDP诱导的肾损伤比例之高已成为严重的医疗问题[3]。除了不良反应给化疗过程带来的影响, 肿瘤细胞对化疗药物产生耐药性或敏感性下降也是肿瘤患者化疗过程中面临的严重问题, 如研究表明因卵巢癌死亡的患者中约90%与肿瘤耐药有关[4, 5]。在患者进行多疗程CDDP化疗过程中, 肿瘤细胞对CDDP的药物敏感性下降甚至耐药已成为影响其临床疗效的另一个重要因素[6]。综上, 探究CDDP在临床应用过程中的减毒增效方法已成为CDDP研究的热点方向。
有研究表明, 无论是CDDP诱导的肾损伤, 还是诱导肿瘤细胞对CDDP敏感性下降或耐药, 均与细胞膜上特异性药物转运体的作用密切相关。CDDP借助摄取型转运体将其转运至细胞内发挥其细胞毒作用, 同时外排型的转运体负责将其转运出细胞外, 降低其细胞毒作用, 因此, 在CDDP诱发肾损伤及细胞耐药过程中, 多种转运体起到了重要作用[7]。有机阳离子转运体2 (organic cation transporter 2, OCT2) 主要分布在肾小管上皮细胞中, 在CDDP诱导肾损伤过程中起到了最为重要的作用, 能够介导血液循环中的CDDP摄取进入肾小管细胞中。研究表明, OCT2低表达能够抑制CDDP的肾脏摄取从而减轻CDDP诱导的肾损伤[8]。而肿瘤细胞中的多药耐药相关蛋白2 (multidrug resistance protein 2, MRP2) 是一种外排型转运体, 它负责将肿瘤细胞中的CDDP外排出细胞, 在CDDP诱导的多药耐药过程中起到了重要作用。研究表明, 反复给予CDDP刺激后能够诱导MRP2的过表达, 导致CDDP外排增加降低其细胞毒作用, 是CDDP疗效降低及耐药的重要机制[9]。综上, 以转运体作为减轻CDDP诱导的肾损伤与增强肿瘤细胞对CDDP化疗敏感性的共同靶点具有理论可能性。
联合使用中药在协同增加CDDP抗肿瘤作用以及减轻肾毒性方面具有很大的潜力[10]。黄芪甲苷(astragaloside IV, AS IV) 是我国传统中药黄芪的主要活性成分, 具有多种药理作用, 是目前中药活性成分研究的热点化合物(图 1)[11]。课题组前期发现口服灌胃AS IV 7天(每日75 mg·kg-1) 能够减轻CDDP (15 mg·kg-1, 腹腔注射) 诱导的大鼠急性肾损伤, 是一种潜在的CDDP肾毒性保护药[12]。但是AS IV能否在减毒的基础上亦发挥增效的作用、机制如何, 尚不清楚。因此, 本研究建立Lewis肺癌细胞(LLC) 荷瘤小鼠模型, 同时考察AS IV联合CDDP的减毒增效作用, 并探究相关转运体MRP2和OCT2的表达, 采用高效液相色谱串联质谱(HPLC-MS/MS) 测定肾脏及肿瘤组织中CDDP的含量, 最终明确AS IV对CDDP减毒增效的协同作用机制。
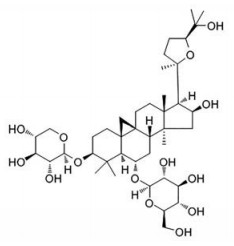
|
Figure 1 The chemical structure of astragaloside IV (AS IV) |
主要试剂 黄芪甲苷(大连美仑生物技术有限公司, 纯度 > 98%); 顺铂注射液(江苏豪森药业股份有限公司, 30 mg/6 mL); DMEM培养基(Gibco公司); 胎牛血清和胰蛋白酶(以色列BI公司); 肌酐(Cr)、尿素氮(BUN) 测定试剂盒(南京建成生物工程研究所); TUNEL细胞凋亡染色试剂盒、GAPDH兔单克隆抗体、辣根过氧化酶标记山羊抗兔IgG (碧云天生物技术有限公司); MRP2兔多克隆抗体、OCT2兔多克隆抗体(美国Abcam公司); 0.42 μm PVDF转移膜(美国GE Healthcare公司)。
仪器 MCO-5AC二氧化碳培养箱(日本松下); KBX41电子显微镜(日本奥林巴斯公司); ELx800酶标仪(美国Bio-TEK); -80 ℃超低温冰箱(海尔公司); 生物安全柜(苏州苏净公司); 低温冷冻离心机(湖南赫西公司); DYY-Ⅲ蛋白电泳仪、DYCZ-40D转膜仪(北京六一生物科技有限公司); 电子分析天平(美国奥豪斯公司); 高效液相串联质谱(HPLC-MS/MS) 由Agilent 1200系列高效液相色谱仪(美国安捷伦公司) 和AB API4000Q型质谱仪(美国AB公司) 组成。
实验动物与细胞 SPF级雄性BALB/c小鼠20只, 体重18~22 g, 购自长春亿斯实验动物技术有限责任公司, 许可证号SCXK (吉)-2018-0007。LLC细胞株购于中国科学院细胞库。
LLC荷瘤小鼠模型的构建 将液氮中冻存的LLC细胞于37 ℃水浴中复苏后, 用含10%胎牛血清的DMEM培养基培养于5% CO2、37 ℃的培养箱中, 当细胞密度达到70%左右时进行传代。将处于对数生长期的LLC细胞用胰蛋白酶消化后采用细胞计数板对LLC细胞进行计数, 最终配制成细胞密度为每毫升2×106个的混悬液接种小鼠。每只小鼠在左侧腋窝皮下接种0.2 mL细胞混悬液, 接种后每两日测量细胞大小, 当细胞体积V (V = a×b2/2, a为长直径, b为短直径) ≥ 50 mm3时即为造模成功。本研究相关动物实验通过吉林大学第一医院动物伦理委员会批准(2018-054)。
动物分组及给药 将造模成功的20只小鼠按照肿瘤体积均匀分为4组, 即对照组(Ctrl)、CDDP组(CDDP)、CDDP联合AS IV组(CDDP + AS IV) 和单独给予AS IV组(AS IV): CDDP注射液经生理盐水稀释后腹腔注射剂量为3 mg·kg-1, 隔天注射一次, Ctrl组和AS IV组腹腔注射同体积生理盐水, 共注射6次; AS IV以0.3%羧甲基纤维素钠(CMC-Na) 混悬后每日灌胃1次, 剂量为100 mg·kg-1, Ctrl组和CDDP组给予相同体积的CMC-Na灌胃, 共灌胃12天。
抗肿瘤药效学分析 隔天测量一次肿瘤体积V, 测量方法同模型建立时, 制作肿瘤体积变化曲线; 12天给药结束后测定小鼠体重, 分离肿瘤组织并称重; 将部分肿瘤组织固定于4%福尔马林溶液中用于制作组织切片, 进行H & E染色及TUNEL染色。
肾损伤分析 12天给药后小鼠摘眼球取血, 静置30 min后3 000 r·min-1分离得到血清, 根据试剂盒说明书中方法测定血清中Cr和BUN水平; 取一侧小鼠肾组织固定于4%福尔马林溶液中, 用于制作组织病理切片, H & E染色分析肾脏组织损伤程度。
免疫组化(IHC)分析 肿瘤及肾脏组织取材后即放入4%福尔马林溶液中固定, 经常规石蜡包埋、切片, 制备得到4 μm切片后进行免疫组化染色。肿瘤组织切片经MRP2 (1∶500) 抗体孵育、肾脏组织经OCT2 (1∶200) 抗体孵育后采用链霉素抗生物素蛋白-过氧化物酶法(SP法) 显色, 所有步骤严格按照试剂盒说明书操作。显色后采用生物显微镜进行阅片并拍摄。
Western blotting蛋白分析 取-80 ℃保存的小鼠肿瘤组织和肾脏组织, 以每40 mg组织中加入400 μL预冷的RIPA裂解液(含1% PMSF) 并匀浆, 4 ℃条件下12 000 r·min-1离心10 min, 取上清液并加入终浓度为20%的SDS-聚丙烯酰胺凝胶电泳上样缓冲液(loading buffer), 煮沸5 min后自然冷却既得样品, -80 ℃保存备用。样品经SDS-聚丙烯酰胺凝胶电泳分离MRP2、OCT2和GAPDH (内参) 蛋白后经转膜、封闭、孵育抗体、曝光显影后, 采用Image J v2.1.4软件对条带进行灰度值分析。MRP2和OCT2灰度值/内参GAPDH灰度值即得相对蛋白表达水平。
HPLC-MS/MS检测肿瘤和肾脏组织中CDDP含量 取-80 ℃保存的肿瘤和肾脏组织, 切取约50 mg的组织以10倍量的生理盐水匀浆, 以4 ℃、12 000 r·min-1条件下离心10 min, 取上清液加入两倍量甲醇去蛋白, 同样条件离心后上清液过0.22 μm滤膜后分析。色谱分析条件: Agilent SB C18色谱柱(150 mm×2.1 mm, 3.5 μm), 流动相为含0.1%甲酸的超纯水(A)-乙腈(B), 流速0.25 mL·min-1, 梯度洗脱程序为0~2 min, 20% B; 2~6 min, 20%~90% B; 6~8 min, 90% B; 8~12 min, 20% B。质谱分析条件: 电离方式为电喷雾电离(ESI), 扫描方式为正离子, 检测方式为多反应监测(MRM), 电离电压5.5 kV, 离子源温度为550 ℃。母离子质量数为301.2, 子离子为284.2*和88.9 (*定量子离子)。考察方法的线性关系、回收率、重复性等均符合生物样品检定标准要求, 方法可靠。
统计学分析 所有实验数值均以(x ± s) 表示, 采用GraphPad Prism 6软件进行数据统计分析和作图, 采用ANOVA法检验组间差异性, 以P < 0.05作为差异具有统计学意义。
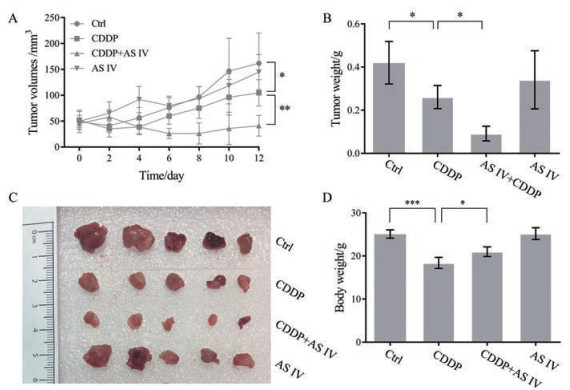
结果 1 AS IV联合CDDP对抗LLC肿瘤作用的影响通过对肿瘤体积生长曲线的绘制及统计分析结果表明, 随着给药次数的增加, CDDP组肿瘤体积逐渐小于Ctrl组, 至给药结束时CDDP组肿瘤体积在给药结束后显著小于Ctrl组(P < 0.05), 表明CDDP能够抑制小鼠LLC肿瘤的生长; 而CDDP + AS IV组肿瘤体积与CDDP组相比体积减小趋势更快速, 至给药结束时CDDP + AS IV组肿瘤体积显著小于CDDP组(P < 0.01), 表明联合AS IV能够增强CDDP抗小鼠LLC肿瘤的作用; AS IV组抗肿瘤作用与Ctrl组类似, 表明单独使用AS IV时无明显抗肿瘤作用(图 2A)。对分离得到的肿瘤组织进行称重(图 2B) 及拍照(图 2C) 结果同样显示, CDDP组肿瘤与Ctrl组相比显著减小(P < 0.05), 但是联用AS IV后与CDDP组相比, 肿瘤抑制程度更加明显(P < 0.05)。而对给药后小鼠体重进行测量发现, Ctrl组与AS IV组体重较大, 可能是由于瘤重增加导致, 而CDDP组体重小于CDDP + AS IV组表明联合AS IV后荷瘤小鼠状态好转, 体重增加(图 2D)。
|
Figure 2 The anti-tumor effects of co-treating with CDDP and AS IV. A: The growth curves of tumor volume; B: Tumor weight; C: Tumor image; D: Body weight. n = 5, ± s. *P < 0.05, **P < 0.01, ***P < 0.001 |
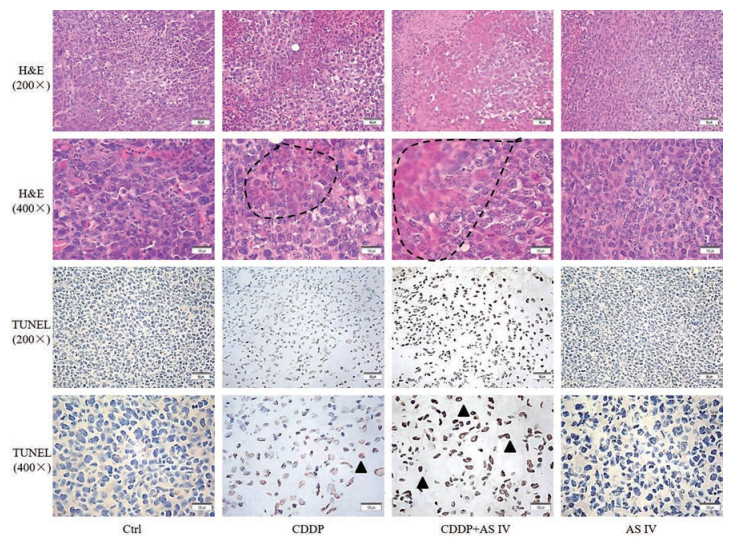
通过对肿瘤组织切片的H & E染色结果进行分析后发现, Ctrl组及AS IV组细胞结构完整, 细胞间边界清晰; CDDP组可造成肿瘤组织细胞的缺血、坏死, 细胞间边界模糊; CDDP + AS IV组可见大量出血、坏死区域, 部分细胞核消失或固缩, 细胞间边界模糊。图 3中H & E染色结果表明, CDDP + AS IV组肿瘤组织坏死面积更大, 与CDDP组相比对肿瘤组织抑制能力更强。TUNEL染色中凋亡细胞成褐色, 图 3中TUNEL染色结果表明CDDP + AS IV组凋亡细胞最多, 表明两者联用能够增强CDDP的抗LLC肿瘤作用。
|
Figure 3 The staining images for tumor tissue of Lewis lung tumor-bearing mice. ---: The area of necrosis cells; ▲: Apoptosis tumor cell. Scale bar = 50 μm (200×) and 100 μm (400×) |
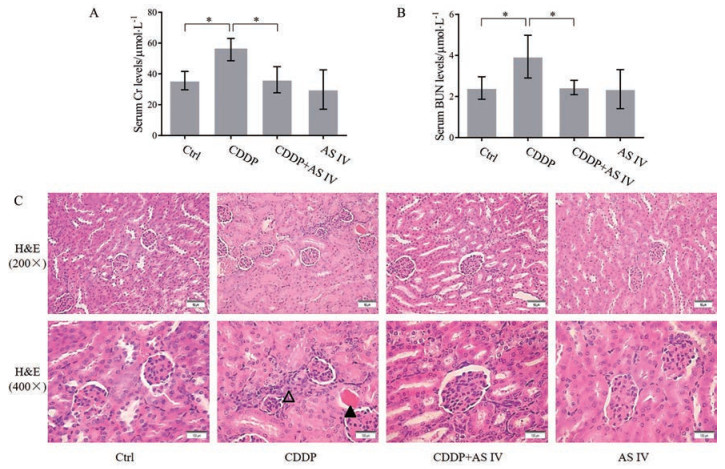
取-80 ℃保存的小鼠血清按照说明书中测定方法对血Cr和BUN的水平进行分析, 结果表明, 与Ctrl组相比, CDDP组的Cr和BUN均显著升高(P < 0.05), 当联合应用AS IV后, 可显著降低CDDP组Cr和BUN水平(P < 0.05), 而与Ctrl组和AS IV组相比差异无统计学意义(图 4A、B)。对肾脏组织H & E染色结果进行分析可见, Ctrl组和AS IV组组织和细胞形态正常, CDDP组可见蛋白管型及炎性浸润, 肾小管上皮细胞界限模糊, 而CDDP + AS IV组则损伤明显趋于正常(图 4C)。
|
Figure 4 Assessment of kidney injury in response to CDDP and AS IV. A: Serum levels of creatinine (Cr); B: Serum levels of blood urea nitrogen (BUN); C: H & E staining images of kidney. n = 5, ± s. *P < 0.05. △: Inflammatory infiltration; ▲: Protein cast. Scale bar = 50 μm (200×) and 100 μm (400×) |
OCT2的组织分布存在特异性, 以肾组织中分布最多, 其在CDDP诱导的肾损伤中起到重要作用。免疫组化染色结果显示, 单独给予CDDP后可诱导OCT2的表达上调, 联合给予AS IV后OCT2的表达上调被抑制(图 5A)。通过Western blotting检测结果同样表明, 与Ctrl组相比, 单独给予CDDP能够引起肾脏组织中OCT2表达的升高(P < 0.001), 然而联合AS IV后OCT2的表达显著降低(P < 0.01), 单独使用AS IV对正常的OCT2表达无影响(图 5B)。因此, 肾脏组织中的OCT2蛋白被抑制可能是AS IV减轻CDDP肾毒性的重要机制之一。
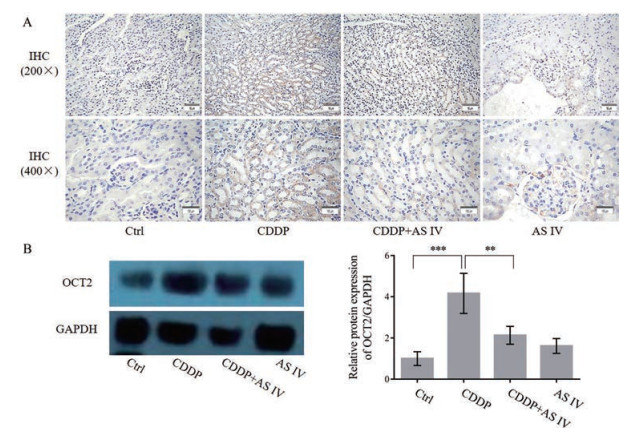
|
Figure 5 Expression levels of organic cation transporter 2 (OCT2) in response to CDDP and AS IV. A: Images of mouse kidney immunohistochemistry sections stained for OCT2 expression; B: Relative expression levels of OCT2 in mouse kidneys, as measured by Western blotting. The relative expression of OCT2 was calculated as the band intensity of OCT2 normalized to GAPDH. n = 3, ± s. **P < 0.01, ***P < 0.001. Scale bar = 50 μm (200×) and 100 μm (400×) |
肿瘤组织中MRP2的过表达能够影响顺铂的抗肿瘤药效, 免疫组化染色结果显示, CDDP组中MRP2蛋白被染成棕色的阳性表达量显著增加, 联用AS IV后阳性表达量减少(图 6A)。通过Western blotting方法进一步考察肿瘤组织MRP2的相对表达情况同样发现, 与Ctrl组相比, 多次给予CDDP能够显著地升高MRP2的表达(P < 0.001), 而联合使用AS IV后肿瘤组织中的MRP2表达显著下降, 与单用CDDP相比差异具有统计学意义(P < 0.001), 单独使用AS IV对正常表达的MRP2无影响(图 6B)。以上结果表明, AS IV可能通过降低CDDP诱导的肿瘤组织中MRP2的过表达从而增强CDDP的抗肿瘤作用。
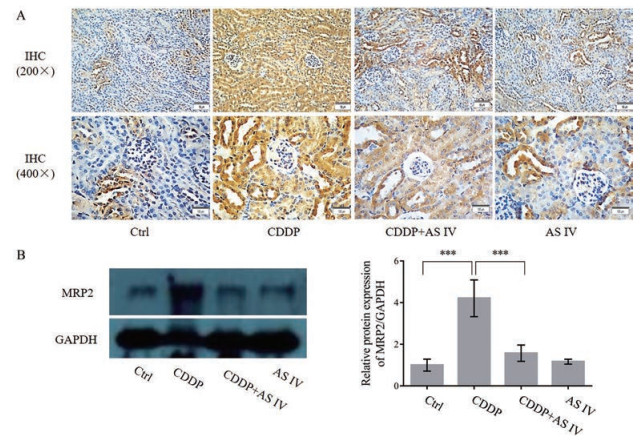
|
Figure 6 Expression levels of multidrug resistance-associated protein 2 (MRP2) in response to CDDP and AS IV. A: Images of mouse tumor immunohistochemistry sections stained for MRP2 expression; B: Relative expression levels of MRP2 in mouse tumors, as measured by Western blotting. The relative expression of MRP2 was calculated as the band intensity of MRP2 normalized to GAPDH. n = 3, ± s. ***P < 0.001. Scale bar = 50 μm (200×) and 100 μm (400×) |
采用HPLC-MS/MS方法测定肿瘤和肾脏组织中CDDP的蓄积量。图 7中结果表明, 肿瘤组织中CDDP + AS IV组的CDDP含量显著高于CDDP组(P < 0.05), 而肾脏组织中CDDP + AS IV组的CDDP含量显著低于CDDP组(P < 0.05)。由调节转运体表达引起CDDP组织蓄积量的不同可能是AS IV最终影响CDDP抗肿瘤作用和肾脏毒性的重要作用机制。
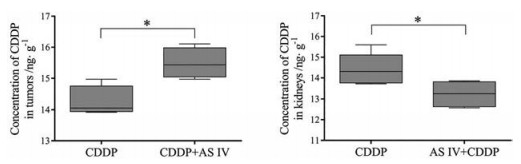
|
Figure 7 The concentrations of CDDP in mouse tumors and kidneys in response to CDDP and AS IV. n = 5, ± s. *P < 0.05 |
肾毒性与化疗敏感性下降是目前CDDP的临床应用中限制其治疗效果的两个重要方面, 采用多种药物开展联合治疗是解决这两个限制因素的重要手段[13]。作者前期研究表明, AS IV能够保护CDDP诱导的急性肾损伤, 因此本研究在此基础之上, 建立了LLC荷瘤小鼠模型, 考察了AS IV联合CDDP给药是否同时具有减毒与增效的作用。结果表明, AS IV能够通过抑制与CDDP跨膜转运相关的重要转运体即肿瘤组织MRP2和肾脏组织OCT2, 调节CDDP在肿瘤组织及肾脏组织中的含量, 最终达到减毒增效的作用。
天然产物中具有众多的活性物质能够对CDDP的肾毒性起到保护作用[14], 在逆转肿瘤细胞对CDDP的耐药性或敏感性下降方面也有广泛作用[10]。我国拥有巨大的中草药资源, 对其进行开发、利用具有很大的价值。黄芪是我国传统中药, 具有多种药理作用, 在医院及民间应用广泛, 主要成分包括皂苷类、黄酮类和多糖类等[15]。已有研究表明, 黄芪总黄酮能够增强CDDP的抗小鼠肺癌肿瘤作用[16], 而本研究中AS IV是黄芪药材中代表性单体成分, 且属于皂苷类, 药材中含量很高, 具有很好的开发潜力。
减毒与增效在化疗药物的应用中往往是矛盾的, 并且其在不同组织产生药效作用的机制繁多, 因此如何平衡CDDP在不同作用部位的细胞毒作用, 即减轻其在肾脏的细胞毒作用同时不影响甚至增强抗肿瘤组织的作用, 是同时达到减毒与增效作用的难点[17]。选择性介导CDDP跨膜转运的转运体能够对CDDP的组织内外分布产生显著影响, 是能够同时介导其减毒与增效效应的共同作用途径之一[18]。OCT2的组织分布具有很大的差异性, 其在肾脏分布最为广泛, 是介导CDDP由血液循环进入肾小管上皮细胞的最重要通道, 抑制或者敲除OCT2的表达能够减轻CDDP诱导的肾毒性, 这可能与阻碍CDDP进入肾脏从而减少其在肾脏蓄积有关[8, 19, 20]。本研究验证了此结论, 与单独使用CDDP组相比, 联用AS IV后能够抑制OCT2的表达, 且肾脏中CDDP的含量也相应降低, 达到减轻CDDP肾损伤的作用。MRP2则在肿瘤组织分布广泛, 对肿瘤细胞CDDP化疗敏感性下降甚至耐药具有更大的影响, 反复给予CDDP可引起MRP2的过表达, 从而引起肿瘤细胞内药物含量的下降, 该变化已被证实是CDDP多药耐药的机制之一[21, 22]。本研究中亦证实了, 多次给予CDDP药物刺激后LLC细胞中MRP2的蛋白表达与Ctrl组相比显著增加, 而联用AS IV后MRP2的过表达被抑制, 同时LLC肿瘤细胞中CDDP的药物含量比单用CDDP显著升高, 达到对CDDP抗肿瘤的增效作用。
综上, OCT2和MRP2是分别与CDDP的肾毒性和耐药相关的重要转运体, 联用CDDP和AS IV后二者的蛋白表达均受到抑制, 从而达到减毒增效的双重作用, 为探究中药活性单体化合物与抗肿瘤药物联用并发挥协同作用提供了一种有益的尝试。
| [1] |
Li J, Xu Z, Jiang L, et al. Rictor/mTORC2 protects against cisplatin-induced tubular cell death and acute kidney injury[J]. Kidney Int, 2014, 86: 86-102. DOI:10.1038/ki.2013.559 |
| [2] |
Qu X, Gao H, Sun J, et al. Identification of key metabolites during cisplatin-induced acute kidney injury using an HPLC-TOF/MS-based non-targeted urine and kidney metabolomics approach in rats[J]. Toxicology, 2020, 431: 153266. |
| [3] |
Rabik CA, Dolan ME. Molecular mechanisms of resistance and toxicity associated with platinating agents[J]. Cancer Treat Rev, 2007, 33: 9-23. DOI:10.1016/j.ctrv.2006.09.006 |
| [4] |
Li N, Zhu Y. Targeting liver cancer stem cells for the treatment of hepatocellular carcinoma[J]. Therap Adv Gastroenterol, 2019, 12: 1756284818821560. |
| [5] |
Rich NE, Yopp AC, Singal AG. Medical management of hepatocellular carcinoma[J]. J Oncol Pract, 2017, 13: 356-364. DOI:10.1200/JOP.2017.022996 |
| [6] |
Cocetta V, Ragazzi E, Montopoli M. Links between cancer metabolism and cisplatin resistance[J]. Int Rev Cell Mol Biol, 2020, 354: 107-164. |
| [7] |
Shimizu T, Fujii T, Sakai H. The relationship between actin cytoskeleton and membrane transporters in cisplatin resistance of cancer cells[J]. Front Cell Dev Biol, 2020, 8: 597835. DOI:10.3389/fcell.2020.597835 |
| [8] |
Hucke A, Rinschen MM, Bauer OB, et al. An integrative approach to cisplatin chronic toxicities in mice reveals importance of organic cation-transporter-dependent protein networks for renoprotection[J]. Arch Toxicol, 2019, 93: 2835-2848. DOI:10.1007/s00204-019-02557-9 |
| [9] |
Sani FV, Palizban A, Mosaffa F, et al. Glucosamine reverses drug resistance in MRP2 overexpressing ovarian cancer cells[J]. Eur J Pharmacol, 2020, 868: 172883. DOI:10.1016/j.ejphar.2019.172883 |
| [10] |
Zhao J, Li YH, Zhang XL, et al. Mechanisms of cisplatin resistance and reverse strategies with traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2020, 55: 2043-2052. |
| [11] |
Liu AM, Mou YL, Xu ZW, et al. Astragaloside Ⅳ ameliorates hypoxia/reoxygenation injury via regulating mitochondrial homeostasis in rat cardiomyocytes[J]. Acta Pharm Sin (药学学报), 2020, 55: 2398-2404. |
| [12] |
Song Y, Hu T, Gao H, et al. Altered metabolic profiles and biomarkers associated with astragaloside Ⅳ-mediated protection against cisplatin-induced acute kidney injury in rats: an HPLC-TOF/MS-based untargeted metabolomics study[J]. Biochem Pharmacol, 2021, 183: 114299. DOI:10.1016/j.bcp.2020.114299 |
| [13] |
Ridzuan NRA, Rashid NA, Othman F, et al. Protective role of natural products in cisplatin-induced nephrotoxicity[J]. Mini Rev Med Chem, 2019, 19: 1134-1143. DOI:10.2174/1389557519666190320124438 |
| [14] |
Ghosh S. Cisplatin: The first metal based anticancer drug[J]. Bioorg Chem, 2019, 88: 102925. |
| [15] |
Zhang R, Cao Q, Li K, et al. Examination of the correlation between grades, chemical characteristics and anti-fatigue effect of Astragali Radix[J]. Acta Pharm Sin (药学学报), 2019, 54: 1092-1100. |
| [16] |
Qi Y, Li X, Qin X, et al. Anti-cancer effect of the flavonoids of astragalus combined with cisplatin on Lewis lung carcinoma-bearing mice[J]. Acta Pharm Sin (药学学报), 2020, 55: 930-940. |
| [17] |
Volarevic V, Djokovic B, Jankovic MG, et al. Molecular mechanisms of cisplatin-induced nephrotoxicity: a balance on the knife edge between renoprotection and tumor toxicity[J]. J Biomed Sci, 2019, 26: 25. |
| [18] |
Martinho N, Santos T, Florindo HF, et al. Cisplatin-membrane interactions and their influence on platinum complexes activity and toxicity[J]. Front Physiol, 2019, 9: 1898. DOI:10.3389/fphys.2018.01898 |
| [19] |
Freitas-Lima LC, Budu A, Arruda AC, et al. PPAR-α deletion attenuates cisplatin nephrotoxicity by modulating renal organic transporters MATE-1 and OCT-2[J]. Int J Mol Sci, 2020, 21: 7416. DOI:10.3390/ijms21197416 |
| [20] |
Huang D, Wang C, Duan Y, et al. Targeting Oct2 and P53:formonoetin prevents cisplatin-induced acute kidney injury[J]. Toxicol Appl Pharmacol, 2017, 326: 15-24. DOI:10.1016/j.taap.2017.04.013 |
| [21] |
Korita PV, Wakai T, Shirai Y, et al. Multidrug resistance-associated protein 2 determines the efficacy of cisplatin in patients with hepatocellular carcinoma[J]. Oncol Rep, 2010, 23: 965-972. |
| [22] |
Zhang W, Zhou H, Yu Y, et al. Combination of gambogic acid with cisplatin enhances the antitumor effects on cisplatin-resistant lung cancer cells by downregulating MRP2 and LRP expression[J]. Onco Targets Ther, 2016, 9: 3359-3368. |
 2021, Vol. 56
2021, Vol. 56


