2. 国家食品药品监督管理总局药品审评中心, 北京 100038;
3. 国家药典委员会, 北京 100061
2. Center for Drug Evaluation, National Medical Products Administration, Beijing 100038, China;
3. Chinese Pharmacopoeia Commission, Beijing 100061, China
叔丁醇(tertiary-butyl alcohol, t-butyl alcohol, tert-butanol, TBA, CAS: 75-65-0), 又称2-甲基-2-丙醇、三甲基甲醇。叔丁醇与正丁醇、异丁醇、仲丁醇一同形成丁醇的四种异构体, 结构式见图 1。

|
Figure 1 Molecular structures of tert-butanol (A), n-butanol (B), iso-butanol (C), and sec-butanol (D) |
叔丁醇分子式为C4H10O, 相对分子质量为74.12, 25 ℃时相对密度为0.81 g·mL-1, 沸点为82.42 ℃, 可与水任意混溶。其结晶点高达24 ℃, 易于在冻干机中完全冻结; 高蒸汽压(35.8 kPa, 0 ℃) 使其能在冻干过程中快速升华[1, 2], 有利于从制剂体系中去除; 其极性小于水, 对弱极性药物的溶解能力远大于水, 并且可以进一步通过提高体系温度增加药物的溶解速度和溶解度。以上三大特点使叔丁醇可以作为一种理想的冻干溶媒, 解决水难溶性药物冻干制剂的制备难题。但是, 国内外药典均未收载叔丁醇, 国内广泛使用的标准仍为2002年修订的石油化工行业标准。目前对于叔丁醇在药物制剂中的残留机制及残留量研究也较少, 未见系统的安全性评价综述。
本文针对叔丁醇在生物医药领域中作为注射用或吸入用冻干制剂的溶媒与助溶剂、冰晶生长引导剂等进行了综述, 也将其在气凝胶、脂质体等特殊制剂方面的应用和制剂中的残留检测方法进行了总结。此外, 对叔丁醇的安全性考量及其最新法规要求进行了综述。
1 叔丁醇在药剂学中的主要功能 1.1 难溶性药物冻干制剂的助溶剂冷冻干燥能够降低药品制备过程中的污染, 提高药品稳定性, 延长生物活性, 增加保存期, 并增强药品复溶后的溶解度与溶解速度。水溶性药品可预先用注射用水溶解, 分装后通过冷冻干燥法除去溶媒得到冻干品; 水难溶性药物无法直接用水制备。另外, 有些药物在水中稳定性差, 在制备过程中即产生大量降解产物, 亦无法用普通冻干工艺制备。常用的有机溶剂或助溶剂, 如乙醇、丙酮和丙二醇等, 因为凝固点高或在常用的冻干条件下不易升华去除。因此, 难以用于难溶性药物的冻干制剂。为解决上述问题, 叔丁醇是一个很好的选择[3]。叔丁醇具有高熔点、高蒸汽压和低毒性等特性, 作为一种可与水互溶的有机溶剂, 可单独使用或与水混合作为共溶剂, 提高难溶性物料溶解度, 增强溶液或冻干品的稳定性, 解决难溶性或热敏性药物的保存问题。
Liu等[4]以叔丁醇-水混合体系增加水难溶性药物硼替佐米的溶解度, 并且探索了叔丁醇在20%~40%体积分数下蔗糖、甘露醇和甘氨酸3种冻干保护剂的最优用量、重要冻干参数和对活性成分含量的影响, 为难溶性药物冻干制剂的设计与优化提供了参考。
叔丁醇也可作为助溶剂用于难溶性药物的吸入用冻干剂制备。Liu[5]选用了叔丁醇与1, 4-二氧六环、乙腈、水共同作为冻干溶媒, 以超速薄膜冻干法制备了固定剂量比的昔萘酸沙美特罗和糠酸莫米松肺吸入粉雾剂, 解决了两种吸入剂分别使用时易引起吸入量不一致的问题。结果表明, 以叔丁醇为助溶剂的超速薄膜冻干法制备的产品为疏松、多孔和易碎结构, 与微粉化药物相比, 比表面积提高了30~40倍, 在大鼠肺部给药模型中表现出了良好的共沉积效果。同时, 昔萘酸沙美特罗和糠酸莫米松两种活性成分均呈无定形状态, 但制剂的辅料中结晶状态有明显区别, 如乳糖和海藻糖呈无定形态, 甘氨酸和甘露醇呈结晶状态。
Yang等[6, 7]采用叔丁醇-水作为共溶剂系统, 以冷冻干燥法制备了莪术油脂质体, 用于减小直接注射莪术油引起的刺激性与溶血性。研究发现, 叔丁醇可以很好地溶解莪术油、磷脂和胆固醇, 并与5%海藻糖水溶液乳化后冻干, 可制备得到大小均匀、粒径为457 nm的球形脂质体。实验发现, 叔丁醇可提高溶媒升华速率, 缩短冻干时间, 但随着叔丁醇的用量增加, 脂质体包封率有明显下降。同时, 发现海藻糖具有抑制叔丁醇-水共溶剂体系形成的特点。
Yao等[8]以叔丁醇为溶剂, 将二硬脂酰基磷脂酰胆碱(distearoyl phosphatidylcholine, DSPC)、胆固醇、脑苷脂和二硬脂酰基磷脂酰乙醇胺(DSPE-PEG2000) 溶解, 并于低温(-35 ℃)、高真空度(0.22 mbar) 下冻干12 h, 得白色脂质冻干粉。进一步加入替诺福韦的N-2-羟乙基哌嗪-N′-2-乙基磺酸缓冲液, 于60 ℃振荡3 min后超声处理5 min, 制备了替诺福韦长循环阳离子脂质体。所制备的脂质体包封率为88%, 粒径为278 nm, zeta电势为+31 mV, 明显增加了细胞摄取能力, 有望成为高效的抗病毒递送系统。
冻干保护剂对冻干制剂的成型性影响较大, 但常用的冻干保护剂为高亲水性物质, 在叔丁醇中溶解度不佳, 从而影响制剂的外观与复溶效果。Xu等[9]对叔丁醇与冻干粉针中的冻干保护剂配伍关系进行了研究。研究发现, 在相同叔丁醇体积分数时, 难溶性活性成分的溶解度随体系温度的升高逐渐增加, 并且, 对甘露醇和甘氨酸的溶解度也具有同样趋势。另外, 随着叔丁醇体积分数由20%增加至40%, 体系对甘露醇的溶解能力增加明显。重要的是, 随体系中叔丁醇体积分数的增加, 冻干品的外观有明显提升。以蔗糖作为支撑剂时, 冻干物外观在20%和30%叔丁醇比例下产品呈塌陷状态, 但叔丁醇比例为40%时则为饱满、平整状态。另外, 在叔丁醇-水二元体系中比较了不同支撑剂外观, 从优至劣依次为甘露醇、蔗糖和甘氨酸。
1.2 多孔结构制剂冻干溶媒多孔结构制剂具有比表面积大、疏松、易于复溶且溶解速度高、溶解度大的特点。叔丁醇密度比水小, 在冷冻过程中易于形成针状结晶, 可以改变冻干产品的微观形态, 更易形成疏松、多孔状的结构。Peng等[10]研究了不同的叔丁醇-水混合体系中的聚酰亚胺气凝胶微观形态, 发现在20%叔丁醇含量时所得气凝胶三维孔洞尺寸最小(5 µm), 此现象与叔丁醇-水可在该比例时形成共晶有关。但是, 当叔丁醇含量高于50%时, 因孔壁现象的发生, 使气凝胶内部出现蜂窝状三维结构。因此, 可通过调节叔丁醇比例调整气凝胶内部微观结构, 从而获得最佳机械性质。
Sun等[11]以叔丁醇为溶媒, 利用高速匀浆技术将聚乳酸已内酯共聚物/丝素蛋白(PLCL/SF, 20∶80, w/w) 纳米纤维分散并冻干制成孔隙率为88%、孔径分布在1~100 µm之间的纳米纤维海绵, 并将该纳米海绵填充于PLCL/SF (75∶25, w/w) 中空纳米纤维神经导管中组成神经导管支架。体外实验表明, 该填充支架具有的大孔结构能够促进schwann细胞生长和黏附, 体内实验也表明填充支架对神经功能的恢复情况明显优于中空神经导管支架。
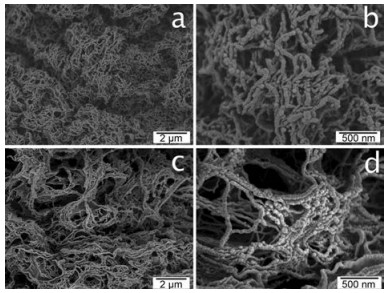
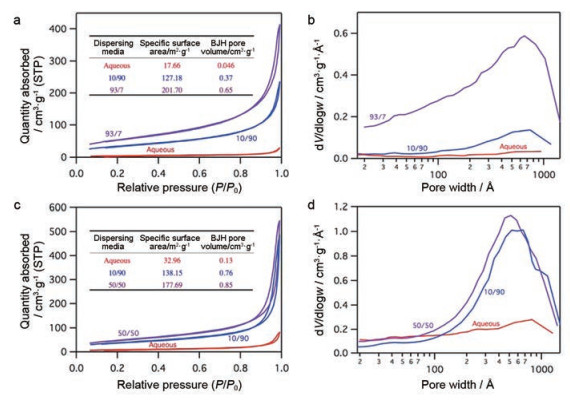
Jiang等[12]以冷冻干燥法制备了稻米秆纤维自组装纳米晶(cellulose nanocrystals, CNC) 和自组装纳米纤维(cellulose nanofibrils, CNF)。研究发现, 以水为溶剂时, 冻干物微观尺度为200~700 nm, 但在体系中增加10%叔丁醇时, CNC和CNF的宽度将显著减小至约40 nm。继续增加叔丁醇的用量为50%和97%时, 制得的CNC和CNF呈多孔结构, 且质地更加均匀(图 2)。对不含叔丁醇或含有不同量时的自组装样品进行氮吸附法孔隙率测定, 结果发现叔丁醇的存在将显著增加孔隙含量(图 3)。
|
Figure 2 Nanofibers assembled from freezing (-196 ℃) and freeze-drying of 0.1% (w/v) cellulose nanocrystals in 93/7 (v/v) tert-butanol/water (a, b) and 0.1% (w/v) cellulose nanofibrils in 50/50 (v/v) tert-butanol/water (c, d). (Adapted from Ref. 12 with permission. Copyright © 2014 American Chemical Society) |
|
Figure 3 N2 adsorption-desorption isotherms (a, c) and pore size distribution (b, d) of cellulose fibrous materials assembled from cellulose nanocrystals (a, b) and cellulose nanofibrils (c, d) in aqueous (red) and tert-butanol/water (blue and purple, with ratios marked in Figures) suspensions. Insets in a and c: specific surface areas and Barrett-Joyner-Halenda pore volume. (Adapted from Ref. 12 with permission. Copyright © 2014 American Chemical Society) |
Chen[13]以明胶和聚乳酸两种材料通过静电纺丝技术制备了纳米纤维, 再以叔丁醇为溶剂高速匀浆并冻干塑形, 交联后得到多孔结构, 具有仿生天然软骨细胞外基质效果的三维支架。压缩力学测试表明, 该三维支架在湿态时压缩弹性高, 80%形变后在外力撤除时可吸水恢复原状。体内外生物学实验证实, 三维支架可促进成纤维细胞的生长和增殖, 细胞形貌良好且已深入到支架内部生长。因此, 以叔丁醇为溶剂并经冻干制成的三维纳米多孔支架, 可应用于软骨组织的修复和再生。
Cheng等[14]对叔丁醇在氧化铝陶瓷生物工程仿生骨支架中的应用进行了研究。结果发现, 相比于传统溶剂, 以叔丁醇为溶剂, 经冻干制备的氧化铝陶瓷支架内部微观结构由原来的片层状转变为片层孔和圆形孔的双孔状结构, 而单独使用叔丁醇为溶剂的体系制造的支架呈圆孔状, 表明溶剂的性质对内部结构具有重要影响, 另外还发现孔径尺寸随预冷冻阶段的温度降低而有减小趋势。细胞实验表明, 双孔状结构骨支架更有利于细胞在其表面生长, 细胞呈清晰结构并铺展良好。
1.3 冰晶生长引导剂叔丁醇具有改变冰晶生长习性的作用, 冷冻过程中形成的针状冰晶可促进水分产生相应移动, 进一步通过冷冻干燥升华去除溶剂时在产物中形成内部孔道结构, 缩短了冷冻干燥时间, 利于产品水化重建。Yu等[15]以叔丁醇作为冰晶生长引导剂, 在定向冷冻装置中冻结乳酸改性的壳聚糖, 并将红霉素包载于其中, 制成了具有内部垂直方向孔道结构的圆柱状海绵体制剂。实验发现, 通过调节叔丁醇-水的比例, 可调整海绵样品的孔径和孔隙率, 从而使活性成分通过符合Couarraze释药模型的基体溶蚀作用和药物后扩散作用的两阶段释放。
Zhang[16]比较了直接冷冻、真空蒸发冷冻和喷雾冷冻3种冷冻方式对碳酸氢钠粉体粒径大小的影响, 结果发现喷雾冷冻方式所得粒径可低至2 µm, 明显小于其他两种方式。并且以5%叔丁醇作为冰晶生长调节剂时可使溶剂的结晶形态发生显著改变, 可有效加快干燥速度。
1.4 冻干保护剂叔丁醇还可作为冻干保护剂, 用于防止制剂在冻干过程中粒子因聚合、团聚或增长等作用而粒径增大。Wu等[17]以金丝桃苷为模型药物, 考察了固体纳米晶体在叔丁醇作为冻干保护剂时的粒径变化情况, 发现叔丁醇对粒子粒径增长的保护作用明显强于多元醇类, 并且用量以20%时最佳。Alqurshi等[18]以叔丁醇为冻干保护剂和溶剂, 将难溶性药物硝苯地平与聚乙烯吡咯烷酮溶解并灌装于明胶胶囊壳中冷冻干燥, 采用原位冻干的方法制备出了无定形物, 实现了活性产物可在6 min内高达80%的超快溶出速度。
2 叔丁醇在药剂学中的主要应用 2.1 在纳米制剂和包合物中的应用脂质体是一种重要的药物靶向递送载体, 有明确降低药物毒副作用的能力, 并表现出长效的作用。对于疏水性药物, 以脂质体为载体还可改善溶解度, 避免制剂中有机溶剂和表面活性剂的使用。但是脂质体产品的产业化是发展的瓶颈之一。近年来, 超临界流体法、二次乳化法及叔丁醇-水共溶剂冻干法制备脂质体技术已更加成熟。叔丁醇-水共溶剂法具有可直接溶解和包载水难溶性药物, 并利用冻干工艺一步去除叔丁醇与水的特点。以叔丁醇-水共溶剂法制备纳米脂质体的方法属纳米制剂制备的bottom-up法[19, 20], 与传统纳米制剂的top-down法具有明显区别, 操作步骤更少、制备效率更高、得率更大, 不需要高压乳匀或超声, 易于大规模制备和工艺放大, 易于无菌生产, 具有明显优于传统的薄膜分散-水化或高压乳匀法的特点。冻干法制备脂质体的成形机制主要是分子、微结构域和独立双分子层在冻干与水化时重构理论[2], 也有人提出叔丁醇-水形成O/W型乳剂在冻干时转变成磷脂单分子层的球形结构和双分子层的半球形结构是脂质体形成的机制[21]。
Li等[22]以多西紫杉醇为模型药物, 将其与磷脂和胆固醇一同溶解于叔丁醇中, 并在搅拌下加入至蔗糖水溶剂中, 在60 ℃环境中形成叔丁醇-水(50∶50, w/w) 二元冻干溶媒体系, 并经无菌过滤后冻干。实验结果显示, 冻干品在简单振摇条件下即可完全水化, 并得到平均粒径为263 nm、多分散系数(polydispersity index, PDI) 为0.13的类球形脂质体混悬液, 包封率高达88%。体外实验表明, 制备的多西紫杉醇脂质体体外可持续释药48 h, 并呈一级动力学特征释放。另外, 发现叔丁醇与水的比例可显著影响脂质体对多西紫杉醇的包封率, 这可能与二元共溶体系中可以容纳并有效分散的磷脂数量不同有关。
Liu等[23]以叔丁醇为溶剂, 采用减压蒸发法去除有机溶剂后制备了盐酸小檗碱长循环脂质体。叔丁醇对大豆磷脂酰胆碱和胆固醇的溶解能力好, 进一步在水相中乳化形成W/O型初乳, 经减压干燥除去叔丁醇后形成胶态, 与外相水进一步乳化后, 通过挤出法可制备得到粒径为110 nm的脂质体。
除了可用于脂质体的制备, 叔丁醇也已经用于制备纳米粒、蛋白亚微粒和包合物。在吸入制剂中, 纳米粒具有避免巨噬细胞吞噬和抵抗黏膜纤毛清除的优点, 可增大药物在肺部的沉积率[24, 25]。Shan等[26]将蛋白多肽类药物胸腺五肽制备成纳米粒, 用以混悬于抛射剂中吸入给药。纳米粒的制备以叔丁醇为溶剂, 溶解表面活性剂磷脂后得到有机相; 以叔丁醇-水二元溶剂溶解活性成分胸腺五肽和冻干保护剂乳糖得到水相, 通过搅拌将水相与有机相混合均匀后冷冻干燥得磷脂包裹的纳米粒。纳米粒外壳的磷脂可进一步以丙醇去除, 获得平均粒径为150 nm的纳米粒, PID值仅0.1, 方法简便, 重现性好。
Chen等[27]以叔丁醇-水二元溶剂体系制备了紫杉醇-白蛋白(1∶9, w/w) 亚微粒。结果发现, 叔丁醇∶水体积比为1∶1.5时制备的产品可良好复溶, 并得到平均粒径为360~540 nm之间的亚微粒, 避免了在处方中使用聚氧乙烯蓖麻油, 减少了过敏反应。
对于水溶性极强的药物可以选择将其包载于疏水性环糊精内, 进而降低活性成分溶解度和释放速度, 制成口服缓释制剂。Liu[28]以高水溶性药物二甲双胍为模型药物, 将其溶解于少量水中, 同时, 将疏水性β环糊精溶解于叔丁醇中, 将水相加入到叔丁醇相中, 混匀, 冷冻干燥, 可得到二甲双胍的β环糊精包合物, 大幅降低了水中溶解度和溶出速度, 体外释放时间长达7 h。
2.2 在气凝胶制备中的应用气凝胶, 又被称作干凝胶, 是一种由介孔或大孔组成的高孔隙率(96%以上)、高比表面积和低密度的固体材料, 广泛应用于吸附、保温隔热、光声学和医药等方面。气凝胶作为药物递送载体时, 可通过其巨大的表面积对活性物质进行吸附, 也可根据不同活性药物的性质对气凝胶表面进行修饰后包载酮洛芬、烟碱和安息香酸等药物[29-31]。
Xu[32]以叔丁醇为溶剂置换剂, 制备了改性二氧化硅气凝胶。该气凝胶比表面积高达669 m2·g-1, 平均孔径11 nm, 疏水角高达150°。Xu等[33]以叔丁醇为水凝胶的溶剂置换剂, 利用冷冻干燥法制备了多孔结构的介孔结构纤维素纳米纤丝气凝胶, 纤维素平均直径为12.86 nm, 平均孔径为28.82 nm。该气凝胶具有强烈的吸附能力, 对化学物质的吸附能力可达196 mg·g-1。Liu等[34]以叔丁醇为溶剂置换剂, 以冷冻干燥法制备了氨基化改性的球形纳米纤维素气凝胶。该气凝胶内部呈纳米纤维素构成的三维网状结构, 孔隙率和平均孔径分别为96.6%和19.4 nm。Li[35]以溶胶-凝胶和叔丁醇溶剂置换法制备了纳米纤维素三维网络, 进一步制备了聚乳酸/纳米纤维素三维网络复合材料, 从而使复合材料的储能模量明显提高, 并且通过异相成核作用, 以网络结构调控泡孔的生长, 提高了机械性能, 制备出了平均孔径4.48 µm、泡孔密度为1.52×1010 cells·cm-3的理想微孔发泡材料。Zhao等[36]从海洋生物绿潮浒苔中提取高结晶度的纤维素, 并利用胶体磨和冷冻干燥技术制备了海藻纤维素气凝胶。在气凝胶制备过程中, 比较了以叔丁醇作为水转换剂与纯水直接冻干制备气凝胶的比表面积差别, 发现叔丁醇冻干物高达277 m2·g-1, 远高于纯水冻干物(16 m2·g-1)。扫描电子显微镜观察发现, 以叔丁醇为冻干溶媒可得疏松多孔状内部微观结构, 而水冻干物则为条索状。相对于无机材料, 大分子多糖类物质作为药物递送载体时的生物相容性有更大优势[29], 但是, 目前报道的多糖类气凝胶多采用水溶液冻干法或超临界流体法制备[31, 37], 产物所具有的较小比表面积限制了其应用效果[30], 若能通过叔丁醇冻干法加以改进将有更广阔的前景。
3 叔丁醇的其他应用Long等[38]以乙醇作为脱水剂、叔丁醇作为冻干溶媒用于纳米纤维素多孔薄膜的制备, 得到了zeta电位为-30 mV、中值孔径为87.73 nm、孔隙率为43%的三维结构纳米多孔薄膜。叔丁醇的使用使体系中更易形成针状结晶, 在升华干燥过程中有效地阻止了毛细管压力, 避免薄膜内部结构坍塌, 保持了良好的三维网状结构, 促进了薄膜的润湿作用。
叔丁醇还可用于脱水剂或溶剂转换剂。生物样品的干燥是扫描电子显微镜观测的关键环节, 样品处理方法影响观察的清晰度与准确度。叔丁醇可在确保彻底干燥的同时, 避免样品因水分蒸发引起表面形貌的变化。Xu等[39]考察了以叔丁醇作为脱水剂转换新鲜植物中的水分, 再用冷冻干燥法升华去除溶剂, 用于电子显微镜法对植物叶片表面蜡质结构进行观察。该研究发现叔丁醇提高了冷冻时形成无定形结构的几率, 减少了重结晶的发生, 大幅减少了冰晶对植物叶片表层蜡质结构的损伤, 明显优于CO2临界点干燥法。此外, 以叔丁醇为有机溶剂对植物中的水分进行置换, 可良好保护月季花瓣的微观结构, 在植物样品电子显微镜制样中应用效果极佳[40]。Xiao等[41]对扫描电子显微镜测定所用生物样品的干燥方法进行了整理, 比较了自然干燥法、烘干干燥法、临界点干燥法、冷冻干燥法和叔丁醇真空干燥法。结果发现, 临界点干燥法和叔丁醇真空干燥法是植物样品处理的首选方法, 可以获得更能保证脱水前真实状态的观测效果, 而动物样品首选临界点干燥法, 微生物样品可选用简单的自然干燥法和烘干干燥法。
糖酯是一种天然非离子表面活性剂, 亲水亲油平衡(hydrophilic-lipophilic balance, HLB) 值介于1~16之间, 可参与肿瘤组织的生成, 可作为血小板活性因子对抗剂发挥阻止动脉硬化作用, 也可作为细胞粘连抑制剂用于治疗或预防炎性疾病和其他病理学病症。Zhou[42]以叔丁醇为溶剂, 利用全细胞脂肪酶为催化剂合成了一种名为蔗糖月桂酸脂的糖脂, 较传统化学合成方法显著降低了反应体系温度并抑制了副产物的产生。同时, 将脂肪酶牢固地通过化学作用固定在细胞表面, 大幅提高了操作稳定性、耐热性和重复利用性。
此外, 叔丁醇可与水混合作为细胞生物疫苗冷冻干燥的溶媒, 所制备的生物制品可不必贮存于传统的低温冷链环境中, 于室温环境下即可保持足够活性并长期存放。Wang等[43]以叔丁醇-水为混合溶媒, 以海藻糖为保护剂, 以非洲锥虫为模型药物, 研究了生物疫苗的玻璃化冷冻干燥工艺。研究发现, 叔丁醇的浓度和冷却速度对冻结温度、结晶潜热和冻干产物微观结构有显著影响, 叔丁醇能与水组成共溶剂并增加药品稳定性, 可改变溶液的结晶形式, 形成的针状结晶能够减小传质阻力而提高冻干效率。
4 质量标准与主要杂质叔丁醇在工业生产中主要采用异丁烯水合法制备, 根据主要成分含量的不同分为叔丁醇-85、叔丁醇-95和叔丁醇-99三种规格, 纯度分别为≥85%、≥95%和≥99%。叔丁醇目前未见药用国家标准, 在国外发达国家药典中也暂未收载。目前国内企业广泛执行的是石油化工行业标准《SH/T1495-2002工业用叔丁醇》、《SH/T1496-1992工业用叔丁醇酸度的测定滴定法》和《SH/T1497-2002工业用叔丁醇含量及杂质的测定气相色谱法》。在叔丁醇-85中, 常存在的杂质有水、3-丁烯-2-醇、仲丁醇、乙二醇乙醚、2, 4, 4-三甲基-1-戊烯和2, 4, 4-三甲基-2-戊烯。以上标准中收录的主要项目有外观、含量、色度、密度、沸程、水分、酸度和蒸发后干残渣量。但是作为药用辅料, 叔丁醇产品的其他关键质量属性, 如羰基化合物、重金属、微生物限度和细菌内毒素等, 需要根据具体制剂品种和给药途径加以额外关注。
5 制剂中残留及检测方法制剂中叔丁醇的残留对产品安全性有潜在风险。因此, 研究去除与降低残留量的生产工艺及参数有重要意义。Wang等[44]以气相色谱法检测了以叔丁醇-水为共溶剂制备的冻干品中叔丁醇残留量, 并探讨了残留量与处方、工艺之间的关系。首先, 叔丁醇的残留量与共溶剂中叔丁醇的用量有关。当叔丁醇-水二元共溶剂体系中叔丁醇用量小于1%时, 叔丁醇残留量高达5.5%, 高残留量可能与叔丁醇无法形成晶核, 玻璃体态的叔丁醇分子在溶质阻碍作用下扩散困难有关。但当叔丁醇比例增加至5%时, 体系中成核率较高的叔丁醇易于被升华去除, 残留量最低(2.6%)。其次, 冻干物的无定形态程度影响叔丁醇残留量: 结晶性辅料β环糊精对叔丁醇的包裹作用较小, 叔丁醇残留少; 无定形物羟丙基β环糊精在预冻过程中包裹了叔丁醇, 导致残留量较高。此外, 羟丙基β环糊精分子中较多的羟基可与叔丁醇间形成更强的分子间氢键, 限制了叔丁醇升华。再次, 叔丁醇的残留量与冻干液灌装量有关, 灌装量较大时比表面积减小, 升华阻力显著增强。然后, 预冻的快慢对残留量也有明显影响。快速预冻的样品可形成细小的冰晶, 孔隙率小, 升华阶段传质阻力较大, 且叔丁醇在结晶之前即已被溶质玻璃体所捕获, 升华困难; 在缓慢降温时, 叔丁醇可形成较大孔隙的结晶, 利于气化后的物质在升华过程中顺利排出。最后, 退火工艺有利于叔丁醇残留量的有效降低。在预冻过程中, 冻结的样品再次升温至玻璃化转变温度之上时, 未能及时结晶的叔丁醇可继续结晶或晶体长大, 有利于升华去除并减少残留量。
叔丁醇在制剂中的残留量检查多用气相色谱法进行, 并以极性毛细管色谱柱分离较为常见[45, 46]。Xu等[9]对叔丁醇在硼替佐米冻干粉针中的残留量进行了研究。该研究采用顶空气相色谱法, 以HP-5型毛细管柱进行分离, 以氢火焰离子化检测器(flame-ionization-detector, FID) 检测, 采用接近叔丁醇沸点的80 ℃对顶空瓶进行加热富集。研究发现叔丁醇的残留量与冻干保护剂的品种有关, 残留量从高到低依次为蔗糖、甘露醇和甘氨酸。另外, 叔丁醇残留量与冻干溶液中叔丁醇体积分数也有一定相关性, 如在甘露醇中残留量随叔丁醇用量增加而增加, 但在蔗糖中随用量增加而减少。Zhang等[47]建立了直接进样的气相色谱法对齐拉西酮冻干粉针中叔丁醇含量进行测定。该方法以强极性PEG-20M毛细管色谱柱对样品进行分离, 以FID检测器进行定量测定, 具有良好的专属性、线性范围、精密度和准确度。
6 安全性研究叔丁醇用途广泛, 人体直接暴露的可能性较高[48], 需关注其安全性[49]。叔丁醇可经吸入或口服后快速吸收, 但不易被皮肤吸收[50]。其属微毒类, 毒性较小, 常认为介于乙醇和丙醇之间, 后效作用比正丁醇和异丁醇强, 对中枢神经系统具有麻醉作用, 对皮肤黏膜有轻度刺激作用[1, 47]。大鼠口服的半数致死量(LD50) 为2 733~3 500 mg·kg-1, 观察到的主要毒性表现为酒精中毒样症状[51]。小鼠静脉给药时LD50为1 538 mg·kg-1 [52]。
目前, 无证据表明叔丁醇具有基因毒性[50]。叔丁醇在污染物致突变性检测(AMES实验) 中未观察到诱变性[48], 在有代谢活化与无代谢活化的体外实验(小鼠淋巴瘤细胞突变实验、染色体畸变和姐妹染色体交换实验) 中也未发现基因毒性。小鼠体内实验表明, 13周内连续口服摄入40 000 mg·kg-1或连续3次每隔24 h腹腔注射625 mg·kg-1叔丁醇后, 均未观察到微核红细胞的增加[48]。
叔丁醇对小鼠和大鼠骨骼或内脏畸形的诱发未建立起关联性, 但在1 000 mg·kg-1·d-1或更高剂量时观察到发育推迟和子宫内或产前死亡现象[50]。在一项历时13周的大鼠亚长期毒性实验中, 口服2 824 mg·kg-1·d-1的高剂量组动物均出现死亡现象, 且雄性较雌性严重, 最敏感效应器官是肾脏[48]。家兔皮肤给药500 µL接触24 h可观察到轻度反应, 眼睛部位给药100 µL接触24 h可观察到重度反应。人体临床试验数据显示叔丁醇无刺激性, 也不引起过敏[51], 中毒剂量约为乙醇的1.5倍[53]。叔丁醇被认为可安全的应用于化妆品产品中[51]。
2021年4月22日发布的人用药品技术要求国际协调理事会(The International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use, ICH) Q3C (R8) 中收录了叔丁醇的每日允许暴露值(permitted daily exposure, PDE)。美国国家毒理部(US National Toxicology Program, NTP) 研究发现, 叔丁醇对雄性大鼠和雌性小鼠有致癌活性, 在雄性大鼠中观察到肾小管腺瘤或癌变事件增加, 在雌性小鼠中可观察到甲状腺滤泡细胞腺癌事件有所增加。但在雌性大鼠中未发现致癌证据, 在雄性小鼠中的证据难以解释。研究发现, 叔丁醇的PDE值与两年的致癌研究相关性最佳, 根据大鼠两年研究得到的最低作用剂量(lowest observed effect level, LOEL) 值为175 mg·kg-1·d-1, 叔丁醇的PDE值可确定为35 mg·d-1。同时, ICH建议将叔丁醇以2类溶剂管理, 列入“需限制的溶剂”[54]。
7 结论在生物医药领域中, 叔丁醇具有难溶性药物冻干制剂的助溶剂、冻干溶媒和冰晶生长引导剂等功能, 并广泛用于纳米药物、包合物和气凝胶等制剂中。但是, 目前叔丁醇产品执行的多为企业标准或石油化工行业标准, 这大大限制了医药行业的应用。因此, 法定药用标准的研究与制订具有紧迫性与实际意义。
作者贡献: 王洪亮、董武军、陈蕾、叶军、王艳宝和刘玉玲共同参与了文章的撰写及修改。
利益冲突: 本文作者声明没有利益冲突。
| [1] |
Teagarden DL, Baker DS. Practical aspects of lyophilization using non-aqueous co-solvent systems[J]. Eur J Pharm Sci, 2002, 15: 115-133. DOI:10.1016/S0928-0987(01)00221-4 |
| [2] |
Li C, Deng Y. A novel method for the preparation of liposomes: freeze drying of monophase solutions[J]. J Pharm Sci, 2004, 93: 1403-1414. DOI:10.1002/jps.20055 |
| [3] |
Van Drooge D, Hinrichs W, Frijlink H. Incorporation of lipophilic drugs in sugar glasses by lyophilization using a mixture of water and tertiary butyl alcohol as solvent[J]. J Pharm Sci, 2004, 93: 713-725. DOI:10.1002/jps.10590 |
| [4] |
Liu JX, Wang Xl, Peng J, et al. Effects of freeze-drying powder protective agents on bortezomib freeze-dried powder[J]. Drugs Clin (现代药物与临床), 2015, 30: 790-794. |
| [5] |
Liu S. Studies on the Fixed Dose Combination Pulmonary Delivery System of Salmeterol Xinafoate and Mometasone Furoate(昔萘酸沙美特罗/糠酸莫米松新型肺部给药系统的研究)[D]. Jinan: Shandong University, 2015.
|
| [6] |
Yang ZW, Yang MH, Cheng QL, et al. Preparation of liposomes loaded with zedoary turmeric oil by freeze-drying[J]. Chin J Pharm (中国医药工业杂志), 2008, 39: 827-830. |
| [7] |
Yang ZW, Yang MH, Xia HG, et al. Preparation of zedoary turmeric oil proliposomes and its quality evaluation[J]. Chin J Pharm (中国药学杂志), 2008, 43: 1488-1491, 1499. |
| [8] |
Yao YB, Chen J, Xu HY. Effect of cationic liposome formulation on human carcinoma hepatic SMMC-7721 cells' uptake of tenofovir and cytotoxicity[J]. J China Pharm (中国药房), 2007, 18: 2655-2658. |
| [9] |
Xu HH, Wang XL, He C, et al. Application of tert-butyl alcohol in preparation of poorly-soluble drug bortezomib[J]. Chin New Drugs J (中国新药杂志), 2016, 25: 578-582. |
| [10] |
Peng LY, Wang YX, Ji JQ, et al. Control of microstructure of polyimide aerogel prepared by freeze-drying[J]. Polym Mater Sci Eng (高分子材料科学与工程), 2018, 34: 115-119. |
| [11] |
Sun BB. Preparation of New Nerve Guidance Conduit for Peripheral Nerve Regeneration (新型神经导管的制备及其在周围神经再生中的应用)[D]. Shanghai: Donghua University, 2017.
|
| [12] |
Jiang F, Hsieh YL. Assembling and redispersibility of rice straw nanocellulose: effect of tert-butanol[J]. ACS Appl Mater Inter, 2014, 6: 20075-20084. DOI:10.1021/am505626a |
| [13] |
Chen WM. Three-Dimensional Porous Scaffolds Based on Gelatin/Polylactic Acid Nanofibers for Articular Cartilage Tissue Regeneration (明胶/聚乳酸纳米纤维三维多孔支架的制备及应用于关节软骨组织再生)[D]. Shanghai: Donghua University, 2017.
|
| [14] |
Cheng Z, Zhao K, Liang SQ, et al. Preparation and biological properties of porous alumina bioceramic scaffold by freezing-casting using the TBA/H2O[J]. J Synt Cryst (人工晶体学报), 2014, 43: 1493-1499. |
| [15] |
Yu F, Xi TF, Zhang ZJ, et al. Preparation of chitosan lactate sponges with uniform vertical pores and fitted analysis of release medicine model in vitro[J]. Chem J Chin Univ (高等学校化学学报), 2012, 33: 843-849. |
| [16] |
Zhang YQ. Study on the Preparation of Ultra-Fine Sodium Bicarbonate by Freeze-Drying (冷冻干燥法制备超细碳酸氢钠工艺研究)[D]. Nanjing: Nanjing University of Science and Technology, 2010.
|
| [17] |
Wu N, Zhang LH, Cheng L, et al. Preparation of hyperoside solid nanocrystal and evaluation of its in vitro release[J]. China Tradit Herb Drugs (中草药), 2015, 46: 1759-1763. |
| [18] |
Alqurshi A, Chan KA, Royall PG. In-situ freeze-drying-forming amorphous solids directly within capsules: an investigation of dissolution enhancement for a poorly soluble drug[J]. Sci Rep, 2017, 7: 1-16. DOI:10.1038/s41598-016-0028-x |
| [19] |
Tan Y, Yang Z, Peng X, et al. A novel bottom-up process to produce nanoparticles containing protein and peptide for suspension in hydrofluoroalkane propellants[J]. Int J Pharm, 2011, 413: 167-173. DOI:10.1016/j.ijpharm.2011.03.069 |
| [20] |
De Waard H, Hinrichs W, Frijlink H. A novel bottom-up process to produce drug nanocrystals: controlled crystallization during freeze-drying[J]. J Control Release, 2008, 128: 179-183. DOI:10.1016/j.jconrel.2008.03.002 |
| [21] |
Wang T, Wang N, Jin X, et al. A novel procedure for preparation of submicron liposomes-lyophilization of oil-in-water emulsions[J]. J Liposome Res, 2009, 19: 231-240. DOI:10.1080/08982100902788390 |
| [22] |
Li F, Wang JZ, Bi YP, et al. Preparation of docetaxel liposomes by freeze-drying of tert-butyl alcohol/water cosolvent system[J]. Chin J Pharm (中国药学杂志), 2016, 51: 293-297. |
| [23] |
Liu LC, Chen GG. Preparation of berberine hydrochloride liposomes and its release in vitro[J]. Pharm Clin Res (药学与临床研究), 2013, 21: 520-525. |
| [24] |
Dong W, Ye J, Zhou J, et al. Comparative study of mucoadhesive and mucus-penetrative nanoparticles based on phospholipid complex to overcome the mucus barrier for inhaled delivery of baicalein[J]. Acta Pharm Sin B, 2020, 10: 1576-1585. DOI:10.1016/j.apsb.2019.10.002 |
| [25] |
Yaghmur A, Mu H. Recent advances in drug delivery applications of cubosomes, hexosomes, and solid lipid nanoparticles[J]. Acta Pharm Sin B, 2021, 11: 871-885. DOI:10.1016/j.apsb.2021.02.013 |
| [26] |
Shan ZJ, Tan YH, Yang ZW, et al. A novel bottom-up process to produce thymopentin nanoparticles and their formulation optimization[J]. Acad J Guangdong Coll Pharm (广东药学院学报), 2012, 28: 355-360. |
| [27] |
Chen C, Yang YN, He J, et al. Preparation of paclitaxel albumin submicron particles by freeze-drying using tert-butanol-water cosolvent systems[J]. Chin J Pharm (中国医药工业杂志), 2011, 42: 104-108. |
| [28] |
Liu ZT. Study on the Controled Release of Water-Soluble Drugs with the Carrier: Polymethacrylates (以丙烯酸树脂材料为载体的水溶性药物控制释放体系的研究)[D]. Guangzhou: Guangdong Pharmaceutical School, 2008.
|
| [29] |
Mehling T, Smirnova I, Guenther U, et al. Polysaccharide-based aerogels as drug carriers[J]. J Non-Cryst Solids, 2009, 355: 2472-2479. DOI:10.1016/j.jnoncrysol.2009.08.038 |
| [30] |
Wang YX, Chen Q, Kuang Y, et al. Progress in application of polysaccharide aerogels[J]. J Wuhan Inst Tech (武汉工程大学学报), 2017, 39: 443-449. |
| [31] |
García-González CA, Jin M, Gerth J, et al. Polysaccharide-based aerogel microspheres for oral drug delivery[J]. Carbohydr Polym, 2015, 117: 797-806. DOI:10.1016/j.carbpol.2014.10.045 |
| [32] |
Xu F. Research on Preparation and Properties of Silica Aerogels and Polyurethane Composite (二氧化硅气凝胶及聚氨酯复合材料的制备与性能研究)[D]. Changchun: Changchun University of Technology, 2019.
|
| [33] |
Xu CX, Jiang S, Han FY, et al. Preparation of cellulose nanofibrils aerogel and its adsorption of methylene blue[J]. J Text Res (纺织学报), 2019, 40: 20-25. |
| [34] |
Liu S, Zhang Y, Zhang TM, et al. Preparation and performance of amine-modified spherical CNF aerogel[J]. J Mater Sci Eng (材料科学与工程学报), 2019, 37: 805-811. |
| [35] |
Li XM. Construction of Nanocrystalline Cellulose Three Dimensional Network in Polylactic Acid and Its Effect on Ibaming Process (纳米纤维素三维网络在聚乳酸中的构建及对其发泡过程的影响)[D]. Hangzhou: Zhejiang University, 2018.
|
| [36] |
Zhao W, Lu Y, Ouyang H, et al. Algal cellulose aerogel: from environmental problem (green tide)to novel high-tech materials[J]. Sci Tech Rev, 2014, 32: 34-39. |
| [37] |
García-González C, Alnaief M, Smirnova I. Polysaccharide-based aerogels-promising biodegradable carriers for drug delivery systems[J]. Carbohydr Polym, 2011, 86: 1425-1438. DOI:10.1016/j.carbpol.2011.06.066 |
| [38] |
Long KY, Wang HS, Ma XH, et al. Preparation of nanocellulose porous membrane by solvent exchange and its characterization[J]. Tran Chin Pulb Paper (中国造纸学报), 2018, 33: 22-26. |
| [39] |
Xu XP, Gu D, Feng M. Comparison of sample preparation methods for scanning electron microscopy (SEM) of leaf epicuticular waxes in Arabidopsis[J]. J Chin Electron Microsc Sci (电子显微学报), 2015, 34: 82-84. |
| [40] |
Xu H, Li ZL, Hao XY, et al. Study on the pretreatment condition of rose petals under the scanning electron microscope[J]. Guangdong Chem Ind (广东化工), 2019, 46: 17-20. |
| [41] |
Xiao Y, Liu W, Wang Y, et al. Drying methods of biological sample preparation for scanning electron microscope[J]. Res Expl Lab (实验室研究与探索), 2013, 32: 45-53. |
| [42] |
Zhou WC. Yeast Display Lipase Catalyzes the Synthesis of Starch Octenyl Succinate and Glycolipid (酵母展示型脂肪酶催化合成辛烯基琥珀酸淀粉酯和糖脂)[D]. Hangzhou: Zhejiang University, 2012.
|
| [43] |
Wang HY, Lun ZR, Lv SS. An optical DSC system and its application in study field of cryopreservation[J]. Cryogenics (低温工程), 2010, 50: 6-10. |
| [44] |
Wang ZX, Deng YJ, Zhang XP, et al. Factors influencing the content of residual tert-butyl alcohol in cyclodextrin complex prepared by lyophilization cosolvent system[J]. Acta Pharm Sin (药学学报), 2007, 42: 314-317. |
| [45] |
Xie YY, Liu YM, Long HY, et al. Determination of residual solvents in methy paraben, ethyl paraben, propyl paraben and buthyl paraben by GC[J]. Drug Stan Chin (中国药品标准), 2020, 21: 249-253. |
| [46] |
Xie YY, Long HY, Liu YM, et al. Residual determination of eight organic solvents in propylparaben by GC[J]. China Pharmacist (中国药师), 2020, 23: 180-182. |
| [47] |
Zhang LQ, Li ZJ. Invenstigation of tert-butyl alcohol residue in ziprasidone freeze-dried powder injection by gas chromatography[J]. China Pharm (中国药业), 2016, 25: 47-48, 49. |
| [48] |
Cirvello JD, Radovsky A, Heath JE, et al. Toxicity and carcinogenicity of t-butyl alcohol in rats and mice following chronic exposure in drinking water[J]. Toxicol Ind Health, 1995, 11: 151-165. DOI:10.1177/074823379501100203 |
| [49] |
Hard GC, Cohen SM, Ma J, et al. Histopathology re-examination of the NTP toxicity/carcinogenicity studies of tert-butyl alcohol to identify renal tumor and toxicity modes of action[J]. Regul Toxicol Pharmacol, 2019, 102: 65-73. DOI:10.1016/j.yrtph.2018.12.011 |
| [50] |
McGregor D. Tertiary-butanol: a toxicological review[J]. Crit Rev toxicol, 2010, 40: 697-727. DOI:10.3109/10408444.2010.494249 |
| [51] |
Chen M. Amended final report of the safety assessment of t-butyl alcohol as used in cosmetics[J]. Int J Toxicol, 2005, 24 suppl 2: 1-20. |
| [52] |
Yang Z, Yu S, Fu D. Preparation of liposomes containing zedoary turmeric oil using freeze-drying of liposomes via TBA/water cosolvent systems and evaluation of the bioavailability of the oil[J]. J Drug Target, 2010, 18: 148-155. DOI:10.3109/10611860903296371 |
| [53] |
World Health Organization. Butanols-Four Isomers: 1-Butanol, 2-Butanol, Tert-Butanol, Isobutanol[M]. World Health Organization, 1987.
|
| [54] |
World Health Organization. Maintenance of the guideline for residual solvents[EB/OL]. World Health Organization, 2021. https://database.ich.org/sites/default/files/ICH_Q3C-R8_Guideline_Step4_2021_0422_1.pdf.
|
 2021, Vol. 56
2021, Vol. 56


