白细胞介素-6 (interleukin 6, IL-6) 由巨噬细胞、T细胞、成纤维细胞等多种不同类型的细胞释放, 其涉及多个生理过程, 包括炎症反应, 诱导靶细胞增殖和分化Th17细胞。IL-6与其受体(IL-6 receptor, IL-6R) 和糖蛋白130 (glycoprotein 130, gp130) 组成的六聚体复合物介导其生物学作用, 激活靶细胞上的细胞内信号传导途径, 其信号传导途径受到严格调控, 如果IL-6信号传导失调, 则会引起慢性炎症、自身免疫性疾病等。IL-6通过JAK激酶(Janus kinases, JAKs) 激活信号转导和转录激活因子3 (signal transducer and activator of transcription 3, STAT3), STAT3在肿瘤细胞增殖、血管生成及肿瘤免疫逃逸等方面发挥着重要的作用, 靶向IL-6/STAT3的小分子抑制剂会成为治疗炎症性疾病和肿瘤的潜在药物。另外, 对SARS-CoV-2的深入研究, IL-6与细胞因子风暴的发生具有密切关系, 可作为新型冠状病毒肺炎(coronavirus disease 2019, COVID-19) 的病情严重程度及预后指标的生物标志物。
1 IL-6/STAT3信号通路IL-6作为四螺旋结构的多效性细胞因子, 最初被命名为B细胞刺激因子-2 (BSF-2), 人BSF-2的cDNA于1986年被成功克隆, 此蛋白序列与干扰素β2、26K因子、杂交瘤/浆细胞瘤生长因子和肝细胞刺激因子相同, 后来被统一称为IL-6, IL-6在自身免疫、慢性炎症、肿瘤等多种疾病具有重要的生物学效应[1]。IL-6/JAK/STAT3通路是IL-6与多种疾病关联的重要通路之一, JAK是一个具有四成员的蛋白酪氨酸激酶家族(包括JAK1、JAK2、JAK3和TYK2), JAK1、JAK2、TYK2共同参与IL-6/STAT3信号通路的协调传导。STATs是一类转录因子, 具有将信号由细胞表面转移至细胞核并激活基因转录的作用, STAT蛋白家族(1、2、3、4、5a、5b、6)具有6个共同结构域, 分别为氨基末端结构域、卷曲螺旋结构域(CCD)、DNA结合域(DBD)、连接结构域(LD)、Src同源结构域(SH2) 及羧基末端反式激活域。STAT3每个结构域都有其特定的生理功能, 氨基末端结构域参与STAT3二聚体核易位以及与DNA结合; 卷曲螺旋结构域介导STAT3与其他蛋白质的相互作用; DNA结合域识别特定的DNA序列, 并形成STAT3-DNA复合物; 连接结构域连接DNA结合域和SH2结构域, 在转录激活中具有重要作用; SH2结构域是STAT3二聚化的关键区域, 该结构存在3个可与STAT3抑制剂结合的位点, 包括: pTyr705识别位点(PY位点); 侧面口袋(PY-X位点); Leu706识别位点(PY+1位点)。STAT3可通过IL-6等多种细胞因子和生长因子和激素与细胞表面受体结合而被激活, 在胚胎发育、细胞增殖、免疫及炎症反应方面具有着重要意义[2-4]。
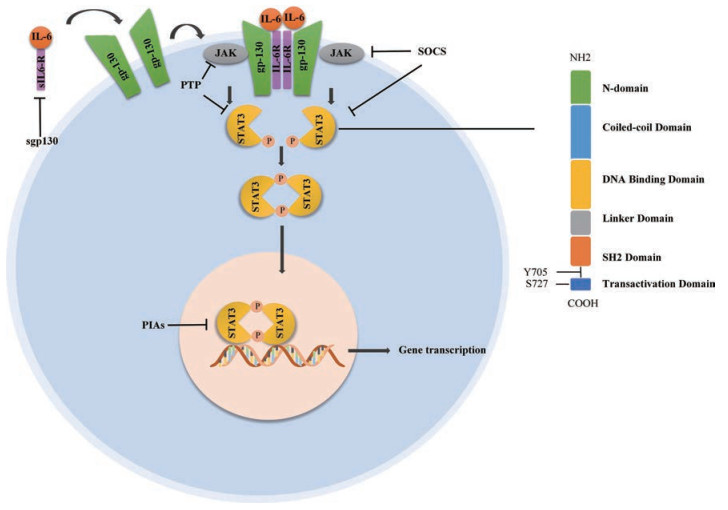
IL-6利用JAK/STAT3通路实现信号转导(图 1), IL-6与细胞膜表面IL-6R (membrane IL-6R, mIL-6R) 结合, 启动了gp130的同源二聚化, 构成六聚体复合物[5, 6], 激活受体相关的JAKs, JAKs磷酸化gp130胞浆区尾部的酪氨酸位点, 之后STAT3的SH2结构域的单个酪氨酸残基(Y705) 被磷酸化, 磷酸化的STAT3通过pTyr705与SH2域相互作用形成同/异二聚体, 易位至细胞核, 与靶基因相应启动子结合引起基因转录[7-9]。在正常生理条件下, 因为存在负性调控途径, IL-6的产生是相对平衡的, STAT3的激活是处于瞬态过程, 涉及负调控的相关因子包括SOCS家族因子、蛋白酪氨酸磷酸酶(PTP)、活性STATs的肽抑制剂(PIAs) 等[10]。不同于此经典信号传导通路, IL-6还可与可溶性受体(soluble gp130, sIL-6R) 结合, 之后同样激活gp130进而引起信号传导, 造成促进炎症的生物效应, 此通路称为反式信号传导通路, 经典信号通路在少数细胞中发挥抗炎作用, mIL-6R主要表达在肝细胞、中性粒细胞、单核细胞和T细胞中, 而gp130在人体中是普遍表达的, 在所有表达gp130的细胞中, IL-6都可以驱动反式信号转导通路。可溶性gp130 (sgp130) 可中和IL-6/sIL-6R复合体以终止此通路, 在此基础上开发了人工融合蛋白sgp130Fc, sgp130Fc由gp130的细胞外区域和人IgG1抗体的Fc部分组成的融合蛋白, 选择性地抑制反式信号通路, 可能成为治疗慢性炎症性疾病(如类风湿性关节炎和克罗恩病) 的候选药物[11]。
|
Figure 1 IL-6/STAT3 signal pathway and STAT3 domains |
慢性炎症反应影响着肿瘤的微环境, 在肿瘤的发生、发展及转移中发挥着关键的作用, 关于炎症和肿瘤之间的记载最早可追溯到19世纪末, Rudolf Virchow基于肿瘤组织中出现白细胞浸润而得出假设: 慢性炎症可以视为恶性肿瘤的起源之一[12]。细胞因子在肿瘤微环境中高表达, 这其中IL-6作为最典型的促瘤细胞因子参与肿瘤细胞的存活与发展、心血管生成及炎症反应, 同时抑制着Th1细胞介导的抗肿瘤免疫[13], IL-6已成为多种肿瘤治疗的检测因子及生存预后的主要指标之一。IL-6在分泌增加后可迅速活化JAK/STAT3信号通路, STAT3的激活在正常细胞中是瞬时且受到严格的调控, 但在多种恶性肿瘤中发现了异常激活状态的STAT3, 肿瘤细胞中过度激活的STAT3也会诱导IL-6的产生, 从而形成正反馈通路。较多文献报道异常激活的STAT3在癌细胞的增殖方面起着重要的作用, 在黑色素瘤中, 激活的STAT3通过上调抗凋亡蛋白的表达(如: Mcl-1和Bcl-XL) 进而正向调节肿瘤细胞的存活[14]。肿瘤细胞的血管网络是渗漏和出血的, 其主要导致因子为VEGF, VEGF可被STAT3诱导上调进而刺激肿瘤细胞的血管生成, 而抑制STAT3的活性可促进肿瘤细胞的凋亡[15, 16]。此外, STAT3还参与了肿瘤的早期发展阶段, 在肿瘤干细胞的维持和分化及正常细胞的恶性转化方面起到了一定的促进作用[17, 18]。
IL-6/STAT3信号通路除了参与肿瘤细胞的生存、增殖、侵袭和迁移, 该通路还可以强烈抑制肿瘤部位的免疫反应, 肿瘤微环境的IL-6通过STAT3抑制树突状细胞(DC) 进而减弱T细胞免疫, 该机制与组织蛋白酶活性的升高有关[19-21], DC在抗原提呈和诱导T细胞免疫上具有较高的效率, 是治疗干预肿瘤的重要靶标。此外, STAT3通过下调IFN-γ/CXCR3/CXCL10反应轴抑制CD8+T细胞在癌细胞的积聚进而帮助肿瘤细胞逃脱免疫系统[22]。鉴于IL-6/STAT3信号通路在肿瘤的增殖、转移、微环境的形成及免疫抑制中有着多重影响机制, 已成为具有潜力的抗肿瘤靶点, 针对肿瘤的特异性免疫激活已成为肿瘤细胞微环境免疫抑制的解决策略, 因此开发高效特异性的IL-6/STAT3信号通路小分子抑制剂已成为抗肿瘤方面值得研究的思路。
2.2 炎症炎症作为机体正常的防御机制, 维持着机体的稳定, 但急性免疫的持续进行会导致慢性免疫, 形成过度的保护性免疫行为, 最终造成机体的损伤, 急性炎症的特征是中性粒细胞的浸润, 24~48 h后转化为巨噬细胞和淋巴细胞等单核细胞的浸润, 最终形成慢性炎症。该过程中IL-6充当了炎症从急性期向慢性期转化的重要调节剂, IL-6通过血管增生、抗凋亡作用及持续促进单核细胞趋化蛋白1 (MCP-1) 分泌进而造成损伤部位的单核细胞的聚集[23, 24]。
类风湿性关节炎(rheumatoid arthritis, RA) 是一种慢性自身免疫性疾病, RA患者血清中的IL-6水平与疾病的活动性程度相关, 其滑液中检测到高浓度的IL-6, IL-6可通过诱导血管内皮生长因子(VEGF) 及分解血管内皮钙粘蛋白造成血管的通透性增加进而加剧炎症, 此外对Th17的诱导可能进一步维持自身免疫症状。IL-6通过诱导成骨细胞表面NF-β受体激活剂配体(RANKL) 的表达, 对破骨细胞的分化起到积极的调节作用, 而破骨细胞是RA患者关节侵蚀的关键因素。托珠单抗是针对IL-6受体的重组人源化单克隆抗体, 是目前被批准首个用于治疗炎症性疾病的IL-6靶向生物制剂, 尤其对全身性炎症的RA患者治疗有效。基于JAKs在IL-6炎性因子信号传导中的作用, JAK抑制剂被欧洲风湿病联盟(EULAR) 纳入RA治疗的药物, Tofacitinib主要抑制JAK1和JAK3, 已被FDA批准作为治疗RA患者的口服制剂。
2.3 COVID-192019年暴发的新型冠状病毒(SARS-CoV-2) 具有高度传染性, 已成为现阶段需紧急攻克的世界难题[25]。新型冠状病毒肺炎(coronavirus disease 2019, COVID-19) 患者初期主要表现为发烧、咳嗽、呼吸困难等, 少数患者在短时间内发生病情的急速恶化, 细胞因子风暴相关的多器官衰竭(multiple organ failure, MOF) 和呼吸窘迫综合征(acute respiratory distress syndrome, ARDS) 成为重症患者致死率高的原因之一[26]。细胞因子风暴又名炎症因子风暴(cytokine storm, CS), 是机体受到创伤或感染后, 引起多种细胞因子分泌调节失控, 免疫正反馈调节系统长期激活的结果, 可造成机体严重损害。此概念由Ferrara[27]于1993年首次使用, CS并非特指的某个疾病, 而是不同疾病触发机体调控网络所引发级联反应的终点, 多见于感染性疾病、自身免疫性疾病等[28]。CS涉及的细胞因子包括干扰素(IFN)、白细胞介素(IL)、趋化因子(chemokines)、集落刺激因子(CSF)、肿瘤坏死因子(TNF) 等, 相关的细胞因子通过调节复杂的反馈系统来维持机体的免疫平衡。在机体中正常的炎症反应是有利的, 可消灭病原体, 恢复机体健康, 然而当免疫调控网络失去控制, 偏激的炎症反应最终造成多数患者因MOF或ARDS而致死[29]。
细胞因子风暴与许多感染性疾病的恶化相关, 包括SARS-CoV、SARS-CoV-2、H1N1、H5N1、H7N9、MERS-CoV及登革热病毒等。SRAS-CoV-2感染机体后, 能够激活CD4+T细胞转变为致病性Th1细胞, 分泌促炎性因子包括粒细胞-巨噬细胞集落刺激因子(GM-CSF) 和IL-6, GM-CSF进一步激活CD14+和CD16+炎性单核细胞分泌大量IL-6和TNF-α等细胞因子[30]。Hirano等[31]提出SARS-CoV-2通过病毒颗粒表面S蛋白与细胞血管紧张素转化酶Ⅱ (ACE2) 受体结合进入细胞, ACE2被占据病毒颗粒导致血清中的血管紧张素-2 (AngⅡ) 增加, 累积的AngⅡ通过去整合素和金属蛋白酶17 (ADAM17) 诱导TNF-α和sIL-6R增加, IL-6/sIL-6R激活STAT3, SRAS-CoV-2自身依靠模式识别受体(pattern recognition receptors, PPRs) 激活NF-κB, NF-κB和STAT3都能激活IL-6放大器(IL-6 amplifier, IL-6 Amp), 诱导多种促炎细胞因子和趋化因子, 造成免疫过度激活, 形成细胞因子风暴。新冠患者体内容易发生免疫系统紊乱, 形成细胞因子风暴, 因此患者的治疗应谨慎用药, 使其体内的免疫系统保持动态平衡。IL-6、TNF-α等细胞因子水平可作为疾病严重程度诊断、预后效果监测的潜在生物标志物, 托珠单抗作为IL-6抑制剂被纳入我国治疗COVID-19的建议中。
3 IL-6/STAT3小分子抑制剂IL-6作为疾病机制涉及的重要因子及预测病情严重程度的生物标志因子, 在CS中发挥着重要的作用, 此外, IL-6/STAT3信号通路影响着肿瘤的生成和恶性转化, 被认为是治疗肿瘤的有效靶点之一。关于阻断这一信号通路, 主要可从两方面进行: ①抑制STAT3激活的上游通路, 可通过阻断IL-6与受体形成复合物或抑制JAKs磷酸化从而使得IL-6受体尾部无法形成对STAT3的募集而完成系列的激活过程; ②抑制STAT3激活下游事件, 可直接作用于STAT3蛋白本身, 防止其磷酸化、二聚化及核易位, 最终造成靶基因无法表达。前期的研究已报道了大量的小分子抑制剂(表 1[32-58]), 因此本文将着重介绍2017年后报道的小分子化合物, 旨在为相关数据库增添新的元素和思路。
| Table 1 Some small molecular inhibitors of IL-6/STAT3 reported before 2017 |
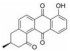
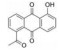
姜黄素(curcumin)为来源于姜黄根茎的天然多酚类化合物, 姜黄素通过抑制JAK2磷酸化进而阻断STAT3激活引起食管鳞状癌细胞(ESCC) 凋亡, 以ESCC细胞系为实验基础模型, 通过细胞免疫印迹、计算机模拟对接等实验技术, 表明姜黄素能够剂量依赖性地抑制JAK2的活性(IC50值为8 μmol·L-1), 抑制STAT3的磷酸化从而阻断信号的传导, 分子对接结果表明姜黄素与JAK2的作用腔很好地结合[33]。姜黄素存在低毒的特性, 但生物利用度低和活性差限制了其临床应用。为了进一步改善姜黄素作为抗肿瘤药物的有效性, 许多姜黄素类似物被开发为STAT3抑制剂, 例如: FLLL31和FLLL32[34]。
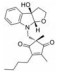
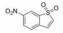
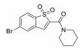
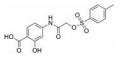
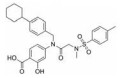
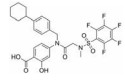
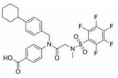
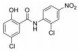
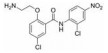
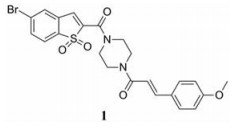
苯并[b]噻吩-1, 1二氧(BTP) 结构作为STAT3有效抑制剂的重要药效团, 含有该部分的抑制剂可显著抑制p-STAT3水平, 如: Stattic[42]、HJC0123[45]和HJC0416[46]等。Zhang等[59]利用此类化合物的特性, 设计合成了系列姜黄素-BTP杂合结构, 其中, 蛋白质印迹法表明, 化合物1可抑制STAT3磷酸化、核易位、与DNA的结合活性及下调靶基因Bcl-2和Cyclin D1的表达, 而对IFN-γ诱导的STAT1磷酸化影响很小, 分子对接表明1与STAT3的SH2结构域紧密结合, 与Arg609、Lys626和Gln635残基形成氢键相互作用。此外, 1对乳腺癌MCF-7和MCF-7/DOX细胞系表现出最佳的抗肿瘤活性和选择性(IC50值分别为0.52和0.40 μmol·L-1), 优于姜黄素(IC50值分别为37.70和32.70 μmol·L-1), 1在0.50 μmol·L-1的剂量下基本抑制了乳腺癌细胞集落形成, 在体内对人乳腺移植瘤(MCF-7) 有明显的抑制作用, 具有较小的毒性。
|
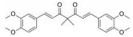
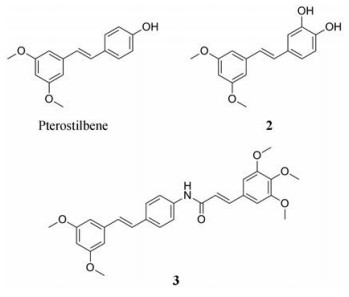
白藜芦醇(resveratrol) 具有抗肿瘤、抗氧化等多种生物活性, 可通过抑制STAT3中Lys685乙酰化和Tyr705磷酸化抑制恶性肿瘤细胞中STAT3信号转导[35, 36], 但药效性差和生物利用度低限制了其作为临床抗癌药物的发展。从紫檀中提取的紫檀芪(pterostilbene) 作为白藜芦醇的二甲醚类似物表现出较优的生物利用度。Wen等[60]研究表明紫檀芪抑制卵巢癌细胞周期进程及诱导细胞凋亡, 剂量依赖性地抑制OVCAR-8和Caov-3细胞的STAT3磷酸化, 抑制STAT3诱导的抗凋亡蛋白和细胞周期蛋白, MTT实验表明紫檀芪与顺铂的联合应用在卵巢癌细胞中有着协同治疗效果。
紫檀芪和化合物2在氧化偶氮甲烷(AOM)/右旋葡聚糖硫酸钠(DSS) 诱导的小鼠结肠炎及结肠肿瘤形成方面显示出一定的治疗作用, 2较紫檀芪在减少结肠肿瘤数量和降低IL-6水平具有更优的效果, AOM/DSS处理后的小鼠经过口服50和250 mg·kg-1的2后, 平均肿瘤数由13.8分别降至5.7和3.2。AOM/DSS处理后的小鼠结肠中SOCS3水平降低, 研究推测2通过上调SOCS3进而负性调节IL-6/STAT3信号途径作为改善结肠炎症的机制[61]。
|
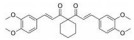
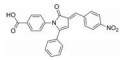
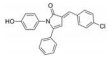
Li等[62]基于白藜芦醇和咖啡酸分别抑制STAT3的乙酰化和磷酸化进而使STAT3功能失活, 设计了系列白藜芦醇-咖啡酸杂合化合物, MTT实验表明化合物3对人结肠癌细胞(HT29) 和人乳腺癌细胞(MDA-MB-231) 的IC50值分别为1.82和2.14 μmol·L-1, 其体外抗肿瘤活性优于白藜芦醇和咖啡酸50倍以上, 蛋白质印迹法表明该化合物可抑制STAT3的Lys685乙酰化和Tyr705磷酸化, 分子对接研究数据表明3通过氢键作用与STAT3的SH2结构域结合紧密, 这是针对STAT3多靶点的合成小分子抑制剂的首次报道。
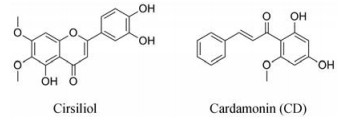
3.3 黄酮类黄酮类化合物与人类的健康息息相关, 具有抗氧化、保护肝脏、抗肿瘤、抗菌及抗炎等活性, 之前的文献已报道了许多具有STAT3抑制活性的黄酮类化合物, 例如: 槲皮素[63]、芹菜素[64]、灯盏乙素[65]等。Lim等[66]选择了线蓟素(cirsiliol) 并评估其对IL-6/JAK2/STAT3信号通路的抑制潜力, 线蓟素通过负性调节JAK2磷酸化抑制STAT3下游激活通路, 但不影响IL-6/IL-6R复合体的生成, 当其浓度为5、10和20 μmol·L-1时, 剂量依赖性地抑制IL-6/STAT3诱导的靶基因转录, 如CRP、IL-1β、ICAM-1。
豆蔻明(cardamonin, CD) 分离于姜科植物草豆蔻, Zhang等[67]的研究表明化合物CD通过对前列腺癌细胞中STAT3信号途径的负性调控达到抗癌效果。免疫印迹实验表明CD处理后的DU145细胞中p-JAK2随时间减少, 分子对接模型表现CD与STAT3的SH2结构域结合, 体内外均能抑制STAT3的二聚化。CD抑制前列腺癌细胞中STAT3的磷酸化、核转位和DNA结合能力, 下调肿瘤增殖、转移和血管生成相关基因的表达, 抑制DU145细胞增殖并诱导其凋亡。
|
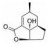
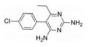
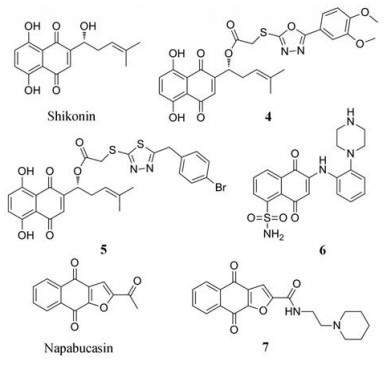
天然化合物紫草素(shikonin) 具有抑制IL-6/STAT3通路的活性[68, 69], 基于紫草素和STAT3蛋白结合的模式, 对紫草素进行结构修饰, 得到了系列化合物, 经过生物活性评估得到有效化合物4。在人乳腺癌MDA-MB-231细胞中, 4的抗增殖活性(IC50值为1.98 μmol·L-1) 优于紫草素(IC50值为2.88 μmol·L-1), 4对STAT3磷酸化、核易位及靶基因表达有一定的负性调节作用[70]。在另一项研究中基于紫草素的支架进行结构修饰, 化合物5对人乳腺癌MDA-MB-231细胞显示出良好的抗增殖活性(IC50值为1.81 μmol·L-1), 剂量和时间依赖性地诱导MDA-MB-231细胞凋亡, 在肿瘤细胞中可抑制STAT3磷酸化、核易位及下游靶基因表达, 而对STAT1和STAT5的激活没有明显的抑制作用, 体内表现出良好的抗肿瘤活性及较低的毒性[71]。
Yu等[72]利用先进的多配体同时对接技术报道了一种新型的口服用STAT3抑制剂化合物6, 直接选择性抑制STAT3的Tyr705位点(Ki值为44 nmol·L-1), 抑制STAT3磷酸化、二聚化及核易位, 对人乳腺癌MDA-MB-231细胞系具有高度选择性(IC50值为0.70 μmol·L-1), 对正常人乳腺上皮细胞的IC50值为128.90 μmol·L-1, 体内抗肿瘤活性优于吉非替尼, 药代动力学测试表明其口服生物利用度为44.7%, 与吉非替尼相当(47.4%), 毒性低于阿霉素, 具有良好的活性和安全性。
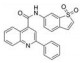
Napabucasin (又称BBI608) 可通过抑制STAT3信号转导及肿瘤干细胞途径起到抗肿瘤的特性。在胰腺癌模型中, 其可阻止肿瘤的复发, 在2016年获FDA批准成为治疗胰腺癌的孤儿药。对napabucasin的乙酰基基团进行结构修饰, 其中化合物7表现出了最优的活性, 在U251、HepG2、HT29和CT26细胞系中均表现出良好的抑制活性(IC50值分别为0.22、0.49、0.07和0.14 μmol·L-1), 在小鼠结直肠癌模型中具有良好的口服抗肿瘤活性, 在50 mg·kg-1对小鼠肿瘤的生长抑制率为63%。7下调细胞中总STAT3和p-STAT3的表达, 表面等离子体共振分析, 7与全长STAT3重组蛋白的KD值为110.2 nmol·L-1, 分子对接测定分析7与STAT3的SH2域结合, 结构中的碱性基团使得该化合物的水溶性较napabucasin高出4.5倍以上[73]。
|
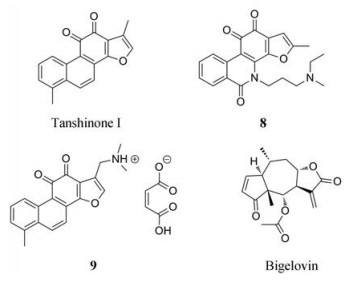
丹参酮类化合物作为从丹参中提取的二萜类成分, 有着心血管作用、抗氧化、抗癌等药理活性, 其中丹参酮Ⅰ (tanshinone Ⅰ) 阻断IL-6诱导的JAK1/2和STAT3的激活, 并下调p-JAK1/2和STAT3的蛋白水平[74]。但丹参酮Ⅰ的水溶性差(< 10-4 mg·mL-1)、活性较低(IC50值为40 μmol·L-1) 使得其无法发挥较好的抗肿瘤效果, Tian等[75]对丹参酮Ⅰ进行结构优化得到两个活性较好的衍生物8和9, 两个化合物的水溶性和药代动力学得到了明显的改善, 在一组癌细胞系的抗增殖实验中, 8和9较丹参酮Ⅰ的活性分别增强了12倍和14倍, 两个衍生物均浓度依赖性地抑制STAT3的Tyr705磷酸化, 并且抑制微血管内皮HMEC-1细胞的迁移和小管形成行为, 因此针对丹参酮Ⅰ的结构优化有着重要的意义。
|
Bigelovin是从旋覆花中发现的倍半萜内酯类化合物, 可剂量依赖性地抑制HepG2细胞中IL-6诱导的STAT3激活(IC50值为3.37 μmol·L-1), 此外, bigelovin可剂量依赖性地抑制HeLa和MDA-MB-468细胞中JAK2的磷酸化, 并在体外抑制JAK2的酶活性(IC50值为44.24 μmol·L-1)。LC-MS结果分析bigelovin通过与JAK2激酶的特定的半胱氨酸结合造成STAT3无法激活[76]。在另一项研究中, Li等[77]报道了bigelovin对结直肠癌的治疗潜力, bigelovin通过抑制IL-6/STAT3通路从而抑制癌细胞的增殖、上皮-间质转化、迁移和定殖, 显著抑制了结肠癌移植瘤小鼠的肿瘤生长和肝/肺转移。
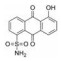
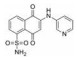
3.6 水杨酸类基于结构的虚拟筛选得到了水杨酸类STAT3抑制剂S3I-201, S3I-201结合STAT3的SH2域, 体外抑制STAT3与DNA结合活性(IC50值为86 μmol·L-1), 选择性抑制STAT3诱导的靶基因转录活性[48], 鉴于S3I-201对STAT3的活性中等, 系列关于S3I-201的结构优化的化合物相继报道, 例如: SF-1-066[49]、BP-1-102[50]和SH-4-54[51]。
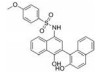
2018年Lopez-Tapia等[78]对BP-1-102的甘氨酸支架结构中亚甲基进行取代, 以期获得活性和药代动力学性质更优的化合物, 得到3个抑制STAT3与DNA结合活性较优的分子: 化合物10~12 (IC50值分别为3.0、1.80和2.40 μmol·L-1), 均较BP-1-102 (IC50值为6.8 μmol·L-1) 抑制STAT3活性更优, 这三个化合物都抑制了人乳腺癌和黑色素瘤细胞中STAT3的磷酸化和激活, 并在体外阻断了肿瘤细胞的存活、生长、克隆形成和迁移。R构型的化合物在STAT3抑制活性、微粒体代谢酶和Caco-2渗透性等表现较优, 其中12对STAT3激活的肿瘤细胞具有高选择性, 优先抑制含有结构型激活的STAT3的MDA-MB-231和MDA-MB-468人乳腺癌细胞的生长。

|
硝呋太尔(nifuratel) 已被临床证明在治疗细菌性阴道炎、念珠菌、阴道毛滴虫等方面是安全有效的, Zheng等[79]报道了nifuratel可作为具有治疗胃癌潜力的新型STAT3抑制剂, 在胃癌细胞中nifuratel剂量依赖性地降低细胞活力及抑制增殖, 并且通过调节凋亡相关蛋白促进胃癌细胞凋亡, 300 μmol·L-1的nifuratel处理后的SGC-7901和BGC-823细胞系分别在6 h和3 h均能观察到p-STAT3的显著下降, 选择性地阻断IL-6诱导的STAT3信号通路而对IFN-γ诱导的STAT1途径没有影响。
Kim等[80]设计了16种新颖的苯并噁唑类化合物作为IL-6抑制剂, 其中化合物13和14在HepG2细胞中有效地抑制IL-6活性(IC50值分别为18.90和5.80 μmol·L-1), 优于IL-6抑制剂madindolin A (IC50值为20.70 μmol·L-1), 两个化合物在20 μg·mL-1时的体外IL-6抑制率分别为97.5%和93.1%, MTT实验表明, 13和14均具有较低的细胞毒性。此外, 13能显著抑制效应因子Th1、Th2和Th17细胞产生的细胞因子, 在慢性炎症和自身免疫性疾病方面具有一定的治疗潜力。
基于计算机虚拟筛选和高通量筛选等技术的联合, Kim[81]等报道了一种具有STAT3抑制活性的化合物ODZ10117, 该化合物只选择性地靶向STAT3的SH2域而不影响其他STAT蛋白及STAT3的上游激活通路, 进而阻断STAT3与DNA的结合、核易位及靶基因转录, 在乳腺癌中的抑制STAT3磷酸化活性优于其他已知STAT3抑制剂(例如: S3I-201[48]、STA-21[38]和nifuroxazide[82]), 对过表达STAT3的MDA-MB-231细胞的IC50值为7.50 μmol·L-1, 诱导肿瘤细胞凋亡, 抑制乳腺癌细胞的侵袭迁移能力。另一项实验中表明了ODZ10117具有治疗胶质母细胞瘤的潜力, ODZ10117可有效降低细胞STAT3的磷酸化和核易位, 减少肿瘤细胞的迁移和侵袭及诱导肿瘤细胞凋亡, 并且通过抑制胶质母细胞瘤干细胞中的STAT3降低干细胞特性, 在胶质母细胞瘤细胞的小鼠异种移植模型中表现出显著的治疗效果及延长了小鼠的存活率[83]。
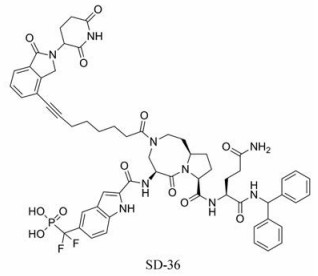
3.8 PROTAC类靶向蛋白降解嵌合体(PROTAC)技术作为新型开发药物的方法, 于20世纪开始应用于目标蛋白的选择性降解, PROTAC作为双功能分子, 一端结合靶蛋白, 另一端的E3连接酶配体靠近靶标并对其泛素化, 从而降解目标蛋白[84]。在之前的研究中已证实STAT3可通过泛素—蛋白酶体系进行降解[85], Bai等[86]报道了一项基于STAT3蛋白降解的PROTAC技术, 基于对STAT3的SH2域抑制剂CJ-887的结构修饰, 得到小分子SI-109, 其显示出有效抑制STAT3转录的活性(IC50值为3.0 μmol·L-1), 采用靶向蛋白降解的方法, 利用连接基将SI-109和E3连接酶Cereblon结合成为新的化合物SD-36用于靶向降解STAT3蛋白, SD-36特异性地降解细胞和肿瘤组织中的STAT3蛋白, 在抑制STAT3依赖的基因转录方面比抑制剂SI-109的活性高1 000倍以上, 在具有免疫能力的CD-1雌性小鼠具有良好的耐受剂量, 并在异种移植模型中诱导体内持久的肿瘤消退。PROTAC技术所带来的成药性、高选择性使得靶向降解STAT3蛋白成为未来有潜力的发展方向。
4 小结IL-6/STAT3信号通路通过多种机制在多种复杂疾病中存在重要作用, 阻断IL-6对于慢性炎症和自身免疫性疾病的治疗有着显著的疗效, 并且可作为新冠肺炎危重症患者的临床指标预警因子。此外, 临床研究表明, 许多恶性肿瘤的发生和发展与STAT3蛋白的过度激活状态有关, 并且与癌症的免疫治疗息息相关, 因此靶向此通路的小分子抑制剂的研发越来越引起人们的关注。PROTAC等新技术与此信号途径的结合, 提供了更多有效的小分子抑制剂, 并且改善肿瘤细胞的耐药性, 为肿瘤的治疗提供更多的可能性, 但PROTAC技术开发新型小分子存在一定的限制, 分子量大导致其具有较差的膜穿透性、药代动力学性质及口服生物利用度。抑制IL-6/STAT3上游和下游靶点成为小分子抑制剂的研制思路, 科研人员已开发了大量的IL-6/STAT3小分子抑制剂, 目前几种IL-6/STAT3小分子抑制剂已进入临床研究阶段(表 2)。
|
| Table 2 Small molecular inhibitors of IL-6/STAT3 in clinical phase |
一些IL-6单克隆抗体在临床上正在使用, 但是它们的高成本, 仅能肠胃外给药和免疫原性的可能性限制了它们的使用, 因此有必要开发低抗原性并且成本降低的新型IL-6小分子抑制剂。到目前为止, 尚无成功上市的STAT3抑制剂, SH2结构域一直是STAT3抑制药物开发的重要策略, 已有研究表明STAT3与DNA的结合可以独立于其磷酸化状态而发生, 该结果表明SH2域抑制剂可能无法完全抑制STAT3活性[87, 88], 另外STAT3二聚化属于蛋白-蛋白相互作用, 相互作用处于面积较大且平坦的表面, 导致小分子可能无法很好地结合。因此未来可以设计STAT3不同的靶标区域抑制剂(如靶向DNA结合域的抑制剂) 并进一步了解IL-6/STAT3与其他信号通路之间的相互作用, 以期发现更多的临床应用[89]。
作者贡献: 赵丽萍负责文章的撰写及文献资料的收集; 宋丹青对文章的选题和思路提出建设性意见, 进行指导和帮助; 汪燕翔为该文章的主要负责人, 负责文章的选题和思路, 对本文进行了细致的修改。
利益冲突: 所有作者均声明无利益冲突。
| [1] |
Tanaka T, Narazaki M, Kishimoto T. IL-6 in inflammation, immunity, and disease[J]. Cold Spring Harb Perspect Biol, 2014, 6: a016295. DOI:10.1101/cshperspect.a016295 |
| [2] |
Schindler C, Levy DE, Decker T. JAK-STAT signaling: from interferons to cytokines[J]. J Biol Chem, 2007, 282: 20059-20063. DOI:10.1074/jbc.R700016200 |
| [3] |
Takeda K, Noguchi K, Shi W, et al. Targeted disruption of the mouse Stat3 gene leads to early embryonic lethality[J]. Proc Natl Acad Sci U S A, 1997, 94: 3801-3804. DOI:10.1073/pnas.94.8.3801 |
| [4] |
Bromberg JF. Activation of STAT proteins and growth control[J]. Bioessays, 2001, 23: 161-169. DOI:10.1002/1521-1878(200102)23:2<161::AID-BIES1023>3.0.CO;2-0 |
| [5] |
Murakami M, Hibi M, Nakagawa N, et al. IL-6-induced homodimerization of gp130 and associated activation of a tyrosine kinase[J]. Science, 1993, 260: 1808-1810. DOI:10.1126/science.8511589 |
| [6] |
Boulanger MJ, Chow DC, Brevnova EE, et al. Hexameric structure and assembly of the interleukin-6/IL-6 alpha-receptor/gp130 complex[J]. Science, 2003, 300: 2101-2104. DOI:10.1126/science.1083901 |
| [7] |
Pellegrini S, Dusanter-Fourt I. The structure, regulation and function of the Janus kinases (JAKs) and the signal transducers and activators of transcription (STATs)[J]. Eur J Biochem, 1997, 248: 615-633. DOI:10.1111/j.1432-1033.1997.00615.x |
| [8] |
Darnell Jr JE. STATs and gene regulation[J]. Science, 1997, 277: 1630-1635. DOI:10.1126/science.277.5332.1630 |
| [9] |
Becker S, Groner B, Müller CW. Three-dimensional structure of the Stat3β homodimer bound to DNA[J]. Nature, 1998, 394: 145-151. DOI:10.1038/28101 |
| [10] |
Clevenger CV. Roles and regulation of stat family transcription factors in human breast cancer[J]. Am J Pathol, 2004, 165: 1449-1460. DOI:10.1016/S0002-9440(10)63403-7 |
| [11] |
Tenhumberg S, Waetzig GH, Chalaris A, et al. Structure-guided optimization of the interleukin-6 trans-signaling antagonist sgp130[J]. J Biol Chem, 2008, 283: 27200-27207. DOI:10.1074/jbc.M803694200 |
| [12] |
Virchow R. An address on the value of pathological experiments[J]. Br Med J, 1881, 2: 198-203. DOI:10.1136/bmj.2.1075.198 |
| [13] |
Tsukamoto H, Fujieda K, Senju S, et al. Immune-suppressive effects of interleukin-6 on T-cell-mediated anti-tumor immunity[J]. Cancer Sci, 2018, 109: 523-530. DOI:10.1111/cas.13433 |
| [14] |
Epling-Burnette PK, Liu JH, Catlett-Falcone R, et al. Inhibition of STAT3 signaling leads to apoptosis of leukemic large granular lymphocytes and decreased Mcl-1 expression[J]. J Clin Invest, 2001, 107: 351-362. DOI:10.1172/JCI9940 |
| [15] |
Bergers G, Benjamin LE. Tumorigenesis and the angiogenic switch[J]. Nat Rev Cancer, 2003, 3: 401-410. DOI:10.1038/nrc1093 |
| [16] |
Niu G, Wright KL, Huang M, et al. Constitutive Stat3 activity up-regulates VEGF expression and tumor angiogenesis[J]. Oncogene, 2002, 21: 2000-2008. DOI:10.1038/sj.onc.1205260 |
| [17] |
Marotta LL, Almendro V, Marusyk A, et al. The JAK2/STAT3 signaling pathway is required for growth of CD44⁺CD24⁻ stem cell-like breast cancer cells in human tumors[J]. J Clin Invest, 2011, 121: 2723-2735. DOI:10.1172/JCI44745 |
| [18] |
Demaria M, Misale S, Giorgi C, et al. STAT3 can serve as a hit in the process of malignant transformation of primary cells[J]. Cell Death Differ, 2012, 19: 1390-1397. DOI:10.1038/cdd.2012.20 |
| [19] |
Park SJ, Nakagawa T, Kitamura H, et al. IL-6 regulates in vivo dendritic cell differentiation through STAT3 activation[J]. J Immunol, 2004, 173: 3844-3854. DOI:10.4049/jimmunol.173.6.3844 |
| [20] |
Palucka K, Banchereau J. Cancer immunotherapy via dendritic cells[J]. Nat Rev Cancer, 2012, 12: 265-277. DOI:10.1038/nrc3258 |
| [21] |
Kitamura H, Kamon H, Sawa S, et al. IL-6-STAT3 controls intracellular MHC class Ⅱ alphabeta dimer level through cathepsin S activity in dendritic cells[J]. Immunity, 2005, 23: 491-502. DOI:10.1016/j.immuni.2005.09.010 |
| [22] |
Yue C, Shen S, Deng J, et al. STAT3 in CD8+ T cells inhibits their tumor accumulation by downregulating CXCR3/CXCL10 axis[J]. Cancer Immunol Res, 2015, 3: 864-870. DOI:10.1158/2326-6066.CIR-15-0014 |
| [23] |
Kaplanski G, Marin V, Montero-Julian F, et al. IL-6:a regulator of the transition from neutrophil to monocyte recruitment during inflammation[J]. Trends Immunol, 2003, 24: 25-29. DOI:10.1016/S1471-4906(02)00013-3 |
| [24] |
Scheller J, Chalaris A, Schmidt-Arras D, et al. The pro- and anti-inflammatory properties of the cytokine interleukin-6[J]. Biochim Biophys Acta, 2011, 1813: 878-888. DOI:10.1016/j.bbamcr.2011.01.034 |
| [25] |
Wiersinga WJ, Rhodes A, Cheng AC, et al. Pathophysiology, transmission, diagnosis, and treatment of coronavirus disease 2019(COVID-19): a review[J]. JAMA, 2020, 324: 782-793. DOI:10.1001/jama.2020.12839 |
| [26] |
Xu Z, Shi L, Wang Y, et al. Pathological findings of COVID-19 associated with acute respiratory distress syndrome[J]. Lancet Respir Med, 2020, 8: 420-422. DOI:10.1016/S2213-2600(20)30076-X |
| [27] |
Ferrara JL, Abhyankar S, Gilliland DG. Cytokine storm of graft-versus-host disease: a critical effector role for interleukin-1[J]. Transplant Proc, 1993, 25: 1216-1217. |
| [28] |
Behrens EM, Koretzky GA. Cytokine storm syndrome: looking toward the precision medicine era[J]. Arthritis Rheumatol, 2017, 69: 1135-1143. DOI:10.1002/art.40071 |
| [29] |
Tisoncik JR, Korth MJ, Simmons CP, et al. Into the eye of the cytokine storm[J]. Microbiol Mol Biol Rev, 2012, 76: 16-32. DOI:10.1128/MMBR.05015-11 |
| [30] |
Zhou Y, Fu B, Zheng X, et al. Pathogenic T-cells and inflammatory monocytes incite inflammatory storms in severe COVID-19 patients[J]. Natl Sci Rev, 2020, 7: 998-1002. DOI:10.1093/nsr/nwaa041 |
| [31] |
Hirano T, Murakami M. COVID-19:a new virus, but a familiar receptor and cytokine release syndrome[J]. Immunity, 2020, 52: 731-733. DOI:10.1016/j.immuni.2020.04.003 |
| [32] |
Hayashi M, Rho MC, Enomoto A, et al. Suppression of bone resorption by madindoline A, a novel nonpeptide antagonist to gp130[J]. Proc Natl Acad Sci U S A, 2002, 99: 14728-14733. DOI:10.1073/pnas.232562799 |
| [33] |
Liu Y, Wang X, Zeng S, et al. The natural polyphenol curcumin induces apoptosis by suppressing STAT3 signaling in esophageal squamous cell carcinoma[J]. J Exp Clin Cancer Res, 2018, 37: 303. DOI:10.1186/s13046-018-0959-0 |
| [34] |
Lin L, Hutzen B, Zuo M, et al. Novel STAT3 phosphorylation inhibitors exhibit potent growth-suppressive activity in pancreatic and breast cancer cells[J]. Cancer Res, 2010, 70: 2445-2454. DOI:10.1158/0008-5472.CAN-09-2468 |
| [35] |
Wung BS, Hsu MC, Wu CC, et al. Resveratrol suppresses IL-6-induced ICAM-1 gene expression in endothelial cells: effects on the inhibition of STAT3 phosphorylation[J]. Life Sci, 2005, 78: 389-397. DOI:10.1016/j.lfs.2005.04.052 |
| [36] |
Nie Y, Erion DM, Yuan Z, et al. STAT3 inhibition of gluconeogenesis is downregulated by SirT1[J]. Nat Cell Biol, 2009, 11: 492-500. DOI:10.1038/ncb1857 |
| [37] |
Don-Doncow N, Escobar Z, Johansson M, et al. Galiellalactone is a direct inhibitor of the transcription factor STAT3 in prostate cancer cells[J]. J Biol Chem, 2014, 289: 15969-15978. DOI:10.1074/jbc.M114.564252 |
| [38] |
Song H, Wang R, Wang S, et al. A low-molecular-weight compound discovered through virtual database screening inhibits Stat3 function in breast cancer cells[J]. Proc Natl Acad Sci U S A, 2005, 102: 4700-4705. DOI:10.1073/pnas.0409894102 |
| [39] |
Bhasin D, Cisek K, Pandharkar T, et al. Design, synthesis, and studies of small molecule STAT3 inhibitors[J]. Bioorg Med Chem Lett, 2008, 18: 391-395. DOI:10.1016/j.bmcl.2007.10.031 |
| [40] |
Lin L, Hutzen B, Li PK, et al. A novel small molecule, LLL12, inhibits STAT3 phosphorylation and activities and exhibits potent growth-suppressive activity in human cancer cells[J]. Neoplasia, 2010, 12: 39-50. DOI:10.1593/neo.91196 |
| [41] |
Zhao C, Wang W, Yu W, et al. A novel small molecule STAT3 inhibitor, LY5, inhibits cell viability, colony formation, and migration of colon and liver cancer cells[J]. Oncotarget, 2016, 7: 12917-12926. DOI:10.18632/oncotarget.7338 |
| [42] |
Schust J, Sperl B, Hollis A, et al. Stattic: a small-molecule inhibitor of STAT3 activation and dimerization[J]. Chem Biol, 2006, 13: 1235-1242. DOI:10.1016/j.chembiol.2006.09.018 |
| [43] |
Ji P, Xu X, Ma S, et al. Novel 2-Carbonylbenzo[J]. ACS Med Chem Lett, 2015, 6: 1010-1014. DOI:10.1021/acsmedchemlett.5b00228 |
| [44] |
Matsuno K, Masuda Y, Uehara Y, et al. Identification of a new series of STAT3 inhibitors by virtual screening[J]. ACS Med Chem Lett, 2010, 1: 371-375. DOI:10.1021/ml1000273 |
| [45] |
Chen H, Yang Z, Ding C, et al. Fragment-based drug design and identification of HJC0123, a novel orally bioavailable STAT3 inhibitor for cancer therapy[J]. Eur J Med Chem, 2013, 62: 498-507. DOI:10.1016/j.ejmech.2013.01.023 |
| [46] |
Chen H, Yang Z, Ding C, et al. Discovery of potent anticancer agent HJC0416, an orally bioavailable small molecule inhibitor of signal transducer and activator of transcription 3(STAT3)[J]. Eur J Med Chem, 2014, 82: 195-203. DOI:10.1016/j.ejmech.2014.05.049 |
| [47] |
Redell MS, Ruiz MJ, Alonzo TA, et al. Stat3 signaling in acute myeloid leukemia: ligand-dependent and -independent activation and induction of apoptosis by a novel small-molecule Stat3 inhibitor[J]. Blood, 2011, 117: 5701-5709. DOI:10.1182/blood-2010-04-280123 |
| [48] |
Siddiquee K, Zhang S, Guida WC, et al. Selective chemical probe inhibitor of Stat3, identified through structure-based virtual screening, induces antitumor activity[J]. Proc Natl Acad Sci U S A, 2007, 104: 7391-7396. DOI:10.1073/pnas.0609757104 |
| [49] |
Zhang X, Yue P, Fletcher S, et al. A novel small-molecule disrupts Stat3 SH2 domain-phosphotyrosine interactions and Stat3-dependent tumor processes[J]. Biochem Pharmacol, 2010, 79: 1398-1409. DOI:10.1016/j.bcp.2010.01.001 |
| [50] |
Zhang X, Yue P, Page BD, et al. Orally bioavailable small-molecule inhibitor of transcription factor Stat3 regresses human breast and lung cancer xenografts[J]. Proc Natl Acad Sci U S A, 2012, 109: 9623-9628. DOI:10.1073/pnas.1121606109 |
| [51] |
Haftchenary S, Luchman HA, Jouk AO, et al. Potent targeting of the STAT3 protein in brain cancer stem cells: a promising route for treating glioblastoma[J]. ACS Med Chem Lett, 2013, 4: 1102-1107. DOI:10.1021/ml4003138 |
| [52] |
Ren X, Duan L, He Q, et al. Identification of niclosamide as a new small-molecule inhibitor of the STAT3 signaling pathway[J]. ACS Med Chem Lett, 2010, 1: 454-459. DOI:10.1021/ml100146z |
| [53] |
Chen H, Yang Z, Ding C, et al. Discovery of O-alkylamino tethered niclosamide derivatives as potent and orally bioavailable anticancer agents[J]. ACS Med Chem Lett, 2013, 4: 180-185. DOI:10.1021/ml3003082 |
| [54] |
Huang W, Dong Z, Wang F, et al. A small molecule compound targeting STAT3 DNA-binding domain inhibits cancer cell proliferation, migration, and invasion[J]. ACS Chem Biol, 2014, 9: 1188-1196. DOI:10.1021/cb500071v |
| [55] |
Huang W, Dong Z, Chen Y, et al. Small-molecule inhibitors targeting the DNA-binding domain of STAT3 suppress tumor growth, metastasis and STAT3 target gene expression in vivo[J]. Oncogene, 2016, 35: 783-792. DOI:10.1038/onc.2015.215 |
| [56] |
Takakura A, Nelson EA, Haque N, et al. Pyrimethamine inhibits adult polycystic kidney disease by modulating STAT signaling pathways[J]. Hum Mol Genet, 2011, 20: 4143-4154. DOI:10.1093/hmg/ddr338 |
| [57] |
Brambilla L, Genini D, Laurini E, et al. Hitting the right spot: mechanism of action of OPB-31121, a novel and potent inhibitor of the signal transducer and activator of transcription 3(STAT3)[J]. Mol Oncol, 2015, 9: 1194-1206. DOI:10.1016/j.molonc.2015.02.012 |
| [58] |
Genini D, Brambilla L, Laurini E, et al. Mitochondrial dysfunction induced by a SH2 domain-targeting STAT3 inhibitor leads to metabolic synthetic lethality in cancer cells[J]. Proc Natl Acad Sci U S A, 2017, 114: E4924-E4933. DOI:10.1073/pnas.1615730114 |
| [59] |
Zhang W, Guo J, Li S, et al. Discovery of monocarbonyl curcumin-BTP hybrids as STAT3 inhibitors for drug-sensitive and drug-resistant breast cancer therapy[J]. Sci Rep, 2017, 7: 46352. DOI:10.1038/srep46352 |
| [60] |
Wen W, Lowe G, Roberts CM, et al. Pterostilbene suppresses ovarian cancer growth via induction of apoptosis and blockade of cell cycle progression involving inhibition of the STAT3 pathway[J]. Int J Mol Sci, 2018, 19: 1983. DOI:10.3390/ijms19071983 |
| [61] |
Lai CS, Yang G, Li S, et al. 3'-Hydroxypterostilbene suppresses colitis-associated tumorigenesis by inhibition of IL-6/STAT3 signaling in mice[J]. J Agric Food Chem, 2017, 65: 9655-9664. DOI:10.1021/acs.jafc.7b03712 |
| [62] |
Li S, Zhang W, Yang Y, et al. Discovery of oral-available resveratrol-caffeic acid based hybrids inhibiting acetylated and phosphorylated STAT3 protein[J]. Eur J Med Chem, 2016, 124: 1006-1018. DOI:10.1016/j.ejmech.2016.10.028 |
| [63] |
Cao HH, Tse AK, Kwan HY, et al. Quercetin exerts anti-melanoma activities and inhibits STAT3 signaling[J]. Biochem Pharmacol, 2014, 87: 424-434. DOI:10.1016/j.bcp.2013.11.008 |
| [64] |
Seo HS, Ku JM, Choi HS, et al. Apigenin overcomes drug resistance by blocking the signal transducer and activator of transcription 3 signaling in breast cancer cells[J]. Oncol Rep, 2017, 38: 715-724. DOI:10.3892/or.2017.5752 |
| [65] |
Liu K, Tian T, Zheng Y, et al. Scutellarin inhibits proliferation and invasion of hepatocellular carcinoma cells via down-regulation of JAK2/STAT3 pathway[J]. J Cell Mol Med, 2019, 23: 3040-3044. DOI:10.1111/jcmm.14169 |
| [66] |
Lim HJ, Jang HJ, Bak SG, et al. In vitro inhibitory effects of cirsiliol on IL-6-induced STAT3 activation through anti-inflammatory activity[J]. Bioorg Med Chem Lett, 2019, 29: 1586-1592. DOI:10.1016/j.bmcl.2019.04.053 |
| [67] |
Zhang J, Sikka S, Siveen KS, et al. Cardamonin represses proliferation, invasion, and causes apoptosis through the modulation of signal transducer and activator of transcription 3 pathway in prostate cancer[J]. Apoptosis, 2017, 22: 158-168. DOI:10.1007/s10495-016-1313-7 |
| [68] |
Pan T, Zhang F, Li F, et al. Shikonin blocks human lung adenocarcinoma cell migration and invasion in the inflammatory microenvironment via the IL‑6/STAT3 signaling pathway[J]. Oncol Rep, 2020, 44: 1049-1063. DOI:10.3892/or.2020.7683 |
| [69] |
Cao HH, Liu DY, Lai YC, et al. Inhibition of the STAT3 signaling pathway contributes to the anti-melanoma activities of shikonin[J]. Front Pharmacol, 2020, 11: 748. DOI:10.3389/fphar.2020.00748 |
| [70] |
Qiu HY, Zhu X, Luo YL, et al. Identification of new shikonin derivatives as antitumor agents targeting STAT3 SH2 domain[J]. Sci Rep, 2017, 7: 2863. DOI:10.1038/s41598-017-02671-7 |
| [71] |
Qiu HY, Fu JY, Yang MK, et al. Identification of new shikonin derivatives as STAT3 inhibitors[J]. Biochem Pharmacol, 2017, 146: 74-86. DOI:10.1016/j.bcp.2017.10.009 |
| [72] |
Yu W, Li C, Zhang W, et al. Discovery of an orally selective inhibitor of signal transducer and activator of transcription 3 using advanced multiple ligand simultaneous docking[J]. J Med Chem, 2017, 60: 2718-2731. DOI:10.1021/acs.jmedchem.6b01489 |
| [73] |
Li C, Chen C, An Q, et al. A novel series of napabucasin derivatives as orally active inhibitors of signal transducer and activator of transcription 3(STAT3)[J]. Eur J Med Chem, 2019, 162: 543-554. DOI:10.1016/j.ejmech.2018.10.067 |
| [74] |
Wang W, Li J, Ding Z, et al. Tanshinone Ⅰ inhibits the growth and metastasis of osteosarcoma via suppressing JAK/STAT3 signalling pathway[J]. J Cell Mol Med, 2019, 23: 6454-6465. DOI:10.1111/jcmm.14539 |
| [75] |
Tian QT, Ding CY, Song SS, et al. New tanshinone Ⅰ derivatives S222 and S439 similarly inhibit topoisomerase Ⅰ/Ⅱ but reveal different p53-dependency in inducing G2/M arrest and apoptosis[J]. Biochem Pharmacol, 2018, 154: 255-264. DOI:10.1016/j.bcp.2018.05.006 |
| [76] |
Zhang HH, Kuang S, Wang Y, et al. Bigelovin inhibits STAT3 signaling by inactivating JAK2 and induces apoptosis in human cancer cells[J]. Acta Pharmacol Sin, 2015, 36: 507-516. DOI:10.1038/aps.2014.143 |
| [77] |
Li M, Yue GG, Song LH, et al. Natural small molecule bigelovin suppresses orthotopic colorectal tumor growth and inhibits colorectal cancer metastasis via IL6/STAT3 pathway[J]. Biochem Pharmacol, 2018, 150: 191-201. |
| [78] |
Lopez-Tapia F, Brotherton-Pleiss C, Yue P, et al. Linker variation and structure-activity relationship analyses of carboxylic acid-based small molecule STAT3 inhibitors[J]. ACS Med Chem Lett, 2018, 9: 250-255. DOI:10.1021/acsmedchemlett.7b00544 |
| [79] |
Zheng H, Hong H, Zhang L, et al. Nifuratel, a novel STAT3 inhibitor with potent activity against human gastric cancer cells[J]. Cancer Manag Res, 2017, 9: 565-572. DOI:10.2147/CMAR.S146173 |
| [80] |
Kim D, Won HY, Hwang ES, et al. Synthesis of benzoxazole derivatives as interleukin-6 antagonists[J]. Bioorg Med Chem, 2017, 25: 3127-3134. DOI:10.1016/j.bmc.2017.03.072 |
| [81] |
Kim BH, Lee H, Song Y, et al. Development of oxadiazole-based ODZ10117 as a small-molecule inhibitor of STAT3 for targeted cancer therapy[J]. J Clin Med, 2019, 8: 1847. DOI:10.3390/jcm8111847 |
| [82] |
Nelson EA, Walker SR, Kepich A, et al. Nifuroxazide inhibits survival of multiple myeloma cells by directly inhibiting STAT3[J]. Blood, 2008, 112: 5095-5102. |
| [83] |
Kim BH, Lee H, Park CG, et al. STAT3 inhibitor ODZ10117 suppresses glioblastoma malignancy and prolongs survival in a glioblastoma xenograft model[J]. Cells, 2020, 9: 722. DOI:10.3390/cells9030722 |
| [84] |
Wang Y, Jiang X, Feng F, et al. Degradation of proteins by PROTACs and other strategies[J]. Acta Pharm Sin (药学学报), 2020, 55: 207-238. |
| [85] |
Murase S. Signal transducer and activator of transcription 3(STAT3) degradation by proteasome controls a developmental switch in neurotrophin dependence[J]. J Biol Chem, 2013, 288: 20151-20161. DOI:10.1074/jbc.M113.470583 |
| [86] |
Bai L, Zhou H, Xu R, et al. A potent and selective small-molecule degrader of STAT3 achieves complete tumor regression in vivo[J]. Cancer Cell, 2019, 36: 498-511. DOI:10.1016/j.ccell.2019.10.002 |
| [87] |
Liu L, McBride KM, Reich NC. STAT3 nuclear import is independent of tyrosine phosphorylation and mediated by importin-alpha3[J]. Proc Natl Acad Sci U S A, 2005, 102: 8150-8155. DOI:10.1073/pnas.0501643102 |
| [88] |
Nkansah E, Shah R, Collie GW, et al. Observation of unphosphorylated STAT3 core protein binding to target dsDNA by PEMSA and X-ray crystallography[J]. FEBS Lett, 2013, 587: 833-839. DOI:10.1016/j.febslet.2013.01.065 |
| [89] |
Beebe JD, Liu JY, Zhang JT. Two decades of research in discovery of anticancer drugs targeting STAT3, how close are we?[J]. Pharmacol Ther, 2018, 191: 74-91. DOI:10.1016/j.pharmthera.2018.06.006 |
 2021, Vol. 56
2021, Vol. 56