胰高血糖素(glucagon) 是由胰腺的胰岛α细胞分泌的激素, 在正常生理条件下, 与胰岛素一起发挥维持血糖稳态的作用。胰高血糖素通过作用于其受体(glucagon receptor, GCGR) 发挥作用, GCGR属于Ⅱ型7次跨膜G蛋白偶联受体[1], 主要表达在肝脏、肾脏、心脏、脂肪组织、脾脏和胰岛细胞等组织中, 其中肝脏和肾脏是GCGR含量最高的组织[2]。
胰高血糖素作用于不同组织可引起不同生理效应: 作用于肝脏时, 可促进肝脏糖原分解、糖异生、脂质代谢和氨基酸代谢; 作用于胰腺时, 可刺激胰岛β细胞的胰岛素分泌; 作用于大脑, 可抑制食欲; 作用于心脏, 可使心率升高、加大心肌收缩[3]; 作用于棕色脂肪, 可促进静息能量消耗, 但也有研究报道胰高血糖素对棕色脂肪的作用不是必需的[4]。胰高血糖素作用于GCGR后, 主要通过激活下游环化一磷酸腺苷(cyclic-adenosine monophosphate, cAMP)-蛋白激酶A (protein kinase A) 信号通路, 进而促进一系列与糖异生、糖原分解和脂肪酸代谢相关基因的表达[5, 6]。另一方面, GCGR的活化还可激活下游磷脂酶C (phospholipase C, PLC)-三磷酸肌醇(inositol triphosphate, IP3) 信号通路, 促进糖异生相关基因的表达[7] (图 1)。在2型糖尿病的发展进程中, 前期由于胰岛素分泌不足和胰岛素抵抗等因素, 胰岛素和胰高血糖素之间的平衡被打破, 此时胰高血糖素的分泌无法被抑制, 进而导致高胰高血糖素血症(hyperglucagonemia), 这也进一步加强了肝脏的葡萄糖产生[8]。因此, 胰高血糖素及其受体作为治疗2型糖尿病的靶点也越来越受到人们关注。

|
Figure 1 Biological function of glucagon. Glucagon binds to glucagon receptor (GCGR) and leads to conformational changes that activate Gq and Gαs coupled proteins. Gq activates phosphatidylinositol 4, 5-bisphosphate (PIP2)-phospholipase C (PLC) signaling, which then phosphorylates inositol trisphosphate (IP3) and promotes endoplasmic reticulum Ca2+ release. Intracellular generated Ca2+ therefore activates calcium-dependent protein kinase Ⅱ (CaMKⅡ) and then phosphatase forkhead box protein O1 (FOXO1) and promotes its nuclear translocation and gluconeogenesis. Gαs increases cyclic-adenosine monophosphate (cAMP) levels, which activates cAMP response element binding (CREB) and protein kinase A (PKA). CREB is then translocated to the nucleus to induce the transcription of grape-6-phosphatase and phosphoenolpyruvate carboxykinase (PEPCK) and gluconeogenesis. Activated PKA leads to a series of pathways related to glucose metabolism. Firstly, it phosphorylates the phosphofructokinase 2 (PFK-2)/fructose 2, 6-bisphosphatase (FBPase2) and promotes FBPase2 activity, leading to an increase of fructose-6-phosphate levels, which will promote gluconeogenesis. At the same time, reduced level of fructose-2, 6-diphosphate will cause glycolysis decrease. Secondly, PKA phosphorylates pyruvate kinase and reduces its activity, leading to reduction of pyruvate and glycolysis. Lastly, PKA activates phosphorylase kinase and inhibits glycogen synthase, which in turn induces a series of glycogenolysis reactions and glycogen synthesis reduction respectively |
为了进一步了解GCGR在2型糖尿病发展进程中的作用, 人们利用转基因技术设计出了胰高血糖素受体敲除小鼠(GCGR-/-)。大量研究表明, 与对照组相比, GCGR-/-小鼠在不出现低血糖症状的前提下, 都能保持较低的餐前和餐后血糖。而且, 这类小鼠还有糖耐量改善、胰岛素水平正常和脂肪组织含量较少等优势[9-12]。更有趣的是, GCGR-/-小鼠还具有较高的GLP-1循环水平, 而GLP-1具有促进胰岛素分泌的功能, 这也进一步降低了GCGR-/-小鼠的糖尿病风险。针对GLP-1水平升高现象的一个解释是, 在GCGR-/-小鼠体内, 由于胰高血糖素无法正常发挥作用, 因此此时机体倾向于代偿性地促进胰高血糖素原表达, 而GLP-1和胰高血糖素都是由胰高血糖素原衍生而来的[9, 13]。
但另一方面, GCGR的敲除意味着胰高血糖素无法正常发挥生理功能, 这也会引起一系列代谢问题。首先, 胰岛α细胞分泌的胰高血糖素无法正常发挥作用, 其在血液中的积累就导致了高胰高血糖素血症。其次, 肝脏作为胰高血糖素主要的靶点, 在GCGR敲除时无法正常进行胰高血糖素介导的脂质代谢进而出现脂质堆积[14, 15]。同时, 肝脏利用氨基酸进行的糖异生也因为胰高血糖素信号的缺失而无法正常进行。最终, 多余的、没有进行代谢的氨基酸就会聚集在胰岛α细胞附近参与α细胞代偿性增生[9-11, 16, 17]。因此, 在针对GCGR开发拮抗性药物时要对以上现象进行重点监测。
3 GCGR拮抗剂在2型糖尿病中的作用针对2型糖尿病或肥胖, 人们针对不同靶点开发了一系列药物[18]。随着GCGR结构的阐明, 近年来人们研发出了一系列针对GCGR的药物, 包括GCGR拮抗剂、GCGR抗体和GCGR反义寡核苷酸等(表 1)。相关的临床试验表明, 虽然这些药物可有效降低2型糖尿病患者餐前和餐后的血糖和糖化血红蛋白(hemoglobin A1c, HbA1c) 水平[19], 但不良反应也很明显, 比如血清低密度脂蛋白(low-density lipoprotein, LDL) 和肝脏转氨酶含量的升高, 以及胰岛α细胞增生和高胰高血糖素血症等[20]。
| Table 1 GCGR antagonists (data from ClinicalTrials.gov) |
为减弱这些不良反应, GLP-1R/GCGR共激动剂被开发(表 2)。一方面, 它可激活GLP-1R来发挥促进胰岛素分泌的作用, 进而降低血糖; 另一方面, 它可激活GCGR, 促进脂质代谢, 降低体重等[21, 22]。而这类药物的不良反应是胃肠道紊乱、食欲不振和剂量依赖的心率升高等。
| Table 2 GLP-1R/GCGR co-agonists (data from ClinicalTrials.gov) |
为缓解2型糖尿病患者的高血糖, 在近20年中开发出了一系列针对GCGR的药物。尽管GCGR拮抗剂类药物在动物模型中效果很好, 但只有少量进入了Ⅰ和Ⅱ期临床试验, 且没有一个进入临床Ⅲ期试验。在GCGR相关药物的研发上仍有很多困难需克服。
4.1 针对GCGR的小分子拮抗剂随着GCGR晶体结构的发现, 人们对GCGR的理解得到了进一步加深, 陆续开发出了一系列针对GCGR的小分子拮抗剂, 这类药物稳定性较好, 可直接口服, 因此, 此领域也是针对GCGR的临床前研究比较活跃的领域。
Bay 27-9955 (Bayer公司) 是首个开发的对人体有效的GCGR竞争性拮抗剂。在2001年的一项对14位健康男性志愿者进行的双盲试验中, 志愿者口服Bay 27-9955后可减轻由于服用外源胰高血糖素引起的肝葡萄糖产生和血糖水平的升高[23], 但关于该分子在糖尿病模型或者糖尿病患者中的药代动力学和长期作用数据却未公开。Bay 27-9955作为首个用于临床的小分子GCGR竞争性拮抗剂, 无疑揭示了GCGR在2型糖尿病发展进程中的重要作用, 也更激励了人们去开发更多更有效的GCGR拮抗剂。
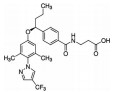
MK-0893是由Merck公司开发出来的GCGR拮抗剂, 已进入针对2型糖尿病患者的Ⅱ期临床试验。在2013年的一项对18位健康男性志愿者进行的双盲试验中, 志愿者口服MK-0893后可剂量依赖性地减轻由于服用外源胰高血糖素引起的血糖升高[24]。在一项针对有饮食控制的2型糖尿病患者的双盲试验中, 患者每天口服1次MK-0893 (20~80 mg), 维持12周可以剂量依赖的方式明显改善空腹和餐后血糖和HbA1c水平[25]。另外, 还有研究考察了MK-0893与二甲双胍或西他列汀联合使用的疗效和安全性。与传统的二甲双胍-西他列汀组合相比, 在二甲双胍或西他列汀中添加MK-0893的降血糖效果更好[26]。但是, 在一些研究中, 受试者的血清LDL和肝转氨酶水平升高, 同时体重和血压也出现了升高, 这些不良反应最终导致MK-0893研究的终止[25, 26]。
MK-3577是Merck公司开发的另一种GCGR拮抗剂, 与MK-0893相比, 半衰期更短。在研究期间, 研究者开发了一种模型, 利用该模型可得到胰高血糖素、葡萄糖以及激发前和激发后的胰岛素水平的观察曲线。该模型适用于2型糖尿病患者人群, 并可提供可靠的预测以协助剂量调整, 进而用于IIa期研究的分析[27]。一项Ⅱ期临床研究在118名已进行饮食控制的2型糖尿病受试者中比较了在早上和夜间口服MK-3577对血糖和血脂的影响, 结果显示参与者的空腹血糖(fasting blood glucose, FBG) 出现了显著降低。但由于一些不必要的脂质不良反应, Merck终止了该化合物的研发[28]。
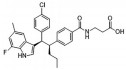
LY2409021是由Eli Lilly公司开发的GCGR拮抗剂, 半衰期约为60 h。在23名健康男性受试者服用LY2409021 28天后, 空腹和餐后血糖都有明显下降, 而转氨酶水平只出现了轻微的、剂量依赖性的可逆性上调[29]。在一项IIa期临床研究中, 针对控制饮食和运动或服用稳定剂量的二甲双胍治疗的2型糖尿病患者, 服用不同浓度LY2409021后, 观察12或24周。与前期研究一样, LY2409021显著降低了血糖和HbA1c水平, 总体耐受性良好, 且低血糖风险较低。同时, 观察到转氨酶出现了适度、可逆的增加[30]。但是一项针对2型糖尿病患者的双盲试验结果显示, 与安慰剂组和西格列汀组相比, 口服LY2409021 6个月会增加肝脏脂质堆积和转氨酶水平, 同时血清中的LDL水平也有升高[31]。
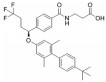
PF-06291874是由Pfizer公司开发的针对GCGR的选择性拮抗剂, 半衰期约为19.7~22.7 h。在一项针对2型糖尿病的临床试验中, 将患者分为口服PF-06291874或安慰剂组, 受试者的背景为试验前至少6周每天服用二甲双胍≥ 1 000 mg或保持稳定的二甲双胍和磺酰脲类药物的摄入, 试验时口服PF-06291874或安慰剂, 持续观察14~28天。在14天时, 口服PF-06291874组的餐后和空腹血糖都有明显下调。在混合膳食耐受测试后, 观察到口服PF-06291874组的胰高血糖素和总GLP-1水平呈现剂量依赖性增加。同时, LDL水平有较小程度的剂量依赖性增加, 转氨酶水平也出现了可逆性增加。在第2和14天时, 可观察到循环糖异生氨基酸水平的升高[32]。在一项针对长期稳定服用二甲双胍的2型糖尿病患者的双盲试验中, 给予患者不同浓度的PF-06291874维持12周, 可观察到FBG和HbA1c的显著降低, 但同时伴有较低幅度的非剂量依赖性的LDL水平增加、血压升高和转氨酶水平升高等不良反应[33]。
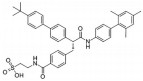
LGD-6972是由Ligand Pharmaceuticals公司开发的针对于GCGR的小分子拮抗剂。在一项针对健康者和2型糖尿病患者的安全性、药代动力学和药效学的临床试验中, 向受试者每天给予不同剂量的LGD-6972, 持续14天。14天时可在两组中观察到剂量依赖的餐前和餐后血糖降低。空腹胰高血糖素呈现剂量依赖性增加, 但在2型糖尿病患者口服葡萄糖后, 胰高血糖素水平降低且胰岛素水平增加。LGD-6972在所有测试的剂量下具有良好的耐受性且不引起低血糖[34]。一项针对稳定服用二甲双胍的2型糖尿病患者的双盲试验中, 将患者分为安慰剂组和不同剂量的LGD-6972组, 每天服用1次药物并维持12周。治疗期间可观察到HbA1c的水平显著降低。在口服葡萄糖耐量试验(oral glucose tolerance test, OGTT) 期间, 所有剂量的LGD-6972均显著降低空腹血糖。同时, LGD-6972治疗还使空腹胰高血糖素、总GLP-1和活性GLP-1水平有较低程度的增加, 并可观察到转氨酶水平轻度的可逆性升高[35]。
研究发现[36], LGD-6972在结构上与其他小分子GCGR拮抗剂不同, 后者包含磺酸尾巴(sulfonic acid tail, SAT) 而不是羧酸尾巴(carboxylic acid tail, CAT)。对与GCGR结合的LGD-6972进行建模并将其与GCGR结合的MK-0893的X射线晶体学数据进行比较, 结果显示, LGD-6972的SAT在GCGR跨膜结构域中的6和7号螺旋之间创建了一个较大的口袋, 并改变了8号螺旋的方向。另外, 通过在胰高血糖素刺激的cAMP积累、β-arrestin募集和受体内化的细胞模型中检查LGD-6972、MK-0893和其他SAT和CAT类GCGR拮抗剂的活性, 结果显示, 所有经测试的GCGR拮抗剂都是cAMP蓄积的完全(> 95%) 拮抗剂。CAT类GCGR拮抗剂是β-arrestin (≥ 96%) 和受体内化(≥ 94%) 的完全拮抗剂。相反, SAT类GCGR拮抗剂降低了对β-arrestin (58%~87%) 和受体内化(6%~52%) 的拮抗作用。而这些不同点恰恰说明相较于之前的小分子GCGR拮抗剂, LGD-6972在完全抑制cAMP功能的同时, 并没有完全拮抗β-arrestin介导的受体内化过程, 即受体偏向的信号传导, 因此其所带来的不良反应也随之减弱[36]。
4.2 针对GCGR的单克隆抗体随着GCGR小分子拮抗剂临床试验的终止以及对GCGR蛋白结构的进一步掌握, 人们开发出了针对GCGR的抗体。单克隆抗体药物具有理化性质均一性强、与抗原结合特异性好、靶向性强、不良反应小、疗效显著、来源相对容易且质量易控制等优点, 是药物开发的热点领域。
LY2786890是一种人源化IgG单克隆GCGR抗体, 对人GCGR具有拮抗活性。一项双盲试验考察了单剂量LY2786890在健康受试者和2型糖尿病患者中的安全性和有效性。LY2786890的药代动力学和药效学特征支持每周皮下给药1次, 皮下注射后的绝对生物利用度约为50%, 半衰期为4~26天, 且其药效是时间-浓度依赖性的。在2型糖尿病患者中, LY2786890可显著降低FBG, 并在第2天将血胰高血糖素水平升高3倍左右。LY2786890有较好耐受性, 偶尔出现轻度低血糖发作, 而在2型糖尿病患者中观察到了转氨酶水平剂量依赖性的升高[37]。
PF-06293620是一种人源化IgG2δa抗体, 可与GCGR结合并阻断胰高血糖素信号传导。在一项针对二甲双胍治疗的2型糖尿病患者的Ⅰ期临床试验中, 对患者注射不同剂量的PF-06293620, 以评估其安全性、耐受性、药代动力学和药效学。患者接受一次性PF-06293620或安慰剂注射, 随访12周后, 可观察到FBG和HbA1c的剂量依赖性降低[38]。
REMD-477是由REMD Biotherapeutics公司开发的针对GCGR的抗体, 半衰期约为7~10天。首先在1型糖尿病动物模型中研究了REMD-477的GCGR拮抗作用。在胰岛素缺乏小鼠中, 即使没有胰岛素, 用该抗体阻断胰高血糖素的作用也能使血糖水平维持在100 mg·dL-1以下, HbA1c水平维持在4%以下[39]。在动物实验的基础上, 进一步在1型糖尿病患者中进行临床试验。一项随机、双盲、安慰剂对照的研究招募了21例1型糖尿病患者。他们接受了为期5天的住院观察, 在此期间通过饮食调控并连续静脉输注胰岛素来维持其葡萄糖水平。在住院的第2天, 有10名患者接受了70 mg的REMD-477单次皮下注射, 而11名患者接受了安慰剂的皮下注射。与安慰剂组相比, 住院期间单剂量REMD-477注射可使每日胰岛素使用量减少多达26% (12个单位) (P = 0.02)。此外, 与住院患者相比, REMD-477组患者在出院的前3周血糖降低了20~31 mg·dL-1 (P < 0.05), 并且没有引起低血糖。因此, 这项研究结果显示, 单剂量REMD-477注射可显著减少1型糖尿病患者的胰岛素需求量, 并在不引起低血糖的情况下提高血糖利用水平[40]。此项研究没有报道该药物明显的不良反应。
REGN1193是一种由Regeneron Pharmaceuticals公司合成的完全人单克隆抗体, 可在体外结合并抑制GCGR信号传导。首先在动物实验中, REGN1193使糖尿病小鼠和猴的血糖正常化, 且在正常血糖的猴中不产生低血糖[41]。一项针对12个健康受试者的随机双盲试验结果显示, REGN1193具有良好的安全性和耐受性, 但同时也观察到了转氨酶的瞬时升高, 以及总GLP-1、GLP-2和胰高血糖素剂量依赖性的增加[42]。
4.3 针对GCGR的反义寡核苷酸目前另一种针对于GCGR的拮抗类药物是GCGR反义寡核苷酸, 这类药物主要通过降低GCGR mRNA的表达来抑制胰高血糖素的作用。
一项针对于健康受试者的随机、双盲、安慰剂对照的试验结果显示, 与安慰剂组相比, 多剂量ISIS-GCGRRx (ISIS 449884, Ionis Pharmaceuticals公司) 治疗具有良好的耐受性, 并且没有引起生命体征、脂质分布、血压、肝或肾功能的临床显著变化。另外, 在治疗期间未观察到低血糖。从给药后第15天开始, 所有给药组的总GLP-1水平均显著增加, 直至治疗后两周[43]。在一项针对接受稳定的二甲双胍治疗的2型糖尿病患者的双盲试验中, 将受试者随机分配至100或200 mg ISIS-GCGRRX以及安慰剂组。结果显示, 在注射ISIS-GCGRRX 11周时, 2型糖尿病患者的FBG和HbA1c水平与安慰剂组相比有明显的改善, 同时, 总GLP-1和血C肽也出现了显著的增加[44]。另一项双盲、安慰剂对照的Ⅱ期临床试验招募了79名每天服用稳定的二甲双胍剂量≥ 1 500 mg的2型糖尿病患者, 每周1次50和75 mg IONIS-GCGRRx给药14和27周均可将HbA1c水平明显降低。同时观察到IONIS-GCGRRx使转氨酶水平出现剂量依赖性的增加, 但没有引起低血糖以及血压、LDL或其他生命体征的变化[45]。GCGR拮抗剂之间存在机制特异性。例如, 在与GCGR结合的小分子和抗体中, 由于对GCGR以及其他G蛋白偶联受体(尤其是与GCGR高度同源的GLP受体) 的特异性结合, 可能会产生不同的影响。IONIS-GCGRRx是一种结构特殊的GCGR拮抗剂, 不太可能影响结构相似的功能蛋白, 因此也没有产生明显的不良反应。由于IONIS-GCGRRx仅部分抑制GCGR (主要是肝), 因此可能不足以引起在GCGR-/-小鼠所观察到的交感神经活动的代偿性增加, 因此不会升高血压[45]。
ISIS 325568 (ISIS 449884, Ionis Pharmaceuticals公司) 是一种降低肝脏GCGR mRNA表达的2'-O-(2-甲氧基乙基)反义寡核苷酸, 一项针对健康受试者的为期6周的试验评估了单剂量和多剂量(50~400 mg) ISIS 325568的安全性、耐受性、药代动力学和药效学。在第1周对受试者进行皮下注射ISIS 325568, 并在随后的5周观察到其可减弱胰高血糖素刺激的肝葡萄糖生成和血糖波动, 进一步支持了针对2型糖尿病患者进行GCGR反义寡核苷酸的治疗[46]。
4.4 GLP-1R/GCGR的共激动剂由于GCGR的激活可促进脂质分解, 因此人们发现了胰高血糖素对减肥的作用。然而, 为了解决其引起的高血糖问题, 考虑到GLP-1可促进胰岛素分泌并降低血糖, 人们发明了GLP-1R/GCGR共激动剂。GLP-1R/GCGR共激动剂不仅可加速能量消耗并减少脂质合成, 还可改善葡萄糖耐量。
MEDI0382 (MedImmune LLC公司) 是一种针对GLP-1R和GCGR的共激动剂。在一项针对健康受试者的Ⅰ期研究中, 通过对受试者皮下注射不同剂量的MEDI0382考察其安全性和耐药性。与安慰剂组相比, MEDI0382组较易发生呕吐、恶心和头晕等症状, 同时MEDI0382治疗似乎使受试者心率呈剂量依赖性增加[47]。随后, 一项针对2型糖尿病患者的随机、安慰剂对照、双盲的Ⅱa期试验发现, 与安慰剂组相比, MEDI0382组患者的血糖和体重有明显的下降, 但同时, MEDI0382组患者出现更多的胃肠道疾病和食欲下降的状况[48]。在一项双盲、安慰剂对照的Ⅱa期研究中, 将21名肥胖的2型糖尿病患者随机分为MEDI0382 (n = 12) 或安慰剂(n = 9) 组, 持续28天每日1次皮下注射MEDI0382。与安慰剂组相比, MEDI0382组餐后肝糖原含量显著降低, 肝脂肪相对减少了33.2%, 空腹丙氨酸、谷氨酸、甘氨酸、赖氨酸和苏氨酸水平也显著降低[49]。
SAR425899是对GCGR和GLP-1R具有共同激动作用的新型多肽, 为了评估其安全性、药代动力学和药效学, 一项针对肥胖健康人群和肥胖2型糖尿病患者的随机、安慰剂对照的双盲临床试验结果显示, SAR425899具有良好的耐受性, 并在2型糖尿病患者中产生了良好的降低血糖和HbA1c水平的效果, 同时在健康受试者和2型糖尿病患者中均减轻了体重。SAR425899最明显的不良反应是胃肠道反应, 但2型糖尿病患者的胃肠道反应要弱于健康肥胖人群[50]。另一项临床试验针对肥胖2型糖尿病患者皮下给药28天, 并在治疗前1天以及治疗第1和28天进行了混合餐耐受性测试。结果发现SAR425899通过显著增强β细胞功能并减慢葡萄糖吸收速率, 改善了餐后血糖控制[51]。
5 总结与展望自发现以来, 人们对胰高血糖素已进行了深入的研究, 并且对胰高血糖素的分泌、胰高血糖素与其受体GCGR相互作用并调节GCGR下游的各种细胞因子和酶功能进行了大量的研究。针对胰高血糖素的拮抗作用目前仍是糖尿病的一种创新疗法。在2型糖尿病患者中, 人们开发了一系列通过调节GCGR来控制高血糖的药物, 例如针对GCGR的拮抗剂、抗体和反义寡核苷酸等。这些化合物都具有明显缓解高血糖的作用, 不良反应主要为血压和转氨酶升高。然而针对GCGR, 不同化合物或多肽在血压和转氨酶方面的不良反应不尽相同, 因此存在开发一种效果显著而不良反应低的GCGR相关药物的可能性, 这很可能带来2型糖尿病治疗的重大进展。
作者贡献: 陈婧文负责文章撰写; 柳星峰、崔冰和李平平负责文章的指导及审阅。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Habegger KM, Heppner KM, Geary N, et al. The metabolic actions of glucagon revisited[J]. Nat Rev Endocrinol, 2010, 6: 689. DOI:10.1038/nrendo.2010.187 |
| [2] |
Svoboda M, Tastenoy M, Vertongen P, et al. Relative quantitative analysis of glucagon receptor mRNA in rat tissues[J]. Mol Cell Endocrinology, 1994, 105: 131-137. DOI:10.1016/0303-7207(94)90162-7 |
| [3] |
Kleinert M, Sachs S, Habegger KM, et al. Glucagon regulation of energy expenditure[J]. Int J Mol Sci, 2019, 20: 5407. DOI:10.3390/ijms20215407 |
| [4] |
Beaudry JL, Kaur KD, Varin EM, et al. The brown adipose tissue glucagon receptor is functional but not essential for control of energy homeostasis in mice[J]. Mol Metab, 2019, 22: 37-48. DOI:10.1016/j.molmet.2019.01.011 |
| [5] |
Li JH, Jain S, McMillin SM, et al. A novel experimental strategy to assess the metabolic effects of selective activation of a Gq-coupled receptor in hepatocytes in vivo[J]. Endocrinology, 2013, 154: 3539-3551. DOI:10.1210/en.2012-2127 |
| [6] |
Lee TP, Kuo JF, Greengard P. Regulation of myocardial cyclic AMP by isoproterenol, glucagon and acetylcholine[J]. Biochem Biophys Res Commun, 1971, 45: 991-997. DOI:10.1016/0006-291X(71)90435-9 |
| [7] |
Xu Y, Xie X. Glucagon receptor mediates calcium signaling by coupling to Gαq/11 and Gαi/o in HEK293 cells[J]. J Recept Signal Transduct Res, 2009, 29: 318-325. DOI:10.3109/10799890903295150 |
| [8] |
Lan JQ, Zhu CJ. Recent advances in pharmacological intervention for prediabetes[J]. Acta Pharm Sin (药学学报), 2015, 50: 1565-1572. |
| [9] |
Gelling R, Du X, Dichmann D, et al. Lower blood glucose, hyperglucagonemia, and pancreatic α cell hyperplasia in glucagon receptor knockout mice[J]. Proc Natl Acad Sci U S A, 2003, 100: 1438-1443. DOI:10.1073/pnas.0237106100 |
| [10] |
Longuet C, Robledo AM, Dean ED, et al. Liver-specific disruption of the murine glucagon receptor produces α-cell hyperplasia: evidence for a circulating α-cell growth factor[J]. Diabetes, 2013, 62: 1196-1205. DOI:10.2337/db11-1605 |
| [11] |
Wei R, Gu L, Yang J, et al. Antagonistic glucagon receptor antibody promotes α-cell proliferation and increases β-cell mass in diabetic mice[J]. iScience, 2019, 16: 326-339. DOI:10.1016/j.isci.2019.05.030 |
| [12] |
Lam CJ, Rankin MM, King KB, et al. Glucagon receptor antagonist-stimulated α-cell proliferation is severely restricted with advanced age[J]. Diabetes, 2019, 68: 963-974. DOI:10.2337/db18-1293 |
| [13] |
Ali S, Lamont BJ, Charron MJ, et al. Dual elimination of the glucagon and GLP-1 receptors in mice reveals plasticity in the incretin axis[J]. J Clin Invest, 2011, 121: 1917-1929. DOI:10.1172/JCI43615 |
| [14] |
Longuet C, Sinclair EM, Maida A, et al. The glucagon receptor is required for the adaptive metabolic response to fasting[J]. Cell Metab, 2008, 8: 359-371. DOI:10.1016/j.cmet.2008.09.008 |
| [15] |
Berglund ED, Lustig DG, Baheza RA, et al. Hepatic glucagon action is essential for exercise-induced reversal of mouse fatty liver[J]. Diabetes, 2011, 60: 2720-2729. DOI:10.2337/db11-0455 |
| [16] |
Solloway MJ, Madjidi A, Gu C, et al. Glucagon couples hepatic amino acid catabolism to mTOR-dependent regulation of α-cell mass[J]. Cell Rep, 2015, 12: 495-510. DOI:10.1016/j.celrep.2015.06.034 |
| [17] |
Dean ED, Li M, Prasad N, et al. Interrupted glucagon signaling reveals hepatic α cell axis and role for L-glutamine in α cell proliferation[J]. Cell Metab, 2017, 25: 1362-1373. DOI:10.1016/j.cmet.2017.05.011 |
| [18] |
Liu J, Wang Y, Lin L. Small molecules for fat combustion: targeting obesity[J]. Acta Pharm Sin B, 2019, 9: 220-236. DOI:10.1016/j.apsb.2018.09.007 |
| [19] |
Bagger JI, Knop F, Holst JJ, et al. Glucagon antagonism as a potential therapeutic target in type 2 diabetes[J]. Diabetes Obes Metab, 2011, 13: 965-971. DOI:10.1111/j.1463-1326.2011.01427.x |
| [20] |
Guan HP, Yang X, Lu K, et al. Glucagon receptor antagonism induces increased cholesterol absorption[J]. J Lipid Res, 2015, 56: 2183-2195. DOI:10.1194/jlr.M060897 |
| [21] |
Sánchez-Garrido MA, Brandt SJ, Clemmensen C, et al. GLP-1/glucagon receptor co-agonism for treatment of obesity[J]. Diabetologia, 2017, 60: 1851-1861. DOI:10.1007/s00125-017-4354-8 |
| [22] |
Patel VJ, Joharapurkar AA, Kshirsagar SG, et al. Therapeutic potential of coagonists of glucagon and GLP-1[J]. Cardiovasc Hematol Agents Med Chem, 2014, 12: 126-133. |
| [23] |
Petersen K, Sullivan J. Effects of a novel glucagon receptor antagonist (Bay 27-9955) on glucagon-stimulated glucose production in humans[J]. Diabetologia, 2001, 44: 2018-2024. DOI:10.1007/s001250100006 |
| [24] |
Engel SS, Xu L, Andryuk PJ, et al. Efficacy and tolerability of MK-0893, a glucagon receptor antagonist (GRA) in patients with type 2 diabetes (T2DM)[C]. Diabetes, 2011, 60: A85.
|
| [25] |
Troyer MD, Hompesch M, Pramanik B, et al. Recovery from hypoglycemia in healthy subjects is preserved despite glucagon receptor blockade by MK-0893[EB/OL]. San Diego, California: American Diabetes Association 71st Scientific Sessions, 2011[2021-06-08]. https://professional.diabetes.org/abstract/recovery-hypoglycemia-healthy-subjects-preserved-despite-glucagon-receptor-blockade-mk-0893.
|
| [26] |
Engel SS, Teng R, Edwards RJ, et al. Efficacy and safety of the glucagon receptor antagonist, MK-0893, in combination with metformin or sitagliptin in patients with type 2 diabetes mellitus[C]. Diabetologia, 2011, 54: S86-S87.
|
| [27] |
Peng JZ, Denney WS, Musser BJ, et al. A semi-mechanistic model for the effects of a novel glucagon receptor antagonist on glucagon and the interaction between glucose, glucagon, and insulin applied to adaptive phase Ⅱ design[J]. AAPS J, 2014, 16: 1259-1270. DOI:10.1208/s12248-014-9648-x |
| [28] |
Nunez DJ, D'Alessio D. Glucagon receptor as a drug target: a witches' brew of eye of newt (peptides) and toe of frog (receptors)[J]. Diabetes Obes Metab, 2018, 20: 233-237. DOI:10.1111/dom.13102 |
| [29] |
Kelly R, Garhyan P, Raddad E, et al. Short-term administration of the glucagon receptor antagonist LY2409021 lowers blood glucose in healthy people and in those with type 2 diabetes[J]. Diabetes Obes Metab, 2015, 17: 414-422. DOI:10.1111/dom.12446 |
| [30] |
Kazda CM, Ding Y, Kelly RP, et al. Evaluation of efficacy and safety of the glucagon receptor antagonist LY2409021 in patients with type 2 diabetes: 12-and 24-week phase 2 studies[J]. Diabetes Care, 2016, 39: 1241-1249. DOI:10.2337/dc15-1643 |
| [31] |
Guzman CB, Zhang XM, Liu R, et al. Treatment with LY 2409021, a glucagon receptor antagonist, increases liver fat in patients with type 2 diabetes[J]. Diabetes Obes Metab, 2017, 19: 1521-1528. DOI:10.1111/dom.12958 |
| [32] |
Kazierad D, Bergman A, Tan B, et al. Effects of multiple ascending doses of the glucagon receptor antagonist PF-06291874 in patients with type 2 diabetes mellitus[J]. Diabetes Obes Metab, 2016, 18: 795-802. DOI:10.1111/dom.12672 |
| [33] |
Kazierad DJ, Chidsey K, Somayaji VR, et al. Efficacy and safety of the glucagon receptor antagonist PF-06291874:a 12-week, randomized, dose-response study in patients with type 2 diabetes mellitus on background metformin therapy[J]. Diabetes Obes Metab, 2018, 20: 2608-2616. DOI:10.1111/dom.13440 |
| [34] |
Vajda EG, Logan D, Lasseter K, et al. Pharmacokinetics and pharmacodynamics of single and multiple doses of the glucagon receptor antagonist LGD-6972 in healthy subjects and subjects with type 2 diabetes mellitus[J]. Diabetes Obes Metab, 2017, 19: 24-32. DOI:10.1111/dom.12752 |
| [35] |
Pettus J, Vajda EG, Pipkin J, et al. Glucagon receptor antagonist LGD-6972 significantly lowers HbA1c and is well tolerated after 12-week treatment in patients with type 2 diabetes mellitus (T2DM) on metformin[EB/OL]. San Diego, California: American Diabetes Association 71st Scientific Sessions, 2011[2021-06-08]. https://diabetes.diabetesjournals.org/content/67/Supplement_1/73-OR.abstract.
|
| [36] |
Vajda EG, Zhi L, Marschke K. An allosteric glucagon receptor antagonist, LGD-6972, displays biased receptor signaling[EB/OL]. San Diego, California: American Diabetes Association, 2018[2021-06-08]. https://diabetes.diabetesjournals.org/content/67/Supplement_1/1117-P.abstract.
|
| [37] |
Kelly RP, Garhyan P, Reynolds VL, et al. 18. Glucagon receptor antibody LY2786890 reduced glucose levels in type 2 diabetes mellitus patients (106-LB)[J]. Ned Tijdschr Diabetologie, 2015, 13: 73-74. DOI:10.1007/s12467-015-0039-4 |
| [38] |
Gumbiner B, Esteves B, Dell V, et al. Single and multiple ascending-dose study of glucagon-receptor antagonist RN909 in type 2 diabetes: a phase 1, randomized, double-blind, placebo-controlled trial[J]. Endocrine, 2018, 62: 371-380. DOI:10.1007/s12020-018-1597-1 |
| [39] |
Wang MY, Yan H, Shi Z, et al. Glucagon receptor antibody completely suppresses type 1 diabetes phenotype without insulin by disrupting a novel diabetogenic pathway[J]. Proc Natl Acad Sci U S A, 2015, 112: 2503-2508. DOI:10.1073/pnas.1424934112 |
| [40] |
Pettus J, Reeds D, Cavaiola TS, et al. Effect of a glucagon receptor antibody (REMD-477) in type 1 diabetes: a randomized controlled trial[J]. Diabetes Obes Metab, 2018, 20: 1302-1305. DOI:10.1111/dom.13202 |
| [41] |
Okamoto H, Kim J, Aglione J, et al. Glucagon receptor blockade with a human antibody normalizes blood glucose in diabetic mice and monkeys[J]. Endocrinology, 2015, 156: 2781-2794. DOI:10.1210/en.2015-1011 |
| [42] |
Kostic A, King TA, Yang F, et al. A first-in-human pharmacodynamic and pharmacokinetic study of a fully human anti-glucagon receptor monoclonal antibody in normal healthy volunteers[J]. Diabetes Obes Metab, 2018, 20: 283-291. DOI:10.1111/dom.13075 |
| [43] |
Scheen AJ, Paquot N, Lefèbvre PJ. Investigational glucagon receptor antagonists in Phase Ⅰ and Ⅱ clinical trials for diabetes[J]. Expert Opin Investig Drugs, 2017, 26: 1373-1389. DOI:10.1080/13543784.2017.1395020 |
| [44] |
Morgan E, Smith A, Watts L, et al. ISIS-GCGRRX, an antisense glucagon receptor antagonist, caused rapid, robust, and sustained improvements in glycemic control without changes in BW, BP, lipids, or hypoglycemia in T2DM patients on stable metformin therapy[J]. Diabetes, 2014, 63: LB28. |
| [45] |
Morgan ES, Tai LJ, Pham NC, et al. Antisense inhibition of glucagon receptor by IONIS-GCGRRx improves type 2 diabetes without increase in hepatic glycogen content in patients with type 2 diabetes on stable metformin therapy[J]. Diabetes Care, 2019, 42: 585-593. DOI:10.2337/dc18-1343 |
| [46] |
van Dongen MG, Geerts BF, Morgan ES, et al. First proof of pharmacology in humans of a novel glucagon receptor antisense drug[J]. J Clin Pharmacol, 2015, 55: 298-306. DOI:10.1002/jcph.396 |
| [47] |
Ambery PD, Klammt S, Posch MG, et al. MEDI0382, a GLP-1/glucagon receptor dual agonist, meets safety and tolerability endpoints in a single-dose, healthy-subject, randomized, Phase 1 study[J]. Br J Clin Pharmacol, 2018, 84: 2325-2335. DOI:10.1111/bcp.13688 |
| [48] |
Ambery P, Parker VE, Stumvoll M, et al. MEDI0382, a GLP-1 and glucagon receptor dual agonist, in obese or overweight patients with type 2 diabetes: a randomised, controlled, double-blind, ascending dose and phase 2a study[J]. Lancet, 2018, 391: 2607-2618. DOI:10.1016/S0140-6736(18)30726-8 |
| [49] |
Robertson D, Hanson L, Ambery P, et al. 354-OR: cotadutide (medi0382), a dual receptor agonist with glucagon-like peptide-1 andglucagon activity, modulates hepatic glycogen and fat content[EB/OL]. San Diego, California: American Diabetes Association, 2020[2021-06-08]. https://diabetes.diabetesjournals.org/content/69/Supplement_1/354-OR.
|
| [50] |
Tillner J, Posch MG, Wagner F, et al. A novel dual glucagon-like peptide and glucagon receptor agonist SAR425899:results of randomized, placebo-controlled first-in-human and first-in-patient trials[J]. Diabetes Obes Metab, 2019, 21: 120-128. DOI:10.1111/dom.13494 |
| [51] |
Visentin R, Schiavon M, Göbel B, et al. Dual glucagon-like peptide-1 receptor/glucagon receptor agonist SAR425899 improves beta-cell function in type 2 diabetes[J]. Diabetes Obes Metab, 2020, 22: 640-647. DOI:10.1111/dom.13939 |
 2021, Vol. 56
2021, Vol. 56