中医药对中华民族健康和国家稳定发挥了重要作用, 1949年新中国成立后, 中共中央、国务院高度重视中医药工作。2020年, 中医药为我国在国际上率先控制新冠肺炎疫情、快速恢复经济发展做出了重要贡献[1, 2]。1996年党中央、国务院明确提出"实现中药与中药生产现代化", 通过二十多年的努力中药行业取得了多方面巨大发展[3]。中药现代化既是当今时代发展的要求, 也为人类应对疾病提供了更多的药物选择。推进中药现代化, 中药的有效性和安全性是关键, 对此要做好两方面工作: 其一是开展严格的临床研究和基础研究, 以验证中药的有效性和安全性, 使传统中医药从经验医学向循证医学转化; 其二是从化学组成复杂的中药中找出决定其疗效和用药风险的物质, 为提高中药疗效、保障用药安全创造条件。
1 为什么要开展中药多成分药代研究 1.1 开展中药多成分药代研究涉及的科学假说对于化学组成复杂的中药, 拿什么物质来研究其药效作用一直是一个棘手的问题。做法之一是检测整个中药的药效活性。由于难以定义这种混合物形式的中药浓度, 因此很难说明其药效活性的强弱。若用中药所含的某个成分来定义浓度, 则问题是该成分是否与中药药效关联、能否代表整个中药; 若以中药用量来定义浓度, 则问题是中药的质量受众多生药学和制剂学因素的影响。做法之二是检测中药所含的一个或几个成分的药效活性。这样做的问题在于所选成分能否代表整个中药、是否会遗漏中药的活性成分。药物在体内产生药效作用是"机体作用药物"和"药物作用机体"两个环节的结果。作者提出, 对于复杂的中药, 其药效作用主要取决于一部分"类药属性"较好的关键成分, 而非其所含的全部化学成分[4-6]。中药成分的类药属性包括: 与中药药效关联的生物活性、安全性、药代属性、在中药中的含量、与其他成分或药物能否和谐相处。基于该假说, 作者进一步提出: 可通过开展中药多成分药代研究, 根据给药后中药成分能否被机体利用产生显著的体内暴露(以成分原形和/或代谢物形式), 选拔出用于考察药效活性的中药物质, 研究物质产生疗效的体内过程和条件, 由此为揭示决定中药疗效的物质创造条件[7-9]。这类药代研究应围绕临床有效中药而开展, 应根据中药的临床定位和可能的药效作用来判断需关注的中药成分被机体利用的方式, 研究工作应达到'精准不漏'的技术要求。除了用于发现与中药药效作用关联的中药物质外, 这类多成分药代研究还可用于揭示与中药不良反应或联合用药风险关联的中药物质[10, 11]。
1.2 从药代研究入手揭示中药的效应物质之所以要从药代研究入手, 为药效研究找出应关注的中药物质, 是因为: ①由于机体的作用, 给药后中药成分被机体利用产生体内暴露存在两个"不一定", 即: 高含量中药成分在给药后的体内暴露水平不一定也高, 给药后体内暴露显著的中药物质不一定是中药所含的成分[5, 8]。②由于多年的技术进步与整合, 中药多成分药代动力学已发展出一套可同时研究众多不同类别成分体内暴露和过程的"高载量"方法, 并能有效应对机体和中药两个复杂体系。③开展多成分药代研究找出给药后能被机体利用产生显著体内暴露的中药成分, 将使后续药效研究能够围绕有限但值得进一步研究的中药物质而开展, 使药效研究更加有效、精准、可行。中药成分绝大部分都是外源性物质, 给药后成分进入机体被利用会受到体内多种生物屏障和消除机制的影响, 机体的这些作用使许多成分在给药后难有足够的体内浓度以发挥效应。同时, 中药化学组成复杂, 不同成分含量差异很大。如果成分在中药中含量过低, 在给药后也难有足够体内浓度以发挥效应。④中药成分在体内发挥作用除了能够被机体利用(如进入体循环产生系统暴露) 外, 其体内暴露形式还需要以足够的浓度到达体内作用靶标。在研究中药成分体内暴露的基础上, 多成分药代研究还可用来寻找真正能到达体内靶标的中药物质(这些物质的药效作用值得进一步研究), 并排除那些难以到达靶标的中药物质(这些物质不需要继续研究)。
1.3 中药药代动力学是中药物质研究的一个发展中药靠其所含成分与机体的相互作用产生效应, 揭示决定效应产生的中药物质是推进中药现代化的重要一环。中药的物质研究起步于中药成分化学, 它通过分离纯化、结构鉴定、定量分析等揭示中药的化学组成, 并获得中药的成分单体。中药成分化学的发展和积累, 既为新药研发创造条件, 也为围绕复杂中药所开展的药代研究创造条件, 药代研究的开展离不开良好的中药成分化学基础。中药多成分药代动力学是中药物质研究的一个发展, 它通过研究给药后中药成分能否被机体显著利用(包括被利用的途径及主要的暴露形式等) 及暴露物质能否到达体内作用靶标等问题, 拉近中药成分与中药效应之间的距离。在此基础上, 中药物质研究的进一步发展是将药代动力学这样的物质研究与药效学、毒理学等效应研究有机结合, 以全面揭示决定中药有效性和安全性的物质, 这将使中药物质研究达到全新水平、为临床精准用药创造条件。
1.4 中药多成分药代研究的发展过程中药多成分药代动力学是分阶段发展的: 第一阶段, 重点针对中药和机体两个复杂体系给研究带来的困难, 将人体和动物实验技术(in vivo技术)、利用细胞和分子生物学的体外实验技术(in vitro技术)、高载量或高通量复杂样品分析技术、计算机预测技术(in silico技术) 及生物信息学技术等进行整合, 打通技术路线, 全面揭示给药后能产生显著暴露的中药物质及其体内过程和药代特征。利用由此创建的中药多成分药代研究方法, 填补一批中药制剂大品种的药代数据空白并支持中药新药的研发[4, 7-9, 12-18]。第二阶段, 在开展中药多成分药代研究的基础上, 进一步针对中药的药效作用、不良反应或药代性质药物相互作用的靶标, 研究给药后中药的体内主要暴露物质能否到达这些靶标及其对靶标的生物活性, 发现与中药有效性和安全性关联的物质及产生效应体内过程的关键环节, 为保证中药的有效性和安全性提供关键信息[10, 11, 19-21]。再下一阶段的工作重点是将多成分药代研究与不同的效应研究进一步结合, 全面揭示中药药效物质基础或用药风险所涉及的关键中药物质以及其中的关键影响因素, 为精准制药和精准用药提供依据。
2 中药多成分药代研究的分类及方法中药多成分药代研究可分为"偏基础"和"偏应用"两类。偏基础的中药药代研究主要是围绕某一类活性成分, 考察该类成分"类药属性"中的药代属性和特征、在体内暴露上的"两个不一定"情况、造成成分间药代差异的原因及成分化学结构与其药代特征之间的关系(简称构-代关系) 等。偏应用的中药多成分药代研究主要围绕较早批准上市的中药制剂大品种科技提升及中药新药研发而开展。
2.1 围绕一类活性中药成分开展研究: 揭示该类成分的药代特征虽然中药化学组成复杂, 但是其所含的众多成分可按母核结构归属到一个或数个成分类别, 同一类别的成分主要在取代基(包括糖基) 的位置、种类和/或数量上存在差异。通常同类成分在理化性质和生物活性方面存在关联, 按成分类别(而非按成分个体) 开展药代研究有助于更好地应对中药的化学组成复杂性。系统研究各类中药成分的药代特征十分重要, 这是因为围绕中药开展药代研究比传统的化药药代研究更为复杂、工作量巨大, 同时中药药代研究起步晚、积累少, 增加对中药各类成分药代特征的认识有利于药代动力学在中药现代化发展中的应用与推广。常见的活性中药成分类别包括: 苯丙素多酚类(包括黄酮类、香豆素类、木脂素等)、非苯丙素多酚类(包括二苯乙烯类、蒽醌类、酚酸类等)、皂苷类(包括三萜皂苷类和甾体皂苷类)、其他萜类(包括单萜类、倍半萜类、二萜类等)、强心苷类、生物碱类等。许多中药成分接有糖基, 被称为苷; 苷类化合物的主要药代特征包括: 膜通透性差、水溶性较好、对宿主代谢酶稳定性好及易被肠道菌代谢酶水解脱糖等。国际上对黄酮类化合物药代特征的研究较早开展[22-25], 近年来对皂苷类、生物碱类、酚酸类化合物药代特征的研究也有很大进步[26-35]。此外, 分析技术的突破促进了挥发性单萜类化合物的药代研究[36]。
当一类中药成分中一些成分被发现具有与中药药效相关的生物活性, 该类成分就可以被认为是一类活性成分, 同类中的其他成分因化学结构的关联可能也具有类似的活性, 而成分间在结构上的一些差异会造成它们在活性强弱上的不同。研究一类活性中药成分的药代特征, 首先需要确定在这类成分中有哪些代表性成分或重要成分, 避免在研究中遗漏这些成分。为此, 应分析和比较中药制剂与中药材之间以及不同中药制剂之间在该类成分上的异同, 以确定研究应关注的成分, 努力获取这些成分的单体化合物以支持后续实验的开展。应围绕要考察的一类中药成分提出应重点研究的药代问题, 这些问题通常包括: 该类成分给药后体内暴露的基本规律、成分之间的暴露差异、构-代关系及影响成分暴露的因素等。为了有效开展研究应将多种研究手段进行整合, 并多角度开展工作。
2.2 已上市中药制剂开展研究: 填补制剂药代数据的空白许多较早批准的中药制剂品种具有较大的临床需求和良好的临床疗效, 但由于受当时研究水平和技术条件的限制, 其功效主要依据中医的传统认识来描述, 缺乏系统深入的科学研究。随着中药现代化努力所带来的科研进步和产业发展, 以及我国新药审评标准的不断提升, 需要对那些临床确有疗效且用量大的中药制剂品种进行科技提升, 以满足时代发展的需要, 促进中药制剂品种自身的可持续发展。在这些科技提升中, 不仅需要按照严格的循证医学标准对中药制剂的有效性和安全性进行再评价[37-41], 还需要揭示决定其有效性和安全性的中药物质。围绕这类中药制剂开展多成分药代研究的目的是填补其药代数据的空白、或者获得准确系统的药代数据, 并为揭示决定制剂有效性和安全性的中药物质及相关影响因素创造必要的条件, 实际上这是一类"补课"性质的药代研究。另外, 围绕中药新药开发进行多成分药代研究, 目前已基本不存在技术困难。与促进中药制剂品种科技提升的药代研究不同, 支持中药新药研发的药代研究要分非临床和临床两个阶段来进行, 并与新药研发所涉及的其他研究紧密结合。
围绕较早批准的中药制剂品种开展多成分药代研究, 可采用"一个基础、一个中心、两个协助、三个支撑"的模式开展工作(图 1)。

|
Figure 1 An overview of approach to multi-compound pharmacokinetic investigation of a Chinese herbal medicine |
"一个基础"是指利用色谱-质谱联用技术, 并整合信息学手段和其他分析技术等, 建立一套集检测-鉴定-定量功能于一体的高载量中药制剂成分谱分析方法, 以此全面认识制剂的化学组成。成分谱分析揭示中药制剂有哪些成分可供机体利用, 是开展后续多成分药代研究的基础, 该分析确定了药代研究应关注的成分对象和范围。中药制剂各成分的剂量(由制剂的日服剂量乘以制剂中成分的含量而得) 是决定给药后成分体内暴露水平的一个因素, 根据成分剂量的高低对成分进行排序分档, 可用于指导后续药代研究。在多成分药代研究中采用"源自制剂的成分剂量"而非"在制剂中的成分含量"来表达成分在制剂中的多少, 这是因为成分剂量便于比较同一成分在不同中药制剂或不同规格的制剂中的多少。此外, 为了确定从某个生产批次获得的药代数据能用于中药制剂的其他生产批次, 需要围绕制剂的主成分(成分剂量≥ 1 μmol·L-1) 考察不同生产批次的质量波动性。
"一个中心"是指按药品说明书规定的给药剂量和途径, 开展中药制剂的人体药代试验, 采集血液、尿液和粪便样品, 以获取人体药代数据, 这是中药制剂整个药代研究的中心。中药制剂的使用对象是人, 人与动物之间的种属差异使人体药代数据成为判断制剂有效性的主要依据, 指导临床合理用药需用人体药代数据。在人体试验中采集的血液样品经抗凝和离心后可获得血浆样品, 人体血浆样品主要用于发现给药后能够进入体循环的制剂主要暴露成分, 获得其主要暴露形式、药动学特征和血浆蛋白结合等信息。尿液样品可用于补充制剂成分系统暴露信息, 又可与血浆样品一起用于获得制剂体内暴露物质的肾排泄信息; 粪便样品可提供制剂物质针对肠道菌的部分肠腔暴露信息。虽然是整个药代研究的中心, 但仅开展制剂的人体药代试验存有局限性。当缺乏中药制剂的临床耐受性数据和安全性评价数据时, 人体药代研究难以考察制剂给药剂量与其物质暴露的关系(量-暴关系); 对于口服制剂, 人体药代研究常因缺乏可用的相关静脉注射制剂, 难以获取口服制剂成分的口服生物利用度(F)、系统清除率(CLtot, p) 及表观分布体积(Vd或VSS) 等关键药代参数; 人体药代研究难以获取制剂物质的肝胆排泄、组织分布、肠中移行、化合物单体给药等的药代数据。
"两个协助"是指为进一步认识中药制剂主要暴露物质(人体药代研究发现) 的药代特征, 开展动物和体外两方面"协助性"的药代研究, 以获取人体药代研究难以获取的关键信息。在开展上述协助性药代研究补充关键信息前, 应先确定实验动物与人体在制剂暴露物质上存在的药代种属相似和差异, 动物药代实验应在种属相似的地方(化合物及其体内过程的重要环节) 进行信息补充。从获得的便利性、技术的成熟度、化合物的使用量等因素考虑, 大鼠是最常用的实验动物。考察大鼠与人体的药代种属相似性和差异, 一方面是围绕给药后制剂成分的系统暴露和肾排泄进行比较, 另一方面还要围绕相关代谢酶、转运体和血浆蛋白等利用体外实验来了解种属相似和差异。在了解种属相似和差异后, 动物药代研究主要用于获取制剂成分的量-暴关系、胃肠道吸收及影响因素、组织分布(包括血脑屏障通过等)、肝胆排泄、药代基质效应(本文后面部分对此有进一步说明)、肠腔暴露等信息。除了考察种属相似和差异外, 体外药代研究还可用于考察不同代谢酶和转运体在制剂成分的体内过程关键环节上的协同与竞争关系, 以及用于考察肠道菌作用下制剂成分的代谢及对肠道吸收的影响。此外, 中药制剂成分的膜通透性、水溶性、酸碱性、血浆蛋白结合率、全血-血浆分配比等信息可用体外实验、化学实验、计算机预测技术等获得。
"三个支撑"是指用于支持中药制剂药代研究中上述"基础-中心-协助"部分的文献挖掘、样品分析及数据分析, 这三方面支撑性工作有助于更好地应对药代研究要面对的两个复杂体系(机体和中药制剂), 提升研究效率、降低研究成本、加速研究进程。
在实验性研究开展前应首先进行文献挖掘, 以获取开展实验性工作所需的信息。为此, 首先要定义文献挖掘要获取的目标信息, 分信息检索、信息提取及信息过滤三步进行, 所获信息和数据可建库保存以便更新和应用。文献挖掘获取的信息可分为"前人相关药代研究已获得的信息"和"支持本次药代研究开展的信息"两类, 前类信息用于帮助确定本次药代研究的新发现或发现前人工作的遗漏和错误, 后类信息用于帮助本次药代研究的开展。
中药制剂药代研究的"基础-中心-协助"部分均产生需要分析的样品, 开展"样品分析"首先要建立分析方法。由于各研究部分所产生的样品性质不同、要求不同, 因此需要为整个药代研究建立多套分析方法, 这些方法可分为两类: "高载量"物质谱分析方法和"高通量"定量分析方法。开展中药多成分药代研究所用的分析技术在本文后面部分进一步说明。
得出重要的研究结果既需要对实验数据及文献数据进行处理, 还需要围绕某个具体问题进行多源数据整合与分析。中药制剂药代研究的"数据分析"主要包括: 中药制剂成分谱数据分析(根据成分剂量对制剂的各成分进行排序分档并围绕主成分进行制剂质量波动性分析)、制剂体内物质暴露谱数据分析(主要依据人体数据确定给药后体内暴露显著的制剂成分和/或代谢物)、药代种属相似和差异数据分析(首先分析给药后制剂体内物质暴露在实验动物与人体上的相似度, 再确定种属相似的制剂成分及其药代特征、种属差异明显的成分及其药代特征)、制剂主要暴露物质体内过程数据分析(通过人体、动物、体外及文献的多源数据分析, 确定影响制剂物质暴露的体内过程关键环节等)、制剂主要暴露物质药代参数分析(采用房室模型或非房室模型计算) 及生理药代动力学(physiologically based pharmacokinetics, PBPK) 建模与预测、数理统计(根据数据的分布特征采用正确的数据表达方式和统计学方法) 等。上述PBPK建模既可检验通过本次药代研究是否精准认识了制剂主要暴露物质的药代特征, 也为开展后续其他临床药代研究打下基础。
在上述多成分药代研究基础上, 后续研究可从以下两个方向来开展。其一、围绕中药制剂能产生显著体内暴露的物质, 进一步研究其能否到达药效作用、不良反应或药物相互作用的靶标及对靶标的生物活性, 向最终全面揭示决定中药制剂有效性和安全性的物质的方向发展。其二、在真实的临床用药背景下, 进一步开展患者和特殊人群的多成分药代研究, 以便精准地指导临床合理用药。中药制剂的人体药代研究通常先在健康志愿者上开展, 在保障受试者福利的条件下, 可对健康志愿者进行必要的限制, 以获取精准的制剂药代数据。之所以将患者药代研究放在健康受试者药代研究之后开展, 是因为患者所参与的研究不能干扰其接受的治疗, 患者在病理、治疗、依从性等方面尤其特殊性。此外, 从人体和动物试验中获得的样品除了用于分析制剂物质外, 还可用于分析与疾病、制剂效应关联的内源性物质。这种药代动力学与代谢组学分享样品的工作模式可进一步促进对制剂效应物质的研究[42]。
3 开展中药制剂多成分药代研究的技术要求开展中药多成分药代研究的一个重要目的是发现与中药临床效应关联的中药物质, 为揭示决定中药有效性和安全性的物质创造条件。开展这类药代研究有三个技术要求: 被研究的中药制剂应有确切的临床疗效、根据制剂的临床定位及可能的药效作用来确定应关注制剂成分以哪些方式被机体利用、精准不漏地揭示给药后制剂的体内物质暴露及主要暴露物质的药代特征。
3.1 如何定义中药制剂的有效性一个有效的中药制剂应有其明确的临床定位(如治疗某种疾病或预防疾病的不良发展等)、稳定的质量及明确的给药途径和剂量。确定中药制剂的临床有效性, 首先要根据严格的大规模临床研究结果, 中药制剂的多个临床研究的荟萃分析结果及权威治疗指南和专家共识的推荐意见也反映中药制剂的有效性。药效作用通过药理学研究来确定, 并与制剂临床疗效关联。以血必净注射液为例, 判断其治疗脓毒症的有效性是基于以下结果和信息。首先, 近期一项在710例重症肺炎(脓毒症) 患者上开展的临床研究表明, 血必净联合脓毒症标准治疗组患者的28天病死率比对照组(仅接受脓毒症标准治疗) 的降低8.7% (P < 0.01; 判断脓毒症药物治疗有效的金标准是用药后患者28天病死率降低5%以上)[41]。其次, 多项荟萃分析结果也提示, 血必净联合脓毒症标准治疗组患者的28天病死率比仅接受脓毒症标准治疗的对照组的病死率降低5%以上[43-45]。另外, 《中医药单用/联合抗生素治疗常见感染性疾病临床实践指南·脓毒症》 (中华中医药学会/2017年) 及《中国脓毒症/脓毒性休克急诊治疗指南》 (中国医师协会急诊医师分会及中国研究型医院学会休克与脓毒症专业委员会/2018年) 均推荐在脓毒症治疗中使用血必净[46, 47]; 《新型冠状病毒肺炎诊疗方案》 (中国国家卫生健康委员会及国家中医药管理局/2020年) 推荐血必净用于新冠肺炎重型(气营两燔证) 和危重型(全身炎症反应综合征或/和多脏器功能衰竭) 的治疗[48]。药理学研究表明, 血必净抗脓毒症可能涉及拮抗内毒素、抑制炎性介质、调节免疫、纠正凝血功能异常、改善微循环、保护内皮细胞及恢复器官功能等多方面的药效作用[49-56]。
3.2 如何确定应关注的机体利用制剂成分的方式中药制剂的临床定位及其可能的药效作用决定药代研究需要关注给药后制剂成分以何种方式被机体利用。成分通过被机体利用贡献于制剂疗效, 就需要给药后其在体内能够到达制剂的药效靶标(或具备到达靶标的条件), 并在靶标处达到并维持足够的浓度(或具备达到和维持足够靶标浓度的条件)。例如, 银杏叶提取物制剂临床上常被用于治疗缺血性心血管疾病和老年痴呆[57-59]。针对该临床定位, 银杏酮酯片的药代研究关注其成分被机体利用的方式包括: 进入体循环的系统暴露(针对缺血性心脑血管疾病的治疗) 和通过血脑屏障的脑暴露(针对老年痴呆的治疗)[13]。甘草酸注射制剂用于病毒性慢性肝炎患者时, 可通过保肝和抗炎作用降低慢性肝炎向肝硬化和肝癌转化的概率[60, 61]。基于该临床定位和作用, 药代研究关注甘草酸成分被机体利用的方式包括: 肝暴露(针对保肝和抗炎作用) 和系统暴露(针对在病毒性慢性肝炎治疗中的联合用药风险)[29]。
3.3 如何以精准不漏为目标开展多成分药代研究揭示中药制剂的体内物质暴露及其主要暴露物质的药代特征, 需要按"精准不漏"的要求开展工作。"精准"是指研究工作准确找出了给药后制剂的主要暴露物质并确定这些物质牵涉制剂临床效应的关键药代特征。"不漏"是指在研究结果中没有遗漏与制剂临床效应关联的制剂的重要物质。面对机体和中药制剂两个复杂体系、医学伦理的限制及技术自身的局限, 仅靠分析给药后的人体血样和尿样是不够的, 需要从以下三处着力: 其一、全面分析并了解制剂的化学组成, 后续药代研究围绕成分谱分析中检出的全部成分(而非选几个成分)来开展。其二、将人体试验、动物实验和体外实验等不同技术手段进行有效整合, 用于考察给药后制剂的体内物质暴露。其三、利用文献挖掘等信息学手段向各个实验性研究工作提供完备的信息, 以提升研究能力和效率。为了做到"精准"还有一处需要注意, 这就是中药制剂的药代基质效应(pharmacokinetic matrix effects)。不同于成分单一的化药, 中药制剂通常具有复杂的化学组成。所谓药代基质效应是指, 制剂所含的其他中药成分影响被检中药成分的体内暴露和药代特征。产生药代基质效应主要有两个原因, 其一是制剂中的其他成分通过药代性质药物相互作用来影响被测成分的暴露和药代特征, 其二是被测成分与制剂中的另一个主要成分或其他多个成分的代谢物是同一化合物。例如: 静脉给药注射用血栓通(中药三七提取物的冻干粉针剂) 后, 血栓通的成分人参皂苷Rd在人体内的消除半衰期(t1/2: 58~307 h) 明显长于静脉给药人参皂苷Rd注射液后的人体半衰期(约18 h)[10, 62]。该药代基质效应产生的原因是, 血栓通所含的另一个主要成分人参皂苷Rb1能在肝脏葡萄糖苷水解酶作用下脱糖水解生成人参皂苷Rd[10, 20]。发现中药制剂对其主要暴露物质是否存在药代基质效应, 通常是在相同给药途径及相同或相近剂量下, 分别给药中药制剂与单体化合物制剂以比较被测化合物的药代参数。选择单体化合物(而非单味中药材提取物) 作为对照, 是因为单味中药材提取物也很复杂, 其质量受诸多生药学因素的影响。由于单体化合物的药代数据比单味中药材提取物的药代数据重复性好, 因此研究药代基质效应通常给药单体化合物作为对照。
4 开展中药多成分药代研究的分析方法虽然仅靠分析中药制剂给药后的人体血样和尿样, 不易做到"精准不漏"地揭示给药后制剂的体内物质暴露及药代特征, 但是样品分析是支撑多成分药代研究的一类关键技术。分析技术的发展和分析方法的建立要紧紧围绕药代研究的需求, 采用"一个核心五个基本要素"的工作模式, 即整个样品分析以获取精准丰富的信息为核心, 以分析前的文献挖掘、重要样品的获得、关键被测化合物的确定、分析方法的优化和可靠性检验、以及数据的分析为基本要素。此外, 分析工作的可靠和有效也有赖于人员培训与规范化实验室管理等。由于整个药代研究会产生各种各样数量不同的样品, 因此要根据研究中的不同需求建立针对众多被测化合物的"高载量"或针对大量样品的"高通量"分析方法。在中药多成分药代研究中所用的分析方法, 大多是基于液相色谱-质谱联用(液-质联用) 技术而建立, 液-质联用技术具有特异性强、灵敏度高的特点, 可根据需要用于发展高载量或高通量的分析方法。在药代研究中的分析方法主要有4类, 即: 中药制剂成分谱分析方法(高载量方法)、中药制剂体内物质谱分析方法(高载量方法)、生物样品中制剂化合物定量分析方法(高通量方法) 及工具化合物定量分析方法(高通量方法)。此外, 对于新发现的中药代谢物的结构解析, 还需要进行核磁共振谱分析。对于挥发性中药成分及其体内暴露物质需用气相色谱-质谱联用(气-质联用) 技术进行分析, 并需采用特殊方法以保护被测化合物在样品前处理时免受损失[36]。
4.1 中药制剂成分谱分析该类分析揭示中药制剂的化学组成, 是开展多成分药代研究的基础。在成分谱分析中要对制剂的各类成分进行检测、鉴定和定量, 分析方法应具有高载量性以胜任对中药制剂众多成分的分析[9-11, 14-18, 20]。强调方法的高载量性是为了避免在分析中遗漏制剂的重要成分(含量高和/或有活性), 为此分析方法应采用具有高载量性的样品提取、色谱分离和质谱检测技术, 并使上述三个步骤在载量性上协调一致。制剂各组成中药的成分化学基础对于开展成分谱分析十分重要, 可通过文献挖掘全面获取学界已有的中药成分信息(重点是成分的化学名称、分子式、分子量、化学结构和分析信息), 并为开展分析构建中药成分目录或成分数据库, 成分谱分析中的成分检测主要依靠这个成分目录。此外, 还可利用同类中药成分共有的离子化和/或打碎规律[63-65]、质量亏损过滤技术[66, 67]及背景扣除技术[68]来检测"成分目录"外的制剂成分, 这些技术的应用有利于扩大检测中药制剂成分的视野。新技术是否成功应用于中药制剂成分谱分析, 要看其能否发现现有技术难以发现或容易遗漏的与制剂疗效或用药风险关联的重要成分。对于复方中药制剂, 还应明确其检出的成分是来自复方的一味中药还是多味中药。要利用各种途径获得上述成分目录中所列中药成分的对照品(用于制剂成分的鉴定和定量)。中药成分化学基础的好坏不仅体现在知道中药含有多少种成分, 也体现在其中有成分可获得对照品。对于有对照品的成分, 成分谱分析中的"鉴定"是基于其与对照品的液-质联用分析数据比对, 包括色谱的保留时间及质谱的母离子质荷比和特征性子离子质荷比等。"定量"则基于用对照品制作的标准曲线。当重要成分难以获得对照品时, 可采用中药成分化学手段从相应中药材中分离制备单体化合物, 并用核磁共振谱技术确定结构, 来获得所需的成分对照品。制剂中检测到的其他成分可通过与文献报道的成分液-质联用数据做比对进行鉴定, 并借助结构相似化合物的标准曲线进行虚拟定量。制剂的检出成分可根据各自的成分剂量进行排序分档, 成分剂量≥ 1 μmol·d-1的成分为制剂的主成分(一般在制剂给药后能产生可检测的系统暴露)、0.01~1 μmol·d-1的成分为制剂的次要成分(制剂给药后较难产生可检测的系统暴露)、< 0.01 μmol·d-1的成分不在后续药代研究中被关注(制剂给药后一般不产生可测的系统暴露)。
4.2 中药制剂体内物质谱分析该类分析针对的主要是中药制剂给药后的人体样品和动物样品, 要检测的化合物是给药后在这些样品中出现的制剂成分的原形化合物和代谢物。制剂体内物质谱分析以前面的"制剂成分谱分析"为基础, 体内物质谱分析方法应能对样品的中药化合物进行检测、鉴定和定量, 分析方法需要具有高载量性。对于制剂成分原形化合物的分析, 首先是看在之前成分谱分析中检出的制剂成分能否在给药后产生可检测的体内暴露。可将前面成分谱分析过的制剂样品作为对照品, 用于对检出的体内暴露成分进行鉴定。对体内暴露成分的定量与成分谱分析中的定量相似, 但需尽量降低复杂生物样品中基质成分对被测化合物电喷雾离子化(ESI) 的影响(基质效应)。对于制剂代谢物的分析, 首先是围绕制剂主成分检测其在人体和动物样品中出现的代谢物, 代谢物的检测主要基于不同类型代谢物与其原形化合物在分子量上的固定差值[69, 70], 以及某些代谢物的特征性碎片离子和/或中性丢失(例如硫酸结合物在ESI正/负离子模式下的79.956 8 Da中性丢失、葡萄糖醛酸结合物在ESI正/负离子模式下的176.032 1 Da中性丢失、谷胱甘肽结合物在ESI正离子模式下的129.042 6 Da中性丢失和在ESI负离子模式下的m/z 272.088 3特征性碎片离子等[71]) 来完成。另外, 一些药物代谢预测软件可用来帮助预测制剂成分在体内可能发生的代谢转化[72-74]。制剂代谢物的鉴定包括化学分析和生化鉴定: 代谢物的化学分析可利用能获得的代谢物对照品与样品中的代谢物做液-质联用分析比对。当制剂重要的代谢物的对照品难以获得时, 可以用化学合成、生物合成或尿样提取等手段制备代谢物单体, 再对其进行核磁共振谱分析, 从而获得所需的代谢物对照品。代谢物的生化鉴定是利用体外代谢反应(其要素包括: 底物、代谢酶、辅酶及代谢物等) 来确定制剂成分在体内发生的代谢转化。代谢物在人体和动物样品中的定量首选代谢物对照品来制作标准曲线, 也可利用体外代谢反应定量生成代谢物来制作标准曲线, 还可利用结构相近化合物的标准曲线进行虚拟定量。
4.3 生物样品中中药制剂化合物的定量分析当通过体内物质谱分析找出中药制剂体内主要暴露物质后, 为了进一步研究这些制剂物质的体内过程并获取相关药代参数, 需要建立定量分析方法, 以检测化合物在人体、动物、体外实验样品中的浓度。由于上述实验产生的样品数量大, 因此定量分析方法应具有"高通量性"。为此, 样品前处理应尽量去掉不必要的环节, 使大批量的样品能平行处理; 被测化合物之间的分离应首选质谱分离, 只有当质谱分离难以实现时才利用色谱分离(较耗时间), 要努力克服ESI源质谱在检测时遇到的样品基质效应。为了进一步提高分析效率, 除了提高分析方法的通量性外, 还需要能快速建立分析方法。为此可利用低浓度电解质效应(low-concentration electrolyte effects) 联合脉冲梯度洗脱技术(pulse gradient elution)来快速为不同化合物建立定量分析方法[75‒78]。在上述采用液-质联用技术的分析方法中, 当使用内标化合物时应注意其与被测化合物在样品提取、色谱分离和质谱检测方面的一致性。面对复杂生物样品时, 被测化合物和内标物在ESI源上受到的基质效应应一致或接近; 虽然稳定同位素内标物能很好地解决这个问题[79, 80], 但是在多成分分析中为所被测化合物制备稳定同位素内标物会大大提高研究成本、延长工作周期, 因此不太可行。在定量分析中采用不加内标物的外标法可有效提高建方法的效率, 为保证外标法的可靠性, 应提高人员培训水平和实验室管理水平、努力降低基质效应对分析的干扰、采用基质匹配的标准曲线、提高实验操作自动化水平等。为保证药代研究数据的准确可靠, 定量分析时采用被测化合物各自的对照品来制作标准曲线, 分析方法应用前要对其浓度线性范围、准确性、精密度、检测灵敏度、稳定性、基质效应、被测化合物相互干扰、被测化合物在分析中的残留等进行系统的检验。
4.4 工具化合物定量分析该类分析主要检测体外代谢和体外转运实验样品中阳性底物及其代谢物等的浓度, 其分析方法作为研究工具, 一般采用优化后的固定条件。可与体外药代实验方法合在一起, 制定相应的标准操作规范, 从而为药代研究的开展提供有力支持。
5 三七中皂苷类成分的药代特征皂苷类成分是五加科(Araliaceae) 中药三七[Panax notoginseng (Burk.) F. H. Chen的干燥根] 中的一类三萜皂苷成分, 根据其苷元结构的不同可分为二醇型人参皂苷成分和三醇型人参皂苷成分。二醇型皂苷成分的苷元为20(S)-原人参二醇, 三醇型皂苷成分的苷元为20(S)-原人参三醇。中医认为三七具有化瘀止血、活血定痛的功效; 三七常用于制备防治缺血性心血管疾病的中药制剂。据报道三七所含的皂苷类成分具有减缓心肌缺血再灌注损伤、血管舒张、抗炎和抗氧化等活性[81-83], 因此该类成分被认为是三七的一类活性成分。除存在于三七外, 上述人参皂苷类成分也存在于五加科中药人参(P. ginseng C.A. Meyer的干燥根, 其蒸制品为红参) 和西洋参(P. quinquefolius L.的干燥根)。三七所含的这类成分与人参和西洋参所含的在成分个体和含量上均存在一定的差异。前期我们主要围绕三七的皂苷类成分开展研究, 以了解该类成分药代动力学特征[7, 8, 10, 18, 20, 26, 28], 这些研究也为认识其他类皂苷成分的药代特征提供参考。三七、人参及西洋参的良好中药成分化学基础[84-86], 为研究人参皂苷类成分的药代特征提供了有利条件。
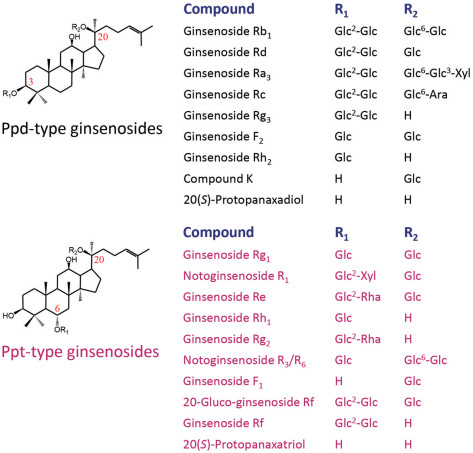
5.1 三七的主要皂苷成分基于对三七药材、复方丹参滴丸(由丹参、三七、冰片组方制备而成)、复方丹参片(由丹参、三七、冰片组方制备而成)、注射用血栓通(三七提取物冻干粉针) 的分析, 三七及其制剂的主要皂苷成分有: 二醇型的人参皂苷Rb1和人参皂苷Rd及三醇型的人参皂苷Rg1、三七皂苷R1和人参皂苷Re。此外, 三七及其制剂还有其他一些低含量的二醇型和三醇型皂苷成分, 20(S)-原人参二醇和20(S)-原人参三醇在三七及其制剂中含量极低(图 2)。
|
Figure 2 Chemical structures of ginsenosides and their aglycones of Sanqi (Panax notoginseng roots) |
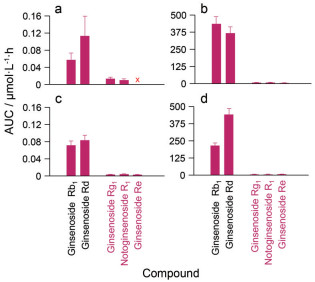
三七提取物口服给药后, 以原形化合物形式进入体循环产生较显著系统暴露的是几个主要的二醇型(人参皂苷Rb1和人参皂苷Rd) 及三醇型皂苷成分(人参皂苷Rg1、三七皂苷R1和人参皂苷Re), 但是二醇型成分的系统暴露水平(血浆中药物浓度-时间曲线下面积/血浆AUC) 明显高于三醇型成分的AUC (成分剂量校正后的比较; 图 3), 且二醇型成分的半衰期t1/2 (人, 41.9~122.8 h; 大鼠, 17.5~31.8 h) 明显长于三醇型成分的t1/2 (人, 1.2~1.4 h; 大鼠, 0.2~0.4 h)。影响血浆AUC的因素有药物的"进入机体" (口服或灌胃给药后, 成分从胃肠道吸收、经肝肠首过、进入体循环)、"组织分布" (从体循环到机体各组织)及"体内消除" (从体循环中消除) 三个方面。这些二醇型和三醇型成分的原形化合物的口服生物利用度(F) 均很低, 分别为0.01%~0.03%和0.18%~0.30% (人); 0.09%~0.18%和0.17%~0.48% (大鼠)。三七提取物静脉注射给药后, 上述二醇型皂苷成分(原形化合物) 的血浆AUC也明显高于三醇型皂苷成分的AUC (成分剂量校正后的比较; 图 3)。在大鼠上将单个不同的人参皂苷类化合物静脉注射给药后, 二醇型成分(原形化合物) 的总清除率(CLtot, p, 8.1~19.9 mL·h-1·kg-1) 明显小于三醇型成分的CLtot, p (686~2 582 mL·h-1·kg-1), 但是两型成分在稳态表观分布体积(VSS, 二醇型成分, 220~256 mL·kg-1; 三醇型成分, 224~552 mL·kg-1) 上的差异相对较小。在人体上静脉滴注血栓通后, 三七的两型主要皂苷成分在CLtot, p (二醇型成分, 1.5~2.2 mL·h-1·kg-1; 三醇型成分, 194.9~253.6 mL·h-1·kg-1) 和VSS (二醇型成分, 90~152 mL·kg-1; 三醇型成分, 295~332 mL·kg-1) 上也呈现出与大鼠类似的情况。以上实验结果说明, 给药后三七两型皂苷成分(原形化合物) 在系统暴露水平上显著差异主要在"体内消除"这一环节, 而非在"进入机体"或"组织分布"两个环节。两型成分在t1/2上的差异也主要由在CLtot, p上的差异引起, 受VSS的影响较小。二醇型成分的长t1/2可使其在连续给药时产生蓄积, 进而加大两型成分在AUC上的差异。上述三七皂苷类成分在系统暴露水平上的差异提示, 除了通常关注较多的口服生物利用度外, 消除动力学特征也可以是造成中药成分间暴露差异的因素。
|
Figure 3 Systemic exposure to ginsenoside Rb1, ginsenoside Rd, ginsenoside Rg1, notoginsenoside R1 and ginsenoside Re in humans receiving a po dose of Sanqi extract[8] (panel a) or an iv dose of XueShuanTong[10] (panel b) and in rats receiving a po dose of Sanqi extract[7] (panel c) or an iv dose of XueShuanTong[10] (panel d). The AUC values of the Sanqi saponins were corrected by the compound dose to 1 μmol·kg-1 for (A and B) and to 6 μmol·kg-1 for (C and D) |
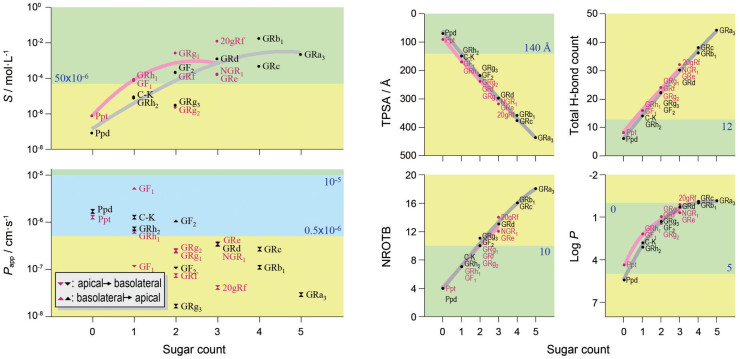
造成三七两型皂苷成分口服生物利用度低的主要原因在于肠道吸收。药物的肠道吸收主要受药物分子的膜通透性、酸碱性(在一定的pH条件下离子化)、水溶性及肠上皮细胞转运体的影响。和其他皂苷类化合物一样, 三七的皂苷类成分也是两性化合物, 其分子中包含亲脂性的苷元和亲水性的糖元。总结三七皂苷类成分在肠道吸收方面的构-代关系后发现: 皂苷类成分分子中的接糖数目是决定其膜通透性和水溶性的因素。不论是二醇型还是三醇型皂苷成分, 接糖数量越多水溶性越好, 膜通透性变差; 这些成分的跨膜转运不受肠转运体影响。随着接糖数目的减少, 膜通透性虽然可改善, 但水溶性变差, 在这种情况下成分的肠道吸收难有大幅度改善(图 4); 三七及其制剂的众多低含量皂苷成分属于这种情况。
|
Figure 4 Relationship between sugar substitution in ginsenosides and their PK properties that limit intestinal absorption. Ginsenoside F1 and ginsenoside F2 exhibited efflux ratios greater than 8 in Caco-2 monolayers. GR: Ginsenoside R; 20gRf: 20-Gluco-ginsenoside Rf; Ppd: 20(S)-Protopanaxadiol; Ppt: 20(S)-Protopanaxatriol; NROTB: Number of rotatable bonds. (Reprinted from Liu et al., 2009[7] with permission of ASPET) |
三七两型皂苷成分在消除动力学特征上的差异, 是由于三醇型皂苷成分的肝胆排泄速率和肾排泄速率均明显快于二醇型成分的相应速率。三醇型的人参皂苷Rg1、三七皂苷R1和人参皂苷Re在肝胆排泄过程中, 多个肝转运体的参与有效克服了该化合物膜通透性差的影响, 这些转运体包括: 人OATP1B3/大鼠Oatp1b2负责将三醇型皂苷成分从血中摄入肝细胞, 人MRP2/BCRP/BSEP/MRP1/大鼠Mrp2/Bcrp/Bsep负责将这些成分从肝细胞外排到胆汁。与三醇型皂苷成分不同, 膜通透性也差的二醇型人参皂苷Rb1和人参皂苷Rd却不是这些肝转运体的底物, 因此这些二醇型皂苷成分的肝胆排泄很慢。上述三七的两型皂苷成分均主要基于肾小球过滤进行肾排泄, 在血浆蛋白结合率上的巨大差异使三醇型成分的肾排泄远快于二醇型成分的排泄。三醇型皂苷成分的血浆游离分数(fu) 为94.8%~98.5% (人) 和83.4%~93.4% (大鼠), 二醇型皂苷成分的fu值很小: 1.2%~1.7% (人) 和0.59%~0.62% (大鼠)。虽然三七皂苷成分在体内能发生一些脱糖水解代谢和氧化代谢, 但是这些代谢反应对CLtot, p的贡献有限。需要指出的是, 虽然不是OATP1B3的底物, 但是二醇型皂苷成分对该转运体的亲和性远高于三醇型皂苷成分。二醇型人参皂苷Rb1和人参皂苷Rd对人OATP1B3展现较强的抑制活性, 使静脉给药的血栓通有可能作为"产生影响的药物"引发药物相互作用。进一步的"构-代关系"研究表明: 在众多人参皂苷类成分中, 当苷元为20(S)-原人参二醇或在C-20位上未接糖基时, 皂苷成分对人OATP1B3的抑制活性变强。
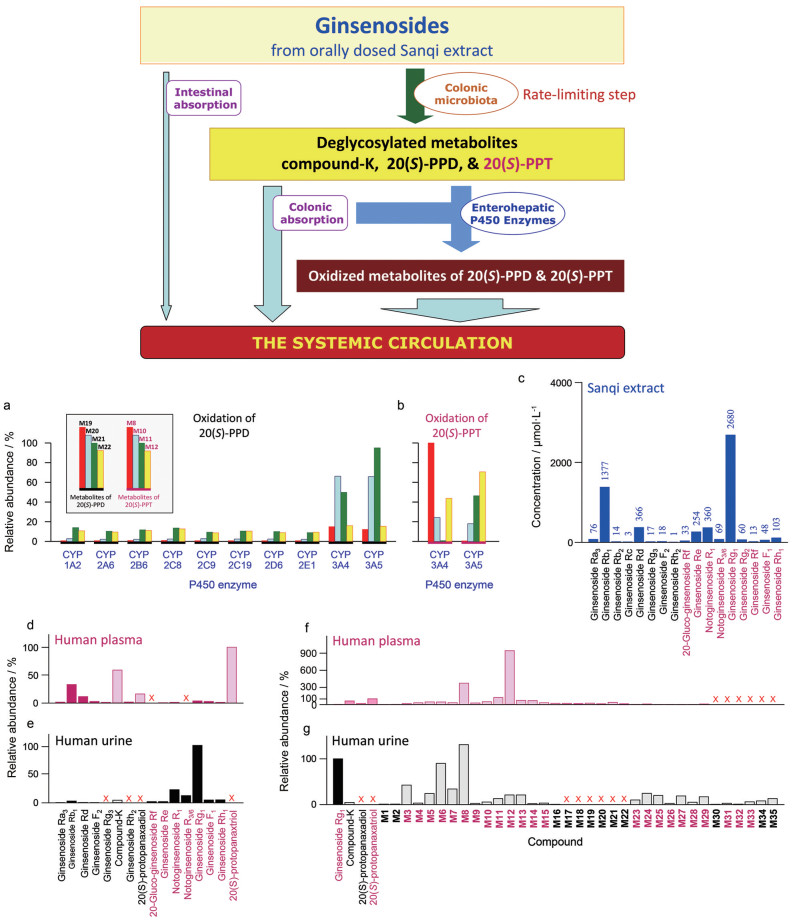
5.5 给药途径对三七皂苷成分系统暴露的影响除了受皂苷成分间消除动力学特征差异的影响外, "给药途径"对三七皂苷成分的系统暴露也具有很大的影响。虽然口服给药后两型皂苷成分的肠道吸收均很差, 但在人体肠道菌作用下, 二醇型皂苷成分可脱糖水解生成较易吸收的化合物-K和苷元20(S)-原人参二醇, 三醇型皂苷成分可脱糖水解生成较易吸收的苷元20(S)-原人参三醇。上述两个苷元代谢物吸收后可进一步在宿主肠肝P450酶作用下发生氧化代谢, 所生成的代谢物是口服后三七皂苷成分进入体循环的主要暴露形式, 尤其是三醇型成分的这类氧化代谢物的血浆AUC值能比人参皂苷Rg1 (系统暴露水平最高的三醇型皂苷成分) 的高出200多倍(图 5)。虽然上述各类代谢物的系统暴露水平比原形成分的高, 但代谢物的血浆AUC存在很大的个体间差异, 且代谢物的AUC并不随三七提取物口服剂量变化而变化(即代谢物的量-暴随动性差)。进一步观察发现, 在上述两步代谢中脱糖水解代谢是限速步骤, 决定后一步氧化代谢的快慢; 表现在不论是不同剂量水平下的单次给药或是连续多次给药, 20(S)-原人参二醇和20(S)-原人参三醇分别与二醇型的各个氧化代谢物和三醇型的各个氧化代谢物在AUC上呈现良好的正相关(P < 0.05)。因此, 20(S)-原人参二醇和20(S)-原人参三醇可作为药代标识物(pharmacokinetic markers), 分别用于表征在二醇型和三醇型氧化代谢物在系统暴露水平上出现的个体差异及不同给药剂量下的变化。上述由肠道菌介导的脱糖水解代谢存在明显的种属差异, 人体肠道菌的代谢能力明显强于大鼠的肠道菌。
|
Figure 5 Metabolism of ginsenosides in humans orally receiving Sanqi extract. Panels a and b, human P450-mediated oxidation of 20(S)-protopanaxadiol and 20(S)-protopanaxatriol, respectively; panel c, ginsenosides present in the dosed Sanqi extract; panels d-g, circulating ginsenosides, unchanged and metabolized, which were detected in plasma and urine samples of humans who orally received the Sanqi extract. (Reprinted from Hu et al., 2013[8] with permission of ASPET) |
不同于三七口服给药(皂苷成分在体循环中以代谢物暴露为主), 静脉滴注注射用血栓通(三七提取物冻干粉针) 后皂苷成分在体循环中以原形化合物暴露为主, 难以在给药后的血浆样品中检测到20(S)-原人参二醇或其氧化代谢物, 仅能检测到很少量的20(S)-原人参三醇及其氧化代谢物。不同给药途径造成皂苷成分的系统暴露出现差异, 提示在研究三七的心血管药效作用时应充分重视这种物质差异, 不同给药途径的三七制剂在临床定位上可能存在差异。在注射用血栓通的说明书中, 除"静脉滴注"外还标有"肌肉注射"。面对口服给药很差的肠道吸收及静脉给药的一些用药风险, 肌肉注射提供了一个可供选择的用药途径, 肌肉注射给药可使两型三七皂苷主成分获得几乎100%的肌注生物利用度; 在体循环中皂苷成分的主要暴露形式为其原形化合物, 仅可测到少量20(S)-原人参三醇及其氧化代谢物。肌肉注射给药后成分的这些系统暴露特点与静脉注射给药的情况相似。
6 研究[11]实例: 连花清瘟胶囊中甘草的多成分药代研究及能引起甘草假醛固酮增多症的物质发现 6.1 连花清瘟胶囊连花清瘟胶囊由(石家庄以岭药业股份有限公司生产; 国药准字Z20040063) 由连翘、金银花、炙麻黄、炒苦杏仁、石膏、板蓝根、绵马贯众、鱼腥草、广藿香、大黄、红景天、薄荷脑、甘草组方制备而成, 具有清瘟解毒、宣肺泄热的功效, 主要用于治疗"热毒袭肺证"型流行性感冒。在国家卫生健康委员会和国家中医药管理局2020年颁布的《新型冠状病毒肺炎诊疗方案》中, 连花清瘟胶囊被推荐用于医学观察期出现乏力伴发热的患者[48]。在国家药品监督管理局2020年颁布的《药品补充申请批件》 (2020B02813) 中, 连花清瘟胶囊被批准用于治疗轻型和普通型新冠肺炎引起的发热、咳嗽和乏力。此外, 连花清瘟胶囊还曾被推荐用于治疗其他病毒感染引起的急性呼吸综合征, 包括2003年的严重急性呼吸综合征(SARS)、2009年的H1N1猪流感、2013年的中东呼吸综合征和H7N9禽流感[87, 88]。
6.2 研究目的开展连花清瘟胶囊多成分药代研究是为了揭示胶囊给药后能被机体利用产生显著体内暴露的胶囊成分及其主要暴露形式的药代特征和体内过程的关键环节, 与药效研究结合揭示胶囊的药效物质基础, 保障临床安全有效用药。针对连花清瘟胶囊的临床定位及其可能的药效作用, 以进入体循环的系统暴露(针对抗病毒、激动β2受体等作用) 和接触肠道微生物的肠腔暴露(针对提升免疫力、预防二次感染等作用) 作为考察给药后胶囊成分能否被机体利用的主要方式。围绕甘草成分所开展的研究是作者进行的一系列连花清瘟胶囊多成分药代研究之一, 考察口服胶囊后系统暴露或肠腔暴露显著的甘草物质[11]。这部分多成分药代研究将与围绕其他组成中药的多成分药代研究一起, 为药效研究指明应重点关注的连花清瘟胶囊物质, 使胶囊的药效物质研究达到全新的技术水平。假醛固酮增多症: 症见高血压、外周水肿、低血钾; 其作用机制是肾中11β-HSD2 (11β-hydroxysteroid dehydrogenase type 2) 酶被抑制后, 内源性氢化可的松的失活(转化成可的松) 受到干扰[89, 90]。由于假醛固酮增多症是连花清瘟胶囊中甘草的专有不良反应, 进一步研究能引起假醛固酮增多症的甘草物质, 对于指导连花清瘟胶囊的安全用药、提升胶囊安全用药的技术水平具有积极意义。
6.3 研究方案本项研究围绕系统暴露和肠腔暴露, 揭示给药后源自甘草且暴露显著的连花清瘟胶囊物质, 并考察能引起假醛固酮增多症的甘草物质, 研究流程见图 6。为了避免在研究中遗漏重要的甘草物质, 首先通过文献挖掘获取开展各项实验研究所需的信息。在开展成分谱分析以全面了解胶囊所含甘草成分的基础上, 让人体受试者按说明书规定的剂量口服连花清瘟胶囊, 采集其血液、尿液及粪便样品。利用液-质联用技术及核磁共振谱技术分析人体血样和尿样中的甘草成分及代谢物, 考察给药后甘草成分的系统暴露, 并通过体外代谢实验进一步验证体内测出的甘草代谢物。为了研究体内甘草物质的肠腔暴露(特别是在结肠的肠腔暴露), 分析给药前后的人体粪样, 并开展厌氧条件下的体外代谢实验, 以考察难吸收甘草成分在肠道微生物作用下的代谢转化。根据给药后系统暴露是否显著、能否在体内接触到肾11β-HSD2及对该酶的抑制活性, 来判断给药后的体内甘草物质是否具备引发假醛固酮增多症的条件。11β-HSD2酶位于肾脏远曲小管和集合管的上皮细胞中, 对此体循环中的甘草物质可在肾排泄时, 通过在远曲小管和集合管的被动重吸收来到达靶标。通过检测肾清除率比值(考察肾排泄时是否存在肾小管重吸收)、血浆蛋白结合率(与肾排泄的肾小球滤过有关)、膜通透性(与肾小管被动重吸收有关)、肾转运体的影响(与肾小管主动分泌有关)等来考察体内甘草物质针对11β-HSD2的靶标到达。采用人肾微粒体考察这些甘草物质对11β-HSD2的抑制活性。为了深入认识体循环中甘草物质的药代特征, 在了解大鼠与人体在甘草药代上的种属相似和差异基础上, 开展多个大鼠药代实验以进一步考察影响甘草物质体内暴露的因素(包括量-暴关系和药代基质效应)、给药后甘草物质的肺暴露、针对11β-HSD2的靶标到达、肠腔暴露等。
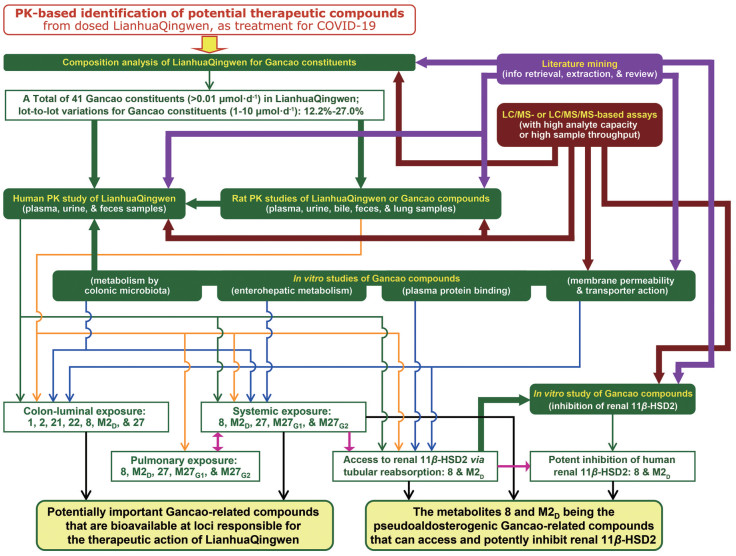
|
Figure 6 An overview of approach to pharmacokinetics-based identification of potential therapeutic compounds from LianhuaQingwen, a Chinese herbal used as treatment for COVID-19. The current investigation focused on constituents originating from the component Gancao. PK, pharmacokinetics or pharmacokinetic. (Reprinted from Lan et al., 2021[11] with permission of APS) |
在连花清瘟胶囊中共检测鉴定出41种甘草成分(成分剂量: 0.01~8.56 μmol·d-1), 其中有皂苷类成分8种(1~8)、黄酮类成分31种(21~51)、香豆素类成分2种(71和72) (图 7)。然而, 连花清瘟胶囊给药后在体循环中暴露显著的甘草物质主要是几个代谢物, 包括甘草次酸(8)、24-羟基甘草次酸(M2D)、甘草素(27)、甘草素葡萄醛酸结合物(M27G1和M27G2); 这些代谢物的甘草原形成分的系统暴露水平很低。甘草皂苷成分甘草酸(1) 和甘草皂苷G2 (2) 的体内代谢途径见图 8, 更多甘草成分的代谢数据见文献[11]。同时, 这些甘草代谢物能随体循环在肺组织中产生显著的暴露。药代研究提示连花清瘟胶囊所含甘草成分与胶囊给药后在体循环中出现的甘草物质有明显差异, 该药代研究结果为连花清瘟胶囊的后续药效研究指明了应关注的甘草物质。胶囊给药后影响甘草成分肠腔(结肠) 暴露的因素包括: 成分的胃肠吸收及由肠道微生物介导的代谢等。虽然1、2、甘草苷(21)、芹糖甘草苷(22) 等成分的胃肠吸收差, 但是由肠道微生物介导的脱糖水解代谢显著缩短了这些甘草成分在大肠的暴露时间, 其脱糖代谢物8、M2D和27是主要的甘草大肠暴露物质, 8和M2D (均为生物药剂学系统/BPS分类Ⅱ) 的肠腔暴露时间比27 (BPS分类Ⅰ) 的长。
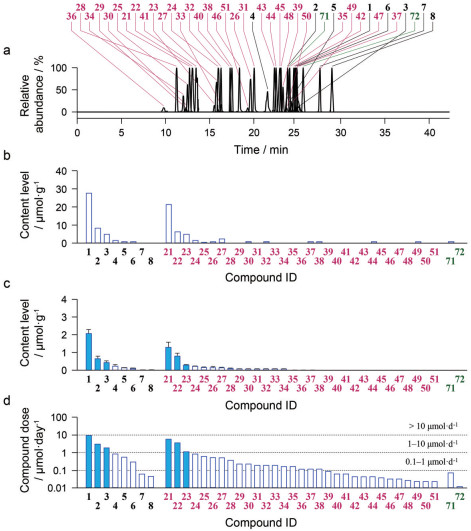
|
Figure 7 Gancao constituents detected in LianhuaQingwen. Panel a, stacked liquid chromatograms of Gancao saponins (1-8), flavonoids (21-51), and coumarins (71 and 72), detected by mass spectrometry, in a typical sample of LianhuaQingwen; panel b, constituents detected in a sample of raw material of Gancao (Glycyrrhiza uralensis roots), obtained from Yiling Pharmaceutical; panel c, mean content levels of Gancao constituents detected in samples of 29 lots of LianhuaQingwen; panel d, daily doses of the Gancao constituents from the lot A1802055 of LianhuaQingwen at the label daily dose 4.2 g·d-1. 1: Glycyrrhizin; 2: Licorice saponin G2; 21: Liquiritin; 22: Liquiritin apioside. The names of the other Gancao compounds are shown in Reference [11]. (Reprinted from Lan et al., 2021[11] with permission of APS) |

|
Figure 8 Proposed metabolic pathways of glycyrrhizin (1) and licorice saponin G2 (2) in humans orally receiving LianhuaQingwen and disposition of the metabolites. CM-G: Glycosidase of colonic microbiota; H-G: Hepatic glycosidase; P450: Cytochrome P450 enzyme; UGT: Uridine 5'-diphosphoglucuronosyltransferase; SULT: Sulfotransferase; NADP: β-Nicotinamide adenine dinucleotide phosphate; NADPH: Reduced β-nicotinamide adenine dinucleotiden phosphate; UDP: Uridine 5'-diphosphate; UDPGA: Uridine 5'-diphosphoglucuronic acid; PAP: 3'-Phosphoadenosine-5'-phosphate; PAPS: 3'-Phosphoadenosine-5'-phosphosulphate; Glu: Glucuronosyl. (Reprinted from Lan et al., 2021[11] with permission of APS) |
甘草引起的假醛固酮增多症一般被认为与甘草酸及其代谢物有关[90], 虽然有不少学者对此开展了研究, 但是一直没能确定在体内具体是哪些甘草物质起作用[91-98]。化合物能否引起假醛固酮增多症要看三点: 进入体循环的系统暴露、针对11β-HSD2的靶标达到、对11β-HSD2的抑制活性。这些条件可用来寻找给药后能引起上述不良反应的体内甘草物质。在系统暴露上, 甘草酸(1) 因难以从肠道吸收, 口服给药后其暴露水平很低。如图 8所示, 甘草次酸(8) 是1在肠道微生物作用下脱糖水解产生的较易吸收的代谢物, 也是口服给药后1在体循环中的主要暴露形式。8吸收后可进一步被代谢成葡萄糖醛酸结合物和硫酸结合物等, 这些首过代谢主要是帮助8随胆汁清除, 8的这些代谢物在体循环中的暴露水平很低。引起假醛固酮增多症的靶标11β-HSD2位于肾脏远曲小管和集合管的上皮细胞中, 体循环中的8可通过肾排泄到达靶标11β-HSD2。8的肾排泄主要基于肾小球过滤, 而肾小管主动分泌的作用可忽略。由于8具有良好的膜通透性, 同时肾小管中水分被大量重吸收和尿液流速显著变缓, 因此8的肾排泄在远曲小管和集合管还涉及肾小管被动重吸收, 该重吸收使8得以到达11β-HSD2靶标。8的上述代谢物不仅很少进体循环而且膜通透性差(难以在肾小管被动重吸收), 这两点均使这些代谢物难以到达11β-HSD2靶标。对于抑制11β-HSD2, 8的活性比其母药成分及代谢物的都强。由于系统开展了连花清瘟胶囊的甘草成分谱分析, 除1外我们还发现甘草皂苷G2 (2)。2在体内能发生与1相似的药代故事, 其脱糖水解代谢物24-羟基甘草次酸(M2D) 也有显著的系统暴露, 也能到达11β-HSD2靶标、并对11β-HSD2有强抑制活性, 因此M2D (和8一样) 也是引起甘草假醛固酮增多症的关键物质, 将8和M2D合在一起有利于精准地评估该不良反应的风险。此外, 甘草黄酮类成分及其代谢物对11β-HSD2的抑制活性很弱, 因此不是引起假醛固酮增多症的物质。总之, 1和2是两个引发假醛固酮增多症的甘草成分, 它们在体内通过代谢激活分别变成8和M2D; 虽然8和M2D不是甘草在体内生成的唯一具有抑制11β-HSD2活性的代谢物, 但是它们是唯一能够到达靶标产生抑制作用的甘草代谢物(图 9)。有一点需要指出, 限制甘草引起假醛固酮增多症的一个关键因素是8和M2D在体循环中与白蛋白高水平结合(~99%), 这对于服用甘草在大多是情况下不产生该不良反应十分重要。
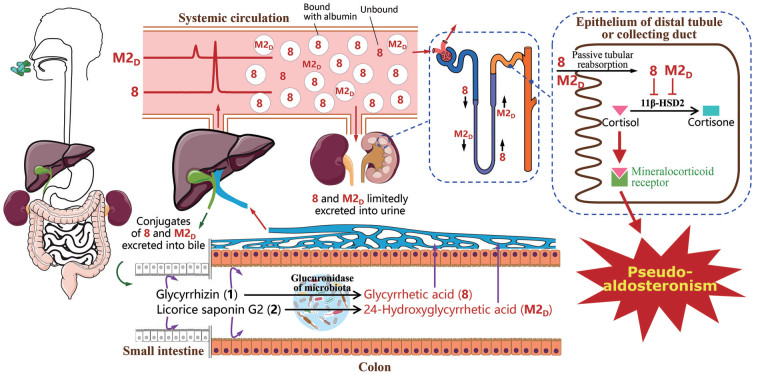
|
Figure 9 Schematic overview of pharmacokinetics-based identification of pseudoaldosterogenic compounds glycyrrhetic acid (8) and 24-hydroxyglycyrrhetic acid (M2D). The Gancao constituents glycyrrhizin (1) and licorice saponin G2 (2) are metabolically activated by glucuronidase of the colonic microbiota to the pseudoaldosterogenic metabolites 8 and M2D, respectively, which can access (via passive tubular reabsorption) and inhibit renal 11β-HSD2. The finding has implications for precisely defining conditions for safe use of LianhuaQingwen. (Reprinted from Lan et al., 2021[11] with permission of APS) |
药物出现不良反应的原因包括"用错了药"和"用错了人"。本研究有助于人们在服用连花清瘟胶囊时, 规避甘草假醛固酮增多症的风险。对此, 应扩大人们对甘草假醛固酮增多症的知晓度, 按用药说明书的规定服药。在服用连花清瘟胶囊时, 应注意人们是否还在服用其他含甘草的中药制剂或饮食。连花清瘟胶囊应慎用于11β-HSD2活性低、低血钾、高血压、低白蛋白血症或肝功能异常的病人。在服用连花清瘟胶囊时, 一旦出现假醛固酮增多症的疑似症状, 应立刻报告医师并停药, 必要时可用利尿药或碱化尿液的药物缓解不良反应。
7 小结与展望开展多成分药代研究是为了让中药制剂的药效作用和用药风险有明确的物质归属, 以促进围绕制剂有效性和安全性的研究发现能向临床应用转化。在开展工作时首先要围绕制剂的临床定位或用药风险, 从制剂众多成分中选拔出给药后能被机体利用产生显著体内暴露的成分, 揭示暴露物质的体内药代特征、影响暴露的体内过程关键环节及暴露物质的体内靶标到达等。虽然研究工作要面对机体和中药两个复杂体系, 但是经过多年的努力, 中药多成分药代研究在理论、方法、技术要求、应用上已取得突破, 成为药代动力学的一个新分支。越来越多类别的中药成分的药代特征和体内过程被认识, 一批中药制剂大品种首次获得系统的药代数据, 药代研究进一步拉近了中药制剂成分与制剂效应之间的距离, 使中药物质研究迈上新的台阶。中药多成分药代动力学将继续围绕产业发展和临床用药的需求凝练问题、开展工作, 通过学科交叉、方法创新、技术融合、标准完善等, 突破传统药代动力学的局限, 中药药代动力学的不断发展将更好地促进围绕中药的研究发现向临床应用转化。
在开展中药制剂多成分药代研究时, 应重视并不断学习相关医学的最新成果, 提高对机体利用中药成分方式的认识, 为精准揭示决定中药疗效和用药风险的物质创造有利条件。传统的药代动力学主要关注药物'进入体循环产生系统暴露'这种机体利用方式, 由此研究药物对'挂在'体循环上靶标的作用。然而, 系统暴露不应该是机体利用中药制剂成分产生药效作用的唯一方式, 随着对疾病和药物治疗认识的进步, 中药多成分药代研究还应重视机体利用成分的其他方式。近20年来人们越来越关注共生的肠道微生物对人体健康的影响, 肠道微生物的组成及代谢能力的改变与许多疾病的发生发展密切相关[99, 100], 肠道微生物及其介导的代谢通路可作为潜在的靶标用于防治疾病[101, 102], 同时肠道微生物也能介导药物在肠腔内发生多种代谢反应[103]。在研究中药制剂通过干预肠道微生物产生药效作用时, 需要了解给药后机体利用中药成分的另一种方式: 针对肠道微生物的肠腔暴露。传统药代动力学对于药物进入体循环的系统暴露有一套研究方法和技术, 对其药代规律及与药效的关联也有较多的认识。然而, 传统药代动力学在药物的肠腔暴露方面尚缺乏研究和经验, 对肠道微生物影响宿主代谢酶和转运体、药物肠腔暴露与系统暴露的关联规律、药物肠腔暴露特征与药效的关联等缺乏认识。随着人们越来越关注中药与肠道微生物的相互作用及中药通过干预肠道微生物发挥药效作用, 加强对给药后中药成分肠腔暴露和规律的研究、发展相关方法和技术已成为中药多成分药代研究的一项重要内容。
将解剖生理学对机体的最新认识用于药代研究, 从细胞水平研究中药暴露物质的体内靶标到达也是拓展中药多成分药代研究的一个方向。作为药理学的一个重要分支, 药代动力学研究机体对药物的作用及规律。推动药代动力学的发展离不开加深对机体的认识, 特别要了解与药物疗效和用药风险相关的效应组织的结构、功能及其内在机制, 解剖生理学是药代动力学发展的一项重要基础。PBPK建模预测技术的发展和应用拓展了基于实验手段的传统药代动力学获取药物药代信息的范围和能力, 并降低研究成本、规避研究风险[104, 105]。细胞药代动力学的创建有助于将药代浓度与药效作用更好地关联[106, 107]。当围绕中药制剂的疗效或用药风险开展多成分药代研究时, 不仅需要了解给药后能被机体利用产生显著体内暴露的制剂成分及其主要暴露形式, 还需要考察这些中药暴露物质的体内靶标到达。为此, 在了解机体效应靶标所在组织的细胞组成、结构和功能的基础上, 需要在细胞水平考察中药暴露物质在靶组织的药代特征, 包括中药暴露物质随体液流动的细胞到达、在细胞上的进出、在细胞内的代谢转化和暴露改变、溶酶体等亚细胞器的影响等。在中药多成分药代研究中, 考察中药暴露物质的体内靶标到达及相关的细胞药代动力学特征, 将更好地拉近中药制剂成分与制剂效应之间的距离, 这对于揭示决定制剂有效性和安全性的物质十分重要。
作者贡献: 李川负责全文的撰写; 程晨、贾伟伟、杨军令、余玄、Olajide E. OLALEYE参与撰写和数据整理; 贾伟伟负责格式修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Zhang BL. Traditional Chinese medicine in China's response to Covid-19, brimming with cultural confidence[J]. Red Flag Manuscript (红旗文稿), 2021, 6: 37-40. |
| [2] |
Ni LQ, Chen LL, Huang X, et al. Combating COVID-19 with integrated traditional Chinese and Western medicine in China[J]. Acta Pharm Sin B, 2020, 10: 1149-1162. DOI:10.1016/j.apsb.2020.06.009 |
| [3] |
Zhang BL, Chen CH. Modernization of Chinese Medicine for Twenty Years (1996-2015)[M]. Shanghai: Shanghai Scientific & Technical Publishers, 2016.
|
| [4] |
Lu T, Yang JL, Gao XM, et al. Plasma and urinary tanshinol from Salvia miltiorrhiza (Danshen), can be used as pharmacokinetic markers for cardiotonic pills, a cardiovascular herbal medicine[J]. Drug Metab Dispos, 2008, 36: 1578-1586. DOI:10.1124/dmd.108.021592 |
| [5] |
Li C. Multi-compound pharmacokinetic research on Chinese herbal medicines: approach and methodology[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 607-617. |
| [6] |
Li C, Yang JL, Cheng C, et al. Pharmacokinetic research on Chinese herbal medicines[J]. Bull Japan China Med Assoc (日中医学), 2018, 33: 9-14. |
| [7] |
Liu HF, Yang JL, Du FF, et al. Absorption and disposition of ginsenosides after oral administration of Panax notoginseng extract to rats[J]. Drug Metab Dispos, 2009, 37: 2290-2298. DOI:10.1124/dmd.109.029819 |
| [8] |
Hu ZY, Yang JL, Cheng C, et al. Combinatorial metabolism notably affects human systemic exposure to ginsenosides from orally administered extract of Panax notoginseng roots (Sanqi)[J]. Drug Metab Dispos, 2013, 41: 1457-1469. DOI:10.1124/dmd.113.051391 |
| [9] |
Zhang NT, Cheng C, Olaleye OE, et al. Pharmacokinetics-based identification of potential therapeutic phthalides from XueBiJing, a Chinese herbal injection used in sepsis management[J]. Drug Metab Dispos, 2018, 46: 823-834. DOI:10.1124/dmd.117.079673 |
| [10] |
Pintusophon S, Niu W, Duan XN, et al. Intravenous formulation of Panax notoginseng root extract: human pharmacokinetics of ginsenosides and potential for perpetrating drug interactions[J]. Acta Pharmacol Sin, 2019, 40: 1351-1363. DOI:10.1038/s41401-019-0273-1 |
| [11] |
Lan XF, Olajide OE, Du FF, et al. Pharmacokinetics-based identification of pseudoaldosterogenic compounds originating from Glycyrrhiza uralensis roots (Gancao) after dosing LianhuaQingwen capsule[J]. Acta Pharmacol Sin, 2021, 42. DOI:10.1038/s41401-021-00651-2 |
| [12] |
Li L, Zhao YS, Du FF, et al. Intestinal absorption and presystemic elimination of various chemical constituents present in GBE50 extract, a standardized extract of Ginkgo biloba leaves[J]. Curr Drug Metab, 2012, 13: 494-509. DOI:10.2174/1389200211209050494 |
| [13] |
Chen F, Li L, Xu F, et al. Systemic and cerebral exposure to and pharmacokinetics of flavonols and terpenelactones after dosing standardized Ginkgo biloba leaf extracts to rats via different routes of administration[J]. Br J Pharmacol, 2013, 170: 440-457. DOI:10.1111/bph.12285 |
| [14] |
Li MJ, Wang FQ, Huang YH, et al. Systemic exposure to and disposition of catechols derived from Salvia miltiorrhiza roots (Danshen) after intravenous dosing DanHong injection in human subjects, rats, and dogs[J]. Drug Metab Dispos, 2015, 43: 679-690. DOI:10.1124/dmd.114.061473 |
| [15] |
Cheng C, Du F, Yu K, et al. Pharmacokinetics and disposition of circulating iridoids and organic acids in rats intravenously receiving ReDuNing injection[J]. Drug Metab Dispos, 2016, 44: 1853-1858. DOI:10.1124/dmd.116.071647 |
| [16] |
Cheng C, Lin JZ, Li L, et al. Pharmacokinetics and disposition of monoterpene glycosides derived from Paeonia lactiflora roots (Chishao) after intravenous dosing of antiseptic XueBiJing injection in human subjects and rats[J]. Acta Pharmacol Sin, 2016, 37: 530-544. DOI:10.1038/aps.2015.103 |
| [17] |
Li XX, Cheng C, Wang FQ, et al. Pharmacokinetics of catechols in human subjects intravenously receiving XueBiJing injection, an emerging antiseptic herbal medicine[J]. Drug Metab Pharmacokinet, 2016, 31: 95-98. DOI:10.1016/j.dmpk.2015.10.005 |
| [18] |
Zhang HY, Niu W, Olaleye OE, et al. Comparison of intramuscular and intravenous pharmacokinetics of ginsenosides in humans after dosing XueShuanTong, a lyophilized extract of Panax notoginseng roots[J]. J Ethnopharmacol, 2020, 253: 112658. DOI:10.1016/j.jep.2020.112658 |
| [19] |
Liu XW, Yang JL, Niu W, et al. Human pharmacokinetics of ginkgo terpene lactones and impact of carboxylation in blood on their platelet-activating factor antagonistic activity[J]. Acta Pharmacol Sin, 2018, 39: 1935-1946. DOI:10.1038/s41401-018-0086-7 |
| [20] |
Olaleye OE, Niu W, Du FF, et al. Multiple circulating saponins from intravenous ShenMai inhibit OATP1Bs in vitro: potential joint precipitants of drug interactions[J]. Acta Pharmacol Sin, 2019, 40: 833-849. DOI:10.1038/s41401-018-0173-9 |
| [21] |
Li J, Olaleye OE, Yu X, et al. High degree of pharmacokinetic compatibility exists between the five-herb medicine XueBiJing and antibiotics comedicated in sepsis care[J]. Acta Pharm Sin B, 2019, 9: 1035-1049. DOI:10.1016/j.apsb.2019.06.003 |
| [22] |
Hollman PCH. Absorption, bioavailability, and metabolism of flavonoids[J]. Pharm Biol, 2004, 42(Suppl): 74-83. |
| [23] |
Chen ZJ, Zheng SR, Li LP, et al. Metabolism of flavonoids in humans: comprehensive review[J]. Curr Drug Metab, 2014, 15: 48-61. DOI:10.2174/138920021501140218125020 |
| [24] |
Williamson G, Kay CD, Crozier A. The bioavailability, transport, and bioactivity of dietary flavonoids: a review from a historical perspective[J]. Compr Rev Food Sci Food Saf, 2018, 17: 1504-1112. |
| [25] |
Feng XC, Li Y, Oppong MB, et al. Insights into the intestinal bacterial metabolism of flavonoids and the bioactivities of their microbe-derived ring cleavage metabolites[J]. Drug Metab Rev, 2018, 50: 343-356. DOI:10.1080/03602532.2018.1485691 |
| [26] |
Yu K, Chen F, Li C. Absorption and disposition of saponins: what do we know and what do we need to know?[J]. Curr. Drug Metab, 2012, 13: 577-598. DOI:10.2174/1389200211209050577 |
| [27] |
He Y, Hu ZY, Li AR, et al. Recent advances in biotransformation of saponins[J]. Molecules, 2019, 24: 2365. DOI:10.3390/molecules24132365 |
| [28] |
Jiang RR, Dong JJ, Li XX, et al. Molecular mechanisms governing different pharmacokinetics of ginsenosides and potential for ginsenoside-perpetrated herb-drug interactions on OATP1B3[J]. Br J Pharmacol, 2015, 172: 1059-1073. DOI:10.1111/bph.12971 |
| [29] |
Dong JJ, Olaleye OE, Jiang RR, et al. Glycyrrhizin has a high likelihood to be a victim of drug-drug interactions mediated by hepatic OATP1B1/1B3[J]. Br J Pharmacol, 2018, 175: 3486-3503. DOI:10.1111/bph.14393 |
| [30] |
Sun Y, Dai JY, Hu ZY, et al. Oral bioavailability and brain penetration of (-)-stepholidine, a tetrahydroprotoberberine agonist at dopamine D1 and antagonist at D2 receptors, in rats[J]. Br J Pharmacol, 2009, 158: 1302-1312. DOI:10.1111/j.1476-5381.2009.00393.x |
| [31] |
Li N, Xia QS, Ruan JQ, et al. Hepatotoxicity and tumorigenicity induced by metabolic activation of pyrrolizidine alkaloids in herbs[J]. Curr. Drug Metab, 2011, 12: 823-834. DOI:10.2174/138920011797470119 |
| [32] |
Feng R, Shou JW, Zhao ZX, et al. Transforming berberine into its intestine-absorbable form by the gut microbiota[J]. Sci Rep, 2015, 5: 12155. DOI:10.1038/srep12155 |
| [33] |
Wang K, Feng XC, Chai LW, et al. The metabolism of berberine and its contribution to the pharmacological effects[J]. Drug Metab Rev, 2017, 49: 139-157. DOI:10.1080/03602532.2017.1306544 |
| [34] |
Jia WW, Du FF, Liu XW, et al. Renal tubular secretion of tanshinol: molecular mechanisms, impact on its systemic exposure, and propensity for dose-related nephrotoxicity and for renal herb-drug interactions[J]. Drug Metab Dispos, 2015, 43: 669-678. DOI:10.1124/dmd.114.062000 |
| [35] |
Tian DD, Jia WW, Liu XW, et al. Methylation and its role in disposition of tanshinol, a cardiovascular carboxylic catechol from Salvia miltiorrhiza roots (Danshen)[J]. Acta Pharmacol Sin, 2015, 36: 627-643. DOI:10.1038/aps.2015.20 |
| [36] |
Cheng C, Liu XW, Du FF, et al. Sensitive assay for measurement of volatile borneol, isoborneol, and the metabolite camphor in rat pharmacokinetic study of Borneolum (Bingpian) and Borneolum syntheticum (synthetic Bingpian)[J]. Acta Pharmacol Sin, 2013, 34: 1337-1348. DOI:10.1038/aps.2013.86 |
| [37] |
Wang C, Cao B, Liu QQ, et al. Oseltamivir compared with the Chinese traditional therapy Maxingshigan-Yinqiaosan in the treatment of H1N1 influenza: a randomized trial[J]. Ann Intern Med, 2011, 155: 217-225. DOI:10.7326/0003-4819-155-4-201108160-00005 |
| [38] |
Li XL, Zhang J, Huang J, et al. A multicenter, randomized, double-blind, parallel-group, placebo-controlled study of the effects of Qili Qiangxin capsules in patients with chronic heart failure[J]. J Am Coll Cardiol, 2013, 62: 1065-1072. DOI:10.1016/j.jacc.2013.05.035 |
| [39] |
Shang HC, Zhang JH, Yao C, et al. Qi-Shen-Yi-Qi dripping pills for the secondary prevention of myocardial infarction: a randomised clinical trial[J]. Evid Based Complement Alternat Med, 2013, 2013: 738391. |
| [40] |
Zhang L, Li P, Xing CY. Efficacy and safety of Abelmoschus manihot for primary glomerular disease: a prospective, multicenter randomized controlled clinical trial[J]. Am J Kidney Dis, 2014, 64: 57-65. DOI:10.1053/j.ajkd.2014.01.431 |
| [41] |
Song YL, Yao C, Yao YM, et al. XueBiJing injection versus placebo for critically ill patients with severe community-acquired pneumonia: a randomized controlled trial[J]. Crit Care Med, 2019, 47: 735-743. |
| [42] |
Xie GX, Wang SL, Zhang H, et al. Poly-pharmacokinetic study of a multicomponent herbal medicine in healthy Chinese volunteers[J]. Clin Pharmacol Ther, 2018, 103: 692-702. DOI:10.1002/cpt.784 |
| [43] |
Chen GC, Gao YY, Jiang Y, et al. Efficacy and safety of XueBiJing injection combined with ulinastatin as adjunctive therapy on sepsis: a systematic review and meta-analysis[J]. Front Pharmacol, 2018, 9: 743. DOI:10.3389/fphar.2018.00743 |
| [44] |
Li CY, Wang P, Zhang L, et al. Efficacy and safety of XueBiJing injection (a Chinese patent) for sepsis: a meta-analysis of randomized controlled trials[J]. J Ethnopharmacol, 2018, 224: 512-521. DOI:10.1016/j.jep.2018.05.043 |
| [45] |
Shi H, Hong Y, Qian JF, et al. Xuebijing in the treatment of patients with sepsis[J]. Am J Emerg Med, 2017, 35: 285-291. DOI:10.1016/j.ajem.2016.11.007 |
| [46] |
Cao Y, Chai YF, Deng Y, et al. Chinese guidelines for emergency management of sepsis and septic shock 2018[J]. J Clin Emerg (临床急诊杂志), 2018, 19: 567-588. |
| [47] |
Zhao GZ, Chen RB, Li B, et al. Clinical practice guideline on traditional Chinese medicine therapy alone or combined with antibiotics for sepsis[J]. AnnTransl Med, 2019, 7: 122. |
| [48] |
Diagnosis and Treatment of Adults with Coronavirus Disease 2019(8th version)[EB/OL]. Beijing: Chinese National Health Commission and Chinese State Administration of Traditional Chinese Medicine, 2020[2021-06-05]. http://www.nhc.gov.cn/cms-search/downFiles/a449a3e2e2c94d9a856d5faea2ff0f94.pdf.
|
| [49] |
Yin Q, Li CS. Treatment effects of XueBiJing injection in severe septic patients with disseminated intravascular coagulation[J]. Evid Based Complement Alternat Med, 2014, 2014: 949254. |
| [50] |
Chen X, Feng YX, Shen XY, et al. Anti-sepsis protection of XueBiJing injection is mediated by differential regulation of pro- and anti-inflammatory Th17 and T regulatory cells in a murine model of polymicrobial sepsis[J]. J Ethnopharmacol, 2018, 211: 358-365. DOI:10.1016/j.jep.2017.10.001 |
| [51] |
Wang L, Liu ZY, Dong Z, et al. Effects of XueBiJing injection on microcirculation in septic shock[J]. J Surg Res, 2016, 202: 147-154. DOI:10.1016/j.jss.2015.12.041 |
| [52] |
Jiang M, Zhou MG, Han YQ, et al. Identification of NF-κB inhibitors in XueBiJing injection for sepsis treatment based on bioactivity-integrated UPLC-Q/TOF[J]. J Ethnopharmacol, 2013, 147: 426-433. DOI:10.1016/j.jep.2013.03.032 |
| [53] |
Dong TH, Zhang GP, Dong K, et al. Research progress on mechanism of action of XueBiJing injection in the treatment of sepsis[J]. Chin J IntegrTradit Chin Med West Med Crit Care (中国中西医结合急救杂志), 2016, 23: 554-557. |
| [54] |
Wang Q, Wu X, Tong XW, et al. XueBiJing ameliorates sepsis-induced lung injury by downregulating HMGB1 and RAGE expressions in mice[J]. Evid Based Complement Alternat Med, 2015, 2015: 860259. |
| [55] |
Zuo LH, Zhou L, Xu TY, et al. Antiseptic activity of ethnomedicinal XueBiJing revealed by the metabolomics analysis using UHPLC-Q-Orbitrap HRMS[J]. Front Pharmacol, 2018, 9: 300. DOI:10.3389/fphar.2018.00300 |
| [56] |
Xu TY, Zhou L, Shi YY, et al. Metabolomics approach in lung tissue of septic rats and the interventional effects of XueBiJing injection using UHPLC-Q-Orbitrap-HRMS[J]. J Biochem, 2018, 164: 427-435. |
| [57] |
Zhou W, Chai H, Lin PH, et al. Clinical use and molecular mechanisms of action of extract of Ginkgo biloba leaves in cardiovascular diseases[J]. Cardiovasc Drug Rev, 2004, 22: 309-319. |
| [58] |
Wu YZ, Li SQ, Cui W, et al. Ginkgo biloba extract improves coronary blood flow in patients with coronary artery disease: role of endothelial-dependent vasodilation[J]. Planta Med, 2007, 73: 624-628. DOI:10.1055/s-2007-981536 |
| [59] |
Le Bars PL, Katz MM, Berman N, et al. A placebo-controlled, double-blind, randomized trial of an extract of Ginkgo biloba for dementia[J]. JAMA, 1997, 278: 1327-1332. DOI:10.1001/jama.1997.03550160047037 |
| [60] |
Orlent H, Hansen BE, Willems M, et al. Biochemical and histological effects of 26 weeks of glycyrrhizin treatment in chronic hepatitis C: a randomized phase II trial[J]. J Hepatol, 2006, 45: 539-546. DOI:10.1016/j.jhep.2006.05.015 |
| [61] |
Ikeda K Glycyrrhizin injection therapy prevents hepatocellular carcinogenesis in patients with interferon-resistant active chronic hepatitis C[J]. Hepatol Res, 2007, 37: S287-S293.
|
| [62] |
Zeng X, Deng YH, Feng Y, et al. Pharmacokinetics and safety of ginsenoside Rd following a single or multiple intravenous dose in healthy Chinese volunteers[J]. J Clin Pharmacol, 2010, 50: 285-292. DOI:10.1177/0091270009344334 |
| [63] |
Qiao X, Lin XH, Ji S, et al. Global profiling and novel structure discovery using multiple neutral loss/precursor ion scanning combined with substructure recognition and statistical snalysis (MNPSS): characterization of terpene-conjugated curcuminoids in Curcuma longa as a case study[J]. Anal Chem, 2016, 88: 703-710. DOI:10.1021/acs.analchem.5b02729 |
| [64] |
Qiao X, Li R, Song W, et al. A targeted strategy to analyze untargeted mass spectral data: Rapid chemical profiling of Scutellaria baicalensis using ultra-high performance liquid chromatography coupled with hybrid quadrupole orbitrap mass spectrometry and key ion filtering[J]. J Chromatogr A, 2016, 1441: 83-95. DOI:10.1016/j.chroma.2016.02.079 |
| [65] |
Yang W, Li Y, Kang C, et al. Sodiation-based in-source collision for profiling of pyranocoumarins in Radix Peucedani (Qianhu): utility of sodium adducts' stability with in-source collision[J]. J Mass Spectrom, 2017, 52: 152-164. DOI:10.1002/jms.3913 |
| [66] |
Pang HQ, An HM, Yang H, et al. Comprehensive chemical profiling of Yindan Xinnaotong soft capsule and its neuroprotective activity evaluation in vitro[J]. J Chromatogr A, 2019, 1601: 288-299. DOI:10.1016/j.chroma.2019.05.023 |
| [67] |
Pan HQ, Zhou H, Miao S, et al. An integrated approach for global profiling of multi-type constituents: comprehensive chemical characterization of Lonicerae Japonicae Flos as a case study[J]. J Chromatogr A, 2020, 1613: 460674. DOI:10.1016/j.chroma.2019.460674 |
| [68] |
Wu L, Gong P, Wu YZ, et al. An integral strategy toward the rapid identification of analogous nontarget compounds from complex mixtures[J]. J Chromatogr A, 2013, 1303: 39-47. DOI:10.1016/j.chroma.2013.06.041 |
| [69] |
Kostiainen R, Kotiaho T, Kuuranne T, et al. Liquid chromatography/atmospheric pressure ionization-mass spectrometry in drug metabolism studies[J]. J Mass Spectrom, 2003, 38: 357-372. DOI:10.1002/jms.481 |
| [70] |
Anari MR, Sanchez RI, Bakhtiar R, et al. Integration of knowledge-based metabolic predictions with liquid chromatography data-dependent tandem mass spectrometry for drug metabolism studies: application to studies on the biotransformation of indinavir[J]. Anal Chem, 2004, 76: 823-832. DOI:10.1021/ac034980s |
| [71] |
Huang K, Huang LY, van Breemen RB. Detection of reactive metabolites using isotope-labeled glutathione trapping and simultaneous neutral loss and precursor ion scanning with ultra-high-pressure liquid chromatography triple quadruple mass spectrometry[J]. Anal Chem, 2015, 87: 3646-3654. DOI:10.1021/ac504737x |
| [72] |
Tan L, Kirchemair J. Drug Metabolism Prediction: Software for Metabolism Prediction[M]. Weinheim: Wiley-VCH, 2014: 29-51.
|
| [73] |
Kirchmair J, Göller AH, Lang D, et al. Predicting drug metabolism: experiment and/or computation?[J]. Nat Rev Drug Discov, 2015, 14: 387-404. DOI:10.1038/nrd4581 |
| [74] |
Wishart DS. Drug Metabolism Prediction: Online Databases and Web Servers for Drug Metabolism Research[M]. Weinheim: Wiley-VCH, 2014: 53-74.
|
| [75] |
Li L, Liang SP, Du FF, et al. Simultaneous quantification of multiple licorice flavonoids in rat plasma[J]. J Am Soc Mass Spectrom, 2007, 18: 778-782. DOI:10.1016/j.jasms.2006.12.011 |
| [76] |
Zhao Y, Wang L, Bao YW, et al. A sensitive method for the detection and quantification of ginkgo flavonols from plasma[J]. Rapid Commun Mass Spectrom, 2007, 21: 971-981. DOI:10.1002/rcm.2907 |
| [77] |
Wang L, Sun Y, Du FF, et al. 'LC-electrolyte effects' improve the bioanalytical performance of liquid chromatography/tandem mass spectrometric assays in supporting drug discovery pharmacokinetic study[J]. Rapid Commun Mass Spectrom, 2007, 21: 2573-2584. DOI:10.1002/rcm.3129 |
| [78] |
Zhao Y, Sun Y, Li C. Simultaneous determination of ginkgo flavonoids and terpenoids in plasma: ammonium formate in LC mobile phase enhancing electrospray ionization efficiency and capacity[J]. J Am Soc Mass Spectrom, 2008, 19: 445-449. DOI:10.1016/j.jasms.2007.11.015 |
| [79] |
Li C, Ji ZH, Nan FJ, et al. Liquid chromatography/tandem mass spectrometry for the determination of fluoxetine and its main active metabolite norfluoxetine in human plasma with deuterated fluoxetine as internal standard[J]. Rapid Commun Mass Spectrom, 2002, 16: 1844-1850. DOI:10.1002/rcm.800 |
| [80] |
Guo B, Li C, Wang GJ, et al. Rapid and direct measurement of free concentrations of highly protein-bound fluoxetine and its metabolite norfluoxetine in plasma[J]. Rapid Commun Mass Spectrom, 2006, 20: 39-47. DOI:10.1002/rcm.2265 |
| [81] |
Karmazyn M, Moey M, Gan XT. Therapeutic potential of ginseng in the management of cardiovascular disorders[J]. Drugs, 2011, 71: 1989-2008. DOI:10.2165/11594300-000000000-00000 |
| [82] |
Sun B, Xiao J, Sun XB, et al. Notoginsenoside R1 attenuates cardiac dysfunction in endotoxemic mice: an insight into oestrogen receptor activation and PI3K/Akt signaling[J]. Br J Pharmacol, 2013, 168: 1758-1770. DOI:10.1111/bph.12063 |
| [83] |
Lee CH, Kim JH. A review on the medicinal potentials of ginseng and ginsenosides on cardiovascular diseases[J]. J Ginseng Res, 2014, 38: 161-166. DOI:10.1016/j.jgr.2014.03.001 |
| [84] |
Qi LW, Wang CZ, Yuan CS. Ginsenosides from American ginseng: chemical and pharmacological diversity[J]. Phytochemistry, 2011, 72: 689-699. DOI:10.1016/j.phytochem.2011.02.012 |
| [85] |
Ru WW, Wang DL, Xu YP, et al. Chemical constituents and bioactivities of Panax ginseng (C. A. Mey.)[J]. Drug Discov Ther, 2015, 9: 23-32. DOI:10.5582/ddt.2015.01004 |
| [86] |
Wang T, Guo RX, Zhou GH, et al. Traditional uses, botany, phytochemistry, pharmacology and toxicology of Panax notoginseng (Burk.) F.H. Chen: a review[J]. J Ethnopharmacol, 2016, 188: 234-258. DOI:10.1016/j.jep.2016.05.005 |
| [87] |
Diagnosis and treatment plan for influenza (2019 version)[EB/OL]. Beijing: Chinese National Health Commission and Chinese State Administration of Traditional Chinese Medicine, 2019-11-07[2021-06-05]. http://www.nhc.gov.cn/yzygj/s7653p/201911/a577415af4e5449cb30ecc6511e369c7/files/75a810713dc14dcd9e6db8b654bdef79.pdf.
|
| [88] |
National Health and Family Planning Commission of People's Republic of China. Gulideline on diagnosis and treatment of Middle East respirotory syndrome (2015 version)[J]. Chin J Viral Dis (中国病毒病杂志), 2015, 5: 352-354. |
| [89] |
Isbrucker RA, Burdock GA. Risk and safety assessment on the consumption of licorice root (Glycyrrhiza sp.), its extract and powder as a food ingredient, with emphasis on the pharmacology and toxicology of glycyrrhizin[J]. Regul Toxicol Pharmaco, 2006, 46: 167-192. DOI:10.1016/j.yrtph.2006.06.002 |
| [90] |
Omar HR, Komarova I, El-Ghonemi M, et al. Licorice abuse: time to send a warning message[J]. Ther Adv Endocrinol Metab, 2012, 3: 125-138. DOI:10.1177/2042018812454322 |
| [91] |
Kato H, Kanaoka M, Yano S, et al. 3-Monoglucuronyl-glycyrrhetinic acid is a major metabolite that causes licorice-induced pseudoaldosteronism[J]. J Clin Endocrinol Metab, 1995, 80: 1929-1933. |
| [92] |
Ohtake N, Kido A, Kubota K, et al. A possible involvement of 3-monoglucuronyl-glycyrrhetinic acid, a metabolite of glycyrrhizin (GL), in GL-induced pseudoaldosteronism[J]. Life Sci, 2007, 80: 1545-1552. DOI:10.1016/j.lfs.2007.01.033 |
| [93] |
Makino T, Ohtake N, Watanabe A, et al. Down-regulation of a hepatic transporter multidrug resistance-associated protein 2 is involved in alteration of pharmacokinetics of glycyrrhizin and its metabolites in a rat model of chronic liver injury[J]. Drug Metab Dispos, 2008, 36: 1438-1443. DOI:10.1124/dmd.108.021089 |
| [94] |
Makino T, Okajima K, Uebayashi R, et al. 3-Monoglucuronyl-glycyrrhretinic acid is a substrate of organic anion transporters expressed in tubular epithelial cells and plays important roles in licorice-induced pseudoaldosteronism by inhibiting 11β-hydroxysteroid dehydrogenase 2[J]. J Pharmacol Exp Ther, 2012, 342: 297-304. DOI:10.1124/jpet.111.190009 |
| [95] |
Makino T. 3-Monoglucuronyl glycyrrhretinic acid is a possible marker compound related to licorice-induced pseudoaldosteronism[J]. Biol Pharm Bull, 2014, 37: 898-902. DOI:10.1248/bpb.b13-00997 |
| [96] |
Ishiuchi K, Morinaga O, Ohkita T, et al. 18β-Glycyrrhetyl-3-O-sulfate would be a causative agent of licorice-induced pseudoaldosteronism[J]. Sci Rep, 2019, 9: 1587. DOI:10.1038/s41598-018-38182-2 |
| [97] |
Takahashi K, Yoshino T, Maki Y, et al. Identification of glycyrrhizin metabolites in humans and of a potential biomarker of liquorice-induced pseudoaldosteronism: a multi-centre cross-sectional study[J]. Arch Toxicol, 2019, 93: 3111-3119. DOI:10.1007/s00204-019-02588-2 |
| [98] |
Morinaga O, Ishiuchi K, Ohkita T, et al. Isolation of a novel glycyrrhizin metabolite as a causal candidate compound for pseudoaldosteronism[J]. Sci Rep, 2018, 8: 15568. DOI:10.1038/s41598-018-33834-9 |
| [99] |
Lynch SV, Pedersen O. The human intestinal microbiome in health and disease[J]. N Engl J Med, 2016, 75: 2369-2379. |
| [100] |
Leviatan S, Segal E. Identifying gut microbes that affect human health[J]. Nature, 2020, 587: 373-374. DOI:10.1038/d41586-020-03069-8 |
| [101] |
Jia W, Li H, Zhao LP, et al. Gut microbiota: a potential new territory for drug targeting[J]. Nat Rev Drug Disco, 2008, 7: 123-129. DOI:10.1038/nrd2505 |
| [102] |
Cani PD, Delzenne NM. The gut microbiome as therapeutic target[J]. Pharm Ther, 2011, 130: 202-212. DOI:10.1016/j.pharmthera.2011.01.012 |
| [103] |
Zimmermann M, Zimmermann KM, Wegmann R, et al. Mapping human microbiome drug metabolism by gut bacteria and their genes[J]. Nature, 2019, 570: 462-467. DOI:10.1038/s41586-019-1291-3 |
| [104] |
Zhuang XM, Lu C. PBPK modeling and simulation in drug research and development[J]. Acta Pharm Sin B, 2016, 6: 430-440. DOI:10.1016/j.apsb.2016.04.004 |
| [105] |
Grimstein M, Yang YC, Zhang XY, et al. Physiologically based pharmacokinetic modeling in regulatory science: an update from the U.S. Food and Drug Administration's office of clinical pharmacology[J]. J Pharm Sci, 2019, 108: 21-25. DOI:10.1016/j.xphs.2018.10.033 |
| [106] |
Zhang JW, Zhou F, Lu M, et al. Pharmacokinetics-pharmacology disconnection of herbal medicines and its potential solutions with cellular pharmacokinetic-pharmacodynamic strategy[J]. Curr Drug Metab, 2012, 13: 558-576. DOI:10.2174/1389200211209050558 |
| [107] |
Ni P, Zhang JW, Liu JL, et al. Research progress in cellular pharmacokinetics[J]. Prog Pharm Sci, 2014, 38: 881-885. |
 2021, Vol. 56
2021, Vol. 56


