2. 暨南大学华侨医院, 广东 广州 510630;
3. 上海爱博才思分析仪器贸易有限公司, 广东 广州 510623;
4. 湖北中医药大学药学院, 湖北 武汉 430065
2. The First Affiliated Hospital of Jinan University, Guangzhou 510630, China;
3. SCIEX(China) Co., Ltd., Guangzhou 510623, China;
4. College of Pharmacy, Hubei University of Chinese Medicine, Wuhan 430065, China
2型糖尿病主要表现为患者体内的胰岛素抵抗以及高血糖, 其在世界范围内的发病率和致死率逐年提升, 已经成为全球性的严重健康问题[1]。通过抑制α-葡萄糖苷酶活性, 可显著减少糖在小肠内的吸收, 从而降低患者的餐后血糖水平[2, 3]。目前, 已经上市并被广泛应用于患者血糖控制的α-葡萄糖苷酶抑制剂, 如阿卡波糖和伏格列波糖, 往往存在胃肠道损伤、皮肤过敏等不良反应。因此, 开发新型的α-葡萄糖苷酶抑制剂用于2型糖尿病患者的治疗显得很有必要。
天然产物是现代药物研发中候选化合物的重要来源, 许多植物提取物都被证实具有降血糖的功效, 其中湖北海棠的降血糖活性尤其值得关注。湖北海棠[Malus hupehensis (Pamp.) Rehd.] 属蔷薇科苹果属植物, 富含黄酮类、多酚类等活性物质, 其降血糖活性已在药理和临床上得到验证[4-6]。Wang等[7]发现, 湖北海棠水提物可有效降低2型糖尿病小鼠的血糖水平。Gong等[8]对2型糖尿病患者加用湖北海棠叶水煎剂治疗, 显著减少治疗组患者的胰岛素用量。然而, 湖北海棠中降血糖活性化合物种类尚不明确, 对α-葡萄糖苷酶的抑制率也有待评估, 需要对其成分进行α-葡萄糖苷酶抑制活性的筛选和评估, 为新型降糖药的研发提供候选化合物。
中药复杂成分的活性筛选主要依赖于传统"活性追踪分离策略" (activity-guided fractionation, AGF), 即"以整体活性为导向, 对复杂中药进行反复柱色谱提取分离直至得到目标单体化合物", 由于"化学分离"与"活性评价"不同步, 分离通量低、单次分析信息量有限, 导致工作量大、周期长和成本高, 在筛选过程中微量活性成分易丢失。基于靶标分子-配体特异性相互作用的亲和筛选技术, 如超滤法、细胞膜色谱法、配体垂钓等, 以与疾病高度相关的酶或受体为靶点, 直接从复杂体系中快速准确地捕获能与靶分子作用的配体群, 具有目标性强、特异性高和操作简便等优点, 已被广泛应用于天然产物活性成分的靶向筛选。然而这些方法仍然无法克服假阳性结果、筛选和活性评估不同步等局限[9]。近年来, 一种基于"高分辨活性轮廓分析"技术(high-resolution bioassay profiling) 的高内涵筛选策略成功突破了传统AGF策略的局限, 通过将液相分离、质谱定性和活性筛选三个模块高度整合, 可真正实现"化学分离"与"活性评价"的同步。复杂样本经色谱高效分离后分流, 一部分进入高分辨质谱获取结构信息, 另一部分经自动化高通量微流分收集后同步进行生物活性轮廓分析获取活性数据, 实现色谱、质谱及活性谱图"实时、同步"无缝拟合, 一次运行即可完成整个筛选的全过程, 大大缩短了筛选时间, 提高了筛选效率、稳定性和准确性, 通过明确揭示活性成分"谱-效关系", 有效避免了假阳性的出现。近线高分辨活性轮廓分析技术已被成功应用于从蛇毒中筛选凝血酶抑制剂[10], 从银杏叶和绿茶中筛选α-葡萄糖苷酶抑制剂[11]等, 在中药活性化合物筛选研究中展现了巨大的潜力和推广价值。
本研究基于近线高分辨活性轮廓分析, 建立了以α-葡萄糖苷酶为靶点的快速活性筛选平台, 并应用该平台从湖北海棠叶提取物中筛选潜在的α-葡萄糖苷酶抑制剂。
材料与方法材料 湖北海棠叶购自中国湖北省襄阳市, 经张婷婷博士鉴定为蔷薇科植物湖北海棠[Malus hupehensis (Pamp.) Rehd.] 干燥叶, 样品标本保存于暨南大学药学院药物分析研究中心(标本号: 0317)。其他试剂为: α-葡萄糖苷酶(14 units·mg-1, 西格玛-奥德里奇试剂有限公司, 批号: SLBQ6215V); 4-硝基苯基-α-D-吡喃葡糖苷(pNPG)、金丝桃苷(上海麦克林生化科技有限公司, 批号分别为: C10679152、C10443230); 槲皮素(萨恩化学技术(上海) 有限公司, 批号: DA190041); 表没食子儿茶素没食子酸酯[(-)-epigallocatechin gallate, EGCG] 和阿魏酸(阿拉丁化学试剂有限公司, 批号分别为: F1805096和J1929052)。
仪器 BSA223S型电子天平(德国赛多利斯公司), 旋转蒸发仪(中国予华仪器有限公司), LC20AD液相系统(日本岛津公司), CTC HTS PAL自动进样系统(瑞士思特斯分析仪器有限公司), X500R Q-TOF-MS高分辨质谱(美国SCIEX公司), 真空干燥箱(上海霄汉实业发展有限公司), PB-10 pH仪(德国赛多利斯公司), Synergy™ LX多功能酶标仪(美国伯腾仪器有限公司)。
样本提取 取湖北海棠干燥叶, 经粉碎机粉碎、过筛, 准确称取15.0 g细粉, 置于具塞锥形瓶中, 加入450 mL甲醇溶液, 30 ℃下超声(40 kHz) 提取2次, 每次30 min。将两次提取液合并, 旋转蒸发去除溶剂, 收集得到粗提物。100 mL超纯水溶解粗提物, 依次使用100 mL石油醚、乙酸乙酯和正丁醇对粗提物进行萃取, 每种溶剂萃取3次, 合并后旋转蒸发去除溶剂, 得到水部位、乙酸乙酯部位和正丁醇部位浸膏, 保存于4 ℃冰箱待用。
α-葡萄糖苷酶活性检测方法 在PB缓冲液(100 mmol·L-1, pH 6.8) 体系下, 制备α-葡萄糖苷酶溶液(4 μg·mL-1) 和底物pNPG溶液(1 mmol·L-1)。向384微孔板微孔中依次加入25 μL的pNPG溶液和α-葡萄糖苷酶溶液, 总体积50 μL。振荡混匀后使用Synergy™ LX酶标仪在405 nm下对微孔板中酶促反应体系的紫外吸收进行动力学监测, 得到动力学曲线斜率(k) 表示体系的酶促反应速率。
湖北海棠叶提取物活性测试 分别称取湖北海棠叶提取物水部位、乙酸乙酯部位和正丁醇部位浸膏2.0 mg溶解于1 mL甲醇中, 得到2 000 μg·mL-1提取物溶液, 用甲醇稀释得梯度浓度(2 000、1 000、500、250和125 μg·mL-1) 的提取物溶液为实验组, 甲醇为空白对照组。将25 μL不同浓度提取物溶液依次加入384孔板对应的微孔中, 每个浓度重复3次, 对照组加入25 μL甲醇。为促进提取物成分的溶解, 便于后续的活性测试, 384孔板需提前加入10 μL的10% DMSO水溶液。随后将384孔板放置于真空干燥箱中, 待溶剂完全挥发后取出, 在加样的微孔内进行α-葡萄糖苷酶活性检测, 按照"α-葡萄糖苷酶活性检测方法"项下操作, 并采用以下公式计算抑制率:
| $ \text { 抑制率 } \%=\left(k_{\text {空白 }}-k_{\text {实验 }}\right) / k_{\text {空白 }} $ | (1) |
式1中, k实验代表实验组的酶动力学增长斜率, k空白代表空白对照组的酶动力学增长斜率。
近线高分辨活性轮廓分析平台的建立 图 1为近线高分辨活性轮廓分析平台示意图。该平台以岛津高效液相色谱系统为基础, 内径为250 μm的Peek管(黑色) 依次连接四元泵、进样器、色谱柱以及用于分流的三通入口, 内径为120 μm的Peek管(红色) 连接三通与分流后的两个出口, 一个流向DAD检测器和高分辨质谱, 另一个连接微流分收集装置。通过调整两根120 μm Peek管的长度来改变各管路内的压力和流量, 使得最终通往DAD检测器和高分辨质谱的通路流量为总流量的1/3, 通往微流分收集装置的通路流量为总流量的2/3。微流分按既定采样频率被收集到384微孔板中, 经过真空干燥箱挥干溶剂后, 进行α-葡萄糖苷酶活性检测。
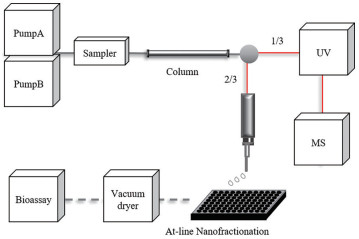
|
Figure 1 Flow chart of at-line high-resolution bioassay profiling platform |
微流分收集装置的搭建 以CTC HTS PAL自动进样系统为基础搭建微流分收集装置。在连接三通分流出口与流分收集装置的Peek管路末端处, 使用二通、连接头等配件连接内径为100 μm的毛细管作为微流分收集的点样器, 点样器固定到CTC HTS PAL自动进样系统的机械臂上。通过修改后PAL Cycle Composer and Drivers软件控制机械臂在384微孔板上精准平行移动, 将微流分收集到384微孔板的每一个孔中。机械臂的平行移动距离可精确到0.1 mm, 在384微孔板每个孔上方的停留时间可精确到0.1 s。
活性评价谱图 将384微孔板的每个孔按微流分收集顺序编号排列, 计算每个孔对应的流分收集时间, 计算公式如下:
| $ t = \left[ {a*(n - 1) + \frac{a}{2}} \right]/6 $ | (2) |
式2中, t代表微流分收集时间(min), a代表单孔收集时长(s), n代表孔序号。将384微孔板各孔动力学曲线的斜率值按对应的编号顺序排列, 算出斜率值的中位数, 并用所有斜率值除以该中位数, 对所有增长斜率进行标准化, 标准化斜率有助于多次实验结果间平行比较。再使用Origin软件按照编号顺序绘制活性谱图, 横坐标为该孔所对应的微流分收集时间, 纵坐标为该孔计算得到的标准化斜率(图 2)。最后将实验所得的活性谱图、色谱图以及质谱总离子流图通过微流分收集时间相关联得到活性评价谱图, 对比分析各图中的生物活性信息与化学结构信息(图 3)。
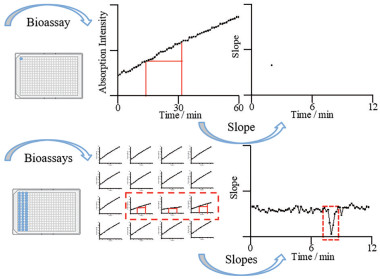
|
Figure 2 Analysis of bioassays in 384-well plate |
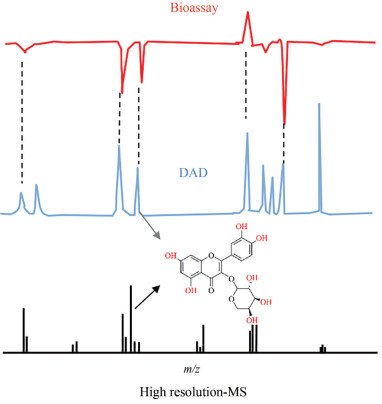
|
Figure 3 Activity profile of at-line nanofractionation |
活性筛选平台的可行性验证 制备金丝桃苷、EGCG、槲皮素及阿魏酸的混合溶液, 各化合物的浓度均为1 000 μmol·L-1, 稀释两次得到333和111 μmol·L-1的梯度稀释液。进行近线高分辨轮廓分析, 色谱柱为Symmertry C18 column (4.6 mm×250 mm, 5 μm, Waters), 柱温箱为室温。流动相A为水(0.1%甲酸), 流动相B为甲醇(0.1%甲酸), 0 min, 30% B; 25 min, 70% B; 40 min, 30% B。进样体积均为20 μL, 液相色谱流速为0.5 mL·min-1, 检测波长为254 nm。为增加抑制剂的溶解性便于后续的活性测试, 384孔板需提前加入10 μL的10% DMSO水溶液, 流分的单孔收集时长为8 s。将所收集的微流分真空干燥去除溶剂, 进行α-葡萄糖苷酶活性检测。
湖北海棠叶乙酸乙酯部位活性评价 制备湖北海棠叶提取物乙酸乙酯部位浸膏溶液(2.5、7.5和15 mg·mL-1, 3% DMSO、30%甲醇水溶液溶解), 进行近线高分辨活性轮廓分析, 色谱柱为Diamonsil C18 column (4.6 mm×250 mm, 5 μm, Dikma), 柱温箱为室温。流动相A为水(0.1%甲酸), 流动相B为甲醇(0.1%甲酸), 梯度洗脱(v/v): 0~25 min, 45% B; 50 min, 100% B; 55 min, 100% B; 60 min, 45% B。进样体积均为20 μL, 液相色谱流速为0.5 mL·min-1, 检测波长为287 nm。微流分收集在提前加有10 % DMSO水溶液(10 μL) 的384孔板中, 单孔收集时长为8 s。将所收集的微流分真空干燥去除溶剂, 进行α-葡萄糖苷酶活性检测。
质谱Q-TOF-MS/MS分析以负离子模式进行, 主要参数为: 离子源温度600 ℃; Curtain Gas压力25 psi (1 psi ≈ 6.9 kPa); 离子源气体1 (60 psi); 离子源气体2 (60 psi); 离子喷射电压, -4.5 kV; TOF-MS扫描的质量范围为100~1 000 Da, 扫描时间间隔为0.25 s, 碰撞能量为-10 V; TOF-MS/MS扫描的质量范围为50~1 000 Da, 扫描时间间隔为0.1 s, 碰撞能量为-35 V (碰撞能量分布为15 V)。
结果与讨论 1 湖北海棠叶提取物活性测试梯度浓度的湖北海棠叶提取物各部位对α-葡萄糖苷酶的抑制率见表 1, 由于活性检测总体积为50 μL, 对应提取物浓度较原浓度减半。湖北海棠叶提取物各部位对α-葡萄糖苷酶均具有抑制作用且抑制率随浓度上升而明显提升, 其中乙酸乙酯部位活性最高, 本实验选用乙酸乙酯部位提取物进行后续测试。
| Table 1 Inhibition of extracts of Malus hupehensis (Pamp.) Rehd. |
为了验证近线高分辨活性轮廓分析平台的可行性, 以金丝桃苷、EGCG、槲皮素及阿魏酸组成对照品混合模型, 其中EGCG (IC50为32.4 ± 2.8 μmol·L-1)、金丝桃苷(IC50为316.9 ± 66.5 μmol·L-1) 和槲皮素(IC50为9.8 ± 0.9 μmol·L-1) 为已知α-葡萄糖苷酶阳性抑制剂, 阿魏酸为阴性对照。结果如图 4所示, 阴性对照阿魏酸色谱出峰位置所对应的活性谱图未见活性负峰, 而阳性抑制剂EGCG、槲皮素和金丝桃苷色谱峰对应位置均出现活性负峰, 且负峰大小随进样浓度的上升而增加。此外, IC50较小的EGCG和槲皮素3个进样浓度均能观察到明显的活性负峰, 而IC50较大的金丝桃苷仅在高浓度时出现较大负峰, 中浓度时负峰不明显, 而低浓度时无负峰。该实验结果充分说明了近线高分辨活性轮廓分析平台可以准确识别混合样品中的α-葡萄糖苷酶抑制剂, 并且活性负峰响应强度与抑制剂的浓度相关, 在一定程度上可以反映抑制剂的量效关系。
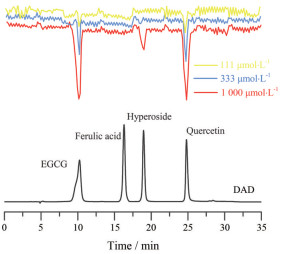
|
Figure 4 Bioassay profiling of standard mixtures. EGCG: (-)-Epigallocatechin gallate |
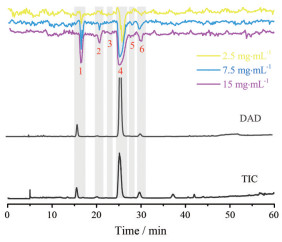
湖北海棠叶乙酸乙酯部位提取物的活性评价谱图如图 5所示, 共有6个具有有效量效关系的活性负峰, 即随进样浓度提升, 活性负峰变大, 说明其中存在至少6个具有α-葡萄糖苷酶抑制活性的成分。其中3号和5号化合物所对应的活性负峰较小, 而1号、2号、4号和6号化合物所对应的活性负峰较明显。
|
Figure 5 Bioassay profiling of ethyl acetate extract of Malus hupehensis |
通过对比活性谱图和对应位置的色谱图, 结合质谱数据(总离子流谱图和二级碎片)分析以及参考文献数据[12-17], 确认了以上6个化合物的结构信息(表 2)。
| Table 2 LC/MS data of α-glucosidase inhibitors screened out from ethyl acetate extract of Malus hupehensis |
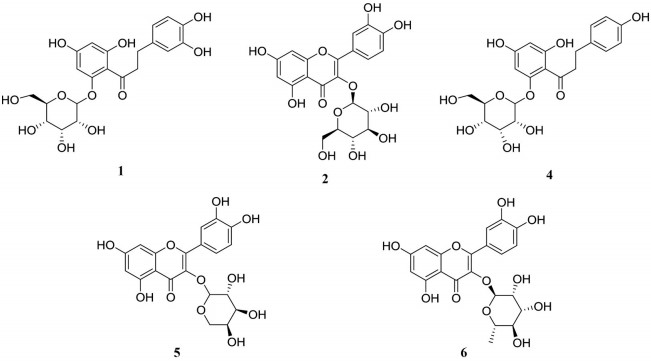
本研究在湖北海棠叶乙酸乙酯部位中筛选到2种二氢查尔酮类化合物, 分别为化合物1和化合物4, 以化合物4为例进行结构鉴定。化合物4 (tR = 25.20 min) 在ESI-模式下产生的准分子离子峰[M-H]-为m/z 435.129 5, 对m/z 435.129 5进行二级全扫描质谱分析, 产生的主要碎片离子有m/z 273、167、125, 与文献[12-16]报道相符。m/z 273是由母离子脱去一分子中性糖(162 u) 得到的苷元根皮素离子峰[12, 16], 其裂解规律与参考文献吻合[16]。结合裂解碎片信息, 参考文献[14]中化合物在反相色谱柱中保留时间, 可确定化合物1和4分别为3-OH根皮苷和根皮苷。
3.2.2 黄酮醇苷类化合物本研究在湖北海棠叶乙酸乙酯部位中筛选到4种黄酮醇苷类化合物, 分别为化合物2、3、5和6, 以化合物2为例进行结构鉴定。化合物2 (tR = 19.93 min) 在ESI-模式下产生的准分子离子峰[M-H]-为m/z 463.088 2, 对m/z 463.083 8进行二级质谱分析, 得到苷元槲皮素的离子峰m/z 301.031 5, 根据化合物分子量, 可推断出此化合物为槲皮素单糖苷。根据二级碎片离子m/z 300离子强度大于m/z 301, 在低质量区发现m/z 271、178和151离子片断, 可以确定为槲皮素3-O-苷类化合物[17]。其余3个化合物具有类似的裂解规律, 再结合参考文献[14]中化合物在反相色谱柱中保留时间, 可确定化合物2、5和6分别为槲皮素-3-O-β-D-吡喃葡萄糖、萹蓄苷和槲皮苷, 3号化合物为5号化合物异构体, 其准确结构有待进一步解析。
以上鉴定出的化合物结构式见图 6。此外, 1号化合物3-OH根皮苷与4号化合物根皮苷作为湖北海棠的主要活性成分, 已被证实具有α-葡萄糖苷酶抑制活性, 且与阳性抑制剂阿卡波糖相比具有更显著的浓度依赖性抑制作用[13]。2号化合物槲皮素-3-O-β-D-吡喃葡萄糖苷, 5号化合物萹蓄苷和6号化合物槲皮苷都是黄酮醇苷, 其苷元槲皮素对α-葡萄糖苷酶的抑制活性已被证实, 已有研究表明其母核色原酮B环上的两个羟基在酶的催化活性中发挥了重要作用[18]。
|
Figure 6 Structures of identified α-glucosidase inhibitors |
本研究基于近线高分辨活性轮廓分析建立了针对α-葡萄糖苷酶抑制剂的高效快速活性筛选平台, 通过对照品混合模型验证了该平台的可行性, 应用于湖北海棠叶提取物的乙酸乙酯部位, 筛选得到6个α-葡萄糖苷酶抑制剂, 其中5个被鉴定为3-OH根皮苷(1)、槲皮素-3-O-β-D-吡喃葡萄糖苷(2)、根皮苷(4)、萹蓄苷(5) 和槲皮苷(6)。该平台操作简单, 快速高效, 在高效分离到更多疾病相关靶点和中药活性成分筛选的研究中。
作者贡献: 郗玲玲完成了主体实验, 撰写了文章部分内容; 简敬一参与了实验设计, 撰写了文章主体内容; 査丁胜撰写了文章部分内容并提供了部分材料; 赵祥龙参与了部分实验并提供了部分材料; 汪锦才参与了部分实验并提供了部分材料; 李娟参与了实验设计并提供了部分材料; 江正瑾主导了实验设计并对文章进行了构思和主要修改; 张婷婷主导了实验设计并对文章进行了构思和主要修改。
利益冲突: 无任何利益冲突。
| [1] |
Pamungkas RA, Chamroonsawasdi K, Vatanasomboon P. A systematic review: family support integrated with diabetes self-management among uncontrolled type Ⅱ diabetes mellitus patients[J]. Behav Sci, 2017, 7: 62-78. DOI:10.3390/bs7030062 |
| [2] |
van de Laar FA, Lucassen PL, Akkermans RP, et al. α-Glucosidase inhibitors for patients with type 2 diabetes: results from a Cochrane systematic review and meta-analysis[J]. Diabetes Care, 2005, 28: 154-163. DOI:10.2337/diacare.28.1.154 |
| [3] |
Derosa G, Maffioli P. α-Glucosidase inhibitors and their use in clinical practice[J]. Arch Med Sci, 2012, 8: 899-906. |
| [4] |
Li Y, Li KY. Advances of chemical constituents and pharmacological activities of Malus hupehensis[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2016, 22: 226-229. |
| [5] |
Chen LL, Wu RJ, Liu LF, et al. Advances and application prospect of Malus hupehensis (Pamp.) Rehd[J]. North Hortic (北方园艺), 2013, 16: 217-227. |
| [6] |
Chen YL, Tan ZX, Peng Y. Application history and research status of Malus hupehensis leaves in Hubei province[J]. Mod Chin Med (中国现代中药), 2017, 19: 1505-1510. |
| [7] |
Wang CL, Wang P, Zhang ZW. Effect of Malus hupehensis on blood glucose in mice[J]. Res Pract Chin Med (现代中药研究与实践), 1999, 13: 19-20. |
| [8] |
Wang Y. Effect of Malus hupehensis leaves decoction on blood glucose in hyperglycemia mice[J]. Technol Wind (科技风), 2009, 11: 244-245. |
| [9] |
Jian JY, Chen HH, Hong QS, et al. Advances in chromatography-based methods for screening active compounds from natural products[J]. Acta Pharm Sin (药学学报), 2020, 55: 1504-1510. |
| [10] |
Mladic M, Zietek BM, Iyer JK, et al. At-line nanofractionation with parallel mass spectrometry and bioactivity assessment for the rapid screening of thrombin and factor Xa inhibitors in snake venoms[J]. Toxicon, 2016, 110: 79-89. DOI:10.1016/j.toxicon.2015.12.008 |
| [11] |
Liu R, Kool J, Jian J, et al. Rapid screening α-glucosidase inhibitors from natural products by at-line nanofractionation with parallel mass spectrometry and bioactivity assessment[J]. J Chromatogr A, 2021, 1635: 461740. DOI:10.1016/j.chroma.2020.461740 |
| [12] |
Nguyen PH, Dung VV, Zhao BT, et al. Antithrombotic and antidiabetic flavonoid glycosides from the grains of Sorghum bicolor (L.) Moench var. hwanggeumchal[J]. Arch Pharm Res, 2014, 37: 1394-1402. DOI:10.1007/s12272-014-0422-5 |
| [13] |
Lv Q, Lin Y, Tan Z, et al. Dihydrochalcone-derived polyphenols from tea crab apple (Malus hupehensis) and their inhibitory effects on alpha-glucosidase in vitro[J]. Food Funct, 2019, 10: 2881-2887. DOI:10.1039/C9FO00229D |
| [14] |
Liu M, Huang X, Liu Q, et al. Rapid screening and identification of antioxidants in the leaves of Malus hupehensis using off-line two-dimensional HPLC-UV-MS/MS coupled with a 1, 1'-diphenyl-2-picrylhydrazyl assay[J]. J Sep Sci, 2018, 41: 2536-2543. DOI:10.1002/jssc.201800007 |
| [15] |
Guo D, Dang J, Yang H, et al. Simultaneous determination of four flavonoids in rat plasma after oral administration of Malus hupehensis (Pamp.) Rehd. extracts by UPLC-MS/MS and its application to a pharmacokinetics study[J]. J Pharm Biomed Anal, 2020, 177: 112869. DOI:10.1016/j.jpba.2019.112869 |
| [16] |
Shen B, Zhou R, Yang Y, et al. Antimicrobial activity-guided identification of compounds from the deciduous leaves of Malus doumeri by HPLC-ESI-QTOF-MS/MS[J]. Nat Prod Res, 2019, 33: 2515-2520. DOI:10.1080/14786419.2018.1457666 |
| [17] |
Wang Y, Gu YT, Ding ZH, et al. Identification and analysis of quercetin and its glycosides from Rosa roxburghii by ultra high performance liquid chromatography-tandem high resolution mass spectrometry[J]. Chin J Anal Chem (分析化学), 2020, 48: 955-961. |
| [18] |
Xu H. Inhibition kinetics of flavonoids on yeast α-glucosidase merged with docking simulations[J]. Protein Pept Lett, 2010, 17: 1270-1279. DOI:10.2174/092986610792231492 |
 2021, Vol. 56
2021, Vol. 56


