2. 南京中医药大学国家教育部中药炮制规范化及标准化工程研究中心, 江苏 南京 210023;
3. 浙江中医药大学药学院, 浙江 杭州 310053;
4. 山西中医药大学中药与食品工程学院, 山西 晋中 030619
2. Engineering Center of State Ministry of Education for Standardization of Chinese Medicine Processing, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. School of Pharmacy, Zhejiang Chinese Medical University, Hangzhou 310053, China;
4. School of Chinese Medicine and Food Engineering, Shanxi University of Chinese Medicine, Jinzhong 030619, China
肝纤维化是由多种原因引起的肝损伤反应, 包括炎症感染、过量饮酒和代谢异常等。当损伤持续时, 受损的肝细胞释放活化的肝星状细胞因子, 从而导致肝星状细胞和非实质细胞产生过多的细胞外基质(ECM), 沉积在窦状隙腔, 最终导致肝纤维化的发生[1, 2]。传统医学中没有肝损伤或急性肝损伤的病名记载, 肝脏受到刺激时, 通过免疫反应清除病毒但同时也会导致肝细胞损伤, 主要病因在于湿邪, 肝脏失于疏泄、气机郁滞, 发为胁痛、臌胀、积聚等[3]。近年来, 中医药在治疗肝损伤领域有着较好的发展, 许多临床使用的保肝类中药具有促进肝脏血液流量、增强肝细胞修复、提高肝脏细胞内活性氧自由基清除能力等多方面作用, 可达到保护肝损伤的效果[4-7]。
山茱萸为山茱萸科植物山茱萸(Cornus officinalis Sieb. et Zucc.) 的干燥成熟果肉。山茱萸酸温质润, 性温而不燥, 补而不峻, 平补肝肾, 贾所学《药品化义》中有"山茱萸为补肝助胆良品"的记载。现代研究表明, 山茱萸总苷、三萜酸以及炮制后产生的5-羟甲基糠醛具有较好的抗肝损伤作用[8-10]。酒蒸山茱萸为山茱萸临床常用的炮制品, 山茱萸酒蒸后, 其化学成分发生了质和量的变化。许多研究表明, 山茱萸炮制品降低肝损伤模型的效果优于其生品, 然而对于其炮制增效的作用机制尚未有深入的研究[11, 12]。
代谢组学目前已逐渐应用于中药炮制机制的研究。代谢组学通过高通量筛选技术结合数据统计对于内源性代谢物的全貌概况分析, 符合中药多成分和多靶点的特性[13, 14]。该研究方法通过对生物体血液、尿液、脑脊液、粪便中代谢物变化的检测, 运用数据统计, 分析中药炮制前后对生物体代谢途径和作用网络的变化, 以深入探究中药炮制机制[15, 16]。Hu等[17]在研究黄芩酒制机制的过程中, 应用代谢组学技术检测了生、酒黄芩组大鼠的血浆, 发现了16种生物标志物, 分析生黄芩可能是通过调节异常的鞘脂代谢途径来治疗大鼠急性肺损伤(ALI), 而酒黄芩则是通过逆转视黄醇代谢和色氨酸代谢途径的异常来治愈ALI。并通过LPS诱导的ALI模型, 分别给予生、酒黄芩水煎液, 比较生、酒黄芩对ALI的干预作用, 发现黄芩酒制品在降低炎症因子(NO、TNF-α、IL-6和IL-8) 水平方面优于黄芩生品。
因此, 本研究采用基于色谱-质谱联用技术的中药效应代谢组学表征内源性代谢产物组, 并结合多种经典药效指标, 比较山茱萸生、制品对补益肝肾的药效强度, 揭示山茱萸生、制品体内代谢的调控机制, 阐明山茱萸"蒸制"整体药效的变化规律, 以期进一步完善山茱萸的系统性研究。
材料与方法药物 山茱萸产地为浙江磐安, 经南京中医药大学中药鉴定教研室陈建伟教授鉴定为正品, 即为山茱萸(Cornus officinalis Sieb. et Zucc.) 的干燥成熟果肉。山茱萸制品的炮制方法为: 称取山茱萸1 kg, 加入黄酒25% (w/w), 拌匀闷润1 h, 115 ℃蒸制1 h, 60 ℃烘干。分别精确称取山茱萸生、制品各600 g, 10倍水浸泡30 min, 煎煮1.5 h后4层纱布过滤, 残渣加入8倍量水煎煮1.5 h后4层纱布过滤, 合并滤液, 旋蒸浓缩至生药量浓度0.3 g·mL-1, 即得山茱萸生、制品提取液。四氯化碳(CCl4, C805332, 上海麦克林生化科技有限公司)、橄榄油(欧丽薇兰食用橄榄油, 上海鑫星食品工业有限公司)、秋水仙碱(国药准字H53021369, 西双版纳药业有限公司)。
动物 雄性SD大鼠54只, SPF级, 体重180 ± 220 g, 采购自北京斯贝福生物技术有限公司, 许可证号: SCXK (京) 2019-0010, 饲养条件: 室温22~27 ℃, 相对湿度50% ± 5%, 自由摄食及饮水。本实验中的所有动物实验均按照南京中医药大学动物实验中心饲养和使用指南进行, 并获得南京中医药大学实验动物伦理委员会批准(批准号: 202009A012)。
仪器与试剂 脱水机(TP1020)、包埋机(Histo Core Arcadia)、病理切片机(RM2265) 均购自德国Lecia; 冻台(JB-L5, 武汉俊杰电子有限公司)、组织摊片机(KD-P, 浙江省金华市科迪仪器设备有限公司)、烤箱(GFL-230, 天津市莱波瑞仪器设备有限公司)、载玻片(188105, 世泰)、正置光学显微镜(Nikon Eclipse 80i, 日本)。超高效液相色谱仪(Shimadzu 30AD, 日本); Triple TOF 5600+系统、数据采集软件Analyst TF1.6 software、数据处理软件系统PeakViewTM软件和MarkerViewTM软件均来自美国AB Sciex公司; 超声波清洗器(KQ5300DC型, 昆山超声仪器有限公司); SPE固相萃取小柱(WATO43395 Waters Sep-pak C18, 上海); 十万分之一电子天平(BSA2245-CW, 北京赛多利斯科学仪器有限公司); 超纯水Milli-Q water由Milli-Q超纯水净化系统(Millipore, Intagral-3, 美国) 制备。谷丙转氨酶(ALT, 20210107)、谷草转氨酶(AST, 20210107)、羟脯氨酸(hydroxyproline, HYP, 20210115) 检测试剂盒均购自南京建成生物工程研究所; 无水乙醇和二甲苯均购自南京化学试剂有限公司; HE染色液(ANG-RS0001)、Masson染色液(ANG-RS0046)、分化液(ANG-FH0003)、返蓝液(ANG-FL0007) 均购自南京奥青生物技术有限公司; 中性树胶(N116470, 阿拉丁)。
动物分组及给药 54只SD大鼠随机分为9组, 每组6只。空白对照组(C)、模型组(M)、阳性药组(秋水仙碱0.2 mg·kg-1, Y)、山茱萸生品低剂量组(0.3 g·kg-1, SL)、山茱萸生品中剂量组(1 g·kg-1, SM)、山茱萸生品高剂量组(3 g·kg-1, SH)、山茱萸制品低剂量组(0.3 g·kg-1, ZL)、山茱萸制品中剂量组(1 g·kg-1, ZM)、山茱萸制品高剂量组(3 g·kg-1, ZH)。模型组及给药组皮下注射40%四氯化碳(CCl4) 橄榄油溶液, 首剂量0.5 mL·100 g-1, 以后每周0.3 mL·100 g-1注射2次, 持续8周。造模第3周开始给予药物干预(10 mL·kg-1), 空白对照组及模型组灌胃生理盐水, 阳性药组灌胃秋水仙碱溶液(0.2 mg·kg-1), 连续给药6周。
样本采集 大鼠末次给药30 min后, 腹腔注射1.5%戊巴比妥钠(30 mg·kg-1, ip) 进行麻醉, 麻醉成功后, 腹主动脉取血3~5 mL。所取血浆置于-80 ℃冰箱保存备用。血清样本3 500 r·min-1离心10 min, 取上清测定谷丙转氨酶(ALT)、谷草转氨酶(AST)。腹主动脉取血后, 摘取各组大鼠肝脏, 生理盐水清洗, 取1/2肝脏, 用4%多聚甲醛固定, 用作HE和Masson染色; 剩余1/2肝脏保存于-80 ℃冰箱, 用于测定肝脏中羟脯氨酸HYP表达。
液相条件 Agilent C18反相UHPLC柱(2.1 mm × 100 mm, 1.8 μm); 柱温: 30 ℃; 流速0.3 mL·min-1; 流动相: 乙腈(B)-0.1%甲酸水(A); 进样量: 3 μL; 梯度洗脱程序: 0~3.0 min, 5%~20% B; 3.0~7.0 min, 20%~80% B; 7.0~30 min, 80%~90% B; 30~32 min, 90%~5% B; 32~35 min, 5% B。
质谱条件 质谱分别在正离子和负离子检测模式下操作。具体参数设置如下: 离子源温度: 550 ℃; 离子喷雾电压: 5 500~4 500 V; 喷雾辅助气体: 氮气; 雾化气(Gas 1): 55 psi (1 psi ≈ 6.9 kPa); 辅助加热气(Gas 2): 55 psi; 气帘气(CUR): 35 psi; 去簇电压(DP): 60 V; 碰撞能量(CE): 30 V; TOF MS和TOF MS/MS的扫描范围分别为100~2 000 Da和50~1 000 Da。
数据处理 将Analyst软件采集到的各组质谱数据导入MarkerViewTM, 进行峰对齐和归一化处理, 为挖掘大鼠肝纤维化相关的潜在生物标志物, 通过SIMCA软件对空白对照组及模型组质谱数据进行两两对比的OPLS-DA分析, 以VIP > 1.5为标准筛选出可能对分类有显著作用的潜在内源性代谢物, 根据其精确的分子量查询公共数据库(HMDB) 检索化合物信息, 并结合文献及MS谱信息共同鉴定潜在生物标志物。将筛选出的内源性代谢物导入MetaboAnalyst进行代谢通路的相关分析。
结果 1 山茱萸生、制品提取物对肝纤维化大鼠生化指标的影响结果如图 1和表 1所示。空白对照组大鼠血清中ALT和AST指标水平均在正常范围; 肝纤维化模型大鼠血清中ALT和AST指标水平与空白对照组相比具有极显著性差异(P < 0.01); 秋水仙碱组相较于模型组ALT和AST指标水平均下降, 有极显著性差异(P < 0.01); 山茱萸生品及制品水煎液低、中、高剂量组与模型组相比ALT和AST指标水平均下调, 有极显著性差异(P < 0.01), 且表现出剂量相关性。根据统计结果, 山茱萸制品低、中剂量组逆转ALT指标水平优于其生品低、中剂量组, 山茱萸生、制品高剂量组之间虽无显著性差异, 但其制品高剂量组呈现降低趋势; 山茱萸制品低、高剂量组逆转AST指标水平优于其生品低、高剂量组, 山茱萸生、制品中剂量组之间虽无显著性差异, 但其制品中剂量组呈现降低趋势。综合来看, 山茱萸制品给药组逆转ALT和AST指标水平优于其生品给药组。
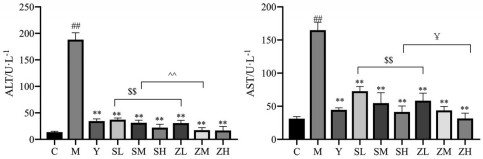
|
Figure 1 Results of biochemical indicators (n = 6, x± s). ##P < 0.01 vs C; **P < 0.01 vs M; $$P < 0.01 vs SL; ^^P < 0.01 vs SM; ¥P < 0.05 vs SH. C: Control group; M: Model group; Y: Colchicine group; SL, SM, and SH: Extracts of crude Fructus Corni groups with low, middle, and high-doses; ZL, ZM, and ZH: Extracts of wine-processed Fructus Corni groups with low, middle, and high-doses |
| Table 1 Results of biochemical indicators and HYP expression (n = 6, x± s). ##P < 0.01 vs C; **P < 0.01 vs M |
结果如图 2和表 1所示。空白对照组大鼠肝脏中HYP表达水平在正常范围; 模型组大鼠肝脏中HYP表达水平与空白对照组相比具有极显著性差异(P < 0.01); 秋水仙碱组相较于模型组HYP表达水平下降, 有极显著性差异(P < 0.01); 山茱萸生品及制品水煎液低、中、高剂量组与模型组相比HYP表达水平均下调, 有极显著性差异(P < 0.01), 且表现出剂量相关性。根据统计结果, 山茱萸制品高剂量组与其生品各剂量组及其制品低剂量组相比, 逆转HYP表达水平均呈现显著性差异, 与其制品中剂量组相比虽无显著性差异, 但其结果呈现下降趋势。综合来看, 山茱萸制品高剂量组逆转HYP表达水平最佳。
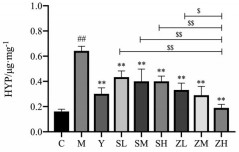
|
Figure 2 Results of hydroxyproline (HYP) expression (n = 6, x± s). ##P < 0.01 vs C; **P < 0.01 vs M; $P < 0.05, $$P < 0.01 vs ZH |
HE和Masson染色结果如图 3所示。HE染色结果显示, 空白对照组肝组织细胞大小形态正常, 肝细胞排列整齐, 结构清晰; 模型组肝组织损伤严重, 肝细胞明显水肿、脂肪变性、坏死, 视野中形成可见P-C桥连, 门管区炎细胞浸润明显, 形成假肝小叶。给予秋水仙碱和山茱萸生、制品水煎液处理后, 肝组织有好转, 秋水仙碱组视野中肝细胞明显脂肪变性、坏死, 可见P-C桥连, 但门管区未见炎细胞浸润。山茱萸生品低、中剂量组视野中部分肝细胞脂肪变性、坏死, 部分区域组织可见P-C及P-P桥连, 门管区肝细胞明显坏死、炎细胞明显浸润。山茱萸生品高剂量组视野中部分炎细胞轻度浸润。山茱萸制品低剂量组视野中明显可见肝细胞脂肪变性、坏死, P-C桥连明显, 门管区肝细胞明显坏死、炎细胞浸润。山茱萸制品中剂量组P-C桥连减少, 门管区炎细胞数目较少、浸润不明显。山茱萸制品高剂量组视野中可见较大区肝细胞脂肪变性、部分区域局灶性坏死, 但门管区未见炎细胞浸润。整体上, 山茱萸制品组对于肝纤维化的肝脏保护效果更佳。
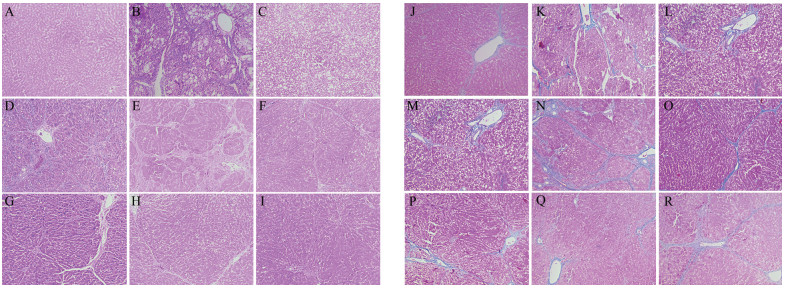
|
Figure 3 Effects of crude and processed Fructus Corni groups on liver histopathology of hepatic fibrosis in rats. A-I: HE staining, ×100; J-R: Masson staining, ×100. A and J: C; B and K: M; C and L: Y; D-F and M-O: SL, SM, and SH; G-I and P-R: ZL, ZM, and ZH |
Masson染色结果显示, 空白对照组大鼠肝组织细胞大小形态正常, 肝细胞排列整齐, 未见明显异常。模型组大鼠肝组织汇管区扩大, 纤维细胞向肝小叶蔓延形成纤维间隔, 有假小叶形成。给予秋水仙碱和山茱萸生、制品水煎液处理后, 相较于模型组, 肝组织形态有明显改善。山茱萸生品低剂量组肝小叶结构明显破坏。山茱萸生品中剂量组视野内汇管区纤维组织增生明显。山茱萸生品高剂量组和山茱萸制品中、高剂量组纤维增生不明显, 纤维化程度明显弱于模型组。
4 山茱萸生、制品提取物干预下的大鼠肝纤维化血浆代谢组学分析 4.1 肝纤维化的潜在生物标志物筛选将空白对照组和肝纤维化模型组大鼠血浆经UHPLC-Q-TOF-MS/MS检测后得到的原始数据导入SIMCA进行PCA分析(图 4a和图 4b)。结果显示, 皮下注射40% CCl4橄榄油溶液后, 大鼠体内的小分子代谢物发生了异常改变, 空白对照组和肝纤维化模型组大鼠样本点完全分离, 表明模型复制成功。可以通过比较组间内源性代谢物的变化来寻找差异性代谢物。对空白对照组和模型组进行OPLS-DA分析, 选择VIP > 1.5的差异变量, 并通过t-检验对差异变量进行初步筛选(P < 0.05), 将筛选出的差异变量荷质比输入HMDB在线数据库进行比对(质荷比误差为10 ppm)。在正、负离子模式下, 以PeakViewTM同位素误差匹配和二级碎片匹配 > 80%为标准, 在模型组大鼠血浆中共筛选得到24种与肝纤维化发病相关的生物标志物, 结果见表 2。基于MetaboAnalyst数据库的pathway analysis模块, 导入所有差异代谢物进行代谢通路分析, 共鉴定出5条与肝纤维化发病机制相关的代谢通路(图 5), 分别为: 初级胆汁酸代谢(primary bile acid metabolism)、甘油磷脂代谢(glycerol phospholipid metabolism)、戊糖和葡萄糖醛酸脂代谢(pentose and glucuronide metabolism)、视黄醇代谢(retinol metabolism)、花生四烯酸代谢(arachidonic acid metabolism)。
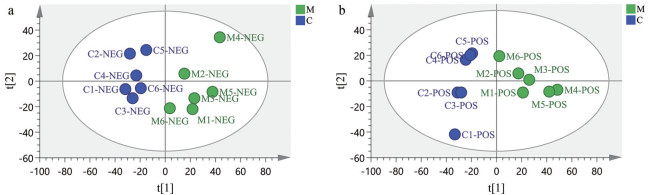
|
Figure 4 PCA score plots (a: Negative ion mode; b: Positive ion mode) of plasma samples from blank control and model groups. C: Blank control group; M: Model group |
| Table 2 Results of identified key potential biomarkers. ↑ and ↓ represent higher and lower compared to blank control group |

|
Figure 5 Pathway analysis of differential metabolites. A: Primary bile acid metabolism; B: Glycerol phospholipid metabolism; C: Pentose and glucuronide metabolism; D: Retinol metabolism; E: Arachidonic acid metabolism |
将空白对照组、模型组和山茱萸生、制品高剂量组共4组样本的数据进行峰对齐和归一化处理后的数据导入SIMCA分析。结果显示, 在正、负离子模式下, 空白对照组与模型组分布于不同的象限区域内, 且各组内样品点聚集良好(图 6)。给药组在干预模型大鼠后, 其回调趋势向空白对照组接近, 且山茱萸制品高剂量组相较于其生品高剂量组更趋向于空白对照组。

|
Figure 6 OPLS-DA score plot of plasma samples from blank control group, model group, and crude and wine-processed Fructus Corni groups with high-dose |
将山茱萸生、制品组的质谱数据导入MarkerViewTM软件, 对24种内源性成分进行提取分析。在给予药物治疗后, 一些在病理状态下异常变化的代谢物群能显著性回调到正常状态的, 即为所要寻找的药效生物标记物。经给药干预后, 有10种潜在生物标志物显著回调。同时, 通过计算这10种潜在生物标志物回调的矫正率[(给药组响应值-模型组响应值) / (空白对照组响应值-模型组响应值)×100%] 来评价给药后各组药物的整体疗效, 结果见表 3和图 7。相较于山茱萸生品组, 山茱萸制品组回调趋于正常的标志物效果更佳。
| Table 3 Callback effects of pharmacodynamic biomarkers related to pathogenesis of hepatic fibrosis after drug intervention |
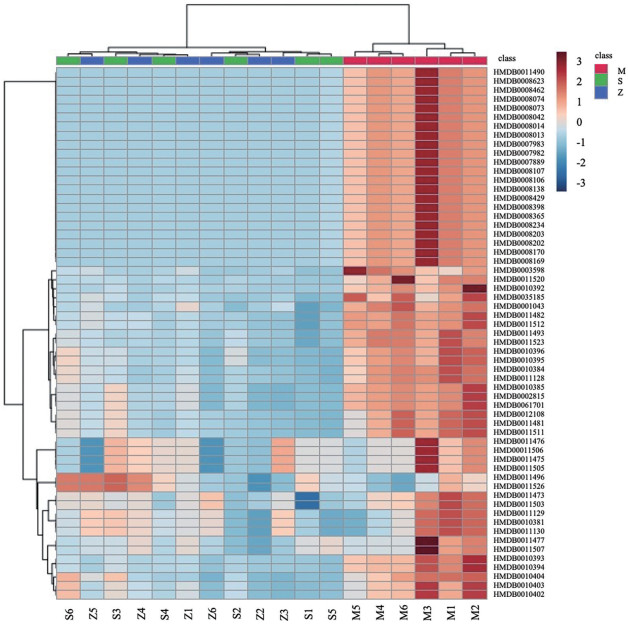
|
Figure 7 Heatmap of differential abundance of metabolites in model group, and crude and wine-processed Fructus Corni groups with high-dose. Rows represent samples; columns represent metabolites. The degree of color saturation indicates the metabolite expression values with blue representing the lowest expression and red representing the highest expression |
四氯化碳(CCl4) 是在啮齿动物肝纤维化和肝硬化研究中最广泛使用的肝毒素, 它模拟了与毒性损伤有关的人类慢性疾病。CCl4的肝脏生物转化依赖于CYP2E1, 生成三氯甲基自由基, 三氯甲基自由基参与多种自由基反应和脂质过氧化过程, 导致了一种由小叶中心肝细胞坏死、巨噬细胞活化和炎症反应诱导形成的急性期反应, 该过程产生一些促进肝干细胞(HSC) 激活的细胞因子, 从而促进肝纤维化[18]。
本研究以皮下注射40% CCl4橄榄油溶液复制肝纤维化模型, 采用UHPLC-Q-TOF-MS/MS分析手段, 并结合经典的药效指标检测, 开展了山茱萸生、制品提取物干预下的肝纤维化大鼠血浆代谢组学研究。药效学结果表明, 皮下注射40% CCl4橄榄油溶液可诱导肝纤维化, 生化指标ALT和AST、肝脏羟脯氨酸HYP显著升高(P < 0.01)。HE和Masson染色可见明显的肝细胞破坏、炎性浸润以及纤维增生。给予山茱萸生、制品水煎液后, ALT、AST、HYP表达均下调, 炎性浸润减少, 纤维增生改善。说明山茱萸具有良好的抗肝纤维化作用, 且制品效果优于生品, 其中以制品高剂量改善肝纤维化效果最佳。
代谢组学分析显示, 模型组与空白对照组血浆样本可明显分为两类。给予山茱萸生、制品水煎液后, 给药组与模型组分离并向空白对照组移动, 提示山茱萸可干预模型组肝纤维化, 恢复机体代谢紊乱。与空白对照组相比, 模型组经筛选鉴定得到24种与肝纤维化相关的潜在生物标志物, 主要参与初级胆汁酸代谢、甘油磷脂代谢、戊糖和葡萄糖醛酸脂代谢、视黄醇代谢、花生四烯酸代谢。这些代谢通路对应的差异性代谢物对疾病的发生和发展产生重要的影响。山茱萸生、制品水煎液对其中10种标志物有着不同程度的回调作用。
甘油磷脂在机体中含量丰富, 其中溶血磷脂酰胆碱(LPC) 和溶血磷脂酰乙醇胺(LPE) 共同约占细胞膜磷脂类成分的50%, 此外还参与细胞膜对蛋白质的识别和信号传导等。当肝脏受损, 蛋白质激酶C (PKC) 途径激活, 肝脏中磷脂酶A2 (PLA) 活性增强, LPC和LPE含量降低, 而LPC和LPE是磷脂酰胆碱经PLA降解生成的产物, 因此溶血磷脂的不足反映了磷脂酰胆碱的不足[19, 20]。磷脂酰胆碱类物质含量变化与机体免疫和炎症反应的激活密切相关。本研究结果与文献报道一致, 相比于空白对照组, 模型组的LPC和LPE含量显著下降。给予山茱萸水煎液后, LPC和LPE回调并趋于正常水平。根据表 3的计算可知, 山茱萸制品对于LysoPC (22∶6/0∶0)、LysoPC (20∶4/0∶0)、LysoPE (0∶0/22∶4) 等的回调水平优于其生品。
视黄醇代谢可促进HSC的活化, 促进肝纤维化。肝星状细胞(HSC) 是储存视黄酯(retinyl ester) 的主要细胞, 视黄酯可以激活JAK2/STAT5信号通路, 并上调固醇调节元件结合蛋白的表达来抑制肌成纤维细胞标志物的产生, 可以维持HSC的静止状态, 预防肝纤维化的发生[21, 22]。在CCl4诱导的大鼠肝纤维化进程中, 肝脏中的视黄酯和视黄醇乙酸酯水平明显下降, 导致HSC激活, 视黄醇受体信号转导增强, 活化TGF-β, 随后诱导肝纤维化。给予模型组大鼠山茱萸水煎液后可回调视黄酯的水平, 山茱萸生品水煎液回调了132.94%, 山茱萸制品水煎液回调了121.73%, 山茱萸制品的回调水平更趋于空白对照组。
花生四烯酸在正常生理状态下主要以磷脂的形式存在于细胞膜上, 在调节肝脏生理和病理的过程中至关重要。当肝实质细胞膜受到刺激时, 花生四烯酸经环氧合酶转化生成前列腺素, 进一步激活扩大炎症反应导致更为严重的肝损伤[23, 24]。本研究结果显示, 在CCl4的刺激下, 花生四烯酸代谢紊乱, 给予山茱萸水煎液后回调。
综上所述, 肝纤维化的发生是多条代谢通路的共同作用产生的, 山茱萸生、制品水煎液可通过回调溶血磷脂酰胆碱、溶血磷脂酰乙醇胺、视黄酯、视黄醇乙酸酯、花生四烯酸等多种生物标志物, 干预肝纤维化的进程, 从而发挥抗肝纤维化的作用。结合药效指标与回调水平, 山茱萸制品在调节甘油磷脂代谢、视黄醇代谢、花生四烯酸代谢方面效果更佳, 因此表现出更好的抗肝纤维化效果, 进而从血浆代谢的角度阐明了山茱萸蒸制增效的机制。
作者贡献: 蔡皓负责整体设计及文章修改, 钮敏洁负责整体设计、实验操作、数据处理及文章撰写, 王梦晴、于慧、刘鑫、张专协助完成动物实验, 曹岗、段煜、裴科协助指导实验。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Yoo W, Lee J, Hee Noh K, et al. Progranulin attenuates liver fibrosis by downregulating the inflammatory response[J]. Cell Death Dis, 2019, 10: 758. DOI:10.1038/s41419-019-1994-2 |
| [2] |
Kao AW, McKay A, Singh PP, et al. Progranulin, lysosomal regulation and neurodegenerative disease[J]. Nat Rev Neurosci, 2017, 18: 325-333. DOI:10.1038/nrn.2017.36 |
| [3] |
Ma YX. The Theory and Experiment Research of Effect of Chinese Medicine on Liver Injury (中药抗肝损伤理论与实验研究)[D]. Nanjing: Nanjing University of Chinese Medicine, 2015.
|
| [4] |
Su XW, Nong XX, Wang ZC, et al. Study on the mechanism of effective active ingredients of Huangqi on liver fibrosis[J]. Henan Tradit Chin Med (河南中医), 2021, 41: 618-621. |
| [5] |
Wu GQ, Cao G, Xia YH, et al. Protective effects of processed Fructus Corni aqueous extract against carbon tetrachloride-induced acute liver injury in rats[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2014, 32: 2391-2392. |
| [6] |
Zhang YM, Zhao M, Liu YY, et al. Investigation of the therapeutic effect of Yinchen Wuling Powder on CCl4-induced hepatic fibrosis in rats by 1H NMR and MS-based metabolomics analysis[J]. J Pharm Biomed, 2021, 200: 114073. DOI:10.1016/j.jpba.2021.114073 |
| [7] |
Zhang Y, Zhou Q, Ding X, et al. Chemical profile of Swertia mussotii Franch and its potential targets against liver fibrosis revealed by cross-platform metabolomics[J]. J Ethnopharmacol, 2021, 274: 114051. DOI:10.1016/j.jep.2021.114051 |
| [8] |
Nan MJ, Tang K, Zhang HW, et al. Study on the liver-protective effects of different parts extracts of Cornus officinalis on acute liver injury model mice[J]. China Pharm (中国药房), 2018, 29: 2385-2389. |
| [9] |
Zhao CX, Zhang YM, Liu HS, et al. Protective effect of total glycosides from Cornus Officinalis against acute immunologic liver injury induced by ConA in mice[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2017, 35: 1968-1971. |
| [10] |
Yang GM, Zhang YL, Dai TT, et al. Protective effect of Maillard reaction products of Fructus Corni on CCl4-induced liver injury in mice[J]. Tradit Chin Drug Res Clin Pharmacol (中药新药与临床药理), 2015, 26: 786-790. |
| [11] |
Li JS, Yu ZL, Wang MY, et al. Protecting effect of Fructus Corni Officinalis before and after preparation on mice acute liver damage[J]. J Nanjing Tradit Chin Med Univ (南京中医药大学学报), 2008, 24: 236-238. |
| [12] |
Bi HL, Niu D, Guo C, et al. Comparative study of crude and wine-processing Corni Fructus on chemical composition and antidiabetic effects[J]. Evid Based Complement Alternat Med, 2019, 2019: 3986964. |
| [13] |
Hao HM, Jia XY, Zhou HB, et al. Investigation of the anti-renal fibrosis effect of Amygdalus mongolica using metabonomics[J]. Acta Pharm Sin (药学学报), 2020, 55: 2182-2190. |
| [14] |
Du K, Gao XX, Feng Y, et al. Effects of Guilingji on Kidney-Yang deficiency syndrome in rats based on serum metabolomics[J]. Acta Pharm Sin (药学学报), 2019, 54: 1476-1483. |
| [15] |
Chen ZM, Hu CJ, Zheng W, et al. Overview on application of metabonomics in study on processing mechanism of traditional Chinese materia medica[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2018, 36: 275-279. |
| [16] |
Qin KM, Wang B, Chen LW, et al. Perspective and application of metabonomics in modern study of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 3010-3017. |
| [17] |
Hu LQ, Wang YQ, Sun HJ, et al. An untargeted metabolomics approach to investigate the wine-processed mechanism of Scutellariae radix in acute lung injury[J]. J Ethnopharmacol, 2020, 253: 112665. DOI:10.1016/j.jep.2020.112665 |
| [18] |
Yanguas SC, Cogliati B, Willebrords J, et al. Experimental models of liver fibrosis[J]. Arch Toxicol, 2016, 90: 1025-1048. DOI:10.1007/s00204-015-1543-4 |
| [19] |
Wu X, Cao H, Zhao LF, et al. Metabolomic analysis of glycerophospholipid signatures of inflammation treated with non-steroidal anti-inflammatory drugs-induced-RAW264.7 cells using 1H NMR and U-HPLC/Q-TOF-MS[J]. J Chromatogr B, 2016, 1028: 199-215. DOI:10.1016/j.jchromb.2016.06.032 |
| [20] |
Mai DT, Yang C, Xue Y, et al. Investigation on silymarin impact on lipopolysaccharide induced inflammation model based on arachidonic acid metabolism pathway[J]. Chin J Chromatography (色谱), 2017, 35: 578-586. DOI:10.3724/SP.J.1123.2017.01026 |
| [21] |
Yoneda A, Sakai-Sawada K, Niitsu Y, et al. Vitamin A and insulin are required for the maintenance of hepatic stellate cell quiescence[J]. Exp Cell Res, 2016, 341: 8-17. DOI:10.1016/j.yexcr.2016.01.012 |
| [22] |
Shimizu H, Tsubota T, Kanki K, et al. All-trans retinoic acid ameliorates hepatic stellate cell activation via suppression of thioredoxin interacting protein expression[J]. J Cell Physiol, 2018, 233: 607-616. DOI:10.1002/jcp.25921 |
| [23] |
Phillips RJ, Fortier MA, López Bernal A. Prostaglandin pathway gene expression in human placenta, amnion and choriodecidua is differentially affected by preterm and term labour and by uterine inflammation[J]. BMC Pregnancy Childbirth, 2014, 14: 241. DOI:10.1186/1471-2393-14-241 |
| [24] |
Hoxha M. A systematic review on the role of eicosanoid pathways in rheumatoid arthritis[J]. Adv Med Sci, 2018, 63: 22-29. DOI:10.1016/j.advms.2017.06.004 |
 2021, Vol. 56
2021, Vol. 56


