2. 福建中医药大学药学院, 福建 福州 350122;
3. 海军军医大学长海医院药学部, 上海 200433
2. School of Pharmacy, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China;
3. Department of Pharmacy, Changhai Hospital, Naval Military Medical University, Shanghai 200433, China
阿尔茨海默病(Alzheimer's disease, AD) 是一种起病隐匿的神经退行性疾病, 是痴呆症中最常见的一种形式, 患者最主要临床特征是记忆衰退和认知功能丧失[1]。AD的病理特征为神经原纤维缠结(NFT) 和β-淀粉样蛋白(Aβ) 沉积, 还包括神经元丢失、DNA损伤、能量代谢受损、慢性氧化应激等[2]。基于AD复杂的病理机制和疗效欠佳的单靶点药物, 中药因其多组分、多靶点等特性, 近年来已成为治疗AD的潜在药物。丹参中丹参酮类化合物为心脑血管疾病治疗的主要活性物质, 研究表明丹参酮IIA和丹参酮B能降低Tau蛋白的表达, 减弱其磷酸化[3-5]; 知母中的知母皂苷元是抗AD潜在活性成分[6, 7]。然而, 中药丹参和知母因成分的复杂性和AD复杂的发病机制, 难以科学地探讨其治疗AD的机制。
代谢组学对复杂生物基质中的整体代谢特性的研究, 与中医药的整体思维一致, 可用于AD诊断或预后生物标志物的发现, 探究AD病理机制及中药药效。已有报道代谢组学在中药治疗AD的应用, 主要是动物和人体样本[8]。动物模型可以部分模拟AD的病理改变, 但其与人类的种属差异为临床转化埋下了诸多隐患[9]。而细胞代谢组学则可借助于各种人源细胞模型, 鉴识细胞内源性代谢物, 直接反映细胞生命活动的生物标志物信息, 从而揭示有关细胞的代谢途径和过程, 对于体外研究药物作用下代谢谱的变化及改变机制具有重要意义[10, 11]。与整体代谢研究相比, 细胞代谢组学具有一些独特的优势, 如容易控制实验变化、高度重现性、低成本、结果更易解释等。课题组前期通过细胞代谢组学方法研究了丹参对Aβ损伤的AD细胞模型的保护机制[12], 同时发现单一病理机制的AD细胞模型有利于结果阐释和探究中药的作用机制。
本实验通过冈田酸(okadaic acid, OA) 诱导SH-SY5Y细胞Tau蛋白异常磷酸化建立AD细胞模型, 运用细胞代谢组学策略, 寻找AD细胞模型与正常细胞的差异代谢物, 比较研究丹参和知母提取液对AD细胞模型的保护作用机制, 以期为中药防治AD的药效作用机制研究提供新的角度和参考。
材料与方法实验仪器 CKX-41型高倍显微镜(日本OLYMPUS公司), ELX-800型全自动酶标仪(美国Bio-TEK公司), Mini-PROTEAN电泳系统、Mini Trans-Blot转印系统(美国Bio-Rad公司), DFY-200摇摆式粉碎机(浙江大德中药机械有限公司), HA-202M电子分析天平(日本A & D公司), 1290型超高液相色谱仪、6530型四极杆-飞行时间质谱仪(美国Agilent公司), Milli-Q超纯水系统(美国Millipore公司)。
药物及试剂 丹参饮片、知母饮片(上海雷允上有限公司), 多奈哌齐(中国食品药物检定研究院), 十二烷基硫酸钠(sodium dodecyl sulfate, SDS)、甘氨酸、Tris-base (上海生工生物工程有限公司), 蛋白浓度测定试剂盒(上海碧云天生物科技有限公司), CCK8试剂盒、SDS-PAGE试剂盒(大连美仑生物有限公司), DMEM培养基、磷酸盐缓冲盐(PBS) (美国Corning公司), 胰蛋白酶、胎牛血清(FBS) (美国Gibco公司), 人神经母细胞瘤细胞(SH-SY5Y) (美国ScienCell公司), 兔源Tau (phosphor Ser404)一抗、FITC标记的兔源IgG二抗(英国Abcam公司), 二甲基亚砜(DMSO)、冈田酸(OA)、L-丙氨酸等标准品(美国Sigma-Aldrich公司)。所有化学试剂除特殊说明外均为分析纯。
中药材提取丹参提取 将干燥丹参药材粉碎成粉, 称取100 g加入1 L乙醇(90%) 回流1.5 h, 减压过滤并通过旋蒸得到醇提浓缩液。同时药渣加水煎煮两次, 每次1 h, 合并滤液并减压浓缩, 得到水提浓缩液。合并醇提与水提浓缩液后减压浓缩至适量[13]。
知母提取 将干燥知母药材粉碎成粉, 称取100 g加入1 L乙醇(90%) 回流2 h并重复2次, 合并提取液后减压过滤并旋蒸得到醇提浓缩液。同时药渣加水煎煮1 h一次, 合并滤液并减压浓缩, 得到水提浓缩液。合并醇提与水提浓缩液后减压浓缩至适量[13, 14]。
细胞培养 SH-SY5Y细胞常规培养于添加有10% FBS、100 U·mL-1青霉素-链霉素的DMEM培养基中, 37 ℃、5% CO2培养箱中孵育培养。
AD细胞模型的建立OA给药浓度考察 将生长至85%状态良好的SH-SY5Y细胞消化制成单细胞悬液, 按照每孔100 μL, 每孔5×103个的密度接种, 贴壁后, 弃去旧培养基加入100 μL含不同浓度OA溶液(0、5、10、20、40、80 nmol·L-1) 的培养基, 阴性对照组(不含OA) 和空白组(不含细胞) 分别加入等体积的新鲜培养基, 培养24 h后, 弃去培养基, 于空白组孔、阴性对照组孔和OA给药组孔加入10% CCK8工作溶液, 继续孵育3 h, 测量450 nm处吸光度值。
细胞形态分析 将对数生长期的SH-SY5Y细胞消化后以每孔1×105个的密度接种到6孔板培养12 h, 对照组和模型组分别加入2 mL的新鲜培养基和含有40 nmol·L-1 OA的培养基, 培养24 h后于倒置显微镜下观察。
免疫印迹实验 用预冷的PBS洗涤细胞并裂解, 4 ℃、13 000 g离心15 min, 上清采用BCA定量试剂盒进行总蛋白定量。根据蛋白上样量(60 μg) 和蛋白定量浓度计算蛋白上样体积。蛋白样品用SDS-PAGE电泳分离后, 转至NC膜。5%脱脂奶粉室温封闭后用一抗4 ℃孵育过夜, PBST洗脱后孵育二抗, 漂洗NC膜后进行信号检测。
药物对SH-SY5Y细胞的毒性实验 细胞毒性实验分组如下: 阴性对照组、阳性药组(10、3、1、0.3和0.1 μmol·L-1多奈哌齐溶液)、知母药物组(200、100、50、25和12.5 μg·mL-1知母溶液)、丹参药物组(200、100、50、25和12.5 μg·mL-1丹参溶液)。将细胞消化后以每孔5×103个, 每孔100 μL接种, 待贴壁后, 加入培养基和不同浓度药物溶液, 培养24 h后弃去培养基, 各组分别加入10% CCK8试剂的培养基继续避光孵育3 h, 于450 nm处测量吸光度值。
药物对AD细胞模型的药效实验 选用40 nmol·L-1 OA损伤SH-SY5Y细胞24 h作为AD模型组。实验设立空白组(空白培养基)、阴性对照组(空白培养基+细胞)、模型组(OA 40 nmol·L-1损伤细胞)、阳性药组和不同浓度药物保护组(药物+细胞+OA 40 nmol·L-1)。将细胞消化后以每孔5×103个, 每孔100 μL接种, 待贴壁后加入不同浓度药物进行预保护。4 h后加入10 μL浓度为440 nmol·L-1 OA溶液(终浓度为40 nmol·L-1), 对照组、空白组加入10 μL培养基, 孵育24 h后弃去培养基, 加入100 μL含10% CCK8试剂的培养基避光孵育3 h, 于450 nm处测量吸光度值。
细胞代谢组学实验分组及给药 取对数生长期的SH-SY5Y细胞, 离心后将细胞重悬并等量接种于含8 mL DMEM的培养皿中培养。实验设置5组: 对照组、模型组、阳性药组、丹参组、知母组, 每组平行10个样品。待细胞长至80%时弃去旧培养基, 实验组分别加入6 mL含1 μmol·L-1多奈哌齐、100 μg·mL-1知母、50 μg·mL-1丹参的细胞培养基预处理4 h, 空白组、模型组加入6 mL培养基。然后根据分组加入40 nmol·L-1 OA溶液及空白培养基后继续培养24 h。
样品的收集与处理 取出培养皿, PBS润洗后立即加入液氮淬灭, 待液氮挥干后, 加入1.5 mL含有1 μg·mL-1 L-2-氯苯丙氨酸内标溶液的CHCl3细胞提取液(-20 ℃), 收集提取液并反复冻融三次, 涡旋并离心15 min, 取上清液用氮气吹干。进样前, 将样品复溶于60 μL50%甲醇溶液中, 涡旋并离心10 min后取上清进样, 各取10 μL样品混匀以制备QC样品。
UHPLC-QTOF/MS分析 色谱柱: Waters XSelect HSS T3 column色谱柱和Waters XBridge BEH Amide column色谱柱; 柱温: 30 ℃; 流速: 0.4 mL·min-1; 进样量: 3 μL; 流动相A: 含0.1%甲酸的水, 流动相B: 含0.1%甲酸的乙腈。RPLC梯度洗脱条件: 0~2 min, B相2%; 2~17 min, B相2%→98%; 17~19 min, B相比例98%。HILIC梯度洗脱条件: 0~2 min, B相95%; 2~4 min, B相95%→89%; 4~10 min, B相89%, 10~12 min, B相89%→66%; 12~15 min, B相66%。质谱条件: 干燥气温度: 350 ℃, 干燥气体流量: 11 L·min-1; 碎裂电压: 120 V; 毛细管电压: 4 000 V (ESI+)/3 500 V (ESI-); 质谱扫描范围m/z 50~1 500。
数据处理及生物标志物筛选 将采集的质谱数据通过R软件XCMS程序将质谱数据转化为二维数据矩阵。保留矩阵列表中频数超过80%的质核比数据, 并对所有峰面积根据内标峰面积以及细胞量进行归一化。采用偏最小二乘判别分析(PLS-DA) 研究各组细胞代谢轮廓, 用正交偏最小二乘判别分析(OPLS-DA) 研究正常组和模型组组间差异, 两组之间采用独立样本t检验(P < 0.05) 结合VIP值(VIP ≥ 2), 通过比对数据库(HMDB数据库、METLIN数据库) 筛选潜在的差异代谢物。利用二级质谱进行结构确认, 对比分析标准物质在相同条件下的保留特征、质谱信息验证得到生物标志物。采用MetaboAnalyst进行通路分析并结合KEGG数据库可视化受影响的途径。根据拓扑分析计算出的P值和影响值选择最重要的路径。
统计学分析 使用SPSS21.0统计软件进行数据统计分析, 组间数据采用单因素方差分析(ANOVA), 两组样本分析采用独立样本t检验, 分析数据以P < 0.05为差异有统计学意义。
结果 1 AD细胞模型建立不同浓度OA作用于SH-SY5Y细胞后, 细胞活性如图 1A所示, 与对照组相比, 当OA浓度低于20 nmol·L-1时, 细胞活性没有明显影响, 当OA浓度≥ 20 nmol·L-1时, 细胞活性随着OA浓度的增高逐渐下降, 呈现浓度相关性。当OA浓度为40 nmol·L-1时, 细胞活力显著降低(P < 0.001), 因此, 40 nmol·L-1 OA是建立AD模型的最佳浓度。用Western blot检测ser404位点Tau蛋白的表达水平, 如图 1B所示, 模型组磷酸化Tau蛋白的表达水平高于对照组; SH-SY5Y细胞形态变化如图 1C和1D所示, 与对照组相比, 模型组细胞形态变化显著, 胞体发亮变圆, 贴壁不良, 细胞突起缩短消失, 胞体皱缩, 细胞密度降低。以上说明模型建立成功。
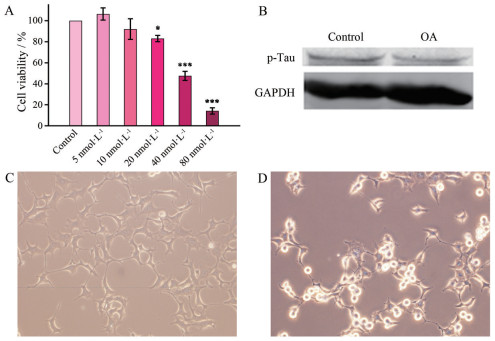
|
Figure 1 Establishment of AD cell model. A: The cell viability of different concentrations of OA on normal SH-SY5Y cells; B: Western blot of the control group and model group; C: Cell morphology of the control group; D: Cell morphology of the model group. GAPDH: Glyceraldehyde-3-phosphate dehydrogenase. OA: Okadaic acid. *P < 0.05, ***P < 0.001 vs control group |
不同浓度丹参提取液、知母提取液、阳性药组对SH-SY5Y细胞的毒性结果如图 2所示, 在测试浓度范围内药物对细胞均无毒性, 可用于AD细胞模型的药效实验研究。此外, 100和200 μg·mL-1知母提取液作用下, 细胞活性相较对照组有所提高, 但是无统计学意义, 提示知母中成分可能促进正常细胞的增殖。
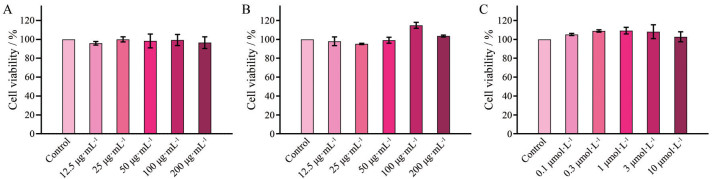
|
Figure 2 The cell viability of normal SH-SY5Y cells with different concentrations of Salvia miltiorrhiza extract (A), Anemarrhena asphodeloides extract (B), and donepezil, positive control (C) |
用不同浓度的含药培养基对SH-SY5Y细胞预保护后, 加入OA溶液以诱导Tau蛋白的异常磷酸化并于24 h后检测细胞活性。结果如图 3所示, 与模型组相比, 阳性药多奈哌齐在特定浓度下能提高AD细胞模型的活性。经不同浓度丹参提取液预保护AD细胞模型后, 细胞活性相较于模型组均有所提高, 当浓度为50 μg·mL-1时, 细胞活性显著提高(P < 0.05)。而AD细胞模型经不同浓度知母提取液预保护作用后, 细胞活性虽略有提高, 但无统计学意义, 可见丹参提取物比知母提取物对AD细胞模型的保护作用更佳。后续选用50 μg·mL-1丹参提取液、100 μg·mL-1知母提取液和1 μmol·L-1多奈哌齐进行细胞代谢组学实验。

|
Figure 3 The cell viability of AD model cells with different concentrations of Salvia miltiorrhiza extract (A), Anemarrhena asphodeloides extract (B), and donepezil, positive control (C). ###P < 0.001 vs control group, *P < 0.05 vs model group |
将UHPLC-QTOF/MS采集的数据处理后, RPLC-MS正离子模式下含有1 421个峰, 负离子模式下含有1 406个峰; HILIC-MS正离子模式下含有1 009个峰, 负离子模式下含有1 174个峰。通过PLS-DA分析, 其得分图如图 4所示, 对照组与模型组样本各自聚为一类且完全分离, 说明AD细胞模型的代谢轮廓发生显著改变, 代谢物的种类或水平发生了明显变化。丹参给药组能够与模型组明显区分, 并向对照组靠近, 表明丹参可回调部分代谢物至正常水平, 而知母给药组虽能与模型组明显区分, 却无回调代谢物至对照组的趋势。从代谢轮廓看, 丹参回调代谢物的趋势较知母更为明显, 对OA诱导的Tau蛋白异常磷酸化AD细胞模型的保护作用比知母更佳, 印证了AD细胞模型的药效实验结果。
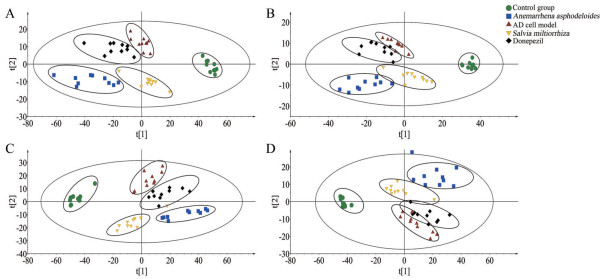
|
Figure 4 PLS-DA scores plot of potential biomarkers from control group, AD cell model, donepezil group, Salvia miltiorrhiza group, and Anemarrhena asphodeloides group in positive mode (A, B) and in negative mode (C, D) of both RPLC-MS (A, C) and HILIC-MS data (B, D). AD: Alzheimer's disease |
OPLS-DA得分图及R2X、R2Y、Q2显示对照组与模型组的显著分离, 具有良好的区分能力和预测能力, 具体如图 5所示。通过VIP ≥ 2及AD细胞模型组和对照组的t检验(P < 0.05), 筛选出45个与Tau蛋白异常磷酸化AD细胞模型相关的差异代谢物作为潜在生物标志物(表 1)。通过MetaboAnalyst对潜在的生物标志物进行通路拓扑分析, 得到-lgP值和影响值, 如图 6所示, 从中筛选出影响值大于0.10且P < 0.05的通路, 可知12条代谢通路与调节OA诱导的Tau蛋白异常磷酸化AD细胞模型代谢紊乱有关, 其中重要的代谢通路包括苯丙氨酸、酪氨酸和色氨酸的生物合成, D-谷氨酰胺和D-谷氨酸代谢, 丙氨酸、天冬氨酸和谷氨酸代谢等。

|
Figure 5 OPLS-DA scores plots from the control group and AD cell model of both RPLC-MS (A, C) and HILIC-MS data (B, D) in positive mode (A, B) and in negative mode (C, D). Green dots and red triangles represent samples in control group and AD cell model separately. A: R2X = 0.849, R2Y = 0.995, Q2(cum) = 0.989; B: R2X = 0.865, R2Y = 0.993, Q2(cum) = 0.982; C: R2X = 0.725, R2Y = 0.992, Q2 (cum) = 0.981; D: R2X = 0.807, R2Y = 0.988, Q2(cum) = 0.974 |
| Table 1 Different metabolites and metabolic pathways. ↓ and ↑ indicate relative decrease in signal of model groups or increase in signal of model groups vs control groups; # indicates potential biomarkers identified with reference standards |

|
Figure 6 The metabolomic pathway analysis of the AD cell model. 1: Phenylalanine, tyrosine and tryptophan biosynthesis; 2: D-Glutamine and D-glutamate metabolism; 3: Alanine, aspartate and glutamate metabolism; 4: Arginine and proline metabolism; 5: Phenylalanine metabolism; 6: Glutathione metabolism; 7: Arginine biosynthesis; 8: Cysteine and methionine metabolism; 9: Citrate cycle; 10: Pyruvate metabolism; 11: Pyrimidine metabolism; 12: Glycolysis/gluconeogenesis |
通过比较丹参组和知母组与AD模型组、对照组、阳性药组之间45个潜在生物标志物的相对峰强度, 可以提示潜在生物标志物的变化趋势。如图 7所示, 与模型组相比, 在丹参作用下, 有30个代谢物水平有向正常组回调的趋势, 其中18个代谢物与模型组比较有显著差异, 在知母作用下, 有7个代谢物水平回调趋势, 有3个代谢物与模型组比较有显著差异。丹参比知母回调代谢物种类更多, 回调趋势显著, 同时, 丹参和知母均比阳性药回调代谢物能力更强。
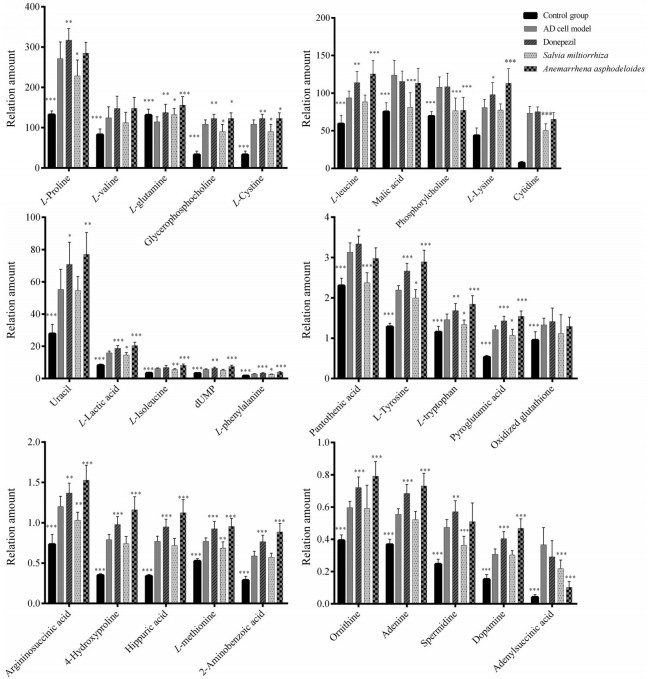
|
Figure 7 Relative signal intensities of 30 potential metabolites in control, control group, AD cell model, donepezil group, Salvia miltiorrhiza group, and Anemarrhena asphodeloides group. n = 10, ± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs model group |
中药丹参和知母对于预防和治疗AD具有较好的疗效, 但两者对AD的药效差异及作用机制对比研究较少。SH-SY5Y细胞是目前广泛应用于AD体外研究的神经细胞, 而OA是一种蛋白磷酸酶PP2A、PP4、PP5和PPI的细胞通透性抑制剂, 可上调细胞中Tau蛋白磷酸化的水平, 从而引起神经元内的纤维缠结[15, 16], 因此OA诱导成为模拟AD发病建立体外细胞模型的有效途径。本研究中采用40 nmol·L-1 OA作用SH-SY5Y细胞24 h后建立了稳定的Tau蛋白异常磷酸化AD细胞模型, 用于比较研究了丹参、知母提取物对该细胞模型的药效差异。
基于UHPLC-QTOF/MS的细胞代谢组学技术筛选出与OA诱导的Tau蛋白异常磷酸化AD细胞模型密切相关的45种差异代谢物, 涉及12条代谢通路。给予丹参提取液后30个差异代谢物出现回调, 而知母提取液干预后7个代谢物出现回调, 丹参回调代谢物的范围更广且能覆盖所有知母回调的代谢产物, 说明与知母提取液相比, 丹参提取液对Tau蛋白异常磷酸化AD细胞模型具有更好的保护作用。
中枢神经系统的免疫激活和炎症反应是AD发病的重要因素。苯丙氨酸转换受损不仅影响酪氨酸的产生, 而且影响神经递质多巴胺、去甲肾上腺素和肾上腺素的生物合成。苯丙氨酸浓度的升高与AD中慢性免疫激活有关, 在AD患者中可检测到与免疫激活相关的较高血清苯丙氨酸浓度[17, 18]。也有研究发现苯丙氨酸与血浆神经纤维丝蛋白轻链(neurofilament light chain, NF-L) 呈正相关, 而NF-L与神经退行性病变直接相关[19]。色氨酸可以转化为重要的神经递质5-羟色胺及色胺, 直接参与了与AD密切相关的犬尿酸途径和5-羟色胺能系统, 犬尿酸通路的激活可以作为AD的发病标志[20, 21]。本研究中, 与AD细胞模型组相比, 丹参处理组的色氨酸、苯丙氨酸、多巴胺、酪氨酸含量均显著降低, 恢复至对照组水平, 而知母并无相应调节作用。研究发现丹参中丹参酮ⅡA和隐丹参酮等有效成分通过调节神经活动配体-受体相互作用通路, 调控一系列神经递质的水平从而抗AD[22]。与知母相比, 丹参的保护优势可能是通过调节苯丙氨酸、酪氨酸和色氨酸的生物合成及代谢, 影响神经递质生成及免疫激活实现的。
氨基酸作为神经递质、代谢调节剂和神经调节剂在中枢神经系统中起着非常重要的作用[23]。与神经递质相关的氨基酸代谢物有色氨酸、酪氨酸、苯丙氨酸、谷氨酰胺、甘氨酸等。谷氨酰胺是兴奋性氨基酸戊二酸和天冬氨酸的前体, 也是抑制性氨基酸γ-氨基丁酸的前体[24]。谷氨酸神经传递减少是AD的重要特征, 会导致相应的神经递质谷氨酰胺水平降低[25]。谷氨酰胺对阿尔茨海默病有保护作用, 谷氨酰胺/谷氨酸代谢的可调节性可以预防认知能力下降[26]。本研究中与对照组细胞相比, AD细胞模型组中谷氨酰胺水平降低, 经丹参、知母预保护后谷氨酰胺水平提高, 表明丹参、知母均能通过调节谷氨酸和谷氨酰胺的代谢实现保护作用。
AD的发病机制与能量代谢、线粒体功能障碍密切相关, 可通过TCA循环、糖酵解等途径影响[27, 28], 研究显示较低的有氧糖酵解与较高的Tau蛋白的沉积有关[29]。本研究中观察到Tau蛋白过度磷酸化AD细胞模型中乳酸水平的增加, 这表明AD模型糖酵解代谢的紊乱。AD研究中屡有报道碳水化合物分解代谢速率降低导致神经元产能减少[30], 本研究中乳酸、柠檬酸、丙酮酸、苹果酸、酮戊二酸、泛酸、焦磷酸硫胺等TCA循环和糖酵解等糖代谢关键中间产物的增加反映了神经元对葡萄糖利用障碍, 与AD患者糖代谢水平紊乱相关。与AD模型细胞相比, 丹参、知母处理组均能恢复部分糖代谢产物至对照组水平。
综上, 本文通过建立Tau蛋白异常磷酸化AD细胞模型, 采用UHPLC-QTOF/MS的细胞代谢组学方法, 比较研究了中药丹参和知母对该AD细胞模型的保护作用及其机制, 最终发现丹参对神经递质生成及免疫激活的调节作用更加显著, 对该细胞模型保护药效更佳。研究结果为中药防治AD药效评价提供新的思路和有效手段。
作者贡献: 王辉、蔡颖负责实验设计、实验开展及论文撰写; 刘敏负责修改文章; 洪战英负责实验设计、指导写作、修改及校对文章; 柴逸峰负责审阅文章。
利益冲突: 本文无利益冲突。
| [1] |
Scheltens P, Blennow K, Breteler M, et al. Alzheimer's disease[J]. Postgrad Med J, 2016, 388: 505-517. |
| [2] |
Polis B, Samson AO. Role of the metabolism of branched-chain amino acids in the development of Alzheimer's disease and other metabolic disorders[J]. Neural Regener Res, 2020, 15: 1460-1470. DOI:10.4103/1673-5374.274328 |
| [3] |
Zhao R, Liu XF, Zhang LX, et al. Current progress of research on neurodegenerative diseases of salvianolic acid B[J]. Oxid Med Cell Longev, 2019, 2019: 3281260. |
| [4] |
Cai N, Chen J, Bi DC, et al. Specific degradation of endogenous Tau protein and inhibition of Tau fibrillation by Tanshinone IIA through the ubiquitin-proteasome pathway[J]. J Agric Food Chem, 2020, 68: 2054-2062. DOI:10.1021/acs.jafc.9b07022 |
| [5] |
Zhan ZG. Advances in biosynthesis and regulation of the active ingredient of Salvia miltiorrhiza based on multi-omics approach[J]. Acta Pharm Sin (药学学报), 2020, 55: 2892-2903. |
| [6] |
Lee B, Jung K, Kim DH. Timosaponin AIII, a saponin isolated from Anemarrhena asphodeloides, ameliorates learning and memory deficits in mice[J]. Pharmacol Biochem Behav, 2009, 93: 121-127. DOI:10.1016/j.pbb.2009.04.021 |
| [7] |
Liu YW, Zhu X, Lu Q, et al. Total saponins from Rhizoma Anemarrhenae ameliorate diabetes-associated cognitive decline in rats: involvement of amyloid-beta decrease in brain[J]. J Ethnop, 2012, 139: 194-200. DOI:10.1016/j.jep.2011.11.004 |
| [8] |
Wilkins JM, Trushina E. Application of metabolomics in Alzheimer's disease[J]. Front Neurol, 2017, 8: 719. |
| [9] |
Huang LJ, Zhao CY, Feng XH, et al. Exploration of nonclinical pharmacodynamics evaluation system of Alzheimer's disease[J]. Acta Pharm Sin (药学学报), 2020, 55: 789-805. |
| [10] |
Zhang A, Sun H, Xu H, et al. Cell metabolomics[J]. Omics, 2013, 17: 495-501. DOI:10.1089/omi.2012.0090 |
| [11] |
Wishart DS. Metabolomics for investigating physiological and pathophysiological processes[J]. Physiol Rev, 2019, 99: 1819-1875. DOI:10.1152/physrev.00035.2018 |
| [12] |
Zhang MY, Liu Y, Liu M, et al. UHPLC-QTOF/MS-based metabolomics investigation for the protective mechanism of Danshen in Alzheimer's disease cell model induced by Aβ[J]. Metabolomics, 2019, 15: 13. DOI:10.1007/s11306-019-1473-x |
| [13] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. Beijing: China Medical Science Press, 2015: 212-213.
|
| [14] |
Jia XZ, Zhang ZD, He JX, et al. Research advances in polysaccharides of Anemarrhena asphodeloides Bge[J]. Inf Tradit Chin Med (中医药信息), 2020, 37: 111-115. |
| [15] |
Derya MA, Duygu GA, Erdinc D, et al. Okadaic acid-induce tau hyperphosphorylation and the downregulation of Pin1 expression in primary cortical neurons[J]. J Chem Neuroanat, 2018, 92: 41-47. DOI:10.1016/j.jchemneu.2018.05.006 |
| [16] |
Boban M, Babic LM, Terezija M, et al. Human neuroblastoma SH-SY5Y cells treated with okadaic acid express phosphorylated high molecular weight tau-immunoreactive protein species[J]. J Neurosci Methods, 2019, 319: 60-68. DOI:10.1016/j.jneumeth.2018.09.030 |
| [17] |
Wissmann P, Geisler S, Leblhuber F, et al. Immune activation in patients with Alzheimer's disease is associated with high serum phenylalanine concentrations[J]. J Neurol Sci, 2013, 329: 29-33. DOI:10.1016/j.jns.2013.03.007 |
| [18] |
Ravaglia G, Forti P, Maioli F, et al. Plasma amino acid concentrations in patients with amnestic mild cognitive impairment or Alzheimer disease[J]. Am J Clin Nutr, 2004, 80: 483-488. DOI:10.1093/ajcn/80.2.483 |
| [19] |
Chatterjee P, Cheong YJ, Bhatnagar A, et al. Plasma metabolites associated with biomarker evidence of neurodegeneration in cognitively normal older adults[J]. J Neurochem, 2020. DOI:10.1111/jnc.15128 |
| [20] |
Tanaka M, Toldi J, Vecsei L. Exploring the etiological links behind neurodegenerative diseases: inflammatory cytokines and bioactive kynurenines[J]. Int J Mol Sci, 2020, 21: 7. |
| [21] |
Gonzalez SM, Jimenez J, Narvaez A, et al. Kynurenic acid levels are increased in the CSF of Alzheimer's disease patients[J]. Biomolecules, 2020, 10: 571. DOI:10.3390/biom10040571 |
| [22] |
Li WT, Zhao MM, Tao YY, et al. Research on mechanism of active ingredients of Danshen in the treatment of Alzheimer's disease based on network pharmacology[J]. Eval Anal Drug Use Hosp Chin (中国医院用药评价与分析), 2020, 20: 1409-1416. |
| [23] |
Socha E, Koba M, Piotr K. Amino acid profiling as a method of discovering biomarkers for diagnosis of neurodegenerative diseases[J]. Amino Acids, 2019, 51: 367-371. DOI:10.1007/s00726-019-02705-6 |
| [24] |
Zhao X, He YR, Li M, et al. Analysis of amino acid and monoamine neurotransmitters and their metabolites in rat urine of Alzheimer's disease using in situ ultrasound-assisted derivatization dispersive liquid-liquid microextraction with UHPLC-MS/MS[J]. J Pharm Biomed Anal, 2017, 135: 186-198. DOI:10.1016/j.jpba.2016.11.056 |
| [25] |
Widner B, Leblhuber F, Walli J, et al. Tryptophan degradation and immune activation in Alzheimer's disease[J]. J Neural Transm, 2000, 107: 343-353. DOI:10.1007/s007020050029 |
| [26] |
Adams CD. Circulating glutamine and Alzheimer's disease: a Mendelian randomization study[J]. Clin Interv Aging, 2020, 15: 185-193. DOI:10.2147/CIA.S239350 |
| [27] |
Bubber P, Haroutunian V, Fisch G, et al. Mitochondrial abnormalities in Alzheimer brain: mechanistic implications[J]. Ann Neurol, 2005, 57: 695-703. DOI:10.1002/ana.20474 |
| [28] |
Zádori D, Veres G, Szalárdy L, et al. Alzheimer's disease: recent concepts on the relation of mitochondrial disturbances, excitotoxicity, neuroinflammation, and kynurenines[J]. J Alzheimer's Dis, 2018, 62: 523-547. DOI:10.3233/JAD-170929 |
| [29] |
Vlassenko AG, Gordon BA, Goyal MS, et al. Aerobic glycolysis and tau deposition in preclinical Alzheimer's disease[J]. Neurobiol Aging, 2018, 67: 95-98. DOI:10.1016/j.neurobiolaging.2018.03.014 |
| [30] |
Mosconi L, Mistur R, Switalski R, et al. FDG-PET changes in brain glucose metabolism from normal cognition to pathologically verified Alzheimer's disease[J]. Eur J Nucl Med Mol Imaging, 2009, 36: 811-822. DOI:10.1007/s00259-008-1039-z |
 2021, Vol. 56
2021, Vol. 56


