2. 东莞市东阳光生物药研发有限公司, 广东 东莞 523000;
3. 宜昌东阳光长江药业股份有限公司, 湖北 宜昌 443000
2. HEC Pharma Co., Ltd., Dongguan 523000, China;
3. HEC Pharma Co., Ltd., Yichang 443000, China
胰岛素是一种调节代谢的激素, 在体内可增加葡萄糖由细胞外向细胞内的转运, 增加葡萄糖在体内的酵解和利用、并能促进肝糖原和肌糖原的形成, 促进葡萄糖转变为脂肪; 另一方面胰岛素能抑制肝糖原分解, 并能抑制甘油、乳酸及氨基酸转变为糖原, 减少了糖原异生, 从而使血糖降低。胰岛素还能促使蛋白质和脂肪的合成, 减少其分解, 可减轻酮症酸血症的各种症状[1]。
门冬胰岛素为运用DNA重组技术制备的速效人胰岛素类似物, 将人胰岛素B链28位的脯氨酸替换成天门冬氨酸, 因负电荷相斥作用降低门冬胰岛素分子单体形成六聚体倾向, 达到快速吸收及快速起效的目的。门冬胰岛素的主要作用机制与人胰岛素一致, 在摩尔当量的基础上, 门冬胰岛素与人胰岛素等效价[2]。在过去, 胰岛素分析使用放射免疫分析法(RIA) 或酶联免疫吸附分析法(ELISA)。由于ELISA法和RIA法的许多缺点, 需要LC-MS法对胰岛素进行分析, 例如, 缺乏标准化、交叉反应性、有限的线性动态范围和样品制备时间等问题, 文献[3, 4]中均有报道。配体结合测定方法对于胰岛素类似物准确定量最大的挑战就是交叉免疫反应, 不同市售的胰岛素测定的试剂盒的差异很大而且呈现浓度的依赖性, 但大多数的患者可能会混合使用多种胰岛素类似物的药物。这些因素推动了替代的LC-MS/MS分析方法的发展和LC-MS/MS方法的标准化。
已有文献[3, 5]报道了采用LC-MS/MS分析人血浆中的门冬胰岛素, 有的采用酶解测定特征性片段, 也有使用有机溶剂进行部分沉淀萃取后用SPE浓缩的前处理方法, 这些方法前处理过程步骤多且复杂, 不易批量处理。也有文献[6]报道采用二元液相的方法对5种胰岛素类似物进行良好的分离测定, 用两根色谱柱, 一个色谱柱作为捕获柱(trap column) 对样品进行富集, 再在另外一个色谱柱上逐步洗脱, 虽然这种方法对各种胰岛素类似物达到良好的色谱分离和定量下限, 但是对仪器软件控制要求比较高。也有采用LC-HRMS方法测定血浆中的胰岛素类似物[7], 将Triple Quad 6500和Triple TOF 5600 LC-MS/MS方法进行了对比, 证明LC-HRMS方法可以达到相似的结果。LC-HRMS的优势在于可以消除干扰, 获得更好的特异性, 但是灵敏度方面没有Triple Quad 6500有优势。
本文开发了一个迅速的、灵敏度高的、简单的、高通量的分析方法支持人血浆中门冬胰岛素的定量测定, 并且此方法成功支持了采用葡萄糖钳夹技术在健康男性受试者中比较门冬胰岛素注射液与诺和锐®的药代动力学研究。
材料与方法仪器与对照品 美国Waters公司超高效液相色谱仪: Acquity, UPLC。三重四极杆质谱仪: Applied Biosystem, Sciex API 6500+。电子天平: 梅特勒-托利多, MX5。超纯水仪: 美国Millipore公司, 型号: Milli-Q。AR级乙酸, LC-MS级乙腈, LC-MS级甲醇, LC-MS级异丙醇, 三氟乙酸(纯度~98%) 和AR级三羟甲基氨基甲烷均采购自Sigma公司。
门冬胰岛素对照品来源于宜昌东阳光长江药业股份有限公司, 批号为WRS (CP)-ASP011709, 纯度为99.7%。牛胰岛素对照品采购自大连美仑生物技术有限公司, 批号为D1203A, 纯度为100.0%。
色谱条件 液相色谱柱: Waters ACQUITY UPLC CSH C18 (2.1 mm×50 mm, 1.7 μm); 流动相A: 乙酸-水(5∶1 000); 流动相B: 乙酸-乙腈(5∶1 000); 流速: 0.600 mL·min-1, 梯度洗脱, 起始17.5% B, 洗脱程序: 0~3 min, 29.5% B; 3~3.5 min, 50% B; 3.5~4 min, 98% B; 4~5.5 min, 98% B; 5.5~5.51 min, 17.5% B; 5.51~6 min, 17.5% B。柱温30 ℃; 进样量30 μL。
质谱条件 ESI离子源; 喷雾器电压: 5 500 V; 温度: 500 ℃; 碰撞气(N2) 压力: 12 psi (1 psi ≈ 6.9 kPa); 喷雾气(N2) 压力: 70 psi; 气帘气体(N2) 压力: 30 psi; 辅助气(N2) 压力: 50 psi; 入口电势(EP): 10 V; 正离子方式检测; 用于定量分析的离子反应分别为m/z 971.8→1 133.4 (门冬胰岛素)、m/z 963.8→1 123.5 (牛胰岛素)。
溶液的配制 对照品储备液: 准确称量一定量的门冬胰岛素对照品, 按照校正系数进行校正。溶解于甲醇-水-乙酸溶液(30∶60∶10) 中得到浓度为1.00 mg·mL-1的标准储备液。内标储备液: 准确称量一定量牛胰岛素对照品, 按照校正系数进行校正。溶解于甲醇-水-乙酸溶液(30∶60∶10) 中得到浓度为0.500 mg·mL-1的标准储备液。
标准曲线样品和质控样本的制备 使用人空白血浆(EDTA-K2) 将储备液序列稀释制备浓度为0.200、0.500、1.00、2.00、5.00、9.00和10.0 ng·mL-1的标准曲线血浆样本和0.200、0.600、1.50、4.00和8.00 ng·mL-1的质控样本。
血浆样品前处理 在300 μL的血浆样品中加入内标工作液25 μL, 涡旋混合, 再加入250 μL的三羟甲基氨基甲烷缓冲液涡旋混匀。采用甲醇(每个孔200 μL) 活化SPE板Waters Oasis HLB μElution, 采用水(每个孔200 μL) 平衡SPE板, 取上述血浆样品全部转移到SPE板上, 先后用100 μL的三羟甲基氨基甲烷缓冲液和200 μL的甲醇-水-乙酸溶液(5∶95∶1) 清洗SPE板, 再用30 μL的甲醇-水-乙酸溶液(70∶20∶10) 洗脱两次, 添加80 μL水至收集板中稀释混匀进样分析。
专属性 通过比较6个不同来源的人的空白血浆以及空白溶剂样品进行LC-MS/MS分析, 考察是否对待测物和内标的测定存在干扰。
标准曲线 选择适宜的浓度点, 以待测化合物与内标峰面积的比值(Y), 分析物的浓度(X), 采用加权(W = 1/x2) 最小二乘法进行线性回归绘制标准曲线方程, 求得的标准曲线的相关系数(r2) 均大于0.99。
最低定量限(LLOQ) LLOQ是标曲的最低点, 认为信噪比大于5符合要求。其准确度在±20%以内且精密度RSD低于20%可接受。
准确度和精密度 按"血浆样品前处理"项下处理LLOQ、LQC、LMQC、MQC和HQC样品, 每个浓度QC样品需要6个重复进行LC-MS/MS分析。分别于同一天内完成和连续3天完成, 计算日内/日间精密度和准确度。
提取回收率共配制两组样品, 每组样品低、中、高3个浓度, 每个浓度平行6个样本。两组样品分别是: 6份LQC、MQC和HQC样品按"血浆样品前处理"项下处理样品(A); 提取9个空白基质样品, 按"血浆样品前处理"项下处理样品, 在提取后的空白基质中加入适当的浓度的溶液达到LQC、MQC和HQC进样浓度水平的回收率样品, 并设定其分析物和内标的回收率为100% (B)。将两组样品进样分析, 提取回收率= (A样品峰面积/B样品的峰面积)×100%。
基质效应 分别取6个不同来源的空白血浆样品按"血浆样品前处理"项下处理样品, 提取后的空白基质中加入相应浓度的对照品溶液, 配成LQC和HQC两个进样溶度水平的样品, 进行LC-MS/MS分析, 分析获得相应峰面积(A)。同时用溶液代替空白血浆, 按上述处理, 获得相应峰面积(B)。以每一浓度两种处理方法的峰面积比值计算基质效应, 计算公式为基质效应百分率= (A样品峰面积/B样品峰面积)×100%。以分析物和内标的基质效应比值计算内标归一化的基质效应。
稳定性考察 制备LQC和HQC浓度水平的稳定性样品, 每个浓度平行测定6份, 分别考察以下3种情况的稳定性: ①短期稳定性: 稳定性样品在室温下放置25 h; ②长期稳定性: 稳定性样品在-60~-80 ℃冰箱冻存111天; ③冻融稳定性: 稳定性样品经过5次冻融循环。
溶血和高脂评价 基于(2%) 溶血空白基质配制的LQC和HQC样品, 或使用一个批次的天然高脂血(甘油三酯含量≥300 mg·dL-1) 配制成LQC和HQC样品, 按"血浆样品前处理"项下处理样品, 进样LC-MS/MS分析。
数据采集与方法学验证 采用Analyst软件采集色谱图, Watson软件进行定量, 校正标样和QC样品中门冬胰岛素的浓度通过基于待测物与内标峰面积比值的定量函数来计算。评估了方法的线性、精密度、准确度、残留、干扰、回收率、基质效应以及稳定性。
药动学应用 采用葡萄糖钳夹技术在健康男性志愿者中注射宜昌东阳光长江药业股份有限公司生产的门冬胰岛素注射液与诺和诺德公司生产的门冬胰岛素注射液, 并评价两种制剂间的生物等效性(遗传办批号: 国科遗办审字[2018] 597号)。血浆样品在给药前30、0 min, 给药后10、20、30、40、50、60、75、90、105、120、150、180、210、240、270、300、330、360、420、480和600 min采集, 并储存在-70 ℃。本研究的实施遵从源于赫尔辛基宣言的《临床试验质量管理规范》 (GCP)、适用进行临床试验的国家的法律、法规, 由四川大学华西医院临床试验伦理分委员会批准[批准号: 2017年临床试验(西药) 审(148)号]。
结果与讨论 1 质谱方法优化门冬胰岛素的相对分子质量为5 825.8, 单电荷的母离子不能用普通的三重四极杆质谱仪进行定量, 但可以形成多电荷离子[M+nH]n+, 就可落入普通的三重四极杆的定量范围内。门冬胰岛素的电喷雾多电荷全扫描图见图 1。母离子带电荷越多, 离子的质荷比越低, 但同时特异性越低。由于门冬胰岛素A链和B链间有很强的二硫键相连, 产生的碎片强度都不高。在选择碎片离子时, 一般选择比母离子大的质荷比的碎片, 这种碎片离子可能整体信号强度较低, 但会有更好的信噪比。这种碎片离子比母离子的相对分子质量低, 但因带的电荷少, 产生了较高的质荷比, 具有更高的专属性[5, 6]。门冬胰岛素的子离子扫描图见图 2。流动相的组成以及源参数会影响离子通道的响应, 一般会同时选择3或4个离子通道, 后期进一步优化。根据最终确定的色谱条件以及空白基质的干扰情况, 确定门冬胰岛素用于定量分析的离子反应分别为m/z 971.8→1 133.4 (门冬胰岛素)、m/z 963.8→1 123.5 (牛胰岛素)。
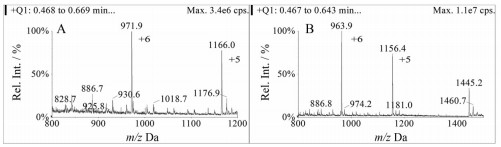
|
Figure 1 Full scan electrospray mass spectrum of insulin aspart (A) and bovine insulin (B) showing multiply charged clusters. [M+6H]6+ has been enhanced for greatest visibility |
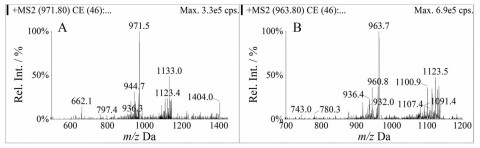
|
Figure 2 Product ion scan spectrum of insulin aspart (A) and bovine insulin (B) |
文献[6, 7]报道, 含有甲酸的流动相具有较高的质谱响应。在此实验中, 对比了甲酸、乙酸、丙酸和三氟乙酸等酸性条件, 最终确定乙酸的酸性体系, 具有最高的质谱响应以及极佳的峰形。同时采用Waters ACQUITY UPLC CSH C18 (2.1 mm×50 mm, 1.7 μm) 色谱柱, 与常用的Peptide 300A和130A色谱柱相比, 具有更窄的峰形和较好的分离度。门冬胰岛素定量下限以及空白样品的色谱图见图 3。
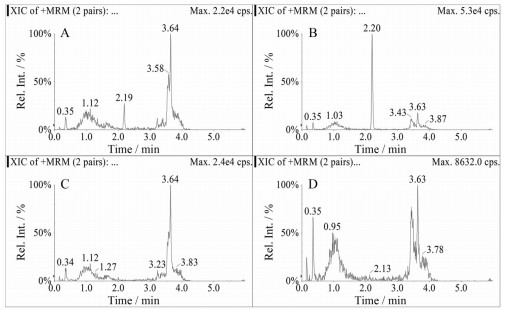
|
Figure 3 MRM chromatograms of insulin aspart and internal standard bovine insulin in human plasma. A: LLOQ chromatogram of insulin aspart (RT = 2.19 min); B: LLOQ chromatogram of bovine insulin (RT = 2.20 min); C: Blank plasma chromatogram of insulin aspart (RT = 2.19 min); D: Blank plasma chromatogram of bovine insulin (RT = 2.20 min) |
选用Waters HLB μElution的SPE板, 直接用小体积洗脱直接进样的方式, 避免了常规SPE板吹干复溶过程产生的特异性吸附造成的信号损失。已有文献[6]报道, 一般都是采用蛋白沉淀结合SPE的前处理方式, 这种方法不能用96孔板批量处理样本, 比较耗时。虽然本实验的回收率在40%左右, 低于文献[6]报道的回收率, 但本实验的提取方法更简单高通量, 同时也达到了定量对检测限的要求, 更加方便实用。
4 方法验证 4.1 标准曲线采用分析物对内标的峰面积比来计算结果。相关系数(r) 均≥0.992 2, 表明人血浆中门冬胰岛素在标准曲线范围0.200~10.0 ng·mL-1内线性关系良好。
4.2 精密度与准确度门冬胰岛素各浓度水平质控样品的日内准确度在-4.6%~7.5%之间, 精密度在2.5%~14.5%之间; 日间准确度在-3.0%~3.0%之间, 精密度在3.8%~14.0%之间。精密度和准确度均满足生物样品分析的要求, 方法重现性良好。
4.3 专属性在含有内标的空白基质、空白试剂和6个空白基质样品中, 门冬胰岛素色谱图区域未见明显干扰(≤平均LLOQ响应的20.0%)。结果表明本实验方法定量测定人血浆中的门冬胰岛素的选择性良好。门冬胰岛素定量下限以及空白样品的色谱图见图 3。门冬胰岛素的保留时间约为2.19 min, 内标牛胰岛素的保留时间约为2.20 min。
4.4 回收率结果显示, 门冬胰岛素在各质控样品浓度水平下的回收率一致, 方法的回收率在36.7%~41.7%。
4.5 基质效应采用含有基质离子的峰响应与不含有基质离子的平均峰响应的比值来计算基质效应因子。用分析物的基质效应因子除以内标的基质效应因子来计算内标归一化基质效应。结果表明本文方法的基质效应因子在0.872~0.888。
4.6 溶血与高脂评价门冬胰岛素在含有2%溶血的人血浆中的质控样品的准确度在88.6%~91.8%。在≥300 mg·dL-1甘油三酯水平的人血浆中的质控样品的准确度在100.9%~102.5%。
4.7 血浆稳定性本文考察了门冬胰岛素在不同存储条件下的稳定性。结果表明, 门冬胰岛素在人血浆中室温放置25 h, 5个冻融循环以及-60~-80 oC条件下储存111天均稳定。LQC的准确度在91.2%~99.2%之间, HQC的准确度在87.3%~101.0%之间, 符合生物样品分析的要求。
5 药代动力学应用用以上验证的分析方法成功支持测定采用葡萄糖钳夹技术在健康男性志愿者中注射宜昌东阳光长江药业股份有限公司生产的门冬胰岛素注射液(test) 与诺和诺德公司生产的门冬胰岛素注射液(reference) 的药效学和药代动力学研究采集的样品, 给药后门冬胰岛素的平均药-时曲线图见图 4。
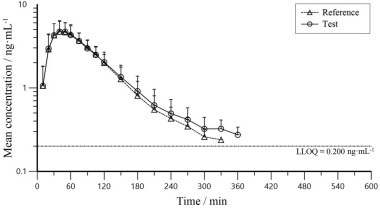
|
Figure 4 Concentration-time plot of insulin aspart after administration two products of insulin aspart in 30 healthy subjects (Reference: NovoRapid® produced by Novo Nordisk; Test: The insulin aspart injection produced by HEC Pharma Co., Ltd.) |
本文共选取了120个样品对门冬胰岛素进行了已检测样品再分析(ISR), 以确认分析方法的重现性。结果表明, 95.8%的门冬胰岛素样品的初始分析结果和复测结果的差异在±20.0%的范围内, 方法重现性良好。
结论本文成功建立了一种UPLC-MS/MS的方法, 快速地、灵敏地、可靠地、直接测定人血浆中的门冬胰岛素。并且此验证的方法成功应用于门冬胰岛素的药代动力学研究。
致谢: 宜昌东阳光长江药业股份有限公司和东莞市东阳光生物药研发有限公司合作并支持本项目。
作者贡献: 韩盈和米楠为本实验的主要操作者及撰写者; 魏国兰和毕吕存负责具体实验的指导与本文的修改。郭林峰、胡春云和李爽为本实验的合作方。
利益冲突: 本方法开发和验证由徕博科医药研发(上海) 有限公司完成。样品分析受宜昌东阳光长江药业股份有限公司委托进行测定。本文无任何利益冲突。
| [1] |
Chen HZ, Liao LT, Yang BH, et al. Practical Internal Medicine (实用内科学)[M]. 12th Ed. Beijing: People's Health Publishing House, 2005: 1015-1026.
|
| [2] |
NovoLogTM, insulin aspart (rDNA origin) injection label[EB/OL]. Silver Spring, US: FDA, 2020[2021-08-11]. https://www.accessdata.fda.gov/drugsatfda_docs/label/2000/20986lbl.pdf.
|
| [3] |
Chambers EE, Legido-Quigley C, Smith N, et al. Development of a fast method for direct analysis of intact synthetic insulins in human plasma: the large peptide challenge[J]. Bioanalysis, 2012, 5: 65-81. |
| [4] |
Hess C, Thomas A, Thevis M, et al. Simultaneous determination and validated quantification of human insulin and its synthetic analogues in human blood serum by immunoaffinity purification and liquid chromatography-mass spectrometry[J]. Anal Bioanal Chem, 2012, 404: 1813-1822. DOI:10.1007/s00216-012-6271-5 |
| [5] |
Blackburn M. Advances in the quantitation of therapeutic insulin analogues by LC-MS/MS[J]. Bioanalysis, 2013, 5: 2933-2946. DOI:10.4155/bio.13.257 |
| [6] |
Chambers EE, Fountain KJ, Smith N, et al. Multidimensional LC-MS/MS enables simultaneous quantification of intact human insulin and five recombinant analogs in human plasma[J]. Anal Chem, 2014, 86: 694-702. DOI:10.1021/ac403055d |
| [7] |
Li YX, Ke Y, Li JY, et al. Quantitation of insulin analogue glargine and its two metabolites M1 and M2 on triple quad 6500 and triple TOF 5600 LC-MS/MS systems in a dog toxicokinetics study[J]. J Anal Bioanal Tech, 2013. DOI:10.4172/2155-9872.S5-004 |
 2021, Vol. 56
2021, Vol. 56


