2. 中国药科大学, 江苏 南京 210009;
3. 江苏艾洛特医药研究院有限公司, 江苏 南京 211103
2. China Pharmaceutical University, Nanjing 210009, China;
3. Jiangsu Cell Tech Medical Research Institute, Nanjing 211103, China
人类成纤维细胞生长因子21 (fibroblast growth factor, FGF21) 是一种含209个氨基酸残基的多肽, 具有能够降低血糖、提高胰岛素敏感性, 降低血清甘油三酯、提高脂质利用率和能量消耗、减轻体重等生理活性[1, 2]。但是, FGF21稳定性差, 并且易被肾过滤清除, 因此其在表达、纯化及给药过程易失活, 且半衰期短, 靶组织利用率低, 成药性差[3]。通过使用聚乙二醇修饰、Fc修饰、CVX-200耦合、人血清白蛋白(HSA) 融合等方法, 可以延长FGF21的血浆半衰期, 目前已报道临床前及临床研究的FGF21类似物R1MAB、Fc-FGF21、LY2405319、PF-05231023和HSA-mFGF21等均具有降脂作用[3-7]。FGF21-164是通过对FGF21的结构修饰、偶联得到的融合蛋白, 拟用于治疗肥胖引起的糖脂代谢紊乱的候选药物。为了考察该候选药物的成药性以及指导其安全性及有效性评价, 本文拟对FGF21-164融合蛋白在小鼠体内的药代动力学进行考察。
配体结合分析(LBA) 法是大分子药物的主要定量手段, 但是其方法开发过程耗时且昂贵[8, 9]。液相色谱-串联质谱(LC-MS/MS) 法可以通过直接检测大分子药物的特征肽段, 为生物基质中大分子药物的快速、高效定量分析提供了手段, 相较于LBA法更适用于大分子候选药物前期的药代动力学研究[9, 10]。目前, 已有3篇文献[11-13]报道LC-MS/MS法定量分析生物基质中FGF21或重组FGF21蛋白。然而, FGF21-164融合蛋白在酶解后无法得到文献中定量所使用的特征替代肽段。本文利用Skyline软件预测FGF21-164融合蛋白酶解后产生的肽段信息, 采用高分辨质谱法(HR-MS) 验证, 确定定量所使用的特征替代肽段。随后, 建立了LC-MS/MS法分析小鼠血清中的特征肽段, 以外标法定量小鼠血清中的FGF21-164融合蛋白的浓度, 并将该方法应用于FGF21-164融合蛋白在小鼠体内的药代动力学初步研究。
材料与方法药品与试剂 FGF21-164融合蛋白(2.27 mg·mL-1, 纯度: 100%) 由江苏艾洛特医药研究院有限公司提供。乙腈和甲酸均为色谱纯, 分别购自德国Merck公司和日本TCI公司; 去离子水由法国Millipore超纯水仪制备。色谱纯碳酸氢铵、十二烷基硫酸钠(SDS)、二硫苏糖醇(DTT) 和碘乙酰胺(IAA) 均购自大连美仑生物科技有限公司。胰蛋白酶购自美国Promega公司。小鼠血清作为空白基质由上海药物研究所实验动物中心提供。
候选肽段的预测 使用Skyline软件(美国华盛顿大学) 预测FGF21-164蛋白经胰蛋白酶酶解后产生的肽段以及各肽段具体信息。预测条件如下: 酶解条件: 胰蛋白酶; 肽段氨基酸残基个数: 6~20以内; 母离子带电荷数: 2~3; 子离子带电荷数: 1; 子离子输出模式: y离子, 子离子质荷比 > 母离子质荷比且介于200~1 500之间。
鉴定候选肽段高分辨质谱条件 高分辨质谱采集在Vanquish超高效液相色谱系统和Q Exactive Plus质谱仪上进行, 该质谱仪采用电喷雾电离(ESI) 源, 美国Thermo公司。色谱柱为Agilent Extended C18柱(150 mm×4.6 mm, 5 μm; 美国Agilent公司)。流动相为含0.1%甲酸的水溶液(A相) 和含0.1%甲酸溶液的乙腈溶液(B相)。流速为0.4 mL·min-1。使用的梯度洗脱条件如下: 0~2.0 min, 5% B; 2.0~24.0 min, 5% B~50% B; 26.0~28.8 min, 50% B~95% B; 28.8~28.9 min, 95% B~5% B; 28.9~35 min, 5% B。总运行时间为35.0 min。ESI正离子模式, 鞘气45 L·min-1, 辅助气体10 L·min-1, 毛细管温度320 ℃, 辅助气体加热器温度400 ℃, 毛细管电压3.5 kV。通过XCalibur软件(美国Thermo公司) 进行数据采集, 质谱扫描范围为100~1 200 Da。
定量替代肽段UHPLC-MS/MS条件 LC-20AD LC系统, 日本岛津公司。色谱分离采用EclipsePlus C18柱(2.1 mm×50 mm, 1.8 μm; 美国Agilent公司)。流动相为含0.1%甲酸的水溶液(A相) 和0.1%甲酸溶液的乙腈溶液(B相)。流速为0.3 mL·min-1。使用的梯度洗脱条件如下: 0~0.5 min, 10% B; 0.5~3 min, 10% B~30% B; 3.0~3.1 min, 30% B~80% B; 3.1~4.0 min, 80% B; 4.0~4.1 min, 10% B; 4.1~5.0 min, 10% B。总运行时间为5.0 min。
质谱检测在配备了ESI电离源的AB Sciex Triple Quad5500三重四极杆质谱仪(QQQ) 上进行。ESI正离子模式, 喷雾电压和源温度分别设置为5 500 V和550 ℃。气帘气体、雾化气体(Gas 1) 和加热气体(Gas 2) 分别优化为35、40和40 psi (1 psi ≈ 6.9 kPa)。替代肽段(YLYTDDAQQTEAHLEIR) 的多反应监测(MRM) 的定量离子对: m/z 689.3→738.4。使用Analyst 1.6.2 (AB Sciex) 进行数据采集和处理, 以加权最小二乘回归方法(1/x2) 绘制分析物的峰面积比与浓度的关系。
标准曲线与质控样品的制备 由2.27 mg·mL-1的FGF21-164融合蛋白溶液以小鼠空白血清依次稀释至浓度为500、250、100、25.0、10.0和2.50 μg·mL-1作为标准曲线样品和浓度为400、15.0和4.00 μg·mL-1的质控样品。
预处理条件 选择候选肽段时, 80 μL的FGF21-164蛋白溶液(100 μg·mL-1) 加入10 μL胰酶(100 μg·mL-1) 后在37 ℃, 1 000 r·min-1条件下酶解2 h。然后, 加入35 μL终止液(含2%甲酸溶液的20%乙腈溶液), 在常温下1 000 r·min-1振荡10 min以终止酶切。该体系混匀后, 取10 μL进样高分辨质谱仪或5 μL进样UHPLC-MS/MS分析。
定量分析替代肽段时, 标准曲线、质控和未知浓度血清样品经0.1% SDS的PBS溶液10倍稀释后, 取20.0 μL加入20.0 μL DTT (100 mmol·L-1) 在60 ℃、300 r·min-1条件下变性30 min; 而后加入20 μL的IAA (250 mmol·L-1), 在室温、300 r·min-1条件下反应15 min; 再加入10 μL胰蛋白酶(100 μg·mL-1) 在37 ℃、1 200 r·min-1条件下酶解2 h。最后, 向终体系中加入35 μL终止液, 在常温下1 000 r·min-1振荡10 min以终止酶切。混匀后, 取5.00 μL进行UHPLC-MS/MS分析。
方法学验证 对建立的方法进行方法验证, 参照中国药典2020年版生物分析指导原则[14], 从方法的选择性、标准曲线和定量下限、精密度和准确度、基质效应和稳定性等方面进行了验证。
选择性 取6个不同来源的小鼠空白血清以及相应空白血清配制的LLOQ样品按照“预处理条件”项下操作, 考察是否有干扰测定。
标准曲线 标准曲线样品处理按照“预处理条件”项下操作, 以待测物浓度为横坐标, 待测物的峰面积为纵坐标, 用加权(W = 1/x2) 最小二乘法进行回归运算, 求得的标准曲线的相关系数(r) 均大于0.995 0。
定量下限 LLOQ血清样品处理按照“预处理条件”项下操作, 进行6样本分析, 连续测定3批次, 并根据当批次标准曲线计算每一样本的测得浓度, 计算该浓度的批内和批间精密度和准确度。
准确度和精密度 低、中、高浓度QC样品(血清浓度均分别为4.00、15.0和400 μg·mL-1) 处理按照“预处理条件”项下操作, 每个浓度进行6样本分析, 分别在2日、3分析批内测定批内、批间的精密度和准确度。
基质效应 取6个不同来源空白血清配制低和高两QC浓度的样品, 按照“预处理条件”项下操作。同时用PBS缓冲盐溶液代替空白血清配制低和高两QC浓度样品, 直接酶解后进行3样本分析。以两种处理方法的峰面积比值计算待测物基质效应, 计算公式为血清样品待测物的峰面积/待测物相同浓度标准溶液获得的平均峰面积×100%。
稳定性 考察FGF21-164血清样品室温放置和-20 ℃长期放置稳定性, 采用当日新鲜配置的标准曲线进行定量分析。
小鼠药动学研究 动物实验经中国科学院上海药物研究所实验动物伦理委员会(批号: 20180004040450) 批准, 在该研究所实验动物中心完成。C57小鼠12只共设3组, 每组4只, 体重20 g左右。由于小鼠采血量较小, 因此通过交叉时间点采血, 将3组小鼠的时间-浓度数据绘制为一条完整的平均药时曲线。通过尾静脉注射单次给予每只小鼠FGF21-164注射液22.7 mg·kg-1, 给药前禁食10 h, 自由饮水, 给药后4 h, 统一进食。各组小鼠于以下时间点经眼球后静脉丛取血150 μL。待血液凝固后在11 000 r·min-1下离心5 min, 分取血清, 冰浴操作。第一组: 给药前、30 min和4 h; 第二组: 5 min、1 h和6 h; 第三组: 15 min、2 h和8 h。血清样品经UHPLC-MS/MS定量分析所得时间-浓度数据采用Phoenix WinNonlin 7.0软件以非房室模型计算FGF21-164的药动学参数。
结果与讨论 1 替代肽段的预测与选择在Skyline软件中输入FGF21-164的肽段序列进行预测分析, 通过选择合适的筛选条件, 输出该蛋白经胰蛋白酶酶解后产生的各肽段信息如表 1所示。为了保证所选肽段适合LC-MS/MS分析检测, 序列长度设置为6~20个氨基酸, 且排除了含有半胱氨酸、天冬氨酸和色氨酸等易被修饰氨基酸的肽段[15, 16]。随后, 利用高分辨质谱对FGF21-164经胰蛋白酶解后的溶液进行分析, 验证Skyline软件预测的肽段信息。总离子色谱图如图 1A所示, 肽段SPSYAS和EDGTVGGAADQSP ESLLQLK (EDG) 的母离子具有较高的质谱响应, 而肽段ALKPGVIQILGVK和YLYTDDAQQTEAHLEIR (YLY) 母离子的质谱响应相对较低。使用三重四极杆质谱对上述肽段的母离子和子离子进行监测及质谱条件的优化, MRM监测响应较高的四个离子对(图 1B) 分别为m/z 689.3→738.4 (YLY)、m/z 672.3→701.4 (EDG)、m/z 1 008.0→1 014.7 (EDG) 和m/z 1 033.5→1 096.5 (YLY)。肽段EDG虽然母离子响应较高, 但由于氨基酸序列较长, 子离子较多, 且带电荷数较多, 所以在三重四级杆中单一离子对的响应均低于肽段m/z 689.3→738.4 (YLY) 的响应。随后, 通过Protein BLAST (NCBI) 工具进行蛋白质库搜索发现, 内源性FGF21经胰蛋白酶酶解后也可产生肽段YLY。但该内源性蛋白的体内浓度极低, 约为20 pg·mL-1~2 ng·mL-1, 远远低于本实验中的定量下限(2.50 μg·mL-1), 不干扰FGF21-164融合蛋白的定量[17]。因此, 选用肽段YLY作为替代肽段, 以离子反应m/z 689.3→738.4定量分析FGF21-164在生物基质中的浓度。
| Table 1 Information of peptides generated by FGF21-164 after trypsin enzymolysis predicted by Skyline. *Selective peptide and ion pairs using |

|
Figure 1 The total ion chromatogram of all peptides of FGF21-164 digest obtained by HR-MS (A). MRM chromatograms of 4 ion pairs for determination of FGF21-164 by LC-MS/MS (B) |
利用ProtParam (Expasy) 工具对所选肽段(YLY) 进行预测分析发现, 该肽段亲水性较强(氨基酸亲水性的平均值为-1.00), 且呈酸性(等电点为4.31)。因此, 在色谱条件的流动相梯度选择时, 尝试使用低有机相的起始比例, 以缓慢的梯度上升(10%~30%, 0.5~3 min) 最大化地分离样品中的极性物质与待测物。同时, 对血清样品进行高温变性和烷基化处理可以降低不稳定肽段对替代肽段的干扰, 以降低血清样品的基质效应[18]。本实验对FGF21-164蛋白的酶解条件进行了优化, 结果显示, 该蛋白在37 ℃与胰酶孵育2 h便可达到最佳的酶解效率, 且60 ℃变性和烷基化处理不会对待测蛋白的酶解效率造成影响。然而, 终止液中有机相的比例会对替代肽段的响应有一定影响, 高水相比例的终止液(含2%甲酸溶液的20%乙腈-水溶液) 可以提高替代肽段在最终体系中的溶解度, 提高质谱响应[19]。
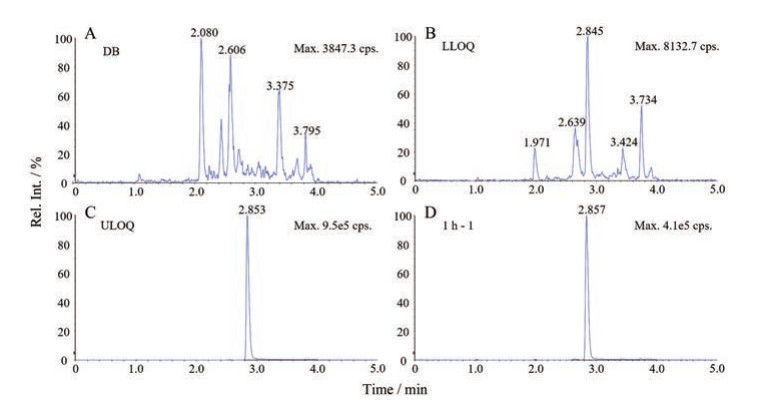
3 方法验证 3.1 选择性结果表明, 空白小鼠血清中的内源性物质不干扰FGF21-164的测定, UHPLC-MRM典型色谱图见图 2所示。
|
Figure 2 Typical UHPLC-MRM chromatograms of FGF21-164. A: Blank plasma sample; B: Blank plasma sample spiked with FGF21-164 at LLOQ; C: Blank plasma sample spiked with FGF21-164 at ULOQ; D: Serum sample gathered at 1 h followed by intravenous administration of 22.7 mg·kg-1 FGF21-164 to C57 mice (n = 4) |
测定小鼠血清中FGF21-164的线性范围为: 2.50、10.0、25.0、100、250和500 μg·mL-1。典型标准曲线回归方程为: y = 7.51×103 x + 8.44×103 (r = 0.998 8)。
3.3 定量下限(LLOQ)LLOQ血清样品(FGF21-164的血清浓度为2.50 μg·mL-1) 的批内精密度为9.9%, 批间精密度为10.8%, 相对误差为9.8%。
3.4 准确度和精密度待测物低、中、高质控样品的批内精密度均小于7.2%, 批间精密度均小于6.9%, 相对误差在-8.9%~2.9%, 均符合生物样品测定相关要求[14]。
3.5 基质效应待测物在低和高浓度的基质效应分别为133%和123%, 相对标准差均小于13.4%。结果表明, 待测物在本实验条件下, 可忽略基质效应的影响。
3.6 稳定性本文考察了FGF21-164低和高两浓度QC血清样品在-20 ℃放置81天和室温下放置6 h的稳定性。在上述情况下待测物均稳定。
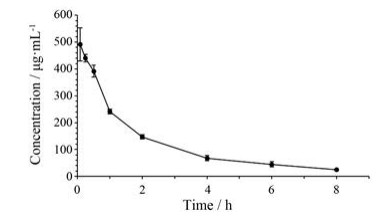
4 药动学研究本方法的线性范围2.50~500 μg·mL-1满足本药动学实验所需, 分析批内的标准曲线和质控样品准确度均位于±15%以内。静脉给予C57小鼠22.7 mg·kg-1 FGF21-164融合蛋白后, FGF21-164的药时曲线和主要药动学参数分别见图 3和表 2。相比于内源性FGF21, FGF21-164蛋白的终末消除半衰期(t1/2) 由0.5 h延长至2.60 ± 0.335 h[20], 其体内清除率(CL) 为21.9 ± 1.22 mL·h-1·kg-1。该蛋白在小鼠体内的表观分布容积(Vd) 为64.2 ± 1.78 mL·kg-1, 这与小鼠的总血容量相似, 表明该蛋白集中分布于血管内, 与同类其他FGF21类似物结果相同[3, 6]。
|
Figure 3 Mean plasma concentration-time curves of FGF21-164 followed by intravenous administration of 22.7 mg·kg-1 FGF21-164 to C57 mice (n = 4) |
| Table 2 Pharmacokinetic parameters of FGF21-164 followed by intravenous administration of 22.7 mg·kg-1 FGF21-164 to C57 mouse (n = 4). Data are given as mean (SD). *Geometric mean (SD) |
本文建立了快速、高效的UHPLC-MS/MS法定量小鼠血清中FGF21-164融合蛋白的浓度, 并详细介绍了结合预测软件与高分辨质谱法选择替代肽段, 和以三重四级杆质谱进行定量检测的一般流程。该方法经验证后成功应用于FGF21-164融合蛋白在小鼠体内的药代动力学研究。结果表明, 相对于内源性FGF21, 结构修饰后的FGF21-164融合蛋白在小鼠体内的半衰期明显增加, 有望延长该蛋白的疗效。
作者贡献: 陈震东和高宇雄负责实验方案设计与实施和论文撰写; 薛皓、郑元东和王蓉负责实验施行和数据采集; 杨美家和钟大放负责基金获得、实验监督及论文审阅。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Hecht R, Li YS, Sun J, et al. Rationale-based engineering of a potent long-acting FGF21 analog for the treatment of type 2 diabetes[J]. PLoS One, 2012, 7: e49345. DOI:10.1371/journal.pone.0049345 |
| [2] |
Weng Y, Ishino T, Sievers A, et al. Glyco-engineered long acting FGF21 variant with optimal pharmaceutical and pharmacokinetic properties to enable weekly to twice monthly subcutaneous dosing[J]. Sci Rep, 2018, 8: 4241. DOI:10.1038/s41598-018-22456-w |
| [3] |
Stanislaus S, Hecht R, Yie J, et al. A novel Fc-FGF21 with improved resistance to proteolysis, increased affinity toward beta-klotho, and enhanced efficacy in mice and cynomolgus monkeys[J]. Endocrinology, 2017, 158: 1314-1327. DOI:10.1210/en.2016-1917 |
| [4] |
Wu AL, Kolumam G, Stawicki S, et al. Amelioration of type 2 diabetes by antibody-mediated activation of fibroblast growth factor receptor 1[J]. Sci Transl Med, 2011, 3: 113r. |
| [5] |
Le CT, Nguyen G, Park SY, et al. LY2405319, an analog of fibroblast growth factor 21 ameliorates α-smooth muscle actin production through inhibition of the succinate-G-protein couple receptor 91(GPR91) pathway in mice[J]. PLoS One, 2018, 13: e0192146. DOI:10.1371/journal.pone.0192146 |
| [6] |
Weng Y, Chabot JR, Bernardo B, et al. Pharmacokinetics (PK), pharmacodynamics (PD) and integrated PK/PD modeling of a novel long acting FGF21 clinical candidate PF-05231023 in diet-induced obese and leptin-deficient obese mice[J]. PLoS One, 2015, 10: e0119104. DOI:10.1371/journal.pone.0119104 |
| [7] |
Watanabe H, Miyahisa M, Chikamatsu M, et al. Development of a long acting FGF21 analogue-albumin fusion protein and its anti-diabetic effects[J]. J Control Release, 2020, 324: 522-531. DOI:10.1016/j.jconrel.2020.05.036 |
| [8] |
Damen CW, Schellens JH, Beijnen JH. Bioanalytical methods for the quantification of therapeutic monoclonal antibodies and their application in clinical pharmacokinetic studies[J]. Hum Antibodies, 2009, 18: 47-73. DOI:10.3233/HAB-2009-0206 |
| [9] |
Gao Y, Zhong D. Advances in bioanalysis of antibody drugs by LC-MS[J]. Acta Pharm Sin (药学学报), 2020, 55: 453-462. |
| [10] |
Todoroki K, Mizuno H, Sugiyama E, et al. Bioanalytical methods for therapeutic monoclonal antibodies and antibody-drug conjugates: a review of recent advances and future perspectives[J]. J Pharm Biomed Anal, 2020, 179: 112991. DOI:10.1016/j.jpba.2019.112991 |
| [11] |
Zhen EY, Jin Z, Ackermann BL, et al. Circulating FGF21 proteolytic processing mediated by fibroblast activation protein[J]. Biochem J, 2016, 473: 605-614. DOI:10.1042/BJ20151085 |
| [12] |
Zhao Y, Liu G, Kwok S, et al. Highly selective and sensitive measurement of active forms of FGF21 using novel immunocapture enrichment with LC-MS/MS[J]. Bioanalysis, 2017, 10: 23-33. |
| [13] |
Li F, Weng Y, Zhang G, et al. Characterization and quantification of an Fc-FGF21 fusion protein in rat serum using immunoaffinity LC-MS[J]. AAPS J, 2019, 21: 84. DOI:10.1208/s12248-019-0356-4 |
| [14] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2020 Ed. Vol 4. Beijing: China Medical Science Press, 2020: 466-468.
|
| [15] |
Zhou SV, Ferrari L, Qu J. Practical considerations in enhancing LC-MS sensitivity for therapeutic protein bioanalysis[J]. Bioanalysis, 2017, 9: 1353-1356. DOI:10.4155/bio-2017-4982 |
| [16] |
Shen JX, Liu G, Zhao Y. Strategies for improving sensitivity and selectivity for the quantitation of biotherapeutics in biological matrix using LC-MS/MS[J]. Expert Rev Proteomics, 2015, 12: 125-131. DOI:10.1586/14789450.2015.1024225 |
| [17] |
Angelin B, Larsson TE, Rudling M. Circulating fibroblast growth factors as metabolic regulators--a critical appraisal[J]. Cell Metab, 2012, 16: 693-705. DOI:10.1016/j.cmet.2012.11.001 |
| [18] |
Gao Y, Zhang D, Yang C, et al. Two validated liquid chromatography-mass spectrometry methods with different pretreatments for the quantification of an anti-CD47 monoclonal antibody in rat and cynomolgus monkey serum compared with an electrochemiluminescence method[J]. J Pharm Biomed Anal, 2019, 175: 112792. DOI:10.1016/j.jpba.2019.112792 |
| [19] |
Gao Y, Chen Z, Yang C, et al. Liquid chromatography-mass spectrometry method for the quantification of an anti-sclerostin monoclonal antibody in cynomolgus monkey serum[J]. J Pharm Anal, 2020. DOI:10.1016/j.jpha.2020.08.005 |
| [20] |
Kharitonenkov A, Wroblewski VJ, Koester A, et al. The metabolic state of diabetic monkeys is regulated by fibroblast growth factor-21[J]. Endocrinology, 2007, 148: 774-781. DOI:10.1210/en.2006-1168 |
 2021, Vol. 56
2021, Vol. 56


