2. 宜明昂科生物医药技术 (上海) 有限公司, 上海 201200
2. ImmuneOnco Biopharma Co., Ltd., Shanghai 201200, China
非霍奇金淋巴瘤(non-Hodgkin lymphoma, NHL) 是最常见的淋巴组织恶性肿瘤, 其死亡率在我国居恶性肿瘤中的第十位。NHL的传统治疗方案是以化疗为主, 局部放疗、手术治疗为辅的综合治疗, 复发和难治常常是导致治疗失败的主要原因。利妥昔单抗的问世使表达CD20的成熟B细胞淋巴瘤、白血病的生存率有了大幅度的提升, 然而仍然有20%~30%患者因复发和难治而死亡。癌症及其他疾病等常因许多信号通路而导致发病, 单靶点免疫疗法似乎不足以破坏癌细胞。为了克服单克隆抗体(mAb) 治疗的缺点并提高治疗效果, 优于mAb并以免疫球蛋白G (IgG) 为基础的双特异性抗体和抗体融合蛋白变得越来越受关注。单克隆抗体是单特异性的, 但以IgG为基础的双特异性抗体和抗体融合蛋白可以同时识别相同或不同抗原上的两个不同表位[1], 从而实现新的治疗应用。
由宜明昂科生物医药技术(上海) 有限公司开发的IMM0306目前已完成临床前各项相关研究, 在长期毒性实验中食蟹猴重复给药后出现了可能与肾脏毒性和输液反应相关的死亡; 免疫毒性实验中可见某些细胞因子表达上调; 体外溶血实验中, 对食蟹猴红细胞有凝聚作用。虽然IMM0306在临床前研究中存在少量的不良反应, 但是其抗肿瘤的疗效显著, 整体安全性良好, 目前IMM0306处于临床研究阶段, 有望提供更好的治疗手段。
IMM0306研究目前处于临床I期, 需要开发一种方法检测人血清中IMM0306的浓度, 用于研究IMM0306在人体内的药代动力学。本研究建立了检测人血清中IMM0306的浓度的ELISA方法, 并根据相关的指导原则验证了其临床应用的准确性和重现性。
材料和方法试剂和血清 健康受试者的空白人血清由邢台医学高等专科学校第二附属医院提供, 已通过邢台医学高等专科学校第二附属医院临床试验伦理委员会批准(批号: XYEYCTEC-HS-011)。样本、抗体融合蛋白治疗药物IMM0306由宜明昂科生物医药技术(上海) 有限公司提供。包被抗原重组人CD47蛋白(Recombinant human CD47 protein, 批号: LC13JA1123) 购自北京义翘神州生物技术有限公司, 链霉亲和素-HRP (High Sensitivity Streptavidin-HRP, 批号: VC300763) 和酶标板(StripwellTM Microplate, 批号: 28718008) 购自Thermo Fisher公司。TMB (3, 3', 5, 5'-四甲基联苯胺, 批号: 10456483) 显色液购自Sera care公司。生物素标记的抗IMM0306抗体(Anti-IMM0306-Biotin, 批号: 20200319) 由本实验室自行标记。
主要仪器 多功能酶标仪(SpectraMax M2e) 购自美国Molecular Devices公司, 电化学发光分析仪(MESO QuickPlex SQ120) 购自美国Meso Scale Discovery公司, 小型数字微型摇板机(Compact Digital MicroPlate Shaker) 购自美国Thermo Fisher公司, 洗板机(405 LSR) 购自美国Biotek公司。
溶液配制 包被液: 1×碳酸盐缓冲液; 分析缓冲液和封闭缓冲液: 5%脱脂奶粉溶于0.1% PBST; 洗板液: 0.1% PBST。
抗原包被 将重组人CD47蛋白溶于无菌双蒸水中, 配制成250 μg·mL-1储备液储存, 后用1×碳酸盐缓冲液稀释成2 μg·mL-1的工作浓度。每孔中加入100 μL, 4 ℃孵育过夜; 孵育结束后弃去孔内包被液, 每孔加入300 μL 5%脱脂奶粉, 室温封闭2 h, 封闭结束后弃去孔内溶液, 洗涤并拍干。
抗IMM0306抗体的生物素标记 抗IMM0306抗体是经IMM0306免疫猴后, 经亲和纯化获得的多抗, 其可以与IMM0306特异性结合。将抗IMM0306抗体与生物素进行偶联标记, 产物经Thermo Scientific™ Zeba™脱盐离心柱脱盐离心纯化后收集, 后采用BCA法测定蛋白浓度, 标记完成后置-90~-60 ℃保存备用。
标准曲线样品和质控样本的制备 用混合健康受试者空白血清加标IMM0306配制得到标准曲线样本和质控样本, 标准曲线设计8个点, STD1~STD8的浓度分别为: 100、80、40、20、10、6、4和2 ng·mL-1, STD8为锚点, 混合健康受试者血清作为空白对照。质控设计5个点, 分别为定量上限(ULOQ)、高、中、低浓度质控(HQC、MQC、LQC) 和定量下限(LLOQ), 浓度分别为: 100、75.0、15.0、8和4 ng·mL-1。
ELISA检测方法 于包被有重组人CD47蛋白的酶标板中分别加入1∶10稀释的标准曲线样本、质控样本以及待测样本100 μL, 室温振荡孵育1.5 h; 弃去板中溶液, 洗涤液洗涤3次; 每孔加入100 μL生物素标记的抗IMM0306抗体(1∶500稀释), 室温振荡孵育1 h; 弃去板中溶液, 洗涤液洗涤5次, 每孔加入100 μL链霉亲和素-HRP (1∶5 000稀释), 室温振荡孵育1 h; 弃去板中溶液, 洗涤液洗涤5次, 每孔加入TMB显色液100 μL, 室温避光孵育5~15 min; 每孔加入终止液100 μL, 终止反应; 使用酶标仪在450 nm/630 nm双波长下读板并保存数据。
方法验证标准曲线与定量范围 向空白混合人血清加入已知浓度的IMM0306配制得到标准曲线样品, 每个批次每块板上须包括一套标准曲线和一套空白样品。标准曲线共8个点, STD1~STD8的浓度分别为: 100、80、40、20、10、6、4和2 ng·mL-1, 每个样品做复孔分析。在实验中, 由4名分析人员在两天完成6个可接受分析批, 以浓度为横坐标, 以OD值(吸光值) 为纵坐标, 进行5逻辑参数拟合绘制标准曲线。
精密度和准确度 4名分析人员在两天进行6个分析批测试, 以考察批内和批间的精密度和准确度。一块板上包含1套标准曲线, 3套QC样品, 每套含5个浓度水平(LLOQ、LQC、MQC、HQC以及ULOQ: IMM0306的浓度分别为4、8、15、75和100 ng·mL-1), 评估每一浓度水平质控样品的准确度和精密度以及方法总误差。
选择性向10个不同来源的空白人血清中加入LLOQ和ULOQ浓度水平的分析物, 同时测量未加入分析物的基质。
稀释线性和钩状效应 配制浓度高于定量上限的QC样品(500和50 μg·mL-1), 若其测量值高于ULOQ样品的测量值, 则说明此方法没有产生钩状效应。如果观察到钩状效应的发生, 应评估其产生的原因并根据评估结果采取相应的措施。另外, 用空白基质配制稀释线性样品, 浓度分别为5 000、500、50、25、5和2.5 ng·mL-1, 每个浓度重复5次, 以考察样品的稀释线性。
特异性 选择利妥昔单抗作为分析物的相关干扰物质, 向空白基质中加入HQC与LQC质控样品, 并分别加入终浓度为2 000和200 ng·mL-1的利妥昔单抗。同时测量添加利妥昔单抗的空白样品的响应值。
稳健性 在批内和批间精密度实验中同时进行不同的分析员、不同实验天、不同的摇板机、不同的孵育时间(包括样品孵育的时间为90 ± 10 min, 检测抗体的孵育时间为60 ± 10 min) 变化的实验。
稳定性 在空白混合人血清中配制LQC和HQC浓度水平的稳定性样品, 浓度分别为8和75 ng·mL-1, 每一浓度水平样品重复3次, 分别考察不同条件下的稳定性, 包括血清样品的室温放置稳定性、2~8 ℃放置稳定性、冻融稳定性、长期稳定性;
样本分析 验证过的方法用于IMM0306临床I期的PK (药代动力学) 研究, 该研究为单臂、多中心、开放性、单次和多次给药、剂量递增以及队列扩展的临床试验。该试验获得中国医学科学院肿瘤医院伦理委员会批准[批准号: CTR20192612)]。
结果 1 方法学验证 1.1 标准曲线与定量范围标准曲线定量范围为4~100 ng·mL-1, 6个分析批中标准曲线各浓度样品准确度Bias%在-2.0%~2.5%之间, 精密度CV%在0.4%~3.1%之间, 均满足接受标准。
1.2 准确度、精密度和方法总误差每一浓度水平IMM0306的QC样品的批内精密度均小于12.1%, 批间精密度均小于8.2%。总误差在3.9%~9.2%之间。待测物各浓度水平的批内和批间准确度和精密度均符合生物样品测定相关要求。
1.3 选择性选择性样品分析结果显示, 未加入IMM0306的空白基质样品浓度均BQL (低于定量下限), LLOQ水平选择性样品中10/10 (100%) 个体的Bias%在-15.3%~2.3%之间, ULOQ水平选择性样品中10/10 (100%) 个体的Bias%在-12.3%~0.0%之间, 满足选择性接受标准, 结果表明该方法无基质效应的影响。
1.4 稀释线性和钩状效应人血清中500 μg·mL-1和50 μg·mL-1 IMM0306的信号值均高于ULOQ样品, 表明在50~500 μg·mL-1浓度内无钩状效应(数据未显示)。理论浓度位于标准曲线定量范围内的3个稀释线性样品的Bias%在-6.2%~14.4%之间, CV%在0.5%~8.8%之间。稀释线性数据表明, 人血清最大稀释倍数为100 000。
1.5 特异性特异性样品分析结果显示, 加入2 000和200 ng·mL-1的利妥昔单抗的空白特异性样品测量值均BQL。在高浓度质控样品(75 ng·mL-1 IMM0306) 和低浓度质控样品(8 ng·mL-1 IMM0306) 中加入2 000 ng·mL-1利妥昔单抗, 其测得的Bias%分别为-10.1%、-16.3%, 精密度分别为4.7%、2.7%。
在高浓度质控样品(75 ng·mL-1 IMM0306) 和低浓度质控样品(8 ng·mL-1 IMM0306) 中加入200 ng·mL-1利妥昔单抗, 其测得的Bias%分别为-14.0%、-12.6%, 精密度分别为8.0%、8.2%。结果表明该实验方法不受利妥昔单抗的干扰, 具有特异性。
1.6 稳健性在批内和批间精密度实验中进行方法稳健性的评价, 结果显示精密度满足接受标准, 表明此方法在不同的分析员、不同实验天、不同的摇板机、不同的孵育时间这些变化中具有稳健性。
1.7 稳定性供试品高、低浓度(75和8 ng·mL-1) 血清稳定性样品分别于室温放置不少于24 h, 2~8 ℃放置不少于24 h, -90~-60 ℃以下放置不少于1个月后和反复冻融5循环和7循环后进行测定。结果显示, 样品在室温和2~8 ℃放置24 h是稳定的, 样品可经历7次冻融循环, 样品在-90~-60 ℃存放189天是稳定的。
2 样本分析验证过的方法用于IMM0306临床I期的PK (药代动力学) 研究, 目前剂量递增阶段已完成3个剂量组的摸索: 40、100和250 μg·kg-1。
图 1显示了患者静脉注射后IMM0306的平均血清浓度与时间的关系。其中, 受试者1的给药剂量为100 μg·kg-1, 受试者2和受试者3的给药剂量为250 μg·kg-1。40 μg·kg-1剂量组因血药浓度较低, 样品检测结果不在此图中显示。
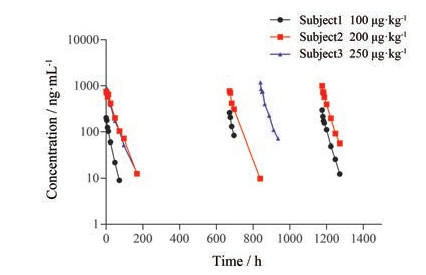
|
Figure 1 Profiles of the pharmacokinetic study |
抗体融合蛋白是一种新兴的药物, 具有重要的治疗价值。因此, 开发一种可靠的、稳健的和可重复的双特异性抗体融合蛋白分子的PK检测方法是非常重要的。由于抗体融合蛋白结构的复杂性, 以及多种因素可能会影响测量的准确性, 因此对每个不同结构的抗体融合蛋白需开发一个适合目的检测方法, 这是具有挑战的。大多数抗体融合蛋白的生物分析方法是基于配体结合测定的原理。选择一个合适的配体结合测定方法包括检测平台、分析模式和关键试剂的选择。它还需要对其他可能导致生物分析错误和误导评估(风险评估) 的因素进行适当的评估[2, 3]。
一些全球监管机构已经发布了生物制剂的开发指南[4-7]。然而, 双特异性抗体融合蛋白方法的开发策略可能会有些挑战。双特异性抗体融合蛋白可以与各种循环配体结合, 如游离靶蛋白、ADAs (抗药抗体) 和其他内源性血清成分。此外, 双特异性抗体融合蛋白可能由于生物转化而失去其结合能力。因此, 双特异性抗体融合蛋白可以以双靶点抗原结合位点的药理活性形式存在, 也可以以部分或无靶点结合位点的非活性形式存在。是否测量活性浓度或总浓度(活性加非活性/部分活性形式) 来评估PK/PD (药代动力学/药效学), 作为生物分析策略的一部分, 仍然存在争议[8, 9]。配体结合测定生物分析焦点小组最近发表的白皮书讨论了测量游离(活性)、总药物和目标蛋白的挑战和问题, 以及如何利用这些数据支持药物发现和开发。通常, 当考虑哪种治疗性蛋白的形式应该被测量以达到研究的预期目的时, 应采用一种“符合目的”的方法[10]。
本研究中, IMM0306是重组人信号调节蛋白α-抗CD20人鼠嵌合抗体融合蛋白。结构为抗CD20人鼠嵌合单克隆抗体的重链N端连接了CD47配体蛋白SIRPa的第一个结构域SIRPa-D1, 适应症拟为难治或复发性CD20阳性B-NHL。使用CD47靶点包被捕获药物, 抗独特型抗体检测的ELISA方法, 可以很好地规避B-NHL存在的大量的游离CD20靶点的问题[11], 方法的灵敏度为4 ng·mL-1, 可以满足临床试验的需求。但是由于此ELISA方法的定量范围较窄, 如果有条件建议使用MSD平台以获得更大的动态范围。
作者贡献: 靖钰负责实验设计及论文撰写, 姚慕蓉负责实验的操作及文献整理, 宗山海负责论文的审阅, 杨勇和钟勘负责终稿审查。李松、陈典泽和张力负责IMM0306临床前研究资料的支持, 验证方案和报告的审核。
利益冲突: 所有作者均不存在利益冲突。
| [1] |
Klein C, Sustmann C, Thomas M, et al. Progress in overcoming the chain association issue in bispecific heterodimeric IgG antibodies[J]. MAbs, 2012, 4: 653-663. DOI:10.4161/mabs.21379 |
| [2] |
Findlay J, Smith WC, Lee JW, et al. Validation of immunoassays for bioanalysis: a pharmaceutical industry perspective[J]. J Pharm Biomed Anal, 2000, 21: 1249-1273. DOI:10.1016/S0731-7085(99)00244-7 |
| [3] |
Trivedi A, Stienen S, Zhu M, et al. Clinical pharmacology and translational aspects of bispecific antibodies[J]. ClinTransl Sci, 2017, 10: 147-162. |
| [4] |
Harmonised ICH. Bioanalytical method validation M10[S/OL]. Geneva, Switzerland: ICH Harmonised, 2019-02-26[2021-04-20]. https://www.wrib.org/PDFs/ICH_M10_BMV_Draft_Guideline-190227.pdf.
|
| [5] |
Chinese Pharmacopoeia Commission. Pharmacopeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 Ed. Beijing: China Medical Science Press, 2015: 363-368.
|
| [6] |
European Medicines Agency. Guideline on bioanalytical method validation[S/OL]. Amsterdam: European Medicines Agency, 2011-07-21[2021-04-20]. https://www.ema.europa.eu/en/documents/scientific-guideline/guideline-bioanalytical-method-validation_en.pdf.
|
| [7] |
Food and Drug Administration. Bioanalytical method validation guidance for industry[S/OL]. Silver Spring, US: Food and Drug Administration, 2018-05-24[2021-04-20]. https://www.fda.gov/media/70858/download.
|
| [8] |
Gunasekaran K, Pentony M, Shen M, et al. Enhancing antibody Fc heterodimer formation through electrostatic steering effects: applications to bispecific molecules and monovalent IgG[J]. J Biol Chem, 2010, 285: 19637-19646. DOI:10.1074/jbc.M110.117382 |
| [9] |
Zenjiro S, Tomoyuki I, Tetsuhiro S, et al. Identification and multidimensional optimization of an asymmetric bispecific IgG antibody mimicking the function of factor VIII cofactor activity[J]. PLoS One, 2013, 8: e57479. DOI:10.1371/journal.pone.0057479 |
| [10] |
Stevenson L, Amaravadi L, Myler H, et al. 2014 White Paper on recent issues in bioanalysis: a full immersion in bioanalysis (Part 3-LBA and immunogenicity)[J]. Bioanalysis, 2014, 6: 3355-3368. DOI:10.4155/bio.14.283 |
| [11] |
Giles FJ, Vose JM, Do KA, et al. Circulating CD20 and CD52 in patients with non-Hodgkin's lymphoma or Hodgkin's disease[J]. Br J Haematol, 2015, 123: 850-857. |
 2021, Vol. 56
2021, Vol. 56


