2. 山西大学化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
3. 地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006;
4. 中国科学院过程工程研究所, 北京 100190;
5. 山西省果业工作总站, 山西 太原 030001
2. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education of Shanxi University, Taiyuan 030006, China;
3. Key Laboratory of Effective Substances Research and Utilization in TCM of Shanxi Province, Taiyuan 030006, China;
4. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
5. Shanxi Fruit Industry Work Station, Taiyuan 030001, China
黄芪是多年生豆科植物蒙古黄芪Astragalus membranaceus (Fisch.) Bge. var. mongholicus (Bge.) Hsiao或膜荚黄芪Astragalus membranaceus (Fisch.) Bge.的干燥根, 始载于《神农本草经》, 列为上品, 在临床中广泛应用[1]。研究发现黄芪中含有多糖类、黄酮类、皂苷类以及氨基酸等多种化学成分, 其中, 黄芪多糖(Astragalus polysaccharide, APS) 具有抗肿瘤、抗氧化、降血糖血脂、保护心血管等药理作用[2]。课题组前期研究发现, 黄芪多糖按照分子量可划分为两个部分, 分别为大于2 000 kDa的APS-Ⅰ组分和分子量约为10 kDa的APS-Ⅱ组分(active Astragalus polysaccharide, APS-Ⅱ), 后者在体外特异性与非特异性免疫方面均显示出较强的免疫促进活性, 并通过环磷酰胺免疫抑制小鼠的体内实验筛选, 验证了APS-Ⅱ为黄芪多糖免疫促进活性最强组分[3]。
多糖的活性与其相对分子质量、糖苷键位置、单糖组成及构型等因素息息相关, 但多糖较大的分子量以及分支结构尚无法准确测定的国际性难题限制了其新药研发[4]。在大分子蛋白质的研究中, 多采用“自上而下”法将大分子蛋白质降解为多肽或氨基酸后进行表征与分析[5]。多糖与蛋白质相似, 可同样采用“自上而下”的研究策略, 将多糖水解为寡糖, 从结构相对简单的寡糖水平阐释结构特征[6]。近年来多糖受体理论研究成果表明[7], 糖类在发挥药效的过程中, 仅是其中一个或多个寡糖片段“活性中心”与受体蛋白相互作用。因此将多糖降解为寡糖, 通过研究寡糖的结构和功效, 为突破多糖研究的技术瓶颈提供了新策略。
目前已有按照此策略开发的新型药物。磺达肝癸纳是根据肝素核心五糖结构合成后开发的新型抗凝血药物, 与肝素药物相比, 不仅出血不良反应更小, 而且半衰期更长, 已广泛应用于重大手术治疗中预防血栓的形成[8, 9]。此外, 巴戟天寡糖抗抑郁药物的研发[10]、香菇核心七糖的发现[11]、活性壳寡糖的应用[12]以及抗阿尔茨海默症药物GV-971[13]的研发均为本研究提供了思路。
综上, 本研究以活性多糖APS-Ⅱ为研究对象, 借鉴“自上而下”的研究策略, 结合多糖受体理论学说的研究思路, 采用三氟乙酸的部分酸水解方法, 通过单因素试验和正交试验寻找APS-Ⅱ的最佳酸解条件, 同时结合超高效液相联用高分辨质谱对降解产物黄芪寡糖(Astragalus oligosaccharides, APOS) 进行结构分析, 并将其分离制备为不同聚合度(degree of polymerization, DP) 的寡糖片段, 通过体外细胞免疫活性筛选, 初步确定免疫活性黄芪寡糖片段。研究结果不仅为阐明黄芪多糖构效关系奠定基础, 同时促进药物的开发, 对其他中药寡糖的研究具有一定的示范作用。
材料与方法仪器 2695型高效液相色谱仪(6000蒸发光散射检测器, HPLC-ELSD, 美国Waters); 5600型超高效液相色谱-电喷雾电离高分辨飞行时间质谱(UPLC-ESI-QTOF-MS, AB SCIEX, 西班牙); 4250型纯化制备色谱仪(德国Interchim); 3000型超高效液相色谱仪(电喷雾检测器, UPLC-CAD, 美国Thermo); GS-NF500型膜片式切向流膜分离系统, PES材质GS-10 wDa膜(上海顾信生物科技有限公司); CPA225D型十万分之一分析天平(德国Sartorius); Neofuge 13R高速冷冻离心机(上海力申科学仪器有限公司); ZX-LGJ-18普通型冷冻干燥机(上海知信实验仪器技术有限公司); RE-52旋转蒸发器(上海亚荣生化仪器厂); Infinite M200酶标仪, 细胞培养箱(力康生物医疗科技控股有限公司)。
样品与试剂 本实验所用植物为山西浑源黄芪的干燥根, 五年生, 采于2017年10月, 由山西大学秦雪梅教授鉴定。
葡萄糖、葡聚二糖、葡聚三糖、葡聚四糖、葡聚五糖、葡聚六糖、葡聚七糖、葡聚八糖、葡聚九糖(纯度大于95%, 批号201903, 山西玖玖商贸有限公司); 三氟乙酸(纯度大于99%, 批号201811, 中国上海阿拉丁); 分析级无水乙醇、无水甲醇(批号201902, 天津市大茂化学试剂厂); 色谱级甲酸、乙腈、甲醇、质谱级乙腈(批号202008, 美国Thermo公司); 分析级甲酸铵(批号20180926, 国药集团化学试剂有限公司); DMEM培养基(批号20210221, 武汉博士德生物工程有限公司); 中性红试剂、胎牛血清(FBS)、青链霉素混合液(P/S)、刀豆蛋白A (ConA)、脂多糖(LPS)、PBS缓冲盐溶液、红细胞裂解液、细胞计数试剂盒-8 (CCK-8)、小鼠免疫球蛋白G (Ig G) 的酶联免疫吸附测定(ELISA) 试剂盒(批号202102, 美国Solarbio公司)。
BALB/c小鼠购自北京维通利华实验动物技术有限公司, 许可证号SCXK (京2016-0006), 动物实验通过山西大学科学研究伦理委员会批准(批准号SXULL-2018009)。
APS-Ⅱ的分离制备 将浑源黄芪干燥根粉碎成粉末, 过100目筛, 取细粉约60 g置2 L烧杯中, 按照料液比1:20加去离子水1 200 mL, 于磁力搅拌器上搅拌, 热提温度90 ℃, 提取时间4 h。经水提后样品置于离心机中离心(3 000 r·min-1, 15 min), 上清液抽滤后浓缩至400 mL, 加木瓜蛋白酶15 mg, 45 ℃下恒温水浴反应6 h, 加原溶液体积1/3量的10%三氯乙酸, 在冰浴中搅拌15 min后静置30 min, 3 000 r·min-1离心15 min, 弃沉淀。取上清液加无水乙醇至终醇浓度为80%, 静置过夜, 收集沉淀冷冻干燥得APS。取APS溶解在去离子水中, 采用超滤膜截留法(100 kDa膜) 分离, 收集膜后溶液, 浓缩冻干得到APS-Ⅱ。
APS-Ⅱ的部分酸水解
单因素试验考察标准品的配制: 精密称取葡萄糖、葡聚二糖、葡聚三糖、葡聚四糖、葡聚五糖、葡聚六糖、葡聚七糖、葡聚八糖和葡聚九糖5 mg置于同一量瓶中定容至5 mL, 经0.22 μm微孔滤膜过滤后, 进行HPLC-ELSD分析。
精密称取APS-Ⅱ 150 mg, 每10 mg置于一个水解管中, 在一定温度下加入2 mL固定浓度的三氟乙酸溶液降解多糖一定的时间, 分别考察酸解温度、酸浓度和酸解时间对多糖降解的影响。保持酸浓度1.0 mol·L-1和酸解时间2 h不变, 考察酸解温度70、80、90、100和110 ℃对降解产物的影响; 保持酸解温度80 ℃和酸解时间2 h不变, 考察酸浓度0.2、0.5、1.0、2.0和4.0 mol·L-1对降解产物的影响; 保持酸解温度80 ℃和酸浓度1.0 mol·L-1不变, 考察酸解时间30 min、1 h、2 h、3 h和4 h对降解产物的影响。酸解完成后立即旋干, 用1 mL无水甲醇复溶3次, 旋干, 除去多余的三氟乙酸, 再用1.5 mL超纯水复溶, 经0.45 μm微孔滤膜过滤后, 进行HPLC-ELSD分析。
HPLC-ELSD分析条件: 色谱柱为华谱X Amide (250 mm×4.6 mm, 5 μm); 流动相为A-纯水, B-乙腈; 梯度洗脱0~50 min, 15% A~50% A, 85% B~50% B; 流速1 mL·min-1; 柱温35 ℃; 进样量20 μL; ELSD漂移管温度105 ℃; 载气流速2.5 L·min-1。
正交实验优化酸解条件精密称取APS-Ⅱ 10 mg放入水解管中, 加入三氟乙酸溶液2 mL, 以水解温度(A)、酸浓度(B) 及水解时间(C) 为考察因素进行正交水解实验, 每个因素选择3个水平, 因素水平表详见表 1。以产生寡糖的峰面积和与10 000的比值作为综合评价指标, 优选APS-Ⅱ的部分酸水解最优条件。
| Table 1 APS-Ⅱ partial acid hydrolysis orthogonal test factor level table (APS-Ⅱ: Active Astragalus polysaccharide) |
将综合评分得出的最优条件和极差分析得出的最优条件进行验证, 每组重复3次, 确认最佳条件的综合评分是否比九组正交评分值都高。
HPLC-ELSD分析条件: 同单因素试验考察的检测条件。
最优酸解条件的重复性评价通过对寡糖降解条件的优化, 选取最佳酸水解条件进行重复性考察。取APS-Ⅱ适量, 以最佳酸解条件水解, 平行六份, 进行UPLC-CAD分析, 按综合评分计算RSD%值评价降解条件的重复性。
UPLC-CAD分析条件: 色谱柱为华谱X Amide (250 mm×4.6 mm, 5 μm); 流动相: A-纯水, B-乙腈; 梯度洗脱: 0~55 min, 15% A~50% A; 55~60 min, 50% A~50% A; 流速: 1 mL·min-1; 柱温35 ℃; 进样量20 μL。
黄芪寡糖的质谱解析 将上述单因素考察中制备的葡聚糖标准品和使用最佳酸解条件制备的样品, 通过UPLC-ESI-QTOF-MS分析。
色谱条件: 色谱柱为Acquity UPLC BEH Amide (10 mm×2.1 mm, 1.7 μm); 流动相为A: 0.1%甲酸水, B: 乙腈; 梯度洗脱0~2 min (65% B), 2~6 min (65% B~60% B), 6~8 min (60% B~55% B), 8~10 min (55% B), 10~12 min (55% B~65% B), 12~13 min (65% B); 流速0.3 mL·min-1; 柱温40 ℃; 样品室温度4 ℃; 进样量2 μL。
质谱条件: 采用电喷雾电离源(electrospray ionization source, ESI) 负离子模式检测; 离子源温度为100 ℃; 雾化气为55 psi (1 psi ≈ 6.9 kPa); 辅助气为55 psi; 气帘气为30 psi; 雾化温度为500 ℃; 离子释放延迟(IRD) 为67; 离子束宽度(IRW) 为25; 一级质量扫描范围m/z 100~2 500, 去簇电压(DP) 为60 V, 碰撞能(CE) 为10 V; 二级质量扫描范围m/z 100~1 250, 去簇电压(DP) 为80 V, 碰撞能(CE) 为35 ± 15 V。
黄芪寡糖的分离制备 称取APOS粉末溶于蒸馏水中配成10 mg·mL-1的溶液, 经0.22 μm微孔滤膜滤过, 通过纯化制备色谱仪检测分离。该过程采用分流技术(1∶10), 比例为1的洗脱液采用高效液相色谱蒸发光散射检测器检测, 比例为10的洗脱液根据检测器显示的色谱峰情况接收保存, 最后将所有洗脱液分段合并分为6个寡糖片段APOS-1、APOS-2、APOS-3、APOS-4、APOS-5和APOS-6, 分别浓缩冻干。取制备好的寡糖片段配置成5 mg·mL-1的溶液, 经0.22 μm微孔滤膜过滤后, 进行UPLC-CAD检测。
制备液相条件: 色谱柱为华谱X Amide (20 mm×250 mm, 5 μm, 100A); 流动相: A-纯水, B-乙腈, C-甲酸铵溶液(pH = 3.2, 100 mmol·L-1); 梯度洗脱: 0~100 min, 5% A~35% A, 80% B~50% B, 15% C~15% C; 0~20 min手动接峰, 20~80 min用Waste模式自动收集, 80 min后手动接峰; 流速: 25 mL·min-1; 进样量5 mL。
UPLC-CAD分析条件: 同最优酸解条件的重复性评价的检测条件。
不同聚合度黄芪寡糖片段的固有免疫评价 用DMEM培养基(含10% FBS和1% P/S) 将RAW264.7细胞浓度调节至1×106/mL, 将细胞接种到96孔板中培养12 h (37 ℃, 5% CO2), 每孔200 μL, 12 h后弃去培养液, 用PBS清洗各孔2次。分别加入不同聚合度寡糖片段溶液200 μL继续培养24 h, 给药糖溶液终浓度为0、20、50、100、150、200、250 μg·mL-1, 每个浓度设6个平行孔, 24 h后弃去培养液, 用PBS清洗各孔2次。然后向各孔中加入以PBS配制的0.075%中性红溶液200 μL, 于培养箱中培养2 h后除去培养液, 用PBS清洗各孔2次。最后加细胞裂解液200 μL裂解细胞, 细胞裂解液为体积比1∶1的C2H5OH和CH3COOH, 4 h后用酶标仪测定96孔板在540 nm处的吸光度值(A540)。
不同聚合度黄芪寡糖片段的细胞免疫评价 小鼠脾淋巴细胞的提取[14]: 将BALB/c小鼠采用颈椎脱位法处死, 75%乙醇浸泡30 min, 超净台解剖, 无菌获取脾, 将其在200目无菌筛网中轻轻研磨, 用PBS溶液洗涤2次, 过滤获得单细胞悬浮液。滤液以1 000 r·min-1离心10 min, 弃去上清, 沉淀中加入适量红细胞裂解液, 混匀溶液, 再次离心10 min。然后用PBS溶液洗涤沉淀3次, 每次以1 000 r·min-1的速度离心5 min, 收集细胞即为小鼠脾淋巴细胞。
用RPMI 1640培养基(含10% FBS和1% P/S) 将小鼠脾淋巴细胞浓度调节至1×106/mL, 将细胞接种到96孔板中培养24 h, 每孔100 μL, 然后分别加入不同浓度的不同聚合度寡糖片段溶液90 μL与ConA溶液5 μL, 使各孔中给药糖溶液终浓度为0、20、50、100、150、200和250 μg·mL-1, 但是ConA的终浓度为10 μg·mL-1, 设定6个平行孔, 继续在培养箱中培养24 h。根据试剂盒说明每孔加入CCK-8 20 μL, 使用酶标仪在450 nm处测定吸光度值(A450)。
不同聚合度黄芪寡糖片段的体液免疫评价 用RPMI 1640培养基(含10% FBS和1% P/S) 将小鼠脾淋巴细胞调节至1×106/mL, 将细胞接种到96孔板中培养24 h, 每孔100 μL, 然后分别加入不同聚合度寡糖片段溶液90 μL与LPS溶液10 μL, 使各孔给药糖溶液终浓度为0、20、50、100、150、200、250 μg·mL-1, LPS终浓度为10 μg·mL-1, 设定6个平行孔, 继续在培养箱中培养24 h。然后将96孔板以3 000 r·min-1离心10 min, 取上清液根据试剂盒说明测定IgG分泌情况。
结果与讨论 1 APS-Ⅱ的分离制备水提醇沉所得的APS中包含两个不同分子质量的多糖, 分别为大于2 000 kDa的APS-Ⅰ组分和分子质量约为10 kDa的APS-Ⅱ组分, 经超滤机截留得到APS-Ⅱ组分, 即黄芪中的免疫活性多糖部分。
2 APS-Ⅱ部分酸水解的单因素试验结果酸水解是多糖结构分析的重要步骤, 其中部分酸水解即通过控制水解过程中的时间、温度等, 使多糖降解为不同聚合度的寡糖, 有助于质谱、核磁等技术手段对结构信息的精准判断[15-17]。近年来, 亲水作用色谱(hydrophilic interaction chromatography, HILIC) 因以强极性材料作为固定相, 以高比例的有机溶剂-水体系作流动相, 近年来广泛用于糖类、蛋白质、多肽、氨基酸等成分的分离和分析, 尤其在糖类应用中对不同聚合度的寡糖具有良好的分离效果[18-20]。
如图 1所示, 通过亲水作用色谱柱的检测分离, 不同聚合度的葡聚糖标准品的分离度明显, 葡萄糖在10 min左右出峰, 葡聚二糖到葡聚九糖从15 min开始按极性从小到大依次出峰, 保留时间分别为: 15.123、20.211、25.538、29.074、30.921、33.593、36.076和37.902 min。

|
Figure 1 HPLC-ELSD chart of glucose and dextran with different degree of polymerization (1: Glucose; 2: Glucobiose; 3: Glucotriose; 4: Glucotetraose; 5: Pentaglucan; 6: Glucohexaose; 7: Heptaglycan; 8: Octaglucan; 9: Nona glucan) |
影响多糖酸水解的主要因素有酸的种类、酸浓度、水解温度和水解时间等[15]。硫酸、盐酸等无机酸的酸性过强, 水解过程难以控制, 酸解结束用碱中和除酸会形成新物质盐, 影响质谱检测结构分析, 还易氧化多糖, 破坏多糖结构, 而有机酸甲酸、乙酸等酸性较弱, 降解能力较差。因此本实验选用毒性较低、氧化性弱的三氟乙酸作为水解试剂, 它能与甲醇互溶, 挥发性好易除去, 可以保证降解产物的稳定性。
保持酸浓度和酸解时间一致, 考察APS-Ⅱ在不同酸解温度下产物的差异。在100和110 ℃下, APS-Ⅱ水解过度, 100 ℃时表征为聚合度DP2-DP6的低聚合度寡糖, 不能满足寡糖的丰富性以确保免疫活性中心寡糖的存在, 110 ℃时过度水解为单糖和二糖。70和80 ℃下酸解程度相近, 呈现为丰富的寡糖片段, 但70 ℃时低聚合度寡糖各组分峰面积较小, 可能存在APS-Ⅱ降解不完全的情况。90 ℃降解产物的分离度最好, 但是寡糖丰富性不如80 ℃时的寡糖数目, 聚合度较大的寡糖被进一步降解。因此推断不同温度对APS-Ⅱ酸解产物具有极显著的影响, 主要表现在降解后寡糖组分含量以及数目的多少, 综上将70、80和90 ℃作为正交试验的三个水平。
保持酸解温度和酸解时间一致, 考察APS-Ⅱ在不同酸浓度下产物的差异。随三氟乙酸浓度的增加, APS-Ⅱ酸解产物中各寡糖组分数目相对稳定, 没有很大区别, 仅在寡糖含量上存在一定区别, 0.2 mol·L-1的酸浓度较小, 导致七糖以下的组分峰高较低, 可能由于酸度不够未能将APS-Ⅱ的糖苷键断裂完全。因此将酸浓度居中的0.5、1.0和2.0 mol·L-1作为正交试验的三个水平。
保持酸解温度和酸浓度一致, 考察APS-Ⅱ酸解不同时间下产物的差异。随着酸解时间的延长, 寡糖含量及数目均呈现下降趋势。酸解30 min时, DP9-DP15的色谱峰分离度不好, DP15以上的高聚合度寡糖未表征完全, 说明酸解时间较短, 有一部分多糖还未被降解; 酸解时间为1 h时, 寡糖产物的色谱峰数目及含量均呈现较好的分离, APS-Ⅱ水解恰当; 酸解时间延长至2和3 h时, DP12以上的寡糖各组分峰面积较小, 此时黄芪寡糖的丰富性降低; 继续延长酸解时间, 在APS-Ⅱ酸解4 h时, APS-Ⅱ降解程度加强, 产生了更多的二糖、三糖、四糖和五糖, DP10以上的寡糖基本不存在。为了提高效率缩短实验时间, 因此将1、2和3 h作为正交试验的三个水平。
3 APS-Ⅱ部分酸水解的正交试验结果九组正交试验酸解条件下, APS-Ⅱ降解的黄芪寡糖片段在亲水色谱柱中分离效果良好, 按照极性由小到大的顺序依次被洗脱, 不同聚合度寡糖可以明显分离。表 2分析结果显示, 九组正交试验中综合评分最高的组合为正交8试验, 综合评分为23 259.89, 由此得出的最佳酸解条件为A3B2C1, 即水解温度90 ℃, 三氟乙酸浓度1.0 mol·L-1, 水解时间1 h。然而, 由表 2的极差分析可知, 三种因素的影响顺序为: B (酸浓度) > C (酸解时间) > A (酸解温度), 且B2 > B3 > B1, C1 > C3 > C2, A2 > A1 > A3, 由此得出的最佳工艺组合为A2B2C1, 即水解温度80 ℃, 三氟乙酸浓度1.0 mol·L-1, 水解时间1 h。两个最佳组合相比, 影响因素较大的酸浓度和水解时间保持一致, 故B2C1为确定条件, 对于影响因素较小的A因素酸解温度, 进一步采用上述两组条件A3B2C1和A2B2C1进行验证, 以选择最佳条件。对实验结果进行方差分析即F检验, 用F值来评估组间差异, F值越大, 说明该组影响因素的差异越显著, 由F值可以看出, 酸浓度(F = 1.156) > 酸解时间(F = 0.569) > 酸解温度(F = 0.349), 影响因素排序同极差分析一致。
| Table 2 The orthogonal test results of APS-Ⅱ partial acid hydrolysis (K1/K2/K3: The average of the three groups of experiments at the 1/2/3 level of each influencing factor. R: The difference between the maximum K value and the minimum K value of each influencing factor) |
按照酸解条件A3B2C1和A2B2C1进行验证实验, 结果显示新组合A2B2C1的综合评分为26 874.59, 比九组正交结果中任意一组都高。因此确定APS-Ⅱ的最佳部分酸解条件为A2B2C1, 即水解温度80 ℃, 三氟乙酸浓度1.0 mol·L-1, 水解时间1 h。
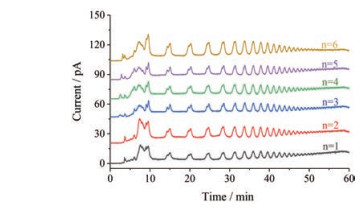
4 APS-Ⅱ在最佳酸解条件下的重复性评价如图 2所示, 重复性实验结果表明, APS-Ⅱ通过最优酸解条件下平行六份的综合评分值均高于正交试验中任何一组, 最低值为26 725.16, 最高值为27 391.29, 平均值为27 171.25, RSD%为1.6%, 小于3%, 符合要求, 表明该酸降解法重复性良好。
|
Figure 2 UPLC-CAD chromatogram of repeatability experiment of APS-Ⅱ acid hydrolysis |
电喷雾电离高分辨飞行时间质谱使用离子束压缩技术和增强型离子反射镜技术, 具有极高的质量精确度和分辨率, 二级质谱分析可对选定母离子施加多个裂解电压, 使一级产物打碎并呈现一定的断裂规律, 根据碎片离子之间的前后裂解次序能找到母离子与子离子的关系, 从而得到寡糖碎片离子的裂解顺序, 在糖类分析中广泛应用[21]。
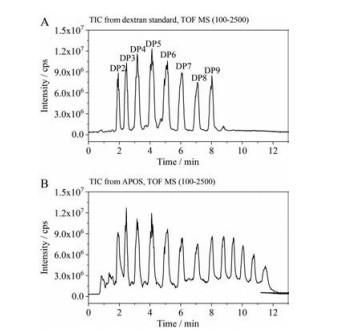
APS-Ⅱ经部分酸水解得到的特征性寡糖片段, 采用UPLC-ESI-QTOF-MS在负离子模式下对其进行结构表征, 不同聚合度的葡聚糖标品以及APS-Ⅱ部分酸解产物的总离子流图(TIC) 如图 3所示。对图 3B的样品质谱图进行分析, 结合文献[22]以及图 3A的葡聚糖标品质谱图可知, 1.8 min前的色谱峰为氨基酸杂质及单糖成分, 1.8~8.5 min之间的色谱峰依次为聚合度是2~9的寡糖, 样品中8.5 min后的色谱峰为聚合度更大的寡糖, 根据表 3中的碎片离子推断黄芪寡糖混合物中含有聚合度为DP2~DP14的寡糖。但是, 鉴于质谱质荷比的限制, 一级质谱只显示出最大为DP14的黄芪寡糖, 二级质谱只显示出最大为DP7的寡糖碎片信息, 根据表 3中碎片离子的规律性, 可以推测黄芪寡糖中存在聚合度更大的寡糖。
|
Figure 3 The total ion current of dextran standard (A) and APOS (B) in negative ion mode (APOS: Astragalus oligosaccharide, DP: Degree of polymerization) |
| Table 3 Detailed information of APS-Ⅱ partial acid hydrolysis products |
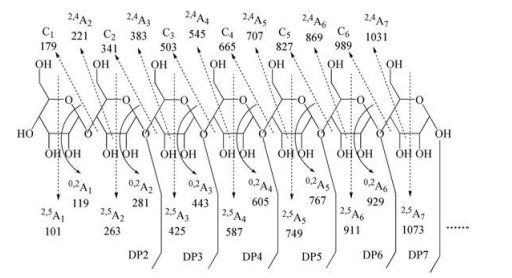
以聚合度为7的寡糖为例(m/z = 1 152), 根据Domon与Costello提出的命名规则定义APS-Ⅱ降解后的寡糖片段碎片离子。以[M-H]-为母离子, 发生糖苷键断裂, 母离子丢失己糖残基(162 u) 形成一系列C型碎片离子, 179 (C1), 341 (C2), 503 (C3), 665 (C4), 827 (C5), 989 (C6)。同时, [M-H]-母离子发生开环断裂, 丢失60 u, 产生0, 2Ai碎片离子, 119 (0, 2A1), 281 (0, 2A2), 443 (0, 2A3), 605 (0, 2A4), 767 (0, 2A5), 929 (0, 2A6), 1 091 (0, 2A7)。接着, 0, 2Ai碎片离子再丢失1个水分子, 产生2, 5Ai碎片离子, 101 (2, 5A1), 263 (2, 5A2), 425 (2, 5A3), 587 (2, 5A4), 749 (2, 5A5), 911 (2, 5A6), 1 073 (2, 5A7)。结合相关文献[23, 24]分析, 这两种离子为1→4连接寡糖开环断裂产生的特征性碎片, 由此推测APS-Ⅱ降解获得的寡糖为1→4连接。此外, [M-H]-母离子也发生了2, 4开环断裂, 产生2, 4Ai碎片离子, 221 (2, 4A2), 383 (2, 4A3), 545 (2, 4A4), 707 (2, 4A5), 869 (2, 4A6), 1 031 (2, 4A7)。
如表 3所示, 其他聚合度寡糖的碎片数据均包含上述碎片离子, 进一步说明APS-Ⅱ降解产物为1→4连接的六碳醛聚糖。表中的碎片离子信息为黄芪寡糖实际测定值, 最后一个数值即为分子离子峰实测值, 与理论寡糖的相对分子质量相差值为1, 是由于质谱检测条件为负离子模式造成。课题组前期研究发现APS-Ⅱ的主要单糖组成为半乳糖和葡萄糖, 二者总和占比高达97%, 其中葡萄糖含量是半乳糖的2.5倍, 二级质谱数据与该结果相呼应。对于各糖之间的连接顺序, 以及糖链分支结构需要更多的核磁手段和甲基化分析进行深入分析。综上所述, APOS主链结构包含有1→4连接的六碳醛聚糖结构, 如图 4所示。
|
Figure 4 Potential structure of APOS |
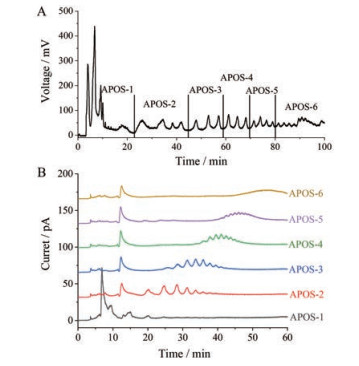
黄芪寡糖APOS经纯化制备色谱仪分离, 如图 5A所示为蒸发光散射检测器的在线检测色谱图, 各寡糖成分分离明显, 随时间的增加, 依次出现聚合度增大的寡糖, 按照色谱峰被分为6个组分, 分别对应于APOS-1、APOS-2、APOS-3、APOS-4、APOS-5和APOS-6。
|
Figure 5 Preparative liquid chromatogram of APOS (A) and UPLC-CAD chromatograms with different degrees of polymerization of APOS (B) |
如图 5B所示, 六条谱图从下到上依次对应于聚合度从小到大的寡糖片段, 整体呈现梯度趋势, 但是不同寡糖片段之间存在一定的交集寡糖组分, 与理论合并的洗脱液存在区别, 可能是由于制备时间过短, 制备柱较粗导致各寡糖洗脱后柱内仍有残留而造成。第一个寡糖片段中糖类成分主要是单糖和DP2 (80.81%), 含有少量的三糖成分, 制备量为70 mg; 第二个寡糖片段中主要成分是DP3-DP7 (96.06%), 制备量为80 mg; 第三个寡糖片段中主要成分是DP5-DP9 (88.00%), 制备量为40 mg; 第四个寡糖片段中主要成分是DP9-DP14 (89.27%), 制备量为50 mg; 第五个寡糖片段中主要成分是DP12-DP17 (95.45%), 制备量为90 mg; 第六个寡糖片段中主要成分是DP16-DP19的高聚合度寡糖, 制备量为100 mg。
7 不同寡糖片段的免疫活性评价巨噬细胞在非特异性免疫中起着至关重要的作用, 是研究细胞吞噬、细胞免疫和分子免疫学的重要对象。中性红是一种大分子的荧光试剂, 只能被内吞才能被摄取到细胞内, 因此通过检测药物干预细胞中性红摄取量可以反映巨噬细胞的吞噬能力[25]。如图 6A所示, 当不同APOS在20~200 μg·mL-1作用于巨噬细胞时, 吞噬活性均呈现增强趋势, 浓度到200 μg·mL-1时达到最强吞噬能力, 超过该剂量时巨噬细胞吞噬能力降低, 量效曲线呈现“钟罩型”。表明APOS调节免疫功能呈双向调节性, 并不是质量浓度越大功能越强, 而是存在某一最佳剂量。当APOS-4.5.6的浓度为150、200和250 μg·mL-1时, APOS促进巨噬细胞的吞噬能力强于阳性对照APS-Ⅱ (100 μg·mL-1, P < 0.05), 巨噬细胞的吞噬活性均在30%以上。综上, 表明APOS在固有免疫方面促进巨噬细胞的吞噬能力, 且不同APOS的促进能力不同: APOS-5 > APOS-4 > APOS-6 > APOS-2 > APOS-1 > APOS-3。

|
Figure 6 Influence of different oligosaccharide fragments on immune activity. A: The effect of macrophage phagocytic activity; B: The effect of T lymphocyte proliferation induced by concanavalin A (ConA); C: The effect of splenic lymphocytes secreting IgG induced by lipopolysaccharide (LPS). n = 6, x±s, *P < 0.05, **P < 0.01 vs APS-Ⅱ |
如图 6B所示, 不同浓度的不同聚合度寡糖片段协同ConA在不同程度上增加了T淋巴细胞的增殖。当APOS-5.6的浓度为100~250 μg·mL-1时, T淋巴细胞的增值率均高于阳性对照APS-Ⅱ (100 μg·mL-1), 增值率达23%以上, 存在统计学意义(P < 0.05)。当APOS-4的浓度为150~250 μg·mL-1时, T淋巴细胞的增值率高于阳性对照APS-Ⅱ, 存在统计学意义(P < 0.01)。6种黄芪寡糖对T淋巴细胞的增殖影响依次为APOS-5 > APOS-6 > APOS-4 > APOS-2 > APOS-1 > APOS-3。表明APOS在ConA诱导下, 能通过T淋巴细胞的增殖增强机体的细胞免疫功能。
如图 6C所示, 不同聚合度的寡糖片段随浓度的增加, 在LPS的诱导下, 脾淋巴细胞中IgG的分泌量呈剂量依赖性, 整体于200 μg·mL-1时分泌量达到最大值, 超出此剂量时脾淋巴细胞的IgG分泌量降低。当APOS-4.5.6的浓度为100~250 μg·mL-1时, 脾淋巴细胞分泌的IgG均高于阳性对照APS-Ⅱ (100 μg·mL-1) 对脾淋巴细胞分泌IgG的影响, IgG分泌量均在6.27 ng·mL-1以上, 且存在统计学意义(P < 0.05)。不同聚合度寡糖片段对脾淋巴细胞分泌IgG的影响依次为APOS-6 > APOS-5 > APOS-4 > APOS-2 > APOS-3 > APOS-1。表明APOS可以通过增强小鼠脾淋巴细胞分泌IgG的水平, 发挥特异性免疫功能, 增强机体抗感染的能力, 这可能是APOS发挥适应性免疫调节功能的机制之一。
结论黄芪多糖是由黄芪药材经过水提醇沉、除蛋白纯化后得到的复杂多糖, 主要由APS-Ⅰ和APS-Ⅱ组成, 课题组前期研究发现APS-Ⅱ在促进免疫活性中扮演着重要角色, 然而由于其相对分子质量较大, 结构难以精确测定, 限制了黄芪多糖的深入研究。本研究借鉴“自上而下”的研究策略, 结合多糖受体理论学说的研究思路, 采用正交实验方法, 筛选出APS-Ⅱ的最佳酸降解条件, 即酸解温度80 ℃, 三氟乙酸浓度1.0 mol·L-1, 酸解时间1 h, 通过降解可以得到相对分子质量较小的寡糖。通过采用UPLC-ESI-QTOF-MS进行结构表征, 表明黄芪寡糖的结构为1, 4连接的六碳醛聚糖。通过纯化液相色谱仪的分离制备、体外非特异性免疫和特异性免疫的筛选实验, 表明聚合度DP9~DP19的寡糖免疫活性优于APS-Ⅱ, 该研究为黄芪多糖提质增效奠定了基础, 也为进一步研究其构效关系提供了保障。
作者贡献: 石丽霞和李科负责文中实验方案设计; 石丽霞负责实验实施、数据收集、结果分析和文章撰写等工作; 李科负责提供文章思路, 在文章写作方面进行指导和修改; 焦思明负责文中质谱图分析的指导; 崔连杰在质谱解析方面进行分析; 秦雪梅和杜昱光对整个实验内容给予监督, 并对文章进行修改完善; 李震宇、李晓霞负责对文章内容的修改完善。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. 2015 Ed. Beijing: China Medical Science Press, 2015: 302-303.
|
| [2] |
Ma X, Liu SJ, Zhang WY, et al. Research progress on isolation, purification and pharmacological effects of Astragalus polysaccharides[J]. Chem Eng (化学工程师), 2019, 33: 50-53. |
| [3] |
Cao YX. Quality Comparison of Astragali Radix from Different Sources Based on Polysaccharide Molecular Weight Distribution and Immune Activity (基于多糖分子量分布和免疫活性比较的黄芪质量研究)[D]. Taiyuan: Shanxi University, 2020.
|
| [4] |
Li XQ, Li K, Qin XM, et al. Research progress on the structure analysis methods of polysaccharides[J]. J Shanxi Med Univ (山西医科大学学报), 2021, 52: 380-387. |
| [5] |
Estefanía MG, Benito C, María AP, et al. Characterization of Pt-protein complexes by nHPLC-ESI-LTQ MS/MS using a gel-based bottom-up approach[J]. Talanta, 2012, 88: 599-608. DOI:10.1016/j.talanta.2011.11.044 |
| [6] |
Liang T, Fu Q, Xin HX, et al. Structural characterization of Astragalus polysaccharides using partial acid hydrolysis-hydrophilic interaction liquid chromatography-mass spectrometry[J]. Chin J Chromatogr (色谱), 2014, 32: 1306-1312. DOI:10.3724/SP.J.1123.2014.08023 |
| [7] |
Cao YX, Li K, Qin XM, et al. Research approach on quality control of Astragalus polysaccharides based on polysaccharide receptor theory[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 2201-2209. |
| [8] |
Wang SM, Zhao XL, Li J, et al. Research on the relationship between different molecular weight D-polymannuronicate and activity ratio of anti-FXa/anti-FⅡa[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2013, 29: 695-697. |
| [9] |
Liu D. Study on the Preparation of a New Type and Ultra-pure Low Molecular Weight Heparin (新型超纯低分子肝素的制备方法研究)[D]. Suzhou: Soochow University, 2010.
|
| [10] |
Zhu JY, Peng QW, Xu Y, et al. Morinda officinalis oligosaccharides ameliorate depressive‐like behaviors in poststroke rats through upregulating GLUT3 to improve synaptic activity[J]. FASEB J, 2020, 34: 13376-13395. DOI:10.1096/fj.201902546RR |
| [11] |
Zhang HT, Zhu L, Zhang S, et al. Mechanism of lentinan hydrolysis based on ESI-CID-MS /MS and preparation of full series of oligosaccharides[J]. Chem J Chin Univ (高等学校化学学报), 2014, 35: 2329-2334. |
| [12] |
Li XX, Wu XL, Jia SL, et al. Effect of chitosan oligosaccharide on learning and memory functions and serum antioxidant status in a rat model of Amyloid-β1–42-induced alzheimer's disease[J]. Food Sci (食品科学), 2017, 38: 220-225. |
| [13] |
Wang X, Sun G, Feng T, et al. Sodium oligomannate therapeutically remodels gut microbiota and suppresses gut bacterial amino acids-shaped neuroinflammation to inhibit Alzheimer's disease progression[J]. Cell Res, 2019, 29: 1-17. DOI:10.1038/s41422-018-0116-5 |
| [14] |
Li SY. Screening and Structure Study of the Active Polysaccharides of Astragalus Polysaccharides for Injection (注射用黄芪多糖中活性多糖的筛选及结构研究)[D]. Taiyuan: Shanxi University, 2020.
|
| [15] |
Li DD, Song Y, Wu MY, et al. Review on the hydrolysis of plant polysaccharides and the structure of hydrolysate[J]. Food Ferment Ind (食品与发酵工业), 2013, 39: 165-170. |
| [16] |
Wang H, Xin HX, Cai JF, et al. Fingerprint profiling of Astragalus polysaccharides based on partial acid hydrolysis-hydrophilic interaction chromatography analysis and comprehensive quality evaluation of Astragalus membranaceus combined with reversed-phase liquid chromatography fingerprint analysis[J]. Chin J Chromatogr (色谱), 2016, 34: 726-736. DOI:10.3724/SP.J.1123.2016.03006 |
| [17] |
Lupo C, Boulos S, Nystrm L. Influence of partial acid hydrolysis on size, dispersity, monosaccharide composition, and conformation of linearly-branched water-soluble polysaccharides[J]. Molecules, 2020, 25: 2982. DOI:10.3390/molecules25132982 |
| [18] |
Guo ZM, Zhang XL, Xu Q, et al. Stationary phases for hydrophilic interaction liquid chromatography and their applications in separation of traditional chinese medicines[J]. Chin J Chromatogr (色谱), 2009, 27: 675-681. |
| [19] |
Fu Q, Liang T, Zhang XL, et al. Carbohydrate separation by hydrophilic interaction liquid chromatography on a 'click' maltose column[J]. Carbohyd Res, 2010, 345: 2690-2697. DOI:10.1016/j.carres.2010.09.033 |
| [20] |
Pu JH, Zhao X, Han WW, et al. Application of hydrophilic interaction chromatography in analysis of carbohydrates[J]. J Instrument Anal (分析测试学报), 2017, 36: 145-150. |
| [21] |
Cui LJ, Li K, Li ZY, et al. Progress in oligosaccharide extraction, separation and structural analysis by mass spectrometry[J]. Acta Pharm Sin (药学学报), 2020, 55: 843-853. |
| [22] |
Liao JZ, WangYX, Chen YM. Analysis of partial acid hydrolyzate of P. ginseng polysaccharides by HPLC-ESI-QTOF-MS[J]. J Anal Sci (分析科学学报), 2015, 31: 339-344. |
| [23] |
Du BX, Xiang MR, Fu YP, et al. Structural characterization of Glehniae Radix polysaccharides using partial acid hydrolysis-hydrophilic interaction liquid chromatography-mass spectrometry[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 4814-4818. |
| [24] |
Fu Q, Wang H, Jin Y. Quality evaluation of Polygonatum odoratum polysaccharides based on hydrophilic interaction chromatography-tandem mass spectrommetry method[J]. China Sci Paper (中国科技论文), 2018, 13: 660-666. |
| [25] |
Zhen QJ, Cao XQ, Lu JJ, et al. MOMP of Legionella inhibits phagocytosis of RAW264.7 macrophages and enhances their chemotaxis by activating NOD2/RIP2 signaling pathway[J]. Chin J Cell Mol Immunol (细胞与分子免疫学杂志), 2018, 34: 488-494. |
 2021, Vol. 56
2021, Vol. 56


