2. 中国人民解放军联勤保障部队第九四〇医院药剂科, 甘肃 兰州 730050;
3. 西北师范大学生命科学学院, 甘肃 兰州 730030
2. Department of Pharmacy, the 940th Hospital of Joint Logistics Support Force, PLA, Lanzhou 730050, China;
3. College of Life Science, Northwest Normal University, Lanzhou 730030, China
胆汁酸是胆汁的主要成分, 初级胆汁酸在肝脏经一系列酶促反应合成产生, 在肠道内经过肠道菌群代谢并完成肝肠循环。肠道菌群分泌的微生物酶可以对胆汁酸产生去共轭和去羟基化作用, 生成游离胆汁酸和次级胆汁酸, 在胆汁酸的正常代谢中起着关键的作用[1]。根据胆汁酸来源不同, 可以分成初级胆汁酸、次级胆汁酸、三级胆汁酸; 结构上又可分为结合型胆汁酸和游离型胆汁酸。胆汁酸池的大小由机体和肠道菌群共同决定, 经胆汁酸-法尼醇X受体(farnesoid X receptor, FXR)-CYP7A1的负反馈调节途径来调节[2]。研究表明: 胆汁酸代谢紊乱和机体的多种疾病状态相关, 如炎症性肠病、代谢性综合征和某些癌症[3]。
高原低氧环境不仅会引发各种高原疾病, 也会对机体肠道菌群的组成和数量造成影响[4]。机体处于疾病状态时, 胆汁酸代谢紊乱和肠道菌群失调往往同时发生。在低氧介导的肠道菌群失调的前提下, 机体胆汁酸池是否会受到影响仍有待研究。当前仍缺乏关于高原低氧环境对胆汁酸池组成影响的研究。因此, 选择高效、准确的技术方式对大鼠小肠内容物胆汁酸进行定量检测显得尤为重要。本文旨在通过超高液相色谱-串联质谱(UHPLC-MS/MS) 技术, 对平原和急进高原大鼠小肠内容物中41种胆汁酸进行检测, 对比两者的胆汁酸池, 并筛选出有差异的胆汁酸, 为后续研究提供支持。
材料与方法仪器试剂 1290 Infinity超高效液相系统(美国Agilent公司); Q Exactive Focus高分辨质谱系统、Heraeus Fresco17低温高速离心机(美国Thermo Fisher Scientific公司); BSA124S-CW电子分析天平(德国Sartorius公司); JXFSTPRP-24研磨仪(上海净信科技有限公司); 明澈D24 UV超纯水仪(美国Merck Millipore公司); PS-60AL超声仪(深圳市雷德邦电子有限公司)。10%水合氯醛(批号20200323) 购自兰州大学第一医院; 胆汁酸对照品(批号按表 1编号依次为: ZZS-20-013-A4; C1650-000; ZZS-20-H228-B3; ZZS-20-601-B2; ZZS-20-105-A6; C1860-000; C1750-000; C2500-000; C0370-000; C0860-000; ZZS-20-182-A3; ZZS-20-186-A1; ZZS-19-012-B7; C2000-000; C1500-000; C1485-000; C1250-000; 2874-014A1; ZZS-19-004-A6; 8-GJF-130-4; ZZS-19-007-A3; ZZS-20-050-B2; C1850-000; C1888-000; ZZS-20-186-A6; ZZS-20-X220-A2; C1320-000; C0867-000; ZZS-20-195-E5; C1087-000; ZZS-20-009-A2; C1860-000; ZZS-20-100-A3; C1021-000; ZZS-20-186-A2; C0892-000; ZZS-20-206-A8; C1162-000; C1893-000; ZZS-20-112-A8; 2900-077A2); 甘氨胆酸-d4 (批号ZZS-20-057-A6)、脱氧胆酸-d6 (批号ZZS-20-181-A6) 购自上海甄准生物公司; 牛磺鹅去氧胆酸-d4钠盐(批号SJ4-2013-072B1) 购自美国Isosciences公司。
| Table 1 The information of different ion peaks |
动物 雄性Wistar大鼠12只[体重180~220 g, 合格证号: SCXK (辽)-20200001], 购自辽宁长生生物技术股份有限公司。本实验获得第九四〇医院伦理委员会批准(批准号: 2020KYLL012), 而且均按照相关指导原则和规定进行。将大鼠饲养于20~25 ℃, 50% ± 10%湿度的大鼠筐内, 以实验室标准饲喂, 并允许随意饮水。实验开始前于联勤保障部队第九四〇医院SPF级动物实验室适应性饲养一周。
动物分组及急进过程 将12只大鼠随机分为两组, 每组6只, 分别为平原组(P组, 海拔1 500 m, 甘肃兰州), 急进高原组(H1组, 海拔4 010 m, 青海玉树藏族自治州)。H1组大鼠采用货车运输急进高原, 于12 h内从兰州运输至青海省玉树藏族自治州, 运输过程中给予果冻补充水分。到达目的地后, 于24 h收集小肠内容物。P组大鼠于兰州同时开展实验。
样品收集处理 用10%水合氯醛0.8 mL通过腹腔注射对大鼠进行麻醉, 麻醉后迅速解剖, 收集大鼠小肠内容物, 密封保存于样品收集盒, 并迅速将其冻存于液氮罐中。提前配制样品提取液(甲醇∶乙腈∶水= 2∶2∶1, 含0.1%甲酸)。准确称取小肠内容物25 mg后, 加入含同位素标记混标的样品提取液1 mL, 涡旋混匀30 s, 加入钢珠研磨, 研磨仪程序为: 35 Hz/4 min, 冰水浴超声5 min, 重复3次; 将样品于-40 ℃静置1 h后, 于4 ℃, 12 000 r·min-1离心15 min; 取上清液至LC进样瓶中, 用于UHPLC-MS/MS分析。
超高液相色谱串联质谱条件 采用Waters ACQUITY UPLC BEH C18 (150 mm×2.1 mm, 1.7 μm, 美国Waters公司) 液相色谱柱对目标化合物进行色谱分离。液相色谱A相为1 mmoL·L-1的乙酸铵和1 mmoL·L-1的乙酸水溶液, B相为乙腈, 流动相流速为0.4 mL·min-1, 梯度洗脱程序为: 0~15 min, A相77.5%, B相22.5%; 15~18 min, A相58.0%, B相42.0%; 18~20 min, A相28.0%, B相72.0%; 20~21.8 min: A相5.0%, B相95.0%; 21.8~26 min: A相77.5%, B相22.5%。柱温箱温度为60 ℃, 样品盘设为4 ℃, 进样体积为1 μL。采用平行反应监测(PRM) 方式进行质谱分析。3种内标分别用于不同类型的胆汁酸定量, 其中甘氨胆酸-d4用于甘氨类胆汁酸定量, 牛磺鹅去氧胆酸-d4钠盐用于牛磺类胆汁酸定量, 脱氧胆酸-d6用于其他胆汁酸定量。进行UHPLC-MS/MS分析之前, 先将目标胆汁酸标准溶液引入质谱中, 对每个目标胆汁酸的PRM参数进行优化。由于大多数胆汁酸类化合物的子离子谱中, 都没有出现强度足够的子离子用于定量, 所以选择了高分辨条件下的母离子进行定量。
数据处理及统计分析 对于得到的原始数据, 对单个峰进行过滤, 剔除空白值> 50%的值。基于代谢组学特性对数据进行多变量统计分析, 进行PCA分析和正交偏最小二乘法判别分析(OPLS-DA); 用T检验、|log2FC| ≥ 1值和火山图进行单变量统计分析。
结果 1 方法专属性在设定的超高液相色谱串联质谱条件下, 对胆汁酸对照品进行分析并记录, 对照品的UHPLC-MS/MS图见图 1, 相关离子峰对应胆汁酸信息见表 1。可以看出在本分析方法下, 所有化合物都呈现出良好的色谱峰, 无杂质干扰; 且很好地实现了各个目标化合物的色谱分离, 说明方法专属性良好。
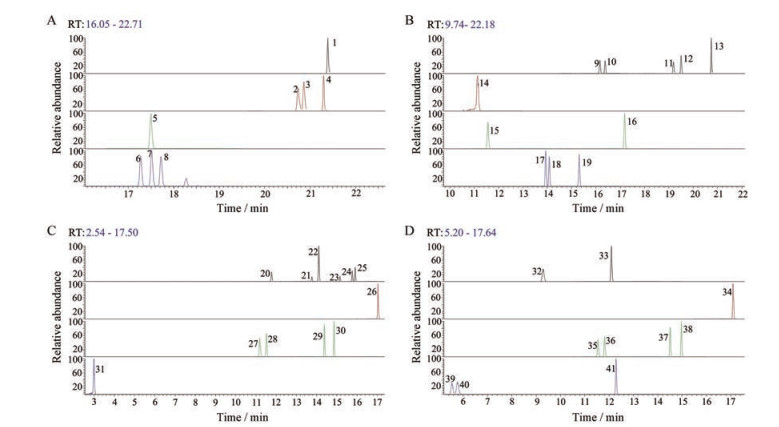
|
Figure 1 The extracted ion chromatographs of standard solutions. A-D show the ion peaks of No. 1-41 bile acids based on their retention time; the horizontal lines represent the same abscissa axis of retention time in each figure; the relative ion peak information of 41 bile acids were given in Table 1 |
多变量分析可以分析代谢物水平之间的关系, 本研究对平原组和急进高原组大鼠小肠内容物胆汁酸进行了主成分(PCA) 分析, 得到拟合出2个主成分的PCA模型(图 2)。第一主成分(PC1) 和第二主成分(PC2) 分别占39.2%、30.1%, 共可以描述总特征的69.3%。散点颜色和形状代表不同的分组, P组样品落于主轴右侧, H1组样品点落于主轴左侧, 二者相距较远, 分离明显, 说明平原组和急进高原组大鼠小肠内容物胆汁酸组成存在差异, 急进高原会对大鼠胆汁酸代谢带来明显的影响。将每个代谢物进行OPLS-DA分析后, 用VIP > 1评估与主成分相关性强的化合物。
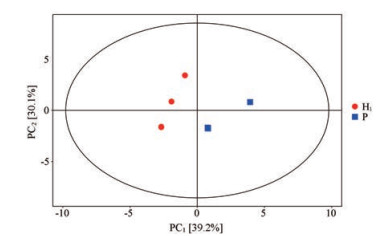
|
Figure 2 PCA scores of the plain group and the acute hypobaric hypoxia group. P: Plain group; H1: Acute hypobaric hypoxia group |
本研究采用T检验、火山图和层次聚类分析对平原组和急进高原组大鼠小肠内容物胆汁酸的组成差异进行呈现, 并筛选出差异胆汁酸。以倍数变化(fold change, FC) 值, P < 0.05作为筛选指标。将各胆汁酸结果进行数据可视化分析后用火山图展现(图 3)。将各胆汁酸结果计算欧力距离矩阵后进行层次聚类分析, 均值化后用热力图展现(图 4)。火山图中的每个点代表一种胆汁酸, 横坐标代表该组各物质的log2FC值, 纵坐标代表T检验后的P值, 散点颜色代表胆汁酸筛选结果。红色点和蓝色点分别代表与平原组相比, 急进高原组中含量显著上升和下降的胆汁酸。如图所示, 相对于平原组, 急进高原组含量显著上升的胆汁酸有5种, 含量显著下降的胆汁酸有2种。
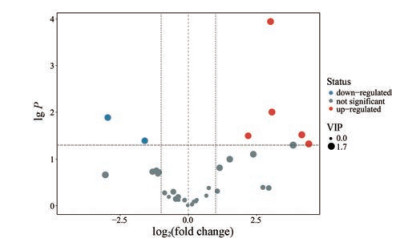
|
Figure 3 Volcano plot of the differentially expressed bile acids. The X coordinate was log2(fold change) and the Y coordinate was lg P |
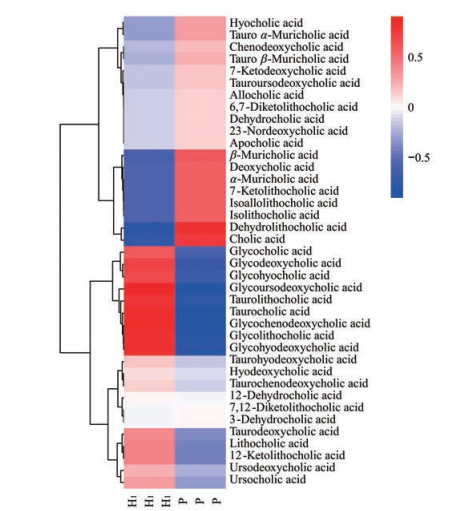
|
Figure 4 Heat map of the bile acids composition in plain group and acute hypobaric hypoxia group |
在层次聚类分析中通过不同的颜色梯度展现了数据矩阵数值大小。横向代表每种胆汁酸在不同样本中的含量, 纵向代表每个样本中不同胆汁酸的含量, 树状图代表对不同样本的不同胆汁酸的聚类分析结果。图中颜色越深代表相对含量越高, 红色表示相对含量升高, 蓝色表示相对含量下降(图 4)。与火山图对应, 充分说明平原组和急进高原组的胆汁酸组成表现出较大的差异性, 急进高原会影响胆汁酸的代谢, 从而改变大鼠小肠内容物胆汁酸的组成。
4 差异胆汁酸筛选对大鼠小肠内容物41种胆汁酸进行检测, 在样品中共检测出39种胆汁酸, 其中isoDCA和GDHCA未检出。当|log2FC| ≥ 1时, 表明急进高原组大鼠胆汁酸变化与平原组相比具有差异性。共筛选出具有显著差异性的胆汁酸7个, 分别为GLCA、GUDCA、GCDCA、TLCA、TCA、DHLCA和CA。相对于平原组, 急进高原组含量显著上调的胆汁酸为GLCA、GUDCA、GCDCA、TLCA和TCA, 均为结合型胆汁酸; 含量显著下调的胆汁酸为DHLCA和CA, 均为游离型胆汁酸(表 2)。结合型胆汁酸显著上调, 而游离型胆汁酸显著下调, 说明小肠内结合型胆汁酸向游离型胆汁酸的转化减少。
| Table 2 Bile acids with significant changes of the two groups |
胆汁酸代谢紊乱和机体的多种疾病状态相关, 机体产生疾病伴随着胆汁酸池紊乱的同时往往也与肠道菌群的变化有密不可分的关系。目前, 肠道菌群-胆汁酸-疾病之间相互作用的关系, 已经成为很多疾病新的研究靶点[5]。肠道菌群分泌的胆盐水解酶(bile salt hydrolase, BSH) 对胆汁酸的正常代谢起着重要的作用, BSH可以作用于结合型胆汁酸的酰胺键, 产生甘氨酸、牛磺酸和游离型胆汁酸, 肠道菌群也可以将初级胆汁酸代谢为次级胆汁酸[1]。根据文献报道: 肠道菌群中产BSH的革兰阳性菌主要包括乳杆菌、双歧杆菌、肠球杆菌、梭菌等, 革兰阴性菌中仅拟杆菌具有BSH活性[6]。前期研究发现: 抗生素处理会改变大鼠肠道菌群组成[7], 急进高原也会影响大鼠肠道菌群组成并导致物种多样性减少, 粪便革兰染色显示革兰阳性菌和革兰阴性菌数量均呈下降趋势[8], 这可能会造成肠道中产BSH菌数量下降, BSH含量减少, 从而导致对结合型胆汁酸的解离作用减弱, 造成肠道胆汁酸池的紊乱。本研究发现, 在急进高原后, 大鼠小肠内胆汁酸在组成上与平原组出现了显著的差异, 且胆汁酸筛选结果具有明显的特征, 即结合型胆汁酸含量显著升高, 说明结合型胆汁酸向游离型胆汁酸的转化受阻。这提示急进高原后大鼠肠道菌群的紊乱可能是胆汁酸代谢变化的重要影响因素, 这有待于通过对大鼠小肠内容物BSH含量的进一步检测来验证。
胆汁酸是食物脂肪和胆固醇代谢的重要途径, 对机体糖脂代谢有着调节的作用[9]。胆汁酸由肝脏经胆固醇合成, 结合型胆汁酸会在回肠重吸收运输回肝脏; 而游离型胆汁酸结构上由于具有更强的疏水性, 所以更容易通过粪便排泄丢失, 肝脏就会通过代谢胆固醇来补充丢失的胆汁酸[10]。急进高原后结合型胆汁酸的增多可能会导致体内脂肪和胆固醇代谢不良, 增加心脑血管疾病的发病率。研究表明[11], 具有BSH活性的益生菌可以促进胆固醇代谢和脂肪吸收, 这可能是通过增加肠道内产BSH菌的丰度, 增强肠道菌群对结合型胆汁酸的解离作用, 促使胆汁酸以游离型胆汁酸的形式排泄, 促进肝脏对胆固醇的消耗来实现的。
当前, 胆汁酸在各种机体生理病理状态轴的调控中的作用成为了当前研究的热点。如: 胆汁酸在肠-肝轴中调控代谢和炎症的作用[12]; 胆汁酸在肠-脑轴中信号分子的作用[13]; 胆汁酸在肠道菌群-脑轴中对阿尔茨海默症的影响[14]; 胆汁酸-肠道菌群-胆汁淤积的三角关系[15]。肠道菌群会影响硝苯地平的代谢, 胆汁酸作为与肠道菌群密切相关的代谢产物, 可能在药物代谢通路上也发挥重要作用。此外急进高原会使炎症因子会显著上调[16], 胆汁酸作为和炎症因子息息相关的靶点, 或许可以为一些高原疾病找到新的研究方向。本研究直接证明了急进高原会使大鼠小肠内容物胆汁酸组成发生变化; 间接验证了高原环境对肠道菌群的影响; 也为一些高原疾病的研究切入了新的视角, 为后续研究提供了方法支持和事实依据。
作者贡献: 张雅婷、黄隆基、赵安鹏完成了动物样品采集; 张雅婷、孙月梅完成了样品分析及数据处理; 张娟红设计了所有实验; 王荣、李文斌、张娟红对所有实验细节进行指导; 张雅婷完成了论文撰写; 王荣完成了论文修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis[J]. Nat Rev Gastroenterol Hepatol, 2018, 15: 111-128. |
| [2] |
Hoeke MO, Heegsma J, Hoekstra M, et al. Human FXR regulates SHP expression through direct binding to an LRH-1 binding site, independent of an IR-1 and LRH-1[J]. PLoS One, 2014, 9: e88011. DOI:10.1371/journal.pone.0088011 |
| [3] |
Staley C, Weingarden AR, Khoruts A, et al. Interaction of gut microbiota with bile acid metabolism and its influence on disease states[J]. Appl Microbiol Biotechnol, 2017, 101: 47-64. |
| [4] |
Hun TY, Hu Y, Zhang WJ, et al. Athletes' diarrhea occurrence and changes of intestinal microbial flora in high altitude training[J]. Prog Mod Biomed (现代生物医学进展), 2018, 18: 1909-1915. |
| [5] |
Molinaro A, Wahlström A, Marschall HU. Role of bile acids in metabolic control[J]. Trends Endocrinol Metab, 2018, 29: 31-41. DOI:10.1016/j.tem.2017.11.002 |
| [6] |
Bustos AY, Font de Valdez G, Fadda S, et al. New insights into bacterial bile resistance mechanisms: the role of bile salt hydrolase and its impact on human health[J]. Food Res Int, 2018, 112: 250-262. DOI:10.1016/j.foodres.2018.06.035 |
| [7] |
Zhang JH, Zhang JM, Wang R, et al. Interaction of amoxicillin and nifedipine mediated by intestinal flora[J]. Acta Pharm Sin (药学学报), 2018, 53: 1721-1725. |
| [8] |
Sun YM, Zhang JH, Zhao A, et al. Effects of intestinal flora on the pharmacokinetics and pharmacodynamics of aspirin in highaltitude hypoxia[J]. PLoS One, 2020, 15: e0230197. DOI:10.1371/journal.pone.0230197 |
| [9] |
Yun HC, Hou SC, Cui B, et al. Research progress on the role of bile acids in regulating glycolipid metabolism[J]. Acta Pharm Sin (药学学报), 2020, 55: 1419-1430. |
| [10] |
Choi SB, Lew LC, Yeo SK, et al. Probiotics and the BSH-related cholesterol lowering mechanism: a Jekyll and Hyde scenario[J]. Crit Rev Biotechnol, 2015, 35: 392-401. DOI:10.3109/07388551.2014.889077 |
| [11] |
Jones ML, Tomaro-Duchesneau C, Martoni CJ, et al. Cholesterol lowering with bile salt hydrolase-active probiotic bacteria, mechanism of action, clinical evidence, and future direction for heart health applications[J]. Expert Opin Biol Ther, 2013, 13: 631-642. DOI:10.1517/14712598.2013.758706 |
| [12] |
Schneider KM, Albers S, Trautwein C. Role of bile acids in the gut-liver axis[J]. J Hepatol, 2018, 68: 1083-1085. |
| [13] |
Xu AW. Hypothalamic sensing of bile acids, a gut feeling[J]. Trends Endocrinol Metab, 2018, 29: 363-366. DOI:10.1016/j.tem.2018.02.001 |
| [14] |
Jia W, Rajani C, Kaddurah-Daouk R, et al. Expert insights: the potential role of the gut microbiome-bile acid-brain axis in the development and progression of Alzheimer's disease and hepatic encephalopathy[J]. Med Res Rev, 2020, 40: 1496-1507. |
| [15] |
Li Y, Tang R, Leung PSC, et al. Bile acids and intestinal microbiota in autoimmune cholestatic liver diseases[J]. Autoimmun Rev, 2017, 16: 885-896. |
| [16] |
Zhang SF, Luo XH. Acute high altitude reaction syndrome and systemic inflammatory response syndrome[J]. Acta Acad Med Sin, 2007, 29: 551-556. |
 2021, Vol. 56
2021, Vol. 56


