2. 广西大学医学院, 广西 南宁 530004
2. Medical School, Guangxi University, Nanning 530004, China
烟碱型乙酰胆碱受体(nicotinic acetylcholine receptors, nAChRs) 是受乙酰胆碱(acetylcholine, ACh) 调控的配体门控离子通道蛋白, 广泛存在于肌肉、中枢和外周神经系统。nAChRs由5个跨膜亚基组成, 目前已经克隆到的神经型nAChRs亚基有12种, 包括9种α亚基(α2~α10) 和3种β亚基(β2~β4)。根据亚基组成的不同, 神经型nAChRs可以分为同型或异型五聚体[1]。α7 nAChR作为其中重要的一种亚型, 广泛分布于哺乳动物的中枢神经系统(central nervous system, CNS), 如: 大脑皮层、嗅球、海马体等, 与阿尔茨海默症(Alzheimer's disease, AD)、癫痫、精神分裂症、帕金森病(Parkinson's disease, PD)、脑内炎症等神经系统疾病密切相关[2-4]。此外, α7 nAChR在巨噬细胞、肺癌细胞、心肌细胞、血管内皮细胞等也有表达, 是胆碱能抗炎通路中的关键蛋白分子[5-9]。α7 nAChR可以通过调节下游NF-κB信号通路和JAK2/STAT信号通路, 抑制炎症细胞因子(IL-1β、IL-6、IL-18和TNF-α等) 以及趋化因子(血小板衍生的生长因子、IL-8、单核细胞趋化蛋白-1、纤维黏连蛋白) 的产生与释放[10-12]。研究表明, α7 nAChR介导的胆碱能抗炎通路是治疗肺炎的关键通路, 且α7 nAChR对肺癌细胞、胃癌细胞、结肠癌细胞等恶性肿瘤细胞的增殖、血管生成、转移以及凋亡等过程产生重要影响[13-15]。发现靶向调控α7 nAChR的化合物, 对于α7 nAChR结构和功能的研究具有重要意义, 也是α7 nAChR相关抗炎药物设计的重要基础。
α-芋螺毒素(α-conotoxin, α-CTx) 是热带海洋软体动物芋螺分泌的一类小分子活性多肽物质, 它们能作用于nAChRs, 且能区分不同的亚型, 是研究受体结构和功能的重要工具[16-18]。如: 从海南海织锦芋螺(Conus textile) 中发现的α-CTx TxIB, 能够特异性阻断α6/α3β2β3 nAChRs亚型, 对于开发新型抗成瘾药物具有较好的应用前景[18]。Michael等[19]从大西洋西部海域的帝王芋螺(Conus regius) 中发现的α-CTx RgIA能够特异阻断α9α10 nAChRs亚型, 在神经痛、乳腺癌治疗方面表现出良好的活性。α-CTx PnIA是从梅尔巴芋螺(Conus pennaceus) 中分离得到的靶向α7和α3β2 nAChRs亚型的阻断剂, 并通过改造(对其第10位的丙氨酸进行替换), 得到了靶向α7 nAChR亚型的良好分子探针[A10L]PnIA, 其对α7 nAChR的半阻断剂量(IC50) 为12.6 nmol·L-1 [20], 可以作为α7 nAChR相关研究的重要工具。
多肽荧光标记技术广泛用于研究多肽及核酸在生物体或细胞内的作用机制, 这种技术为研究多肽提供了可视化的有效工具, 为阐明多肽结构、作用、活性提供了基础。荧光标记多肽主要利用绿色荧光蛋白、罗丹明B、荧光素等有机荧光标记物与多肽结合, 使得多肽在携带荧光信号的同时也保持了活性[21, 22]。如: Chileveru等[23]用罗丹明B标记人α-防御素5 (human α-defensin 5, α-HD5), 使其能够跟踪到细菌细胞的极点和细胞质分裂位点, 证明了α-HD5在细胞内运行, 并靶向细胞分裂的功能。本研究以α-CTx [A10L]PnIA为对象, 利用荧光染料5-羧基四甲基罗丹明琥珀酸亚胺酯(5-TAMRA, SE) 进行标记, 获得荧光多肽[A10L]PnIA (fluorescent [A10L]PnIA, [A10L]PnIA-F), 电生理结果显示其对α7 nAChR的半阻断剂量(IC50) 为17.32 nmol·L-1, 且对细胞无明显的毒性。[A10L]PnIA-F可以为后续研究α7 nAChR相关神经生理、病理过程以及α7 nAChR在细胞组织的定位提供重要工具。
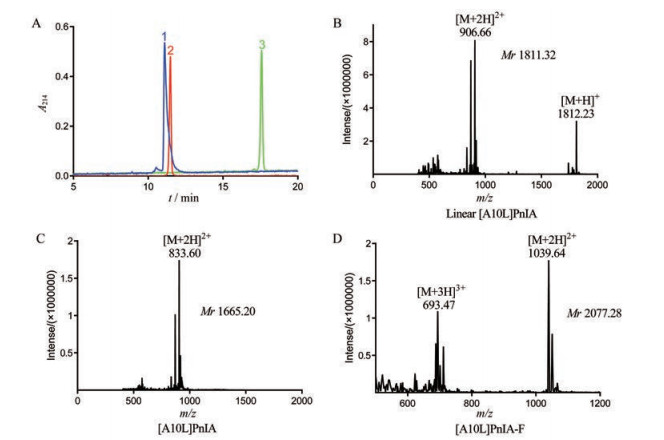
结果 1 [A10L]PnIA-F的合成合成的[A10L]PnIA线性肽初始纯度为90%, 经HPLC纯化后可以得到纯度为95%的线形肽, 可用于后续荧光肽的合成(图 1A峰1)。利用体外两步氧化折叠得到[A10L]PnIA的活性肽(图 1A峰2), 其洗脱时间为11.48 min, 与线性肽保留时间(11.10 min) 基本保持一致, 疏水性没有显著变化。利用5-TAMRA, SE和[A10L]PnIA活性肽进行反应, 得到最终产物[A10L]PnIA-F (图 1A峰3), 其洗脱时间为17.58 min, 较[A10L]PnIA活性肽洗脱时间增加, 疏水性提高。利用质谱分别对不同阶段的[A10L]PnIA的分子质量进行检测, 线性肽的分子质量为1 811.32 Da (图 1B) 与理论值1 811.06 Da相比, 基本一致。[A10L]PnIA活性肽及[A10L]PnIA-F分子质量分别为1 665.20 Da (图 1C) 和2 077.28 Da (图 1D)。[A10L]PnIA活性肽与线形肽相比, 脱去了Acm保护基团并形成了两对二硫键, 分子质量少了146 Da, [A10L]PnIA-F与[A10L]PnIA活性肽相比多了荧光基团的412 Da, 与理论值相符, 说明成功形成两对二硫键并被5-TAMRA标记。
|
Figure 1 Synthesis and identification of [A10L]PnIA-F. A: [A10L]PnIA-linear peptide (1), [A10L]PnIA active peptide (2) and [A10L]PnIA-F (3) HPLC profile; B-D: Mass spectrum data for linear [A10L]PnIA (B), [A10L]PnIA active peptide (C) and [A10L]PnIA-F (D) with observed monoisotopic mass of 1 811.32 Da, 1 665.20 Da and 2 077.28 Da, respectively |
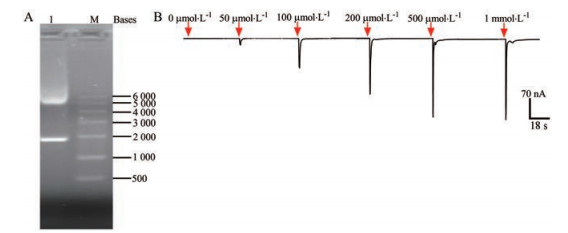
体外转录获得鼠源的α7 nAChR cRNA, 浓度为0.56 μg·μL-1, 用1.5%的琼脂糖凝胶电泳进行检测(图 2A), α7 nAChR亚基的RNA长度约为2 000 bp, 与理论值相符。注射α7 nAChR cRNA的蛙卵在第三天开始表达, 检测不同浓度条件下激动剂ACh (0 μmol·L-1、50 μmol·L-1、100 μmol·L-1、200 μmol·L-1、500 μmol·L-1、1 mmol·L-1) 诱发的电流表达情况。在200 μmol·L-1 ACh刺激下可表达稳定的电流, 电流大小为425.20 ± 116.10 nA (n = 9), 且受体不会脱敏。选择此浓度作为药物活性研究的激动剂浓度(图 2B)。
|
Figure 2 Expression α7 nAChR model in the Xenopus oocyte. A: Agarose gel electrophoresis analysis of α7 nAChR cRNA. M: RNA marker, RL6 000; B: The α7 current trace evoked by increasing ACh concentrations in oocytes |
利用双电极电压钳对[A10L]PnIA本体和荧光肽的活性进行检测。结果显示, [A10L]PnIA连接荧光基团后, 对于α7 nAChR活性影响不大。在100 nmol·L-1的给药浓度下, [A10L]PnIA和[A10L]PnIA-F对α7 nAChR电流的阻断率分别为: (95.99 ± 3.96) % (n = 4) 和(93.45 ± 5.51) % (n = 4) (图 3A、B), 阻断效果基本保持一致。在10 nmol·L-1的给药浓度下, [A10L]PnIA和[A10L]PnIA-F对α7 nAChR电流的阻断率分别为(40.35 ± 9.69) % (n = 6) 和(37.60 ± 17.02) % (n = 6) (图 3A、B), 抑制活性差别不大。为了进一步比较两者对α7 nAChR的活性, 分别对[A10L]PnIA和[A10L]PnIA-F做了剂量反应曲线(图 3C), 两种肽对α7 nAChR的IC50分别为13.84 nmol·L-1 (95% CI, 11.11~17.22 nmol·L-1) 和17.32 nmol·L-1 (95% CI, 11.04~27.17 nmol·L-1), 活性基本保持一致。

|
Figure 3 [A10L]PnIA and [A10L]PnIA-F electrophysiological activity identification. A: Inhibition of α7 nAChR by [A10L]PnIA at 10 and 100 nmol·L-1; B: Inhibition of α7 nAChR by [A10L]PnIA-F at 10 and 100 nmol·L-1; C: Dose response curve of [A10L]PnIA and [A10L]PnIA-F against α7 nAChR. Data represent mean ± SEM (n = 3-6). Data analysis used GraphPad prism 8 (San Diego, CA, USA) for nonlinear regression. The 95% confidence intervals for [A10L]PnIA and [A10L]PnIA-F are (11.11-17.22 nmol·L-1) and (11.04-27.17 nmol·L-1), respectively |
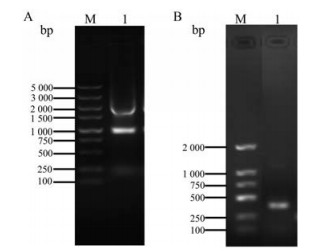
提取RAW264.7细胞的RNA, 浓度为0.33 μg·μL-1, 1%琼脂凝胶电泳(图 4A)。根据NCBI小鼠α7 nAChR基因序列(AF225980.1), 针对特异性较高的配体结合区段(ligand binding domain, LBD), 设计α7 nAChR的正反引物(表 1), PCR扩增, 鉴定细胞上表达的α7 nAChR。PCR产物1%琼脂糖凝胶电泳检测(图 4B), 目标产物长度约300 bp, 与理论值一致。后对PCR产物测序, 确定为α7 nAChR亚型。
|
Figure 4 Identification of α7 nAChR gene on mouse RAW264.7. A: 1% agarose gel electrophoresis analysis of the total RNA extracted from RAW264.7 cells. M: DNA marker, DL5 000; B: 1% agarose gel electrophoresis analysis of the PCR amplification product of α7 nAChR gene of RAW264.7. M: DNA Marker, DL2 000 |
| Table 1 α7 nAChR gene primers |
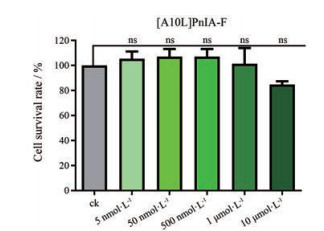
对[A10L]PnIA-F在RAW264.7巨噬细胞细胞毒性进行检测, 选取5 nmol·L-1、50 nmol·L-1、500 nmol·L-1、1 μmol·L-1、10 μmol·L-1 5个浓度, 检测结果如图 5, 对检测结果使用单因素方差分析, 并用邓恩多重比较法对组间差异进行比较, 发现在电生理IC50的50到100倍浓度下, 几乎无任何毒性, 再上升到1 000倍IC50的浓度下, 细胞活力较对照空白组稍有降低, 但在统计学上无显著性差异(P > 0.05)。因此[A10L]PnIA-F在其IC501 000倍的浓度范围内对RAW264.7均无明显的细胞毒性。
|
Figure 5 Cytotoxicity detection of [A10L]PnIA-F to RAW264.7. The data used one-way analysis of variance to analyze the effect of different concentrations of [A10L]PnIA-F on cell viability, significance was determined at the 95/% level. ns: No significant. Data represent mean ± SEM (n = 5). Data analysis was performed using GraphPad prism 8 (San Diego, CA, USA) |
荧光探针作为可视化的工具, 可用于医药行业的靶向、诊断、治疗等, 特别是针对真菌的耐药性研究, 荧光探针一直都是一个重要的工具。如: 利用罗丹明标记蒺藜苜蓿防御素4 (Medicago truncatula defensin 4, MtDef4) 和Dylight550标记蒺藜苜蓿防御素5 (Medicago truncatula defensin 5, MtDef5), 研究MtDef4和MtDef5对两种子囊真菌的细胞进入和亚细胞定位的成像, 这些研究有助于深入了解防御素如何发挥其抗真菌活性的机制[24-26]。荧光探针的优点是可视化, 将微观的生命现象, 转为可视化的荧光信号, 使得研究更为便捷。利用荧光标记多肽, 也是该领域的一个重要应用和热点, 如: Zerfas等[27]利用罗丹明110标记可被免疫蛋白酶体切割的三聚体序列, 使得该探针能够选择性的识别免疫蛋白酶表达细胞, 为研究免疫蛋白酶体在癌症、自身免疫性疾病、退行性疾病中的功能发挥了重要作用。除此之外, 还有很多荧光物质用于多肽标记, 如: 绿色荧光蛋白、罗丹明B、荧光素等, 其主要的合成操作就是将传统的荧光物质通过化学合成反应连接到肽链上。就像本文所选取的5-TAMRA, SE, 因其有着高荧光量子产率、激发波长较长和光稳定性好且在高效液相色谱纯化中有更好的分辨率等特点, 是标记多肽和核苷酸的首选试剂[28, 29]。罗丹明这类荧光染料相对自带荧光蛋白类的染料分子量小, 将它连接到肽链的末端, 不会使肽链结构发生太多改变。但是罗丹明作为黄嘌呤类染料的一种, 可能会破坏肽的活性或者产生更高毒性的肽[21, 22]。本研究结果表明, 所合成的罗丹明标记的[A10L]PnIA-F在保持活性的前提下, 细胞毒性不强, 可以作为研究α7 nAChR受体功能以及分布的良好药理工具, 具有较好应用前景。
α7 nAChR是很多疾病的关键蛋白受体分子, 它除了在脑内有大量分布外, 在非神经细胞上也分布广泛如巨噬细胞、树突状细胞、上皮细胞、各种癌症细胞等, 因此它不仅介导很多神经生理病理进程, 而且还能通过胆碱能抗炎通路调节身体中的炎症反应[7, 30, 31]。近年来, 对于靶向α7 nAChR的拮抗剂或激动剂的研究日益广泛, 如: 目前已知的α7 nAChR的激动剂有托烷司琼(tropisetron)、GTS-21、奎尼丁衍生物(AR-R17779、AZD0328)、PUM282987、中氮茚类化合物等[32, 33]。这些小分子化合物有的是α7 nAChR的完全激动剂, 有的是部分激动剂, 它们对于研究α7 nAChR受体功能具有重要意义, 有的化合物也有望作为治疗α7 nAChR介导的疾病的治疗药物。如: GTS-21研究结果表明, 它可以改善小鼠、灵长类动物的认知缺陷提高学习和记忆能力[34]。目前, 发现的α7 nAChR的拮抗剂也日益增多, 如: 甲基牛扁碱(MLA)、α-真菌毒素等[35]。此外, α7 nAChR也有望成为很多癌症疾病的重要分子靶点, 如Witayateeraporn等[36]发现的三唑基先导化合物QND7是α7 nAChR的拮抗剂, 其可以通过Akt/mTOR信号通路抑制小细胞肺癌的迁移并促进其凋亡。
海洋软体动物芋螺毒液中富含很多小分子多肽, 是很多nAChRs阻断剂的来源, 其中[A10L]PnIA就是从梅尔巴芋螺中分离并改造的获得的α7 nAChR拮抗剂, 它具有较好的活性和选择性, 使其不管是作为靶向α7 nAChR的药物还是荧光探针工具都具有很好的开发前景。基于Conotoxin开发的小分子多肽工具在nAChRs各个亚型的研究中发挥了重要的作用。如Hone等[37]利用α3β2选择性拮抗剂PeIA-5469及α3β4的选择性拮抗剂TxID发现了大鼠肾上腺髓质包含两个嗜铬细胞群, 一种仅表达α3β4 nAChR, 另一种则表达α3β4以及α3β2β4 nAChR亚型。本研究利用5-TAMRA, SE合成的带有荧光标记的芋螺毒素[A10L]PnIA-F在具有荧光标记的同时还保持了活性, 使其可以作为工具用于快速定位α7 nAChR在不同细胞上的分布。如: 肿瘤细胞、不同脑区、免疫细胞等, 用于研究α7 nAChR和细胞行为之间的关系。[A10L]PnIA-F还可以作为药理工具探针, 研究肿瘤细胞或炎症细胞在病理过程中α7 nAChR的分布及丰度变化。目前发现的nAChR亚基有17种, 它们相互组合能形成不同的亚型并发挥不同的功能, 许多细胞和组织会表达多种亚型, 特异荧光探针的开发, 为这些亚型在生理、病理过程中分布变化提供了研究工具。尤其是对免疫细胞, 如: 巨噬细胞、抗原呈递细胞等, α7 nAChR作为一个关键通道蛋白分子, 可能通过影响迁移侵袭及炎症因子的表达, 参与机体的炎症反应。[A10L]PnIA-F的合成为研究炎症相关的生理病理机制, 示踪免疫细胞运动也提供了重要工具。因此, [A10L]PnIA-F的发现不仅可以为不同组织细胞α7 nAChR的分布研究提供工具, 对今后研究α7 nAChR相关神经生理、病理和药理过程也具有重大意义。
实验部分雌性非洲爪蟾(Xenopus laevis) 购自美国Nasco公司; 包含鼠源α7 nAChR亚基基因的质粒获赠于来自美国犹他大学的S. Heinemann教授; 线性肽的合成由合肥国肽生物有限公司完成, 实验室完成纯化和氧化折叠; 5-羧基四甲基罗丹明琥珀酸亚胺酯(5-TAMRA, SE) 购于北京泛博生物化学有限公司; 小鼠单核巨噬细胞白血病细胞RAW264.7购于BNCC细胞库; CCK8试剂盒、质粒提取试剂盒、DMEM-H培养液、引物合成来自生工生物工程(上海) 有限公司; 限制性内切酶(NEB); FastPure Cell/Tissue Total RNA Isolation Kit和2×Taq Plus Master Mix购自南京Vazyme公司; 体外转录和RNA纯化试剂盒购自美国Thermo Fisher Scientific公司; ND96缓冲液(96 mol·L-1 NaCl、2 mol·L-1 KCl、1 mol·L-1 CaCl2、1 mol·L-1 MgCl2、5 mol·L-1 HEPES, pH 7.4); 含抗ND96缓冲液(链霉素10 μg·mL-1、青霉素10 μg·mL-1、庆大霉素100 μg·mL-1)。
Acquity H Class-Xevo TQD质谱仪(Waters, 美国); 2695制备型高效液相色谱仪(Waters, 美国); 2695分析型高效液相色谱仪(Waters, 美国); Christ Alpha 1-4L冷冻干燥机(Christ Alpha, 德国); Warner OC 725D双电极电压钳(Warner, 美国); TYPE LTD-2010恒温恒湿培养箱系统(EYELA, 日本) 等。
1 [A10L]PnIA-F的氧化折叠α-CTx [A10L]PnIA的序列如图 6A所示, 选择荧光染料5-TAMRA, SE进行标记(图 6B)。如图 6所示, [A10L]PnIA酰胺化末端的-NH2基团可以与5-TAMRA, SE发生反应, 反应中5-羧基四甲基罗丹明琥珀酸亚胺酯具有荧光活性的基团可以连接到[A10L]PnIA的氨基末端, 形成带有荧光标记的[A10L]PnIA ([A10L]PnIA-F)。
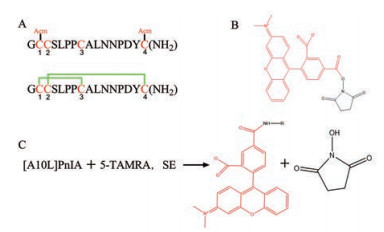
|
Figure 6 The reaction process of [A10L]PnIA and 5-TAMRA, SE. A: [A10L]PnIA linear peptide and [A10L]PnIA oxidized folded peptide; B: Fluorescent dye 5-TAMRA, SE; C: 5-TAMRA, SE and [A10L]PnIA reaction process |
合肥国肽生物科技有限公司合成[A10L]PnIA线形肽, 其中2、4位半胱氨酸用乙酰胺甲基(acetamidomethyl, Acm) 保护。经过纯化后, 线性肽纯度高于90%, 可进行体外氧化折叠, 形成具有两对二硫键(Cys1-Cys3, Cys2-Cys4) 活性结构的[A10L]PnIA。反应过程如下: 称取20~30 mg纯化后线形肽, 加入0.60 g Tris和0.33 g K3[Fe(CN)6], 用水溶解至100 mL反应体系, 空气氧化形成第1对二硫键(Cys1-Cys3)。反应后溶液经制备型色谱柱纯化, 纯化条件: 线性梯度洗脱为0~50 min, 5% B→50% B, 95% A→50% A (A液: 0.1%三氟乙酸/99.9% H2O, B液: 0.1%三氟乙酸/99.9%乙腈), 流速10 mL·min-1, 检测波长UV 214 nm。第二步氧化折叠, 称取30~50 mg I2, 用8~10 mL ACN溶解, 加入第一步反应后纯化产物和1 mL TFA, 用水稀释至100 mL的反应体系, 在氮气的保护下进行碘氧化形成第2对二硫键(Cys2-Cys4), 最终氧化折叠产物经HPLC纯化, 纯化条件: 线性梯度洗脱为0~50 min, 5% B→50% B, 95% A→50% A。纯化后产物经分析型HPLC鉴定: 洗脱线性梯度为35 min, 10% B→55% B, 90% A→45% A, 其中色谱柱流速为0.8 mL·min-1, 产物纯度 > 97%, 质谱鉴定氧化折叠产物。
纯化后的[A10L]PnIA冻干粉1 mg和5-TAMRA, SE 2 mg以摩尔质量1∶1的比例在硼酸氢钠溶液下反应4 h得到初步产物, 再经由制备型色谱柱纯化, 洗脱条件: 线性梯度洗脱0~55 min, 10% B→60% B, 90% A→40% A, 流速为8 mL·min-1, 最终得到[A10L]PnIA-F。利用分析型HPLC和质谱鉴定其纯度和分子量: 取90~100 μL由HPLC色谱柱分析纯度, 洗脱线性梯度为35 min, 10% B→55% B, 90% A→45% A, 其中色谱柱流速为0.8 mL·min-1, 产物纯度 > 97%, 质谱鉴定[A10L]PnIA-F荧光肽。
2 鼠源α7 nAChR模型的构建提取包含α7 nAChR基因的质粒。以20 μg (0.50 μg·μL-1) 质粒作为模板, 使用限制性内切酶酶切Sal I (NEB), 酶切完全的线性化片段, 经纯化试剂盒纯化, 可作为体外转录的模板。取5 μL (0.43 μg·μL-1) 纯化的包含α7 nAChR基因的纯化线性DNA为模板, 用T7 mMESSAGE mMACHINETM体外转录试剂盒进行体外转录, 利用RNA MEGA ClearTM纯化试剂盒纯化转录产物, 最终得到的cRNA用1%琼脂糖凝胶电泳和紫外分光光度计检测其纯度和浓度。检测后的cRNA分装后, -70 ℃冻存, 具体的实验过程参考试剂手册说明书和实验室已发表论文[38]。
分离出质量较好的爪蟾卵母细胞(Ⅴ-Ⅵ期), 将α7 nAChR亚基的cRNA显微注射到卵母细胞, 注射体积59.20 nL·cell-1。注射后的蛙卵细胞, 移至新鲜的含抗ND96溶液中在17 ℃培养。培养2~3天后, 进行电生理检测。设置电生理程序(每个sweep 1 min), 调整灌流系统流速(1 mL·min-1), 将注射过cRNA的爪蟾卵母细胞, 置于50 μL细胞槽中, 将膜电位钳制在-70 mV, 利用双电极电压钳系统, 记录蛙卵在不同浓度ACh刺激下的电流的大小, 证明α7 nAChR成功表达在蛙卵细胞上[16, 18, 38]。
3 [A10L]PnIA-F的活性检测正常条件下, 以200 μmol·L-1 ACh诱导下蛙卵表达α7 nAChR产生的电流为基准(3~5个对照平均), 不同浓度的[A10L]PnIA本体和荧光肽与蛙卵细胞孵育5 min后, 记录此条件下所产生的内向电流, 并计算反应率。电生理数据采集条件: 钳制电压-70 mV, 采样频率slow 100 Hz, 低通滤波10 Hz, 记录时间1 min。数据的采集和分析, 利用Clampex 10.6和Clampfit 10.6软件(Molecular devices)。利用GraphPad Prism 8软件(San Diego, CA, USA) 对数据进行统计和分析, 绘制剂量反应曲线, 采用非线性拟合方程(response% = 100/[1+(IC50/[peptide])nH]), 计算[A10L]PnIA本体和荧光肽的半阻断剂量(IC50)。
4 [A10L]PnIA-F的细胞毒性检测利用RAW264.7小鼠巨噬细胞对[A10L]PnIA-F的细胞毒性进行检测。液氮冻存的RAW264.7小鼠巨噬细胞系复苏后, 置于5% CO2、37 ℃培养箱中培养, 收集对数生长期的细胞, 按照3×105个细胞接种在小皿上, 培养24 h后, 细胞聚合度达到80%~90%, 取出小皿, 利用FastPure Cell/Tissue Total RNA Isolation Kit试剂盒, 采用吸附柱的方法, 提取RNA。用100 μL RNase-free ddH2O洗脱, 1%的琼脂糖凝胶电泳检测所提RNA纯度, 用紫外分光光度计检测其浓度为0.33 μg·μL-1 (1.7 < A260/A280 < 2.0), -80 ℃冰箱保存。使用HiScript®Ⅱ Q RT SuperMix试剂盒以提取的3 μL (1 μg) RNA为模板反转录合成cDNA。根据NCBI网站上提供的基因编号, 设计用于扩增α7 nAChR的引物(表 1), 将cDNA稀释10倍后, 取10 μL为模板, 进行α7 nAChR PCR基因鉴定。依次加入ddH2O 16 μL、2×Taq Plus Master Mix Ⅱ (Dye Plus) 25 μL、Forward primer (10 μmol·L-1) 2 μL、Reverse primer (10 μmol·L-1) 2 μL、模板cDNA 10 μL。反应程序为: 95 ℃ 3 min预变性; 95 ℃ 15 s变性; 57 ℃ 20 s退火; 72 ℃ 20 s延伸; 30个循环; 72 ℃彻底延伸8 min。通过PCR反应确定细胞上存在α7 nAChR。
收集对数生长期的RAW264.7细胞, 按每孔1×104个细胞接种于96孔板中, 待细胞生长到对数生长期分别加入含[A10L]PnIA-F浓度为5 nmol·L-1、50 nmol·L-1、500 nmol·L-1、1 μmol·L-1、10 μmol·L-1的无血清培养液100 μL, 培养箱中培养24 h。弃去含有[A10L]PnIA-F的培养液, 每孔分别加入含有CCK8试剂的培养液100 μL (CCK8∶DMEM-H = 1∶10)。37 ℃孵育1~2 h后, 酶标仪检测450 nm波长下的吸光度值, 对细胞活力的影响的计算方法为: 细胞相对活力(%) = (A处理组- A对照组/A空白组- A对照组) × 100%。数据分析使用GraphPad Prism 8软件(San Diego, CA, USA)进行单因素分差分析(one-way analysis of variance), 组间比较采用邓恩多重比较法(Dunnett's multiple comparisons test)。
作者贡献: 罗素兰、朱晓鹏、长孙东亭负责实验设计、实验指导和论文修改; 谭瑶负责荧光多肽合成、电生理及细胞实验以及论文撰写、数据分析; 杨奕帅负责荧光多肽合成优化; 褚召莉负责细胞毒检测。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Millar NS, Gotti C. Diversity of vertebrate nicotinic acetylcholine receptors[J]. Neuropharmacology, 2009, 56: 237-246. DOI:10.1016/j.neuropharm.2008.07.041 |
| [2] |
Kabbani N, Nichols RA. Beyond the channel: metabotropic signaling by nicotinic receptors[J]. Trends Pharmacol Sci, 2018, 39: 354-366. DOI:10.1016/j.tips.2018.01.002 |
| [3] |
Ma KG, Qian YH. Alpha 7 nicotinic acetylcholine receptor and its effects on Alzheimer's disease[J]. Neuropeptides, 2019, 73: 96-106. DOI:10.1016/j.npep.2018.12.003 |
| [4] |
Wallace TL, Porter RH. Targeting the nicotinic alpha7 acetylcholine receptor to enhance cognition in disease[J]. Biochem Pharmacol, 2011, 82: 891-903. DOI:10.1016/j.bcp.2011.06.034 |
| [5] |
Hajiasgharzadeh K, Somi MH, Sadigh-eteghad S, et al. The dual role of alpha7 nicotinic acetylcholine receptor in inflammation-associated gastrointestinal cancers[J]. Heliyon, 2020, 6: e03611. DOI:10.1016/j.heliyon.2020.e03611 |
| [6] |
Kanaoka Y, Koga M, Sugiyama K, et al. Varenicline enhances oxidized LDL uptake by increasing expression of LOX-1 and CD36 scavenger receptors through alpha7 nAChR in macrophages[J]. Toxicology, 2017, 380: 62-71. DOI:10.1016/j.tox.2017.02.006 |
| [7] |
Ulleryd MA, Mjornstedt F, Panagaki D, et al. Stimulation of alpha 7 nicotinic acetylcholine receptor (alpha7nAChR) inhibits atherosclerosis via immunomodulatory effects on myeloid cells[J]. Atherosclerosis, 2019, 287: 122-133. DOI:10.1016/j.atherosclerosis.2019.06.903 |
| [8] |
Dehkordi O, Rose JE, Balan KV, et al. Co-expression of nAChRs and molecules of the bitter taste transduction pathway by epithelial cells of intrapulmonary airways[J]. Life Sci, 2010, 86: 281-288. DOI:10.1016/j.lfs.2009.12.016 |
| [9] |
Fujii T, Mashimo M, Moriwaki Y, et al. Expression and function of the cholinergic system in immune cells[J]. Front Immunol, 2017, 8: 1085. DOI:10.3389/fimmu.2017.01085 |
| [10] |
de jonge WJ, van der zanden EP, The FO, et al. Stimulation of the vagus nerve attenuates macrophage activation by activating the Jak2-STAT3 signaling pathway[J]. Nat Immunol, 2005, 6: 844-954. DOI:10.1038/ni1229 |
| [11] |
Fujii Y, Fujigaya H, Moriwaki Y, et al. Enhanced serum antigen-specific IgG1 and proinflammatory cytokine production in nicotinic acetylcholine receptor α7 subunit gene knockout mice[J]. J Neuroimmunol, 2007, 189: 69-74. DOI:10.1016/j.jneuroim.2007.07.003 |
| [12] |
Wang H, Yu M, Ochani M, et al. Nicotinic acetylcholine receptor ahira unit is an essential regulator of inflammation[J]. Nature, 2003, 421: 384-388. DOI:10.1038/nature01339 |
| [13] |
Zhang Q, Zhang YJ, Chen XW, et al. Role of alpha7 nicotinic acetylcholine receptor in lung inflammation and carcinogenesis[J]. Chin J Clin Oncol (中国肿瘤临床), 2020, 47: 851-855. |
| [14] |
Chen J, Cheuk IWY, Shin VY, et al. Acetylcholine receptors: key players in cancer development[J]. Surg Oncol, 2019, 31: 46-53. DOI:10.1016/j.suronc.2019.09.003 |
| [15] |
Egleton RD, Brown KC, Dasgupta P. Nicotinic acetylcholine receptors in cancer: multiple roles in proliferation and inhibition of apoptosis[J]. Trends Pharmacol Sci, 2008, 29: 151-158. DOI:10.1016/j.tips.2007.12.006 |
| [16] |
Zhu XP, Yu JP, Hu YY, et al. Analgesic activity of α-conotoxin LtIA[J]. Chin Pharm J (中国药学杂志), 2016, 51: 1941-1946. |
| [17] |
Zhangsun DT, Wu Y, Zhu XP, et al. Sensitivity of α-conotoxin TxID on stoichiometry of α3β4 nicotinic acetylcholine receptors[J]. Chin Pharm J (中国药学杂志), 2016, 51: 802-808. |
| [18] |
Zhangsun DT, Wu Y, Zhu XP, et al. Antagonistic activity of α-conotoxin TxIB isomers on rat and human α6/α3 β2 β3 nicotinic acetylcholine receptors[J]. Chin Pharm J (中国药学杂志), 2017, 52: 574-580. |
| [19] |
Ellison M, Haberlandt C, Gomez-Casati ME, et al. R-RgIA: a novel conotoxin that specifically and potently blocks the α9α10 nAChR[J]. Biochemistry, 2006, 45: 1511-1517. DOI:10.1021/bi0520129 |
| [20] |
Armishaw C, Jensen AA, Balle T, et al. Rational design of alpha-conotoxin analogues targeting alpha7 nicotinic acetylcholine receptors: improved antagonistic activity by incorporation of proline derivatives[J]. J Biol Chem, 2009, 284: 9498-9512. DOI:10.1074/jbc.M806136200 |
| [21] |
Boaro A, Ageitos L, Torres M, et al. Light-emitting probes for labeling peptides[J]. Cell Reports Phys Sci, 2020, 1: 100257. DOI:10.1016/j.xcrp.2020.100257 |
| [22] |
Kong J, Wang Y, Qi W, et al. Green fluorescent protein inspired fluorophores[J]. Adv Colloid Interface Sci, 2020, 285: 102286. DOI:10.1016/j.cis.2020.102286 |
| [23] |
Chileveru HR, Lim SA, Chairatana P, et al. Visualizing attack of Escherichia coli by the antimicrobial peptide human defensin 5[J]. Biochemistry, 2015, 54: 1767-1777. DOI:10.1021/bi501483q |
| [24] |
Zhao C, Mendive-tapia L, Vendrell M. Fluorescent peptides for imaging of fungal cells[J]. Arch Biochem Biophys, 2019, 661: 187-195. DOI:10.1016/j.abb.2018.11.018 |
| [25] |
El-Mounadi K, Islam KT, Hernandez-Ortiz P, et al. Antifungal mechanisms of a plant defensin MtDef4 are not conserved between the ascomycete fungi Neurospora crassa and Fusarium graminearum[J]. Mol Microbiol, 2016, 100: 542-559. DOI:10.1111/mmi.13333 |
| [26] |
Islam KT, Shah DM, El-mounadi K. Live-cell imaging of fungal cells to investigate modes of entry and subcellular localization of antifungal plant defensins[J]. J Vis Exp, 2017, e55995. |
| [27] |
Zerfas BL, Trader DJ. Monitoring the immunoproteasome in live cells using an activity-based peptide-peptoid hybrid probe[J]. J Am Chem Soc, 2019, 141: 5252-5260. DOI:10.1021/jacs.8b12873 |
| [28] |
Liu Y, Liu Z, Wang Y, et al. A tetrathiafulvalene-L-glutamine conjugated derivative as a supramolecular gelator for embedded C60 and absorbed rhodamine B[J]. New J Chem, 2020, 44: 14151-14160. DOI:10.1039/D0NJ01816C |
| [29] |
Kubin RF, Fletcher AN. Fluorescence quantum yields of some rhodamine dyes[J]. J Lumin, 1983, 27: 455-462. |
| [30] |
Shin VY, Wu WK, Ye YN, et al. Nicotine promotes gastric tumor growth and neovascularization by activating extracellular signal-regulated kinase and cyclooxygenase-2[J]. Carcinogenesis, 2004, 25: 2487-2495. DOI:10.1093/carcin/bgh266 |
| [31] |
Zheng Y, Ritzenthaler JD, Roman J, et al. Nicotine stimulates human lung cancer cell growth by inducing fibronectin expression[J]. Am J Respir Cell Mol Biol, 2007, 37: 681-690. DOI:10.1165/rcmb.2007-0051OC |
| [32] |
Yang T, Xiao T, Sun Q, et al. The current agonists and positive allosteric modulators of alpha7 nAChR for CNS indications in clinical trials[J]. Acta Pharm Sin B, 2017, 7: 611-622. DOI:10.1016/j.apsb.2017.09.001 |
| [33] |
Li Q, Yang TY, Xue Y, et al. The structure-activity relationships of novel α7 nicotinic acetylcholine receptor agonists based on indolizine scaffold[J]. Acta Pharm Sin (药学学报), 2016, 51: 1584-1594. |
| [34] |
Kong FJ, Ma LL, Zhang HH, et al. Alpha 7 nicotinic acetylcholine receptor agonist GTS-21 mitigates isoflurane-induced cognitive impairment in aged rats[J]. J Surg Res, 2015, 194: 255-261. DOI:10.1016/j.jss.2014.09.043 |
| [35] |
Mashimo M, Takeshima S, Okuyama H, et al. alpha7 nAChRs expressed on antigen presenting cells are insensitive to the conventional antagonists alpha-bungarotoxin and methyllycaconitine[J]. Int Immunopharmacol, 2020, 81: 106276. DOI:10.1016/j.intimp.2020.106276 |
| [36] |
Witayateeraporn W, Arunrungvichian K, Pothongsrisit S, et al. alpha7-Nicotinic acetylcholine receptor antagonist QND7 suppresses non-small cell lung cancer cell proliferation and migration via inhibition of Akt/mTOR signaling[J]. Biochem Biophys Res Commun, 2020, 521: 977-983. DOI:10.1016/j.bbrc.2019.11.018 |
| [37] |
Hone AJ, Rueda-ruzafa L, Gordon TJ, et al. Expression of alpha3beta2beta4 nicotinic acetylcholine receptors by rat adrenal chromaffin cells determined using novel conopeptide antagonists[J]. J Neurochem, 2020, 154: 158-176. DOI:10.1111/jnc.14966 |
| [38] |
Luo SL, Zhu XP, Yu JP, et al. Pharmacological activities of α3β2 and α3β4 nicotinic acetycholine receptors with different α and β subunit stoichiometries[J]. Chin J Pathophysiol (中国病理生理杂志), 2017, 33: 961-967. |
 2021, Vol. 56
2021, Vol. 56


