2. 江苏省中西医结合老年病防治重点实验室, 江苏 扬州 225001;
3. 扬州市中医院, 江苏 扬州 225001;
4. 青岛农业大学食品科学与工程学院, 山东 青岛 266109
2. Jiangsu Key Laboratory of Integrated Traditional Chinese and Western Medicine for Prevention and Treatment of Senile Diseases, Yangzhou 225001, China;
3. Yangzhou Hospital of TCM, Yangzhou 225001, China;
4. College of Food Science and Engineering, Qingdao Agricultural University, Qingdao 266109, China
链格孢(Alternaria sp.) 是自然界中常见的一种半知菌类真菌, 广泛分布于植物、土壤和海洋环境中。链格孢属真菌能产生丰富的次生代谢产物, 如: 含氮化合物、甾体、萜类及类萜类、吡喃酮类、醌类、酚类等, 它们往往具有细胞毒、抗菌等多种药理活性[1], 是新药先导化合物的重要来源。Alternaria sp. W-1是青岛农业大学王凤舞博士从大型海生褐藻——海带(Laminaria japonica) 中分离获得的一株内生真菌, 前期实验已从Alternaria sp. W-1发酵液中分离得到6个tricycloalternarene (TCA) 化合物, 其中1个新化合物[2]。Tricycloalternarenes (TCAs) 是一类由Alternaria sp.[3]、Aspergillus sp.[4]、Guignardia sp.[5]和Ulocladium sp.[6]等真菌产生的类萜类化合物, 大多数TCAs结构中具有环己-2-烯酮的环系统, 并通过亚甲基和氧原子与环戊烯基/环戊基连接而形成三环化合物。TCA类化合物曾被命名为ACTG-toxin, 它们在结构上很相似, 主要区别在于类异戊二烯侧链和C环的取代方式不同[1]。进一步对Alternaria sp. W-1发酵液粗浸膏中的化学成分进行分离纯化, 结果又分离得到1个新tricycloalternarene化合物6-iso-tricycloalternarene 6a (1, 图 1) 和5个已知物tricycloalternarene 6a (TCA 6a, 2)[7]、tricycloalternarene B (TCA B, 3)[3]、uracil (4)[8]、5-methyluracil (5)[8]和lumichrome (6)[9]。
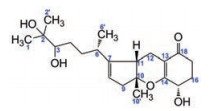
|
Figure 1 Structure of 6-iso-tricycloalternarene 6a (1) |
化合物1为黄色固体。其正源HR-ESI-MS显示准分子离子峰m/z 365.232 8 [M+H]+, 387.214 5 [M+Na]+和751.438 3 [2M+Na]+, 说明其相对分子质量为364, 分子式为C21H32O5 (C21H32O5Na理论值: 387.214 7), 不饱和度为6。化合物1的1H NMR谱显示, 3个甲基单峰δH-1 1.18、δH-2' 1.12、δH-10' 1.50, 1个甲基双峰δH-6' 0.98, 1个双键氢δH-8 5.35; 13C NMR谱显示20个碳信号(C-18位羰基碳信号未观察到), 其中4个双键碳δC-7 150.0、δC-8 120.0、δC-13 105.0和δC-14 170.2。1H和13C NMR谱提示, 化合物1是一个tricycloalternarene化合物。仔细分析其1H和13C NMR数据发现, 化合物1与TCA 6a (2) 和TCA 6b比较相似(三者分子式皆为C21H32O5), 但也存在明显的差异[10]。与TCA 6b相比, 化合物1的1H和13C NMR谱中分别观察到δH-15 4.35和δC-15 66.5, 说明其存在15-OH, 而非17-OH[10]。LC-MS/MS分析显示, 化合物1和TCA 6a (2) 具有相同的二级质谱图, 说明它们具有相同的平面结构; 与TCA 6a (2) 相比, 化合物1的C-5和C-6'向低场移动(ΔδC-5 = 1.1, ΔδC-6' = 0.7)[10]; 同时H-5向低场显著移动(ΔδH-5ab = 0.52), H-6向高场移动(Δδ = -0.20)。这说明化合物1可能是TCA 6a的C-6位异构体。随后进行的一系列2D NMR谱(HSQC、HMBC、COSY和NOESY) 确证了对化合物1的结构推测。
1H-1H COSY谱中观察到: H-3与H-4、H-4与H-5、H-5与H-6、H-4与H-6以及H-5与H-6'相关; H-8与H-9相关; H-11与H-12相关; H-15、H-17与H-16相关。HMBC谱中可以观察到: H-2'与C-1相关; H-1与C-2'相关; H-1、H-2'与C-2相关; H-1、H-2'与C-3相关; H-5、H-6'、H-9、H-12与C-7相关; H-9与C-8相关; H-8、H-10'与C-9相关; H-8、H-9、H-10'与C-10相关; H-8、H-9、H-10'、H-12与C-11相关; H-12、H-16与C-14相关(图 2)。因此, 化合物1被确定为6-iso-tricycloalternarene 6a, 该结构尚未见文献报道, 其1H和13C NMR谱归属列于表 1。

|
Figure 2 1H-1H COSY (—) and HMBC ($\curvearrowright$) correlations of compound 1 |
| Table 1 NMR spectral data of compound 1 (CDCl3, 600 MHz (H)/150 MHz (C), J in Hz) |
采用MTT法测定化合物1~3对人肝癌细胞株SMMC-7721和人胃癌细胞株SGC-7901的体外细胞毒活性, 结果发现, 化合物1~3对上述两种肿瘤细胞株表现出微弱的抑制活性, 在50 μg·mL-1时, 对SMMC-7721细胞的抑制率分别为25.71%、20.22%和28.91%, 对SGC-7901细胞的抑制率分别为23.10%、19.40%和41.04%, 而阳性对照顺铂对这两种肿瘤细胞株的IC50值分别为6.12和1.25 μg·mL-1。
实验部分Bruker AVANCE 600核磁共振波谱仪(德国Bruker公司); Bruker UHR-TOF-Maxis超高分辨飞行时间质谱仪(德国Bruker公司); 超高效液相色谱-四级杆串联飞行时间质谱TripleTOF 4600 (美国AB SCIEX公司); WZZ-2B自动旋光仪(上海精密科学仪器有限公司); Jasco J-810圆二色谱仪(日本分光公司); Hitachi Primaide高效液相色谱仪(日本日立公司), 液相色谱柱Sinochrom ODS-AP (4.6 mm×150 mm, 5 μm) 和Sinochrom ODS-AP (4.6 mm×250 mm, 5 μm) (大连依利特分析仪器有限公司); Isolera one快速纯化制备液相色谱(瑞典Biotage公司); Thermo Series Ⅱ CO2细胞培养箱(美国Thermo Fisher Scientific公司); Bio-Tek SYNERGY2多功能酶标仪(美国Bio-Tek公司) 等。柱色谱硅胶(200~300目) (青岛海洋化工厂分厂); Merck Silica gel 60 F254铝板(20 cm×20 cm) (德国Merck公司); Sephadex LH-20 (瑞典Pharmacia Biotech公司); CDCl3 (美国Sigma-Aldrich公司); CD3OD (青岛腾龙微波技术有限公司); DMSO-d6 (美国Cambridge Isotope Laboratories公司); 色谱甲醇(美国TEDIA公司); 色谱乙腈(国药集团化学试剂有限公司); RPMI 1640、新生胎牛血清和青-链霉素混合液(以色列Biological Industries公司); 0.25%胰蛋白酶(上海碧云天生物技术有限公司); 噻唑蓝(MTT) (大连美仑生物技术有限公司); 顺铂(江苏豪森药业股份有限公司); 其他试剂均为分析纯。人胃癌细胞株SGC-7901 (上海生命科学研究院细胞库); 人肝癌细胞株SMMC-7721 (美国ATCC公司)。
1 提取与分离菌株W-1是青岛农业大学王凤舞博士从山东威海海域采集的野生新鲜海带中分离得到的一株内生真菌, 根据形态学特征及与18S rDNA序列比较, 鉴定其为链格孢Alternaria sp. (GenBank登录号MF184928), 该菌株保存在中国普通微生物菌种保藏管理中心(CGMCC No.15181)。Alternaria sp. W-1采用海水配制的查氏培养基进行液体发酵, 发酵液经乙酸乙酯萃取3次、减压蒸馏去除溶剂后得粗浸膏20 g[2]。
发酵液粗浸膏经硅胶柱色谱粗分离, 二氯甲烷: 甲醇梯度洗脱(v/v 100∶0→0∶100), 得到10个组分Fr.1~Fr.10。Fr.1经进一步硅胶柱色谱分离得到Fr.1-1~Fr.1-4, Fr.1-3经HPLC (Sinochrom ODS-AP柱(4.6 mm×150 mm, 5 μm), 254 nm, 甲醇∶水v/v 55∶45, 1 mL·min-1) 分离纯化得到化合物3 (3.1 mg, tR = 118 min)。Fr.6经进一步硅胶柱色谱分离得到Fr.6-1和Fr.6-2, Fr.6-1经Sephadex LH-20凝胶柱色谱分离得到的Fr.6-1-3经HPLC (Sinochrom ODS-AP柱(4.6 mm×250 mm, 5 μm), 254 nm, 乙腈∶水v/v 15∶85, 1 mL·min-1) 分离纯化得到化合物6 (1.1 mg, tR = 39 min)。Fr.7经Sephadex LH-20凝胶柱色谱分离得到Fr.7-1~Fr.7-3, Fr.7-1经HPLC (Sinochrom ODS-AP柱(4.6 mm×250 mm, 5 μm), 254 nm, 甲醇∶水v/v 34∶66, 1 mL·min-1) 分离纯化得到化合物1 (1.6 mg, tR = 78 min) 和2 (7.8 mg, tR = 73 min); Fr.7-3经HPLC (Sinochrom ODS-AP柱(4.6 mm×250 mm, 5 μm), 254 nm, 甲醇∶水v/v 10∶90, 1 mL·min-1) 分离纯化得到化合物4 (1.2 mg, tR = 3.5 min) 和5 (1.1 mg, tR = 4.3 min)。
2 结构鉴定6-iso-Tricycloalternarene 6a (1) 黄色固体, 分子式C21H32O5。HR-ESI-MS m/z: 365.232 8 [M+H]+, 387.214 5 [M+Na]+, 751.438 3 [2M+Na]+ (C21H32O5Na理论值: 387.214 7)。[α] = -52.2 (c 0.009 6, MeOH); UV (MeOH): λmax (logε) = 262 (3.82) nm; CD (MeOH): λmax (Δε) = 207 (-0.33), 226 (1.40), 288 (-0.23), 304 (0.38) nm; 1H和13C NMR数据见表 1。
Tricycloalternarene 6a (TCA 6a, 2) 黄色粉末, 分子式C21H32O5。HR-ESI-MS m/z: 365.232 5 [M+H]+, 387.213 9 [M+Na]+, 751.440 9 [2M+Na]+ (C21H32O5Na理论值: 387.214 7); 1H NMR (CD3OD, 600 MHz) δ: 5.37 (1H, s, H-8), 4.22 (1H, d, J = 3.0 Hz, H-15), 3.16 (1H, d, J = 10.8 Hz, H-3), 2.87 (1H, s, H-11), 2.63 (2H, m, H-12a, H-9a), 2.56 (1H, m, H-17a), 2.49 (1H, m, H-9b), 2.28 (1H, m, H-17b), 2.19 (2H, m, H-12b, H-16a), 1.94 (2H, m, H-16b, H-6), 1.53 (1H, m, H-5a), 1.50 (3H, s, H-10'), 1.44 (1H, m, H-5b), 1.30 (1H, m, H-4a), 1.15 (1H, m, H-4b), 1.13 (3H, s, H-1), 1.09 (3H, s, H-2'), 0.99 (3H, br s, H-6'); 13C NMR (CD3OD, 150 MHz) δ: 200.0 (C-18), 174.1 (C-14), 151.3 (C-7), 121.4 (C-8), 108.7 (C-13), 90.1 (C-10), 79.9 (C-3), 73.7 (C-2), 67.1 (C-15), 47.9 (C-11), 45.9 (C-9), 34.2 (C-17), 33.8 (C-6), 33.5 (C-5), 30.6 (C-4), 30.5 (C-16), 25.8 (C-1), 24.9 (C-10'), 23.6 (C-2'), 20.6 (C-6'), 16.1 (C-12)。
Tricycloalternarene B (TCA B, 3) 白色粉末, 分子式C23H32O5。HR-ESI-MS m/z: 411.215 5 [M+Na]+, 387.217 6 [M-H]- (C23H32O5Na理论值: 411.214 2); 1H NMR (CDCl3, 600 MHz) δ: 5.39 (1H, s, H-3), 5.33 (1H, s, H-8), 4.43 (2H, s, H-1ab), 4.02 (1H, d, J = 12.6 Hz, H-17), 2.74 (1H, s, H-11), 2.66 (1H, d, J = 16.8 Hz, H-12a), 2.59 (1H, d, J = 16.2 Hz, H-9a), 2.49 (1H, m, H-15a), 2.43 (1H, d, H-9b), 2.38 (1H, m, H-15b), 2.33 (1H, m, H-16a), 2.24 (1H, br d, J = 18.6 Hz, H-12b), 2.07 (3H, s, 1-OOCCH3), 2.02 (1H, m, H-6), 1.95 (2H, m, H-4ab), 1.72 (1H, m, H-16b), 1.61 (3H, s, H-2'), 1.51 (2H, m, H-5ab), 1.43 (3H, s, H-10'), 0.96 (3H, br s, H-6')。
Uracil (4) 白色固体, 分子式C4H4N2O2。HR-ESI-MS m/z: 113.037 4 [M+H]+, 135.017 8 [M+Na]+ (C4H5N2O2理论值: 113.034 6); 1H NMR (DMSO-d6, 600 MHz) δ: 10.96 (2H, s, 1-NH, 3-NH), 7.38 (1H, s, H-6), 5.45 (1H, s, H-5)。
5-Methyluracil (5) 白色固体, 分子式C5H6N2O2。HR-ESI-MS m/z: 127.051 9 [M+H]+, 253.091 1 [2M+H]+ (C5H7N2O2理论值: 127.050 2); 1H NMR (DMSO-d6, 600 MHz) δ: 10.99 (1H, s, 3-NH), 10.59 (1H, s, 1-NH), 7.23 (1H, s, H-6), 1.72 (3H, d, J = 0.6 Hz, 5-CH3)。
Lumichrome (6) 黄绿色粉末, 分子式C12H10N4O2。HR-ESI-MS m/z: 265.070 4 [M+Na]+, 507.152 7 [2M+Na]+ (C12H10N4O2Na理论值: 265.069 6); 1H NMR (DMSO-d6, 600 MHz) δ: 11.70 (2H, s, 1-NH, 3-NH), 7.92 (1H, s, H-9), 7.71 (1H, s, H-6), 2.49 (3H, s, 7-CH3), 2.47 (3H, s, 8-CH3)。
3 体外细胞毒活性测定采用MTT法测定化合物的体外细胞毒活性。肿瘤细胞在含10%新生胎牛血清的RPMI 1640培养液中, 于37 ℃、5% CO2的CO2培养箱内培养至对数生长期。收集对数生长期细胞, 以每孔1×104个细胞接种于96孔板, 当细胞密度达到80%左右时, 药物组分别加入100 µL一定浓度(0.1、1、10、20和50 µg·mL-1) 的待测化合物(少量DMSO助溶), 阴性对照组和空白组分别加入等体积0.1%的DMSO和培养液。培养48 h后, 每孔加入20 μL MTT (5 mg·mL-1), 继续培育4 h。然后弃去培养液, 每孔加100 μL DMSO, 37 ℃振荡10 min, 使结晶充分溶解, 酶标仪在波长490 nm处测定各孔吸光度OD值。顺铂为阳性对照药。计算公式如下:
| $ 增殖抑制率 =\frac{{{\rm{O}}{{\rm{D}}_{ 空白组 }} - {\rm{O}}{{\rm{D}}_{药物组}}}}{{{\rm{O}}{{\rm{D}}_{ 空白组}}}} \times 100\% $ |
致谢: 扬州大学分析测试中心承担化合物结构的分析测试工作。
作者贡献: 王莎莎与陈曦负责海带内生菌Alternaria sp. W-1次生代谢产物的分离及结构鉴定, 另王莎莎负责完成论文初稿; 青岛农业大学王凤舞博士承担Alternaria sp. W-1的分离、鉴定与发酵; 徐亚平承担化合物的质谱分析; 叶桐承担化合物的体外细胞毒活性测定; 申丽负责实验设计和论文框架的构建及稿件修改等。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Lou J, Fu L, Peng Y, et al. Metabolites from Alternaria fungi and their bioactivities[J]. Molecules, 2013, 18: 5891-5935. DOI:10.3390/molecules18055891 |
| [2] |
Shen L, Tian SJ, Song HL, et al. Cytotoxic tricycloalternarene compounds from endophyte Alternaria sp. W-1 associated with Laminaria japonica[J]. Mar Drugs, 2018, 16: 402. DOI:10.3390/md16110402 |
| [3] |
Yuan L, Zhao PJ, Ma J, et al. Tricycloalternarenes A-E: five new mixed terpenoids from the endophytic fungal strain Alternaria alternata Ly 83[J]. Helv Chim Acta, 2008, 91: 1588-1594. DOI:10.1002/hlca.200890172 |
| [4] |
Bai ZQ, Lin X, Wang J, et al. New meroterpenoids from the endophytic fungus Aspergillus flavipes AIL8 derived from the mangrove plant Acanthus ilicifolius[J]. Mar Drugs, 2015, 13: 237-248. DOI:10.3390/md13010237 |
| [5] |
Mei WL, Zheng B, Zhao YX, et al. Meroterpenes from endophytic fungus A1 of mangrove plant Scyphiphora hydrophyllacea[J]. Mar Drugs, 2012, 10: 1993-2001. DOI:10.3390/md10091993 |
| [6] |
Wang QX, Bao L, Yang XL, et al. Tricycloalternarenes F-H: three new mixed terpenoids produced by an endolichenic fungus Ulocladium sp. using OSMAC method[J]. Fitoterapia, 2013, 85: 8-13. DOI:10.1016/j.fitote.2012.12.029 |
| [7] |
Duan RT, Zhou H, Li HT, et al. Chemical constituents of endophytic fungus Alternaria sp. TY2-3 associated with Gastrodia elata[J]. Nat Prod Res Dev (天然产物研究与开发), 2016, 28(Suppl): 188-191. |
| [8] |
Pretsch E, Buhlmann P, Affolter C. Rong GB (translation). Structure Determination of Organic Compounds Tables of Spectral Data (波谱数据表-有机化合物的结构解析)[M]. Shanghai: East China University of Science and Technology Press, 2002: 238.
|
| [9] |
Yang LH, Jin XQ, Zhang W. Studies on the chemical constituents from the skin of Bufo bufo gargarizans cantor[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2000, 17: 292-295. |
| [10] |
Nussbaum RP, Günther W, Heinze S, et al. New tricycloalternarenes produced by the phytopathogenic fungus Alternaria alternata[J]. Phytochemistry, 1999, 52: 593-599. DOI:10.1016/S0031-9422(99)00275-7 |
 2021, Vol. 56
2021, Vol. 56


