2. 北华大学附属医院, 吉林 吉林 132013;
3. 北华大学医学院病理教研室, 吉林 吉林 132013;
4. 北华大学检验学院, 吉林 吉林 132013
2. Affiliated Hospital of Beihua University, Jilin 132013, China;
3. Department of Pathology, College of Medical, Beihua University, Jilin 132013, China;
4. College of Medical Laboratory, Beihua University, Jilin 132013, China
运动性疲劳是指机体超负荷运转而引发的生理机能减退现象[1]。持续性的运动疲劳会造成免疫力下降、内分泌紊乱, 甚至引起机体器质性疾病。肝脏是机体最重要的代谢器官, 它与机体多个组织器官协同合作来保证机体运动时肌肉的正常工作和代谢平衡[2]。运动过度时, 机体代谢增强, 耗氧量增加, 导致机体各组织中产生过多的自由基, 超过机体自身抗氧化防御系统的清除能力, 产生氧化应激损伤。过量的自由基可以攻击肝脏组织中脂质、蛋白质、DNA等细胞大分子, 出现肝脏损伤[3, 4]。在运动训练过程中, 肝脏的血液供应显著减少, 恢复后血液重新分配[5]。恢复过程类似于再灌注过程, 导致自由基产生和脂质过氧化水平显著增加, 再加上训练过程中产生的大量自由基, 使肝组织氧化损伤进一步加重[6]。据研究报道, 小鼠血清中谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST) 含量在经过高负荷耐力训练后升高, 表明肝脏受到损伤[7-9]。而外源性抗氧化剂, 如维生素类、微量元素类、氨基酸类以及中药类, 可通过抑制或阻止细胞内底物的氧化, 抑制脂质过氧化反应, 直接清除自由基; 或与内源性抗氧化剂形成协同抗氧化网络来降低氧化应激, 延迟体力疲劳, 从而减轻肝脏氧化损伤[10]。西药治疗因其疗效慢、不良反应多、费用高等, 在抗疲劳方面并未得到广泛应用[11, 12]。例如倍他乐克显著降低血清去甲肾上腺素含量和乳酸浓度, 但对肾脏有不良影响, 并伴有代谢性酸中毒等急症[13]。而中药补充剂因其治疗效果明显, 不良反应少, 在抗疲劳治疗中被广泛应用[14, 15]。
南五味子(Schisandra sphenanthera Rehd. et Wils.) 为五味子科南五味子属植物的果实, 是中国卫生部颁布的可用于保健食品的中药材之一, 收载于《中国药典》, 具有滋补、强壮等功效[16]。南五味子也常用作日本汉方药和美国保健食品中的成分[17]。木脂素类是南五味子主要的药用活性成分, 具有明显的抑菌、镇静安眠、抗衰老、抗氧化及保护肝损伤等药理作用[18]。五酯片为五味子的乙醇提取制剂药物, 临床中用于治疗病毒和药物引起的肝炎和肝功能不全[19]。安五脂素是南五味子木脂素具有代表性的单体化合物成分[20], 也是五酯片的主要成分之一[21], 但关于安五脂素功效研究的报道较少。本研究前期工作发现, 安五脂素可能通过抗氧化作用显著增强力竭训练小鼠的运动耐力[22], 并能显著改善D-半乳糖及四氯化碳诱导的小鼠肝脏损伤[23, 24]。
NRF2 [nuclear factor (erythroid-derived 2)-like 2] 是编码抗氧化蛋白和其他应激反应介质的主转录调节因子, 其参与调节的NRF2/ARE (antioxidant responsive element) 通路是细胞对抗氧化应激的主要防御通路, 可以调控抗氧化酶, 加速自由基清除, 减轻机体氧化损伤[25, 26]。在本研究前期工作中发现, 安五脂素的上述作用可能与其调节机体骨骼肌或肝脏组织中NRF2/ARE通路有关, 但并未证实其直接相关性[22, 23]。本研究将观察安五脂素对力竭训练小鼠肝脏损伤的改善作用, 并探讨其与NRF2的直接相关作用机制, 为开发具有抗疲劳及保护肝脏作用的保健食品及药物提供理论依据。
材料与方法药物与试剂 安五脂素(成都普菲德生物科技有限公司); ALT试剂盒(C009-2-1)、AST试剂盒(C010-2-1)、SOD (A001-3-2) 试剂盒、MDA (malondialdehyde, A003-1-2) 试剂盒、GSH-Px (A005-1-2) 试剂盒、CAT (A007-1-1) 试剂盒和ROS (E004-1-1) 试剂盒(南京建成生物工程研究所); ROS试剂盒(ml009876-1)、8-OHdG (ml002198) 试剂盒(上海酶联生物科技有限公司); 聚偏二氟乙烯(polyvinylidene difluoride, PVDF) 膜(BSP0161)、HCl-Tris (WB-0021) (北京鼎国试剂公司); Keap1 (Kelch-like ECH-associated protein 1, A1820)、NRF2 (A1244)、HO-1 [heme oxygenase (decycling) 1, A1346]、NQO1 [NAD(P)H: quinone oxidoreductase, A1518]、Bcl-2 (B-cell lymphoma 2, A19693)、Bax (Bcl-2-like protein 4, A18642) 和caspase3 (A11021) (ABclonal公司); ECL (electrochemiluminescence) 显色液(E411-03, 南京诺唯赞公司); 广谱蛋白质标记(PR1910, 北京索莱宝公司); HepG2细胞(美国弗吉尼亚州马纳萨斯ATCC公司); DMEM培养试剂(SH30022.01, 美国洛根HyClone公司)。
动物与实验设计 动物实验程序按照《实验动物的护理和使用指南》进行, 并获得北华大学动物保护与使用委员会(IACUC) 的批准。雄性ICR小鼠, 体重20 ± 2 g, 由中国长春亿斯实验动物研究中心提供, 实验动物生产许可证号SCXK (吉)-2016-0003。小鼠随意饮用标准实验室饲料和水, 按昼夜周期饲养。动物实验分组(共80只): ①空白对照(SED-Con) 组: 0.5% CMC-Na灌胃及静坐实验; ②模型(MOD-Con) 组: 0.5% CMC-Na灌胃及力竭游泳训练; ③安五脂素对照(Anwu-SED) 组: 安五脂素(4 mg·kg-1) 灌胃及静坐实验; ④安五脂素模型(Anwu-MOD) 组: 安五脂素(4 mg·kg-1) 灌胃及力竭游泳训练, 各组小鼠每天训练前1 h给药1次, 给药7周。静坐实验: 不施加其他外界刺激干扰, 不进行运动训练, 保持小鼠正常活动状态。负重游泳训练: 将小鼠置于20 ± 2 ℃、水深20 cm的塑料容器中。游泳训练从第2至第6周, 每周训练6天, 每次训练至小鼠力竭为止(至小鼠沉于水面下3 s后不能浮出水面或游泳动作无力失调为力竭标准, 立即将其从水中捞出, 以免出现溺水死亡)。测量体重后相应增加负荷, 由1%逐渐增加至体重的10%。
生化指标检测 末次给予药物60 min之后, 戊巴比妥钠麻醉后处死, 血清备用, 肝脏组织浸泡在10%福尔马林中或保持在-80 ℃以备用。按照试剂盒方法检测血清或肝脏组织中SOD、GSH-Px活力以及ALT、AST、ROS、MDA、CAT和8-OHdG的含量。
H & E (hematoxylin-eosin) 染色 取适量肝脏组织于福尔马林溶液中固定72 h后, 梯度乙醇进行脱水, 石蜡包埋, 切片(厚度为5 μm)。H & E染色后显微镜下观察肝脏的组织结构。
免疫组化 肝脏组织免疫组织化学染色, 常规脱蜡、乙醇梯度复水, 柠檬酸钠抗原修复液进行抗原修复(微波法), 封闭后加入一抗(NRF2和Bcl-2一抗, 1∶200), 4 ℃孵育过夜, 二抗(1∶250) 室温孵育30 min, DAB (diaminobezidin 3, 3-二氨基联苯胺) 显色后苏木素复染, 中性树脂封片, 测量累积光密度。
细胞培养与分组 HepG2细胞于DMEM培养基(10%胎牛血清), 在37 ℃、5% CO2的饱和湿度培养箱中培养, 取对数生长期细胞进行分组实验。正常对照组(control, CON): 不加H2O2干预处理; 模型组(model, MOD): 正常培养24 h后, 加入H2O2溶液(0.5 mmol·L-1) 刺激2 h; 治疗组(Anwulignan, Anwu): 安五脂素(溶于DMSO, 终浓度4 μmol·L-1) 干预24 h后, 加入H2O2溶液(0.5 mmol·L-1) 刺激2 h; 抑制剂组: 加入ML385 (终浓度2.5 μmol·L-1) 2 h后, 安五脂素(终浓度4 μmol·L-1) 干预24 h, 加入H2O2溶液(0.5 mmol·L-1) 刺激2 h。
细胞存活率检测 取对数生长期的HepG2细胞接种于96孔板(每毫升1.0×104个), 上述分组方法处理细胞后, MTT法检测细胞存活率, 每孔20 μL MTT溶液, 孵育2 h后, 于酶标仪450 nm波长检测。
ROS水平检测 HepG2细胞接种于6孔板(每毫升1.0×105个), 每孔加入10 μmol·L-1 DCFH-DA荧光探针, 37 ℃避光反应20 min, PBS (phosphate buffer saline) 洗涤细胞2次, 胰酶消化细胞后用PBS重悬, DCFH-DA法测定活细胞的ROS相对强度。HepG2细胞接种于96孔板, 每孔体积180 μL (每孔1.0×104个), 取上清液参照ROS ELISA (enzyme linked immunosorbent assay) 试剂盒进行检测。
HepG2细胞氧化水平检测 HepG2细胞接种于6孔板(每毫升1.0×105个), 用预冷PBS洗涤1次, 裂解细胞后, 取上清液参照SOD、MDA试剂盒说明进行检测。
细胞凋亡水平检测 细胞接种于含有载玻片的6孔板中(每毫升1.0×105个), 48 h后, 固定液固定30 min, Hoechst 33258工作液染色20 min, 抗荧光淬灭剂封片, 荧光显微镜进行观察。HepG2细胞接种于96孔板内(每毫升1.0×104个), 取上清液参照Annexin V ELISA测定试剂盒进行检测。
Western blot实验 每组动物肝脏组织冰上裂解1 h, 离心后取上清, 将细胞按每毫升1.0×105个接种于6孔板中, 每孔体积2 mL, 细胞裂解提取细胞总蛋白, BCA (bicinchoninic acid) 法测定蛋白浓度, SDS-PAGE凝胶电泳分离蛋白, 电转移至PVDF膜(2 h), 室温封闭1 h。加入Keap1、NRF2、HO-1、NQO1、Bcl-2、Bax、caspase 3一抗(1∶1 000), 4 ℃孵育过夜后, TBST (TBS + Tween) 洗膜, 二抗室温温育1 h (1∶2 000), TBST洗膜, ECL显影液显色, 实验重复3次。
统计学分析 肝脏指数, 肝脏及肝细胞中SOD、GSH-Px活力, ROS、MDA、CAT含量, 免疫组化以及Western blot实验数据均以x± s表示。采用GraphPad Prism 7对实验数据进行统计学分析, 组间比较采用单因素方差分析(one-way ANOVA), P < 0.05具有统计学意义。
结果 1 安五脂素对力竭训练小鼠肝功能的影响肝指数、AST和ALT是评估肝功能的重要指标, 致病因素导致肝细胞变性和细胞膜通透性增加时, 细胞内释放出ALT; 而当肝细胞损伤严重时, 线粒体内的AST便释放出来, 导致血清AST显著升高。因此, 测定血清AST、ALT水平有利于肝功能异常的诊断和鉴别[27, 28]。为了观察安五脂素对力竭小鼠肝功能的影响, 本研究对这三个指标进行检测。小鼠肝脏指数结果如图 1A所示, 各组小鼠肝脏指数未见明显差异(P > 0.05); ALT和AST检测结果如图 1B、C所示, 与空白对照组相比, 力竭训练小鼠的血清ALT和AST水平显著增加(P < 0.05)。然而, 与力竭训练小鼠相比, 安五脂素给药组小鼠血清AST和ALT水平显著降低(P < 0.05), 提示安五脂素对力竭训练小鼠的肝脏功能具有一定的改善作用。

|
Figure 1 Effects of Anwulignan on liver index and aminotransferases in the exhausted mice. A: Liver index; B: Alanine aminotransferase (ALT); C: Aspartate aminotransferase (AST). n = 20, x± s. *P < 0.05. SED-Con: Sodium carboxymethyl cellulose gavage and no exercise; MOD-Con: Sodium carboxymethyl cellulose gavage and exhaustive swimming training; SED (Anwulignan/4 mg·kg-1): Anwulignan gavage and no exercise; MOD (Anwulignan/4 mg·kg-1): Anwulignan gavage and exhaustive swimming training |
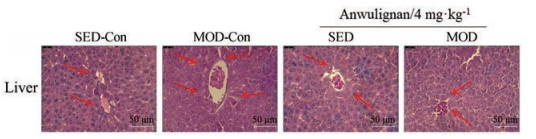
据报道[29], 力竭运动训练后小鼠肝脏结构会发生变化, 主要表现为部分肝细胞破裂, 内容物进入窦状隙等, 病理学观察能够直观反映肝组织及细胞的形态变化。本研究通过H & E染色观察安五脂素对小鼠肝脏组织病理学改变的影响。如图 2箭头指示, 空白对照组与空白给药组小鼠肝细胞结构完整, 无变性、坏死; 肝索排列有序、清楚; 肝窦无淤血, 无炎细胞浸润, 细胞核大且成圆形。力竭训练小鼠肝细胞有肿胀, 间隙增大, 细胞核变小, 汇管区细胞浸润现象。安五脂素给药组小鼠肝细胞结构完整、清晰, 无变性、坏死; 肝窦无淤血, 无炎细胞浸润, 细胞核呈圆形, 排列规律。结果提示, 给予安五脂素后, 力竭训练小鼠肝脏损伤得到一定程度改善。
|
Figure 2 Effects of Anwulignan on pathological changes in the exhausted mice (400×), representative images of hematoxylin-eosin (H & E) staining results. Scale bar: 50 μm. In SED-CON/SED mice (both Anwuligan-treated and untreated), the hepatocytes exhibited a complete and clear structure with a large nucleus and round shape and showed no degeneration, necrosis, hepatic sinus congestion, and inflammatory cell infiltration. The exhausted exercise led to changes in liver structure in mice. As shown in MOD-SED, the hepatocytes of exhausted mice showed swelling, enlarged gaps, small nuclei, and cell infiltration in the portal area. In MOD group (Anwulignan treated), all pathological changes were significantly reversed nearly to the control status, suggesting Anwulignan can prevent the liver structural damage |
力竭训练过程中, 细胞中ROS产生过量, 会诱导氧化应激损伤, 细胞通过凋亡、坏死等途径走向死亡。SOD能够催化自由基生成氧和过氧化氢, 在机体氧化与抗氧化平衡中起到至关重要的作用, GSH-Px能够催化过氧化氢分解, CAT是生物体内的末端氧化酶, 能够清除细胞中代谢产生的过氧化氢, 以上抗氧化酶能够保护机体免受氧化应激的损伤, 是生物防御系统的关键抗氧化酶。MDA是脂质过氧化的最终代谢产物, 8-OHdG是DNA氧化损伤产物, 其含量可反映细胞氧化损伤的程度, 是广泛用于研究氧化损伤机制的关键标志物[30]。本研究对上述指标检测结果显示(图 3), 与空白对照组相比, 力竭训练小鼠肝组织中SOD、GSH-Px、CAT活性显著下降(P < 0.01或P < 0.05), ROS、MDA、8-OHdG含量显著上升(P < 0.01或P < 0.05); 与力竭训练小鼠相比, 安五脂素给药组小鼠肝组织中SOD、GSH-Px、CAT活性显著上升(P < 0.01或P < 0.05), ROS、MDA、8-OHdG含量显著下降(P < 0.01或P < 0.05)。上述结果提示安五脂素可显著提高小鼠机体的抗氧化能力。

|
Figure 3 Effects of Anwulignan on liver oxidation-related biochemical indicators in the exhausted mice. A: Reactive oxygen species (ROS); B: Superoxide dismutase (SOD); C: Glutathione peroxidase (GSH-Px); D: Catalase (CAT); E: Malondialdehyde (MDA); F: 8-Hydroxy-2 deoxyguanosine (8-OHdG). n = 20, x± s. *P < 0.05, **P < 0.01 |
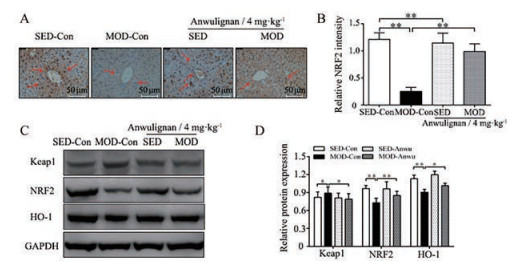
NRF2/ARE通路在调节体内抗氧化损伤中起着重要作用, 通过激活NRF2, 有助于减轻运动过程中产生的过度氧化应激造成的细胞、组织及器官的损伤[31]。本研究应用免疫组化方法对各组小鼠肝脏组织NRF2的表达进行了观察。结果显示, 各组小鼠肝组织均表达NRF2, 空白对照组与空白给药组小鼠可见明显肝细胞核染色, NRF2蛋白表达水平均明显高于力竭训练小鼠, 安五脂素给药组小鼠可见较力竭训练小鼠阳性染色增多, NRF2阳性表达增加(图 4A)。
|
Figure 4 Effects of Anwulignan on nuclear factor (erythroid-derived 2)-like 2 (NRF2)/antioxidant responsive element (ARE) pathway protein expression. A: The NRF2 staining area in indicated groups (400×). Scale bar: 50 μm; B: Quantitative analysis of scanning densitometry for NRF2; C: The expression levels of Kelch-like ECH-associated protein 1 (Keap1), NRF2, heme oxygenase (decycling) 1 (HO-1) were measured by Western blot analysis, and glyceraldehyde-3-phosphate dehydrogenase (GAPDH) was used as control; D: Quantitative analysis of scanning densitometry for Keap1, NRF2, HO-1, and GAPDH. n = 3, x± s. *P < 0.05, **P < 0.01. SED-Anwu: Anwulignan gavage and no exercise; MOD-Anwu: Anwulignan gavage and exhaustive swimming training |
Keap1是NRF2的负调控因子, HO-1是受NRF2调控的抗氧化蛋白酶[32], 为了进一步观察安五脂素对NRF2/ARE通路蛋白表达的调节作用, 本研究应用Western blot方法对各组小鼠肝脏中Keap1、NRF2和HO-1蛋白表达水平进行检测。结果显示(图 4), 与空白对照组相比, 力竭训练小鼠Keap1的表达水平显著增加(P < 0.05), 但NRF2和HO-1的表达显著减少(P < 0.01)。与力竭训练小鼠相比, 安五脂素给药组中Keap1的表达水平显著降低(P < 0.05), NRF2和HO-1的表达均显著升高(P < 0.05或P < 0.01), 表明安五脂素可能通过激活NRF2/ARE信号通路对力竭训练所致的肝氧化损伤起保护作用。
5 安五脂素对力竭训练小鼠肝脏Bcl-2/Bax通路蛋白表达的影响Bax蛋白有促进细胞凋亡作用, Bcl-2蛋白能抑制细胞凋亡, Bcl-2蛋白通过与Bax蛋白竞争生成异源二聚体而达到抑制细胞凋亡的功能。机体可通过自身保护机制调节Bcl-2蛋白与Bax蛋白的表达, 调控由于氧化应激损伤导致的肝细胞凋亡[33]。本研究应用免疫组化及Western blot方法观察各组小鼠肝脏组织Bcl-2/Bax通路相关蛋白的表达情况。免疫组化结果显示(图 5), Bcl-2蛋白分布在细胞膜边缘(黄色部分)。与空白对照组相比, 力竭训练小鼠Bcl-2蛋白表达量显著降低(P < 0.01), 安五脂素给药组阳性表达较力竭训练小鼠显著增加(P < 0.01) (图 5A、B)。

|
Figure 5 Effects of Anwulignan on B-cell lymphoma 2 (Bcl-2)/Bcl-2-like protein 4 (Bax) pathway protein expression in the livers. A: The Bcl-2 staining area in indicated groups (400×). Scale bar: 50 μm; B: Quantitative analysis of scanning densitometry for Bcl-2; C: The expression levels of Bcl-2, Bax, and caspase3 were measured by Western blot analysis; D: Quantitative analysis of scanning densitometry for Bcl-2, Bax, and caspase3. n = 3, x± s. *P < 0.05, **P < 0.01 |
Western blot结果显示(图 5C), 与空白对照组相比, 力竭训练小鼠Bcl-2的表达显著减少(P < 0.01), Bax、caspase3的表达水平显著增加(P < 0.01)。与力竭训练小鼠相比, 安五脂素给药组中Bcl-2的表达水平显著增加(P < 0.01), 而Bax及caspase3的表达均显著降低(P < 0.01), 表明安五脂素能够降低力竭训练小鼠肝细胞凋亡水平, 进而发挥对肝组织的保护作用。
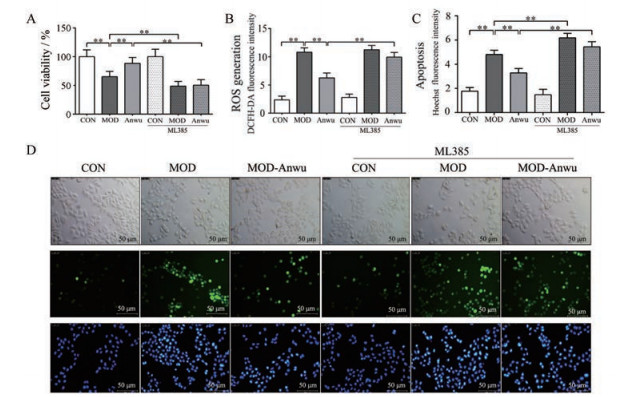
6 安五脂素对H2O2处理的HepG2细胞存活率的影响HepG2细胞是实验常用的人肝癌细胞系, 具有正常肝细胞表型, 分化程度较高。在生化指标、生理功能以及代谢等多个方面与正常肝细胞有许多共同点, 能够合成分泌出与正常肝细胞相同特征的蛋白, 代谢、解毒功能也与正常肝细胞相同, 是可用于肝脏方面研究的理想细胞系[34]。为了进一步明确安五脂素是否特异性激活NRF2靶点来发挥抗氧化应激损伤作用, 本研究通过体外实验, 应用H2O2处理HepG2细胞, 观察安五脂素在给予或不给予NRF2抑制剂-ML385干预时对细胞氧化损伤的影响。结果表明, HepG2细胞在H2O2处理后细胞存活率显著下降(P < 0.01), 用4 μg·L-1安五脂素预处理24 h (Anwu组), 细胞存活率显著升高(P < 0.01)。而应用2.5 μmol·L-1 ML385预处理24 h后, MOD-ML385组细胞存活率显著下降(P < 0.01), 且Anwu-ML385组细胞存活率显著下降(P < 0.01) (图 6A)。提示, 安五脂素对H2O2诱导的细胞氧化损伤具有保护作用, 并且该作用能够被NRF2抑制剂ML385显著抑制。
|
Figure 6 Effect of Anwulignan on the viability of HepG2 cells treated with H2O2 and ML385. A: The viability of HepG2 cells; B: The ROS level of HepG2 cells; C: The apoptosis level of HepG2 cells; D: Representative photomicrographs of HepG2 cells staining for DCFH-DA ROS and Hoechst 33258. Scale bar: 50 μm. n = 6, x± s. **P < 0.01 |
细胞中ROS产生过量, 则会诱导氧化应激损伤。应用DCFH-DA荧光探针检测不同处理后HepG2细胞内ROS水平。结果显示, H2O2显著增加细胞内ROS水平(P < 0.01), 而安五脂素显著减少了H2O2诱导的ROS沉积(P < 0.01); 经ML385处理后, Anwu-ML385组ROS沉积显著增加(P < 0.01) (图 6B)。为了进一步验证上述结果, 本研究应用ELISA法对HepG2细胞内ROS水平进行检测, 结果与上述结果一致(图 7A)。

|
Figure 7 Effect of Anwulignan on oxidation related indicators in HepG2 cells treated with H2O2 and ML385. A: ROS; B: SOD; C: MDA. n = 8, x± s. *P < 0.05, **P < 0.01. ELISA: Enzyme linked immunosorbent assay |
对各组细胞内SOD活性及MDA含量检测结果显示, H2O2诱导后HepG2细胞SOD活性显著下降(P < 0.01), MDA含量显著增加(P < 0.05), 安五脂素显著增强细胞SOD活性(P < 0.05), 显著减少细胞MDA含量(P < 0.05)。经ML385处理后, Anwu-ML385组SOD活性显著下降, MDA含量显著增加(P < 0.01或P < 0.05) (图 7B、C)。结果表明, 安五脂素能够有效降低细胞内ROS水平, 进而保护细胞的氧化损伤, 而ML385显著抑制了安五脂素的抗氧化损伤作用, 进一步证明NRF2与安五脂素的抗氧化作用有关。
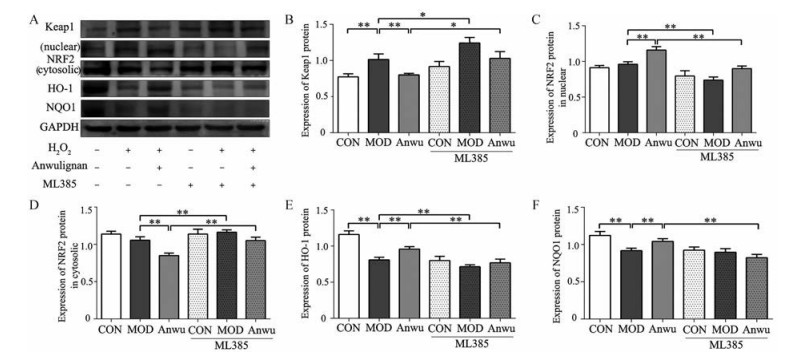
8 安五脂素对H2O2损伤HepG2细胞NRF2/ARE通路的影响为进一步证实安五脂素与NRF2/ARE通路的相关性, 通过给予NRF2抑制剂-ML385进行干预, 观察安五脂素对NRF2/ARE信号通路的激活作用是否产生改变。结果显示(图 8), 与CON组相比, MOD组Keap1表达显著增加(P < 0.01), 与MOD组相比, MOD-Anwu组表达显著减少(P < 0.01), MOD-ML385组表达显著增加(P < 0.05); 与MOD-Anwu组相比, ML385处理后Keap1表达显著增加(P < 0.05)。与CON组相比, MOD组NRF2表达无显著变化, 与MOD组相比, MOD-Anwu组NRF2核内表达显著增加, 胞浆表达显著降低, MOD-ML385组NRF2核内表达显著降低, 胞浆表达显著增加(P < 0.01); 与MOD-Anwu组相比, ML385处理后NRF2核移位水平显著降低(P < 0.01)。与CON组相比, MOD组HO-1、NQO1表达显著降低, 与MOD组相比, MOD-Anwu组表达显著增加, MOD-ML385组HO-1表达显著降低(P < 0.01); 与MOD-Anwu组相比, ML385处理后表达HO-1、NQO1显著降低(P < 0.01)。结果表明, 安五脂素显著增加了NRF2的核移位与其下游抗氧化蛋白酶的表达, 而ML385显著抑制了安五脂素对NRF2的激活作用, 提示安五脂素是通过激活NRF2靶点来发挥相关作用的。
|
Figure 8 Effect of Anwulignan on NRF2/ARE pathway in HepG2 cells treated with H2O2 and ML385. A: The blots of Keap1, NRF2, HO-1, and NQO1 were standardized to that of GAPDH; B-F: Quantitative analysis of scanning densitometry for Keap1 (B), NRF2-nuclear (C), NRF2-cytosolic (D), HO-1 (E), and NQO1 (F) were shown. n = 3, x± s. *P < 0.05, **P < 0.01. NQO1: NAD(P)H: quinone oxidoreductase |
H2O2是体内氧化还原代谢的中间产物, 是一种ROS, 积累到一定程度可对机体细胞产生氧化损伤作用, 与细胞凋亡密切相关。细胞内过量产生的ROS能损害线粒体膜并减低线粒体膜电势, 改变线粒体膜的通透性, 进而通过线粒体信号转导通路引起细胞凋亡。而Bcl-2家族(抗凋亡蛋白Bcl-2和促凋亡蛋白Bax) 参与被认为是细胞凋亡发生的主要机制[35]。
Hoechst染色法是检测细胞凋亡水平的经典方法, 本研究结果显示MOD组细胞凋亡水平显著增加(P < 0.01)。安五脂素减少了H2O2诱导的细胞凋亡(P < 0.01); 经ML385处理后, MOD-ML385组细胞凋亡水平显著增加(P < 0.01), Anwu-ML385组细胞凋亡程度显著增加(P < 0.01, 图 6C)。
Annexin V ELISA法是检测细胞早期凋亡的灵敏指标, 检测H2O2诱导后细胞凋亡水平, 结果显示MOD组细胞凋亡水平显著增加(P < 0.01)。安五脂素减少了H2O2诱导的细胞凋亡(P < 0.01); 经ML385处理后, MOD-ML385组细胞凋亡水平显著增加(P < 0.05), Anwu-ML385组细胞凋亡程度显著增加(P < 0.01) (图 9)。
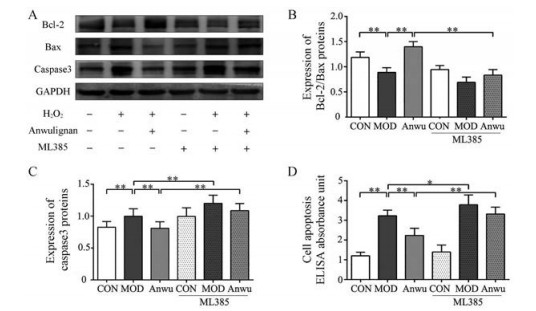
|
Figure 9 Effect of Anwulignan on apoptosis in HepG2 cells treated with H2O2 and ML385. A: The blots of Bcl-2, Bax, and caspase3 were standardized to that of GAPDH, the experiment was repeated 3 times; B-D: Quantitative analysis of scanning densitometry for Bcl-2/Bax (B), caspase3 (C), and Annexin V content (D). n = 8, x± s. *P < 0.05, **P < 0.01 |
以上结果提示, 安五脂素可上调H2O2处理HepG2细胞中Bcl-2的表达, 下调Bax和caspase3的表达(图 9), 发挥了抗凋亡作用。给予ML385及安五脂素后, 其抗凋亡作用被显著抑制, 提示安五脂素的抗凋亡作用与NRF2相关。
讨论长时间剧烈运动会使机体代谢紊乱, 组织器官细胞结构和功能发生变化[36]。其中, 肝组织中的抗氧化酶的变化较为显著, 使肝脏自由基生成增加, 抗氧化酶类物质大量消耗, 抗氧化系统失衡, 将导致肝组织产生氧化应激损伤[3, 4]。积累的自由基攻击细胞膜, 导致细胞膜通透性改变, 膜内物质溢出, 肝细胞功能下降[37]。本研究采用小鼠力竭模型, 在训练6周后, MOD组小鼠肝脏中ROS、脂质氧化终产物MDA和DNA氧化损伤生物标志物8-OHdG的含量显著升高, SOD、GSH-Px和CAT显著降低, 肝细胞出现肿胀, 间隙增大, ALT、AST等肝功重要指标显著升高, 表明模型小鼠肝脏组织产生了氧化应激损伤。同时, 也检测到NRF2/ARE下调, 凋亡水平升高的现象。而安五脂素能显著促进这些指标的恢复。
安五脂素是南五味子有效成分木脂素中的单体化合物成分[20]。而南五味子具有传统中药的滋补、强壮等功效[16], 现代研究表明其木脂素有抑制血小板凝集、抗炎、镇静安眠及抗氧化等作用[18, 38]。含有安五脂素的护肝药物五酯片、五酯滴丸等[39]已上市销售。本研究报道了安五脂素对疲劳性肝损伤的保护作用, 主要表现为: 给予安五脂素后, 力竭训练小鼠肝脏组织ROS、脂质氧化终产物MDA及DNA氧化损伤生物标志物8-OHdG的含量显著减低, 抗氧化酶SOD、GSH-Px和CAT活性显著增强, 肝组织ALT、AST水平显著降低, 肝组织损伤程度及肝功能均显著改善。
NRF2/ARE通路是一种综合的氧化还原敏感信号系统[40]和关键调节因子[41], 存在于肾、肺、心脏、脑和肝脏等组织, 是体内多种Ⅱ相解毒酶的主要转录激活因子。当细胞损伤时, NRF2将上调并激活下游抗氧化酶, 增强细胞对氧化应激的耐受能力。因此, 通过改善体内NRF2的活性, 可防御细胞毒性和氧化损伤及识别ARE的特定DNA序列, 有效地对抗氧化应激损伤[42, 43]。当机体处于氧化应激时, Keap1释放NRF2, 使其活化易位至细胞核后与Maf蛋白形成异二聚体, 激活ARE调控的抗氧化酶, 维持氧化还原稳态和细胞存活[44]。SOD、GSH-Px和CAT是NRF2的下游酶[45]。这些酶将氧自由基转化为过氧化氢, 并迅速分解为水, 有效防止组织细胞被过氧化物破坏[46]。本研究结果显示, 安五脂素能够上调NRF2和HO-1蛋白表达, 下调Keap1蛋白表达, 这与其对肌肉组织的作用是一致的[22], 提示安五脂素可能通过调节小鼠多个组织器官内NRF2-ARE信号通路相关蛋白及其下游酶和底物的水平而发挥抗氧化作用, 进而发挥对力竭训练小鼠包括肝脏在内的多个脏器的保护作用。
NRF2是NRF2/ARE信号通路核心调节因子, 为了进一步确认安五脂素作用与NRF2的相关性, 本研究应用体外细胞实验对其相关机制进行观察。HepG2细胞具有正常肝细胞的多种形态和生化特征, 是体外研究肝脏功能及肝脏疾病发生机制较为常见的研究工具[47]。ML385是特异性的NRF2抑制剂, 能够抑制其转录因子活性, 被广泛用于NRF2相关研究中[48]。本研究通过H2O2诱导HepG2细胞氧化损伤模型, 并应用ML385进行干预, 以明确安五脂素是否通过激活NRF2发挥相关作用。结果表明, 未给予ML385干预时, 安五脂素能显著提高H2O2处理的HepG2细胞存活率, 降低细胞内ROS水平, 提高SOD活力, 降低MDA含量, 上调细胞核内NRF2及细胞内HO-1、NQO1表达, 下调Keap1表达, 这与动物实验中对力竭训练小鼠肝脏组织的检测结果是一致的。而在给予ML385干预后, 上述作用均被显著抑制。这些结果表明, NRF2是安五脂素发挥对肝脏氧化损伤保护作用的关键调节靶点。
大量氧自由基可通过脂质过氧化、蛋白质及酶变性和DNA损伤等途径导致细胞凋亡[49]。作为细胞凋亡的重要调节因子, 以Bcl-2为代表的抗凋亡蛋白和以Bax为代表的促凋亡蛋白, 其比值变化决定细胞凋亡发生的走向[50], 而凋亡的细胞死亡最终由caspase家族完成。Caspase3处于caspase级联反应的中心位置, 是最重要的细胞凋亡执行者[51]。有研究表明, NRF2可通过与Bcl-2基因抗氧化反应元件结合, 调控Bcl-2表达和细胞凋亡过程。且通过使用NRF2抑制剂, 可以使Bcl-2表达减少, Bcl-2/Bax比值降低, 促进凋亡的发生[52]。本研究结果显示, 安五脂素可以上调力竭训练小鼠肝脏组织及H2O2处理HepG2细胞中Bcl-2的表达, 下调Bax和caspase3的表达, 在肝组织中发挥了抗凋亡作用。而Hoechst染色和Annexin V检测实验结果也进一步证实了上述抗凋亡作用。而同时给予ML385及安五脂素后, 其抗凋亡作用被显著抑制, 证实安五脂素的抗凋亡作用与NRF2相关。
综上, 安五脂素能减轻力竭训练小鼠肝损伤, 该作用与调节NRF2蛋白从而发挥抗氧化及抗凋亡作用有关。本研究为开发具有抗疲劳及保护肝脏作用的保健食品及药物提供理论依据。
作者贡献: 陈建光、李贺和张馨芸负责实验构想与设计; 张馨芸、于春艳、林慧娇和刘嘉玮负责样品采集与处理; 庄文越、孙靖辉和王春梅负责数据分析; 张馨芸、敬舒、陈建光和李贺负责写作与修改。所有作者都审阅该文章。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Armstrong LE, Vanheest JL. The unknown mechanism of the overtraining syndrome: clues from depression and psychoneuroimmunology[J]. Sports Med, 2002, 32: 185-209. DOI:10.2165/00007256-200232030-00003 |
| [2] |
Pedotti A. A study of motor coordination and neuromuscular activities in human locomotion[J]. Biol Cybern, 1977, 26: 53-62. DOI:10.1007/BF00363992 |
| [3] |
Powers SK, Jackson MJ. Exercise-induced oxidative stress: cellular mechanisms and impact on muscle force production[J]. Physiol Rev, 2008, 88: 1243-1276. DOI:10.1152/physrev.00031.2007 |
| [4] |
Magherini F, Fiaschi T, Marzocchini R, et al. Oxidative stress in exercise training: the involvement of inflammation and peripheral signals[J]. Free Radic Res, 2019, 53: 1155-1165. DOI:10.1080/10715762.2019.1697438 |
| [5] |
Powers SK, Deminice R, Ozdemir M, et al. Exercise-induced oxidative stress: friend or foe?[J]. J Sport Health Sci, 2020, 9: 415-425. DOI:10.1016/j.jshs.2020.04.001 |
| [6] |
Sjödin B, Westing YH, Apple FS. Biochemical mechanisms for oxygen free radical formation during exercise[J]. Sports Med, 1990, 10: 236-254. DOI:10.2165/00007256-199010040-00003 |
| [7] |
Xu X, Ding Y, Yang Y, et al. β-Glucan salecan improves exercise performance and displays anti-fatigue effects through regulating energy metabolism and oxidative stress in mice[J]. Nutrients, 2018, 10: 858. DOI:10.3390/nu10070858 |
| [8] |
Punduk Z, Oral O, Ozkayin N, et al. Single dose of intra-muscular platelet rich plasma reverses the increase in plasma iron levels in exercise-induced muscle damage: a pilot study[J]. J Sport Health Sci, 2016, 5: 109-114. DOI:10.1016/j.jshs.2014.11.005 |
| [9] |
Huang WC, Chiu WC, Chuang HL, et al. Effect of curcumin supplementation on physiological fatigue and physical performance in mice[J]. Nutrients, 2015, 7: 905-921. DOI:10.3390/nu7020905 |
| [10] |
Lamou B, Taiwe GS, Hamadou A, et al. Antioxidant and antifatigue properties of the aqueous extract of Moringa oleifera in rats subjected to forced swimming endurance test[J]. Oxid Med Cell Longev, 2016, 2016: 3517824. |
| [11] |
Liu C, Huang Y. Chinese herbal medicine on cardiovascular diseases and the mechanisms of action[J]. Front Pharmacol, 2016, 7: 469. |
| [12] |
Tao G, Balunas MJ. Current therapeutic role and medicinal potential of Scutellaria barbata in traditional Chinese medicine and Western research[J]. J Ethnopharmacol, 2016, 182: 170-180. DOI:10.1016/j.jep.2016.02.012 |
| [13] |
Bayer O, Adrion C, Tawil AA, et al. Results and lessons learnt from a randomized controlled trial: prophylactic treatment of vestibular migraine with metoprolol (PROVEMIG)[J]. Trials, 2019, 20: 813. DOI:10.1186/s13063-019-3903-5 |
| [14] |
Chen R, Moriya J, Yamakawa JI, et al. Traditional Chinese medicine for chronic fatigue syndrome[J]. Evid Based Complement Alternat Med, 2010, 7: 3-10. DOI:10.1093/ecam/nen017 |
| [15] |
Shen CY, Jiang JG, Yang L, et al. Anti-ageing active ingredients from herbs and nutraceuticals used in traditional Chinese medicine: pharmacological mechanisms and implications for drug discovery[J]. Br J Pharmacol, 2017, 174: 1395-1425. DOI:10.1111/bph.13631 |
| [16] |
National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China[M]. Beijing: China medical science press, 2015: 244-245.
|
| [17] |
Lai L, Hao H, Wang Q, et al. Effects of short-term and long-term pretreatment of Schisandra lignans on regulating hepatic and intestinal CYP3A in rats[J]. Drug Metab Dispos, 2009, 37: 2399-2407. DOI:10.1124/dmd.109.027433 |
| [18] |
Zhu P, Li J, Fu X, et al. Schisandra fruits for the management of drug-induced liver injury in China: a review[J]. Phytomedicine, 2019, 59: 152760. DOI:10.1016/j.phymed.2018.11.020 |
| [19] |
Chen Z, Liu F, Zheng N, et al. Wuzhi capsule (Schisandra Sphenanthera extract) attenuates liver steatosis and inflammation during non-alcoholic fatty liver disease development[J]. Biomed Pharmacother, 2019, 110: 285-293. DOI:10.1016/j.biopha.2018.11.069 |
| [20] |
Huyke C, Engel K, Simon-Haarhaus B, et al. Composition and biological activity of different extracts from Schisandra sphenanthera and Schisandra chinensis[J]. Planta Med, 2007, 73: 1116-1126. DOI:10.1055/s-2007-981559 |
| [21] |
Wei H, Sun L, Tai Z, et al. A simple and sensitive HPLC method for the simultaneous determination of eight bioactive components and fingerprint analysis of Schisandra sphenanthera[J]. Anal Chim Acta, 2010, 662: 97-104. DOI:10.1016/j.aca.2009.12.039 |
| [22] |
Zhang X, Jing S, Lin H, et al. Anti-fatigue effect of Anwulignan via the NRF2 and PGC-1α signaling pathway in mice[J]. Food Funct, 2019, 10: 7755-7766. DOI:10.1039/C9FO01182J |
| [23] |
Gao J, Yu Z, Jing S, et al. Protective effect of Anwulignan against D-galactose-induced hepatic injury through activating p38 MAPK-Nrf2-HO-1 pathway in mice[J]. Clin Interv Aging, 2018, 13: 1859-1869. DOI:10.2147/CIA.S173838 |
| [24] |
Zhang Y, Zhang X, Wang Y, et al. Anwulignan alleviates carbon tetrachloride-induced acute liver injury in mice[J]. Nat Prod Commun, 2020, 15: 1-8. |
| [25] |
Klaassen CD, Reisman SA. Nrf2 the rescue: effects of the antioxidative/electrophilic response on the liver[J]. Toxicol Appl Pharmacol, 2010, 244: 57-65. DOI:10.1016/j.taap.2010.01.013 |
| [26] |
Weerachayaphorn J, Mennone A, Soroka CJ, et al. Nuclear factor-E2-related factor 2 is a major determinant of bile acid homeostasis in the liver and intestine[J]. Am J Physiol Gastrointest Liver Physiol, 2012, 302: G925-G936. DOI:10.1152/ajpgi.00263.2011 |
| [27] |
Zhuang Y, Ma Q, Guo Y, et al. Protective effects of rambutan (Nephelium lappaceum) peel phenolics on H2O2-induced oxidative damages in HepG2 cells and D-galactose-induced aging mice[J]. Food Chem Toxicol, 2017, 108: 554-562. DOI:10.1016/j.fct.2017.01.022 |
| [28] |
Xu LQ, Xie YL, Gui SH, et al. Polydatin attenuates D-galactose-induced liver and brain damage through its anti-oxidative, anti-inflammatory and anti-apoptotic effects in mice[J]. Food Funct, 2016, 7: 4545-4555. DOI:10.1039/C6FO01057A |
| [29] |
Bian F, Zhao PM, Zhang ZS, et al. Clinical study on treatment of incipient diabetic nephropathy by integrated traditional Chinese and Western medicine[J]. Chin J Integr Med, 2001, 7: 99-102. |
| [30] |
Dong L, He Y, Wang Y, et al. Research progress on application of superoxide dismutase (SOD)[J]. J Agric Sci Technol, 2013, 15: 53-58. |
| [31] |
Nguyen T, Nioi P, Pickett CB. The Nrf2-antioxidant response element signaling pathway and its activation by oxidative stress[J]. J Biol Chem, 2009, 284: 13291-13295. DOI:10.1074/jbc.R900010200 |
| [32] |
Shin JW, Chun KS, Kim DH, et al. Curcumin induces stabilization of Nrf2 protein through Keap1 cysteine modification[J]. Biochem Pharmacol, 2020, 173: 113820. DOI:10.1016/j.bcp.2020.113820 |
| [33] |
Lu E, Hu X, Pan C, et al. Up-regulation of peroxiredoxin-1 promotes cell proliferation and metastasis and inhibits apoptosis in cervical cancer[J]. J Cancer, 2020, 11: 1170-1181. DOI:10.7150/jca.37147 |
| [34] |
Wang T, Long F, Zhang X, et al. Chemopreventive effects of atractylenolide Ⅱ on mammary tumorigenesis via activating Nrf2-ARE pathway[J]. Oncotarget, 2017, 8: 77500-77514. DOI:10.18632/oncotarget.20546 |
| [35] |
He H, Xu J, Xu Y, et al. Cardioprotective effects of saponins from Panax japonicus on acute myocardial ischemia against oxidative stress-triggered damage and cardiac cell death in rats[J]. J Ethnopharmacol, 2012, 140: 73-82. DOI:10.1016/j.jep.2011.12.024 |
| [36] |
Ruhee RT, Ma S, Suzuki K. Protective effects of sulforaphane on exercise-induced organ damage via inducing antioxidant defense responses[J]. Antioxidants (Basel), 2020, 9: 136. DOI:10.3390/antiox9020136 |
| [37] |
Merry TL, Macrae C, Pham T, et al. Deficiency in the ROS-sensing nuclear factor erythroid 2-like 2 causes altered glucose and lipid homeostasis following exercise training[J]. Am J Physiol Cell Physiol, 2019, 318: C337-C345. |
| [38] |
Steckling FM, Lima FD, Farinha JB, et al. Diclofenac attenuates inflammation through TLR4 pathway and improves exercise performance after exhaustive swimming[J]. Scand J Med Sci Sports, 2020, 30: 264-271. DOI:10.1111/sms.13579 |
| [39] |
Hua W, Sun L, Tai Z, et al. A simple and sensitive HPLC method for the simultaneous determination of eight bioactive components and fingerprint analysis of Schisandra sphenanthera[J]. Anal Chim Acta, 2010, 662: 97-104. DOI:10.1016/j.aca.2009.12.039 |
| [40] |
Zeng X, Li X, Xu C, et al. Schisandra sphenanthera extract (Wuzhi Tablet) protects against chronic-binge and acute alcohol-induced liver injury by regulating the NRF2-ARE pathway in mice[J]. Acta Pharm Sin B, 2017, 7: 583-592. DOI:10.1016/j.apsb.2017.04.002 |
| [41] |
Serafini MM, Catanzaro M, Fagiani F, et al. Modulation of Keap1/Nrf2/ARE signaling pathway by curcuma- and garlic-derived hybrids[J]. Front Pharmacol, 2020, 10: 1597. DOI:10.3389/fphar.2019.01597 |
| [42] |
Jin Y, Miao W, Lin X, et al. Acute exposure to 3-methylcholanthrene induces hepatic oxidative stress via activation of the Nrf2/ARE signaling pathway in mice[J]. Environ Toxicol, 2014, 29: 1399-1408. DOI:10.1002/tox.21870 |
| [43] |
Kang KA, Mei JP, Ryu YS, et al. Interaction of DNA demethylase and histone methyltransferase upregulates Nrf2 in 5-fluorouracil-resistant colon cancer cells[J]. Oncotarget, 2016, 7: 40594-40620. DOI:10.18632/oncotarget.9745 |
| [44] |
Michaličková D, Hrnčíř T, Canová NK, et al. Targeting Keap1/Nrf2/ARE signaling pathway in multiple sclerosis[J]. Eur J Pharmacol, 2020, 873: 172973. |
| [45] |
Han C, Wei Y, Cui Y, et al. Florfenicol induces oxidative stress and hepatocyte apoptosis in broilers via Nrf2 pathway[J]. Ecotoxicol Environ Saf, 2020, 191: 110239. DOI:10.1016/j.ecoenv.2020.110239 |
| [46] |
Zhang B, Wang J, Zhao G, et al. Apigenin protects human melanocytes against oxidative damage by activation of the Nrf2 pathway[J]. Cell Stress Chaperones, 2020, 25: 277-285. DOI:10.1007/s12192-020-01071-7 |
| [47] |
Takano S, Shiomoto S, Inoue KY, et al. Electrochemical approach for the development of a simple method for detecting cell apoptosis based on caspase-3 activity[J]. Anal Chem, 2014, 86: 4723-4728. DOI:10.1021/ac403394z |
| [48] |
Xie S, Deng W, Chen J, et al. Andrographolide protects against adverse cardiac remodeling after myocardial infarction through enhancing Nrf2 signaling pathway[J]. Int J Biol Sci, 2020, 16: 12-26. DOI:10.7150/ijbs.37269 |
| [49] |
Wang K, Chen Z, Huang J, et al. Naringenin prevents ischaemic stroke damage via anti-apoptotic and anti-oxidant effects[J]. Clin Exp Pharmacol Physiol, 2017, 44: 862-871. DOI:10.1111/1440-1681.12775 |
| [50] |
Yoo ES, Choo GS, Kim SH, et al. Antitumor and apoptosis-inducing effects of piperine on human melanoma cells[J]. Anticancer Res, 2019, 39: 1883-1892. DOI:10.21873/anticanres.13296 |
| [51] |
Niture SK, Jaiswal AK. Nrf2 protein up-regulates antiapoptotic protein Bcl-2 and prevents cellular apoptosis[J]. J Biol Chem, 2012, 287: 9873-9886. DOI:10.1074/jbc.M111.312694 |
| [52] |
Zhang J, Su L, Ye Q, et al. Discovery of a novel Nrf2 inhibitor that induces apoptosis of human acute myeloid leukemia cells[J]. Oncotarget, 2017, 8: 7625-7636. DOI:10.18632/oncotarget.13825 |
 2021, Vol. 56
2021, Vol. 56


