药对作为中药复方基本组成单元, 以药对作为切入点开展中药复方物质基础研究, 不仅可以大大降低中药复杂体系研究难度, 还可以“化繁为简”有效揭示中药配伍理论科学内涵, 已引起越来越多学者的关注[1]。甘草作为临床最常见的配伍中药, 素有“十方九草”之称, 号称“国老”。因此, 对于甘草药对开展研究, 研究结果对于中药复方研究具有代表性和普遍性价值[2]。例如, 甘草-黄连药对临床使用广泛, 尤其是该药对共煎煮产生大量自沉淀现象, 更为学者所广泛关注[3]。前期有研究表明, 该自沉淀主要由甘草酸、黄连素等小分子化学成分组成[4]。本课题组长期聚焦中药水煎剂自沉淀现象, 已发现在水煎煮过程中, 小分子有效成分相互作用, 在弱键诱导下发生自组装形成超分子体系, 与游离单体成分相比, 生物活性发生显著变化, 以此揭示超分子体系是中药复方物质基础重要组成[5-7]。但目前研究尚未揭示中药大分子物质, 诸如蛋白、多糖等是否参与超分子体系形成的报道, 尤其在制剂过程中经常作为杂质被除掉的蛋白质等大分子, 是否可以通过弱键作用间接影响其他小分子的生物活性?相关问题尚未有效揭示。
研究首次发现黄连-甘草药对共煎后出现的自沉淀中蛋白质含量约为6%, 为深入探究该自沉淀形成原因, 本课题组采用紫外光谱、红外光谱和荧光光谱研究发现在水煎煮过程中甘草蛋白与黄连中异喹啉类生物碱发生相互作用, 利用马尔文粒度仪、扫描电子显微镜研究发现两类成分在疏水作用和静电作用等弱键诱导下形成类球形超分子。进一步通过耐药金葡菌模型评价发现, 两类成分在形成超分子前、后生物活性发生明显变化, 从新的视角揭示甘草-黄连药对配伍的科学内涵。甘草黄连药对是半夏泻心汤、甘草泻心汤等经典名方的重要组成, 该研究结果为当前经典名方二次开发过程中标准汤剂和制剂工艺研究提供参考, 尤其对复方所含有的大分子、小分子药效成分识别和富集提供依据, 真正还原古人经典名方临床使用的“一碗汤剂”[8]。
材料与方法药品与试剂 黄连素(BBR, 成都普瑞法科技有限公司, 纯度 > 98%); 甘草饮片和黄连饮片(北京同仁堂); 茚三酮溶剂和丙酮溶剂(北京化工厂); 双缩脲试剂盒(北京索莱宝科技有限公司)。
实验仪器 Hitachi SU-8020场发射扫描电子显微镜(德国IKA有限公司); 紫外-可见分光光度计、荧光-可见分光光度计、傅里叶变换红外光谱仪(美国Thermo公司); 马尔文粒度仪(英国马尔文仪器有限公司); 酶标仪(芬兰热电科技仪器有限公司)。
黄连-甘草共煎药液制备 称取黄连饮片以及甘草饮片各5.00 g, 装于无纺布煎药袋中, 加入8倍量水冷凝回流提取1 h, 趁热去掉无纺布袋包裹的药渣, 4 000 r·min-1离心30 min, 得到共煎自沉淀和上清溶液, 分别冻干, 备用。
药对共煎自沉淀中可溶性蛋白质提取 精密称取黄连-甘草共煎自沉淀冻干样品5.00 mg置于5 mL离心管中, 加入2 mL去离子水分散, 60 ℃水浴超声提取30 min后, 4 000 r·min-1离心15 min, 吸取上清液; 沉淀用2 mL去离子水复溶, 重复提取、离心, 将两次上清液合并, 即为蛋白质粗提取液。粗提液加入1.5倍体积丙酮沉淀蛋白, -20 ℃放置过夜, 4 000 r·min-1离心30 min, 弃去上清液, 挥干丙酮, 加入500 μL去离子水混悬, 此时的溶液即为共煎自沉淀中可溶性蛋白溶液, 备用。
甘草粗蛋白(glycyrrhiza protein, GP) 溶液制备 称取甘草饮片40 g, 加入8倍量去离子水超声提取30 min, 60 ℃水浴超声提取30 min后, 双层滤布滤去药材残渣, 4 000 r·min-1离心15 min, 吸取上清液。上清液加入1.5倍体积丙酮沉淀蛋白, -20 ℃放置过夜, 4 000 r·min-1离心30 min, 弃去上清液, 挥干丙酮, 得到甘草粗蛋白, 冻干, 备用。精密称取甘草粗蛋白冻干样品25 mg置于50 mL离心管中, 加入25 mL去离子水分散, 此时的溶液为甘草粗蛋白溶液, 备用。
甘草蛋白-黄连素结合体(glycyrrhiza protein-berberine, GP-BBR) 的制备 精密称取黄连素3.72 mg置于50 mL烧杯中, 加入10 mL去离子水充分溶解, 配成1 mmol·L-1黄连素溶液, 取10 mL甘草粗蛋白溶液加入黄连素溶液中, 100 ℃加热60 min, 即可见到絮状沉淀产生, 室温放凉, 4 000 r·min-1离心15 min, 丢弃上清液, 再用去离子水洗涤, 离心和洗涤重复3次, 最后收集沉淀物在真空冷冻干燥机中干燥1~2天, 得到GP-BBR。
甘草蛋白-黄连素机械混合物(glycyrrhiza protein-berberine mechanical mixture, GP-BBR MECH) 的制备 精密称取黄连素3.72 mg置于50 mL烧杯中, 加入10 mL去离子水充分溶解, 配成1 mmol·L-1黄连素溶液, 取10 mL甘草粗蛋白溶液加入黄连素溶液中, 室温下用磁力搅拌器搅拌60 min, 得到甘草蛋白-黄连素机械混合溶液, 用于抑菌实验研究。
蛋白质鉴定反应 取1 mg·mL-1甘草粗蛋白溶液, 滴入适量茚三酮试剂, 水浴加热。
蛋白质含量测定 依据双缩脲试剂盒说明书测定黄连-甘草共煎自沉淀和甘草粗蛋白中可溶性蛋白质的含量。
场发射扫描电子显微镜(FESEM) 观察 用移液枪分别吸取甘草粗蛋白悬浊液及甘草蛋白黄连素结合体悬浊液2 μL滴于硅片上, 室温自然干燥4 h, 将样品进行喷镀黄金处理后放在场发射扫描电子显微镜下, 工作电压8.0 kV, 拍照并观察甘草蛋白单体和甘草蛋白与黄连素反应后的大小和表面形貌差异, 佐证马尔文粒度仪观察到的形态大小。
紫外光谱测定 取盐酸黄连素制成0、0.005、0.010、0.015、0.020和0.025 mg·mL-1标准液, 通过紫外分光光度计在344 nm下测量吸光度值, 制作标准曲线。取黄连素配制成0.01 mol·L-1溶液, 稀释200倍, 通过紫外分光光度计在344 nm下测量吸光度值, 记为A1。另取0.01 mol·L-1黄连素溶液1 mL与1 mg·mL-1甘草粗蛋白溶液1 mL共煎煮60 min后, 取上清液, 定容至2 mL, 稀释100倍, 通过紫外分光光度计在344 nm下测量吸光度值, 记为A2。可通过标准曲线计算出煎煮前黄连素的浓度(C1) 与煎煮后黄连素的浓度(C2), 黄连素与甘草蛋白结合率(W) 按照公式(1) 进行计算。
| $ W \%=\left(C_{1}-C_{2}\right) / C_{1} $ | (1) |
荧光光谱测定 在25、31和37 ℃下, 向甘草粗蛋白溶液中加入不同浓度梯度的黄连素溶液, 配制成最终质量浓度为0.25 mg·mL-1的甘草蛋白黄连素混合液, 混匀后在激发波长370 nm下, 扫描390~600 nm内的发射光谱。
红外光谱测定 精密称取5.00 mg冷冻干燥的盐酸黄连素单体、甘草蛋白单体、甘草蛋白-黄连素结合体样品于离心管中, 与光谱级溴化钾(KBr) 粉末以适当的质量比混合研磨。在27 MPa的压力下压片2 min, 傅里叶变换红外光谱仪的扫描范围为4 000~400 cm-1, 每个样本平均扫描200次, 光谱分辨率为4 cm-1, 空气为背景。红外光谱记录和存储使用光谱软件(OMNIC 8.2)。
最低抑菌浓度测定 从生长的角度探讨了GP-BBR及GP-BBR MECH的抑菌活性, 对耐药金葡菌的最小抑菌浓度(MIC) 的测定, 通过等度微孔稀释法, 采用48孔板, 对GP-BBR及GP-BBR MECH进行抑菌活性研究, 简单来说, GP-BBR及GP-BBR MECH用水稀释后作为样品母液, 将不同体积的样品溶液加入到不同体积培养基中使其总体积为1 mL, 得到浓度依次为0.062 5、0.056 25、0.05、0.043 75、0.037 5、0.031 25和0.025 μmol·mL-1的药物溶液, 每个孔分别加入耐药金葡菌30 μL, 37 ℃培养16 h后, 耐药金葡菌用酶标仪在600 nm处记录悬液的吸光度值(OD)。实验重复3次, 金葡菌的抑制率按照公式(2) 计算。最小抑菌浓度(MIC) 为抑制率 > 80%的最低浓度。
| $ \text { 抑制率 }(\%)=\frac{1-\left(\mathrm{OD}_{\text {样品 }}-\mathrm{OD}_{\text {溶剂 }}\right)}{\mathrm{OD}_{\text {空白菌 }}-\mathrm{OD}_{\text {溶剂 }}} \times 100 \% $ | (2) |
细菌形态观察 取菌悬液置于12孔板中, 加入GP-BBR、GP-BBR MECH和BBR, 使终浓度为0.05 μmol·mL-1, 培养8 h后, 在3 000 r·min-1下离心10 min, 收集细菌。磷酸盐缓冲液(PBS) 清洗3次后, 加入体积分数为2.5%的戊二醛固定4 h, 再用PBS洗涤3次, 采用梯度浓度乙醇(30%、50%、70%、80%、85%、90%、95%、100%) 分别洗脱, 每次脱水10 min, 充分干燥后, 喷金, 在SEM下观察GP-BBR、GP-BBR MECH和BBR干预下的细菌形态学变化。
统计学方法 用IBM SPSS 25.0进行数据统计分析, 方差分析采用ANOVA分析, 运用t检验比较两组数据差异的显著性, P < 0.05表示具有显著性差异。
结果 1 蛋白质的鉴定甘草粗蛋白溶液中滴加茚三酮试剂后水浴加热5 min, 出现紫色, 说明提取物中含有甘草蛋白。
2 蛋白质含量测定黄连-甘草共煎自沉淀中蛋白质含量为6.18%, 甘草粗蛋白提取物中蛋白质含量为69.38%, 说明甘草蛋白粗提物中主要成分为甘草蛋白。
3 结合体的形貌表征100 ℃加热60 min后, 甘草蛋白与黄连素混合煎煮溶液中出现明显沉淀。采用FESEM表征了结合体的微观形貌; 采用动态光散射(DLS) 测量自结合体的尺寸。如图 1所示, 黄连素单体(图 1A) 呈不规则存在的片状晶体, 呈现无规则形态, 混乱凝集成块, 这与黄连素自身晶体性质相符合; 甘草蛋白单体(图 1B) 呈无规则形态, 混乱凝聚成块。黄连素-甘草蛋白结合体(图 1C) 表明微观形态与两个单体区别较大, 呈现清晰的类球状结构, 大小在100~200 nm之间, 呈现大尺度自组装行为。GP-BBR NPs在水溶液中表现出明显的Tyndall光散射效应(图 1D), GP-BBR NPs的zeta电位为-11.1 mV (图 1E), 平均粒径为185.5 nm左右, 多分散性指数为0.285 (图 1F)。FESEM和DLS的结果在大小上基本一致。
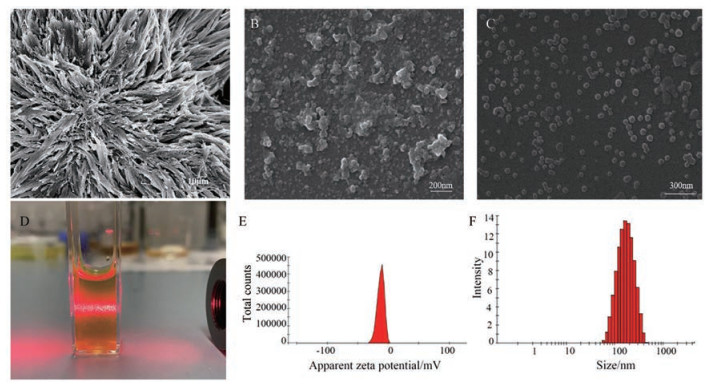
|
Figure 1 Macroscopic and microscopic morphology of monomer and combination. A: Scanning electron microscope (SEM) images of berberine (BBR); B: SEM images of glycyrrhiza protein (GP NPs); C: SEM images of glycyrrhiza protein-berberine (GP-BBR NPs); D: Tyndall effect images of GP-BBR NPs; E: Zeta potential of GP-BBR NPs; F: Size distribution of GP-BBR NPs with polydispersity index (PDI, 0.285) |
甘草蛋白的紫外吸收光谱如图 2A所示, 在200 nm处的吸收峰为肽键吸收峰[9], 有文献[10]报道甘草中存在N端测序为NPDGLIACYCGQYCW的蛋白, 其中包含酪氨酸与色氨酸。酪氨酸与色氨酸在260~280 nm内会出现紫外吸收峰[11]。据此推测本实验发生紫外吸收的氨基酸可能为酪氨酸或色氨酸。

|
Figure 2 Properties of ultraviolet spectrum. A: Ultraviolet and visible spectrophotometry (UV-vis) of GP; B: UV-vis of BBR, GP-BBR, and GP |
黄连素与甘草蛋白煎煮前后的紫外吸收光谱如图 2B所示, 黄连素与甘草蛋白煎煮过后, 黄连素的吸光度明显降低, 说明黄连素与甘草蛋白发生了结合。应用紫外分光光度法对不同浓度黄连素标准品测定后所得的标准曲线, 并据此计算得到的黄连素标准曲线回归方程为y = 53.091x + 0.001 2 (R2 = 0.999 6), 结合率为51.01%。
5 甘草蛋白与黄连素相互作用的红外光谱研究通过分析GP-BBR与其对应单体的特征化学官能团的红外变化发现(图 3): GP红外图谱在1 634 cm-1吸收峰, 归属为C=O的伸缩振动强吸收峰; 1 537 cm-1吸收峰, 归属为酰胺的伸缩振动强吸收峰。BBR红外图谱在1 504 cm-1处有一个尖而强的吸收峰, 归属于芳环骨架振动强吸收峰; 1 103 cm-1归属于异喹啉环中C-N伸缩振动吸收峰; 1 034 cm-1归属于脂肪醚中C-O伸缩振动吸收峰。GP-BBR红外图谱1 602 cm-1归属GP中C=O的伸缩振动强吸收峰, 在1 503、1 103和1 035 cm-1处有吸收峰, 分别归属于BBR中芳环骨架振动吸收峰、异喹啉环中C-N伸缩振动吸收峰和脂肪醚中C-O伸缩振动吸收峰。
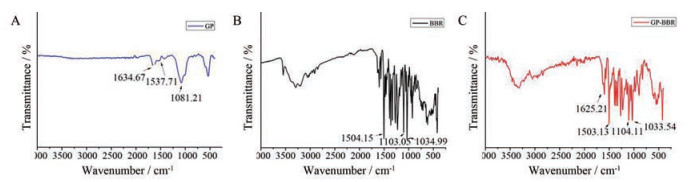
|
Figure 3 Properties of infrared spectrum. A: Fourier-transform infrared spectroscopy (FT-IR) of GP; B: FT-IR of BBR; C: FT-IR of GP-BBR |
甘草蛋白与黄连素组装后, 羰基吸收峰大幅度向低波数偏移, 黄连素中C-N振动吸收峰和脂肪醚中C-O伸缩振动吸收峰基本没有太大变化, 说明酰胺基团是参与组装的关键官能团, 这可能是由于酰胺和季铵离子之间的静电相互作用导致的。
6 荧光光谱结果 6.1 荧光淬灭机制黄连素引起甘草蛋白荧光淬灭的原因可能有动态淬灭和静态淬灭两种形式。静态淬灭是指淬灭剂分子与荧光物质分子之间形成了新的复合物, 淬灭常数随温度的升高而减小; 而动态淬灭是淬灭剂分子与荧光分子的激发态分子之间的相互碰撞而导致的荧光淬灭, 淬灭常数随温度的升高而增大[12], 遵循Stem-Volmer方程式(3):
| $ F_{0} / F=1+\mathrm{K}_{\mathrm{SV}} \cdot[\mathrm{D}]=1+\mathrm{Kq} \cdot \tau_{0} \cdot[\mathrm{D}] $ | (3) |
式中, F0和F表示不存在和存在淬灭剂时荧光物质的荧光强度, [D]为淬灭剂的浓度, Ksv为动态淬灭常数(又称为Stern-Volmer淬灭常数), τ0是内源生物大分子的荧光寿命, 对于生物大分子τ0 = 10-8 s。Kq (Kq = Ksv/τ0) 是双分子淬灭常数, 表示相互作用时分子之间的热运动程度与蛋白质等生物大分子的荧光寿命的关系。
由图 4与表 1表明, 随着BBR浓度的增加, GP荧光强度逐渐降低并且吸收峰位逐渐发生红移。由图 5表明, 淬灭常数随着温度的升高而降低, 且3个不同温度下的Kq均远大于各类淬灭剂对生物大分子最大扩散常数2.0×1010 L·mol-1s-1。因此, 可以推断BBR对GP的淬灭并非动态淬灭, 而是静态淬灭。作者猜测BBR与GP结合可能是BBR分子的苯环端插入GP分子中的疏水空腔内部, 与GP中可以发射荧光的氨基酸发生π电子堆积, 使GP中可以发射荧光的氨基酸苯环上的π*轨道与BBR苯环上的π电子轨道发生偶合, 而偶合后的π*轨道因部分填充电子, 使π→π*跃迁几率减小, 从而使得荧光产生荧光淬灭效应[13], 而荧光光谱的吸收峰位红移[14]说明肽链周围的微环境亲水性增加, 可能是因为BBR插入GP分子内部后, 肽链变得伸展所致。

|
Figure 4 Fluorescence quenching spectra of GP in the presence of different concentrations of BBR. λex = 370 nm, T = 298 K. BBR concentrations from 0 to 8 (1.0×10-6, 2.0×10-6, 3.0×10-6, 4.0×10-6, 5.0×10-6, 6.0×10-6, 7.0×10-6, 8.0×10-6 mol·L-1, respectively) |
| Table 1 Stern-Volmer quenching constants for the interaction of GP with BBR at different temperatures (T). KSV: Dynamic quenching constant; Kq: Dynamic quenching rate constant |
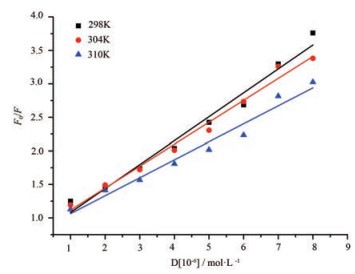
|
Figure 5 Stern-Volmer plots for the fluorescence quenching spectra of GP by BBR at different temperatures |
生物大分子蛋白有多个结合位点且相互独立时, 求结合位点可用方程式(4)[15]计算:
| $ \log \left(F_{0}-F\right) / F=\log K \mathrm{a}+n \log [\mathrm{Q}] $ | (4) |
式中, Ka为表观结合常数; n为结合位点数; [Q] 为游离小分子的浓度, 但对于一个反应体系, 想要得到确切的小分子游离浓度很困难, 故常以小分子淬灭剂的总浓度来代替, n和Ka可由方程的斜率和截距分别得到。由图 6及表 2可见, 3个不同温度下GP与BBR作用的平均结合常数较大, 其Ka值达到了106数量级, 且二者n为1左右。有文献[16]报道GP等电点为4.5, 本实验GP-BBR的pH值为6.8, 大于GP等电点, 因此GP中发射荧光的基团可能与BBR中的季铵离子通过偶极-偶极相互作用结合, 使得BBR与GP之间发生无辐射的能量转移而淬灭GP荧光。

|
Figure 6 Logarithmic curve of fluorescence quenching of GP by BBR |
| Table 2 Binding constants and binding sites of the interaction between BBR and GP. Ka: Binding constant; n: Number of binding sites |
小分子药物与蛋白质大分子以非共价键结合的作用力主要有范德华力、氢键、静电作用及疏水作用等。根据Ross等[17]研究, 熵变(ΔS) > 0是疏水作用的重要特征, 当ΔS > 0时, 主要作用力为疏水作用力, 属熵驱动过程; 当焓变(ΔH) < 0, ΔS < 0时, 主要作用力为氢键和范德华力; 当ΔH < 0, ΔS > 0时, 主要作用力为疏水作用力和静电引力; 当ΔH > 0, ΔS > 0时, 主要作用为疏水作用力。由范特霍夫方程式(5) 可得到热力学参数(ΔS、ΔH及自由能变ΔG)。
| $ \begin{aligned} &\ln K \mathrm{a}=-\Delta H / \mathrm{R} T+\Delta S / \mathrm{R} \\ &\Delta G=\Delta H-T \Delta S \end{aligned} $ | (5) |
R为理想气体常数, 约等于8.314 J·mol-1·K-1; T为开氏温度。
由表 3可知, 当GP和BBR作用时, ΔG < 0表明该过程为自发过程, ΔH > 0表明该过程为吸热过程, 而ΔS的数值(357.60 J·mol-1·K-1), 表明此反应为熵主导的自发吸热反应, GP和BBR之间的结合力主要为疏水作用力。BBR插入到GP疏水空腔内部可以释放原本有序排列的水分子, 因此存在熵增效应。这与上述BBR的异喹啉环能与GP中的荧光基团发生π-π堆积作用致使荧光淬灭现象的发生相吻合。
| Table 3 Relative thermodynamic parameters of the GP-BBR |
选取耐药金葡菌对GP、GP-BBR、BBR和GP-BBR MECH进行MIC值的测定, 发现GP在所选浓度下不表现抑菌活性, GP-BBR发挥抑菌活性的主体为BBR, 其中GP-BBR、BBR和GP-BBR MECH对耐药金葡菌的MIC值分别为0.043 75、0.05和0.05 μmol·mL-1。如图 7所示, 与BBR相比, GP-BBR对耐药金葡菌的抑菌效果较好; GP-BBR相比GP-BBR MECH, 对耐药金葡菌也有较好的抑菌效果。值得注意的是, GP与BBR加热产生的GP-BBR结合体活性优于GP与BBR直接混合的GP-BBR MECH, 表明黄连素抑菌活性的增强有可能与加热过程中的某些反应有关, 侧面揭示了药对在水煎煮过程中蛋白质等大分子也有可能与某些小分子发生相互作用进而影响活性。
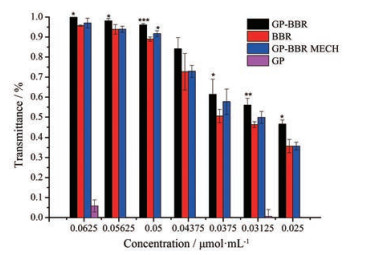
|
Figure 7 Inhibition ratio of GP-BBR NPs, BBR, GP-BBR MECH (mechanical mixing of GP and BBR), and GP. n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs BBR group |
进一步选取0.05 μmol·mL-1浓度下的GP-BBR、BBR和GP-BBR MECH对耐药金葡菌进行平板计数实验。在0.05 μmol·mL-1浓度下的抑菌效果如图 8所示, 3个组分在0.05 μmol·mL-1浓度下, 体现出不同的抗菌作用, 其中GP-BBR未生长出清晰的菌落, 而GP-BBR MECH生长出68个菌落, BBR有个别金葡菌菌落连在了一起, 呈条带状, 生长的菌落有176个。GP-BBR NPs、BBR和GP-BBR MECH与空白对照组相比, 菌落数均减小, 相比较而言, 进一步证实了GP-BBR NPs组的抑菌效果最好。

|
Figure 8 Photographs of agar plates were treated by all samples at 0.05 μmol·mL-1, respectively. A: GP-BBR NPs group; B: BBR group; C: GP-BBR MECH group; D: Control group |
为了进一步破译GP-BBR NPs组的抗菌机制, 观察了其对金葡菌形态学的影响, 研究细菌形态和纳米结构与细菌之间的相互作用。如图 9所示, 正常金葡菌结构完整、表面光滑呈规则的椭球形。BBR干预后的细菌的形状变得不规则, 与正常细菌相比, 塌陷和破裂不明显, 膜结构完整表面略显褶皱, 但仍维持规则的椭球型, 对细菌的破坏性较弱。GP-BBR MECH对细菌的破坏性加强, 与金葡菌共孵育8 h后, 其表面开始皱缩、凹陷, 细菌形态被破坏。相比之下, GP-BBR干预后的金葡菌细胞破坏程度最明显, 边缘呈现严重皱缩的变化, 不再呈标准球形。由此推测GP-BBR NPs可能通过与细菌相互作用后附着在细菌表面, 对其结构完整性造成破坏, 纳米粒持续释放BBR, 使细菌周围BBR浓度升高, 摄取量增大, 最终造成比较强的抗菌效果[18]。有研究表明金葡菌细胞壁含有磷壁酸聚合物, 由交替的磷酸盐和核糖醇或由含D-丙氨酸和N-乙酰氨基葡萄糖残基的甘油基团组成, 带负电荷的磷酸基和带正电荷的D-丙氨酸酯的比例对金葡菌在固体表面的吸附起着关键作用[19]。由于这种双极性的性质, 金葡菌的单个细胞可以与具有疏水表面和带有轻微负电荷的亲水表面物质相互作用并附着[20]。GP-BBR的zeta电位为-11.1 mV, 表面带负电荷, 推测GP表面的氨基酸残基增强了BBR与金葡菌的吸附作用, 也是其增强BBR抑菌活性的原因之一。
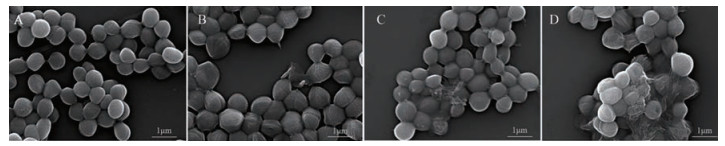
|
Figure 9 FESEM images of bacterial morphology. A: Control group; B: BBR group; C: GP-BBR MECH group; D: GP-BBR NPs group |
利用紫外可见光谱初步判断甘草粗蛋白和黄连素发生相互作用, 结合红外光谱与荧光光谱技术表征了两者间结合的作用力, 发现甘草粗蛋白和黄连素共煎煮时形成静电力和疏水作用力等弱键作用。通过比较甘草粗蛋白黄连素超分子、二者机械混合物及黄连素单体对耐药金葡菌的抑菌活性, 发现本不具有抑菌活性的甘草蛋白与黄连素结合后增强了黄连素的抑菌活性, 同时在不加热条件下的甘草粗蛋白黄连素机械混合物也进行了抑菌活性实验, 发现机械混合物的活性虽强于黄连素单体, 但与加热条件下的结合体存在差别。抑菌活性的实验结果从侧面说明黄连素和甘草粗蛋白在加热过程中发生相互作用且加热过程使二者结合更加彻底, 结合作用力更强, 促进了药效成分发挥作用, 进一步提示了中药共煎煮过程是一个复杂的过程, 在此过程中不仅存在小分子间的弱键作用, 同时也存在小分子与蛋白质等大分子的弱键作用, 且形成超分子过程受温度影响, 影响分子间作用力进而影响活性, 本研究结果表明蛋白等大分子物质可作为载体而间接影响药效。
综合利用光谱等分析技术对中药中蛋白质大分子与小分子的弱键相互作用进行表征是一次全新的尝试, 为探究中药复方有效成分提供了新的视角, 进一步揭示药对配伍的科学内涵。若想真正还原经典名方临床使用的“一碗汤剂”, 在经典名方二次开发, 尤其在标准汤剂研究过程中, 不能忽视蛋白质等大分子通过与小分子间弱键相互作用, 作为中药药效物质基础而发挥作用。
作者贡献: 李文与王志家共同完成实验内容及论文撰写工作; 刘小靖、韩娜娜和李桐辅助完成部分实验内容; 雷海民指导实验和平台支撑; 王鹏龙设计方案并指导论文的撰写和修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Tang YP, Shang EX, Chen YY, et al. Modern research approaches and strategies for compatibility effects and efficacy components of herbal pairs[J]. Acta Pharm Sin (药学学报), 2019, 54: 1564-1573. |
| [2] |
Lin X. Based on the "Sweet Flavor Having the Effect of Relaxing" Theory to Explore the Compatibility Law of Glycyrrhiza uralensis to Reduce Toxicity and Increase Efficiency (基于"甘能缓"理论探讨甘草减毒增效的配伍规律) [D]. Fuzhou: Fujian University of Traditional Chinese Medicine, 2020.
|
| [3] |
Tian XH, Zhang H, Li T, et al. New strategy on scientific connotation of Chinese materia medica compatibility enlightened by precipitation from Chinese materia medica formula decoction[J]. Chin Tradit Herb Drug (中草药), 2017, 48: 4778-4783. |
| [4] |
Zhao J. Study on Chemical Constituents of Glycyrrhiza-Coptis Coptidis, Schizonepeta-Cinnamomum Rhizome and Ginger-Cinnamomum rhizome (药对甘草-黄连、荆芥-桂枝和生姜-桂枝化学成分研究) [D]. Changsha: Central South University, 2008.
|
| [5] |
Li T, Wang PL, Guo WB, et al. Natural berberine-based Chinese herb medicine assembled nanostructures with modified antibacterial application[J]. ACS Nano, 2019, 13: 6770-6781. DOI:10.1021/acsnano.9b01346 |
| [6] |
Huang XM, Wang PL, Li T, et al. Self-assemblies based on traditional medicine berberine and cinnamic acid for adhesion-induced inhibition multidrug-resistant Staphylococcus aureus[J]. ACS Appl Mater Interfaces, 2020, 12: 227-237. DOI:10.1021/acsami.9b17722 |
| [7] |
Cui HR, Li L, Guo WB, et al. Construction and application of new drugs discovery mode of Chinese medicine based on the theory of "compatibility-combination "[J]. World Chin Med (世界中医药), 2020, 15: 2813-2818. |
| [8] |
Liu Y, Zhang J, Chen SL, et al. Research and development strategy of classical formula compound preparation[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2019, 25: 166-172. |
| [9] |
Becklin RR, Desiderio DM. The amount of ultraviolet absor-bance in a synthetic peptide is directly proportional to its number of peptide bonds[J]. Anal Lett, 1995, 28: 2175-2190. DOI:10.1080/00032719508000037 |
| [10] |
Zhou JW, Zhang J, Gao GZ, et al. Boiling licorice produces selfassembled protein nanoparticles: a novel source of bioactive nanomaterials[J]. J Agric Food Chem, 2019, 67: 9354-9361. DOI:10.1021/acs.jafc.9b03208 |
| [11] |
Liu YG, Xu JJ, Li H, et al. Theoretical research on excited states: ultraviolet and fluorescence spectra of aromatic amino acids[J]. Interdiscip Sci, 2020, 12: 530-536. DOI:10.1007/s12539-020-00395-3 |
| [12] |
Zhu J, Tong SY. A study on the reaction between fluoresce in and protein[J]. Chem J Chin Univ (高等学校化学学报), 1996, 17: 539-542. |
| [13] |
Zhong M. Separation, Purification and Bioactivities of Principal Alkaloids from Macleaya cordata (Wind) R. Br. (博落回主要生物碱的分离、纯化及生物活性研究) [D]. Changsha: Central South University, 2011.
|
| [14] |
Rahul C, Susan B, Sangram, et al. Effect of quencher, denaturants, temperature and pH on the fluorescent properties of BSA protected gold nanoclusters[J]. J Lumin, 2015, 168: 62-68. DOI:10.1016/j.jlumin.2015.07.030 |
| [15] |
Feng XZ, Jin XR, Qu Y, et al. Studies on the ions' effect on the binding interaction between HP and BSA[J]. Chem J Chin Univ (高等学校化学学报), 1996, 17: 866-869. |
| [16] |
He XY. Study on the Self-assembly Behavior of Protein Derived from Licorice (甘草蛋白自组装行为研究) [D]. Fuzhou: Fuzhou University, 2013.
|
| [17] |
Ross PD, Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20: 3096-3102. DOI:10.1021/bi00514a017 |
| [18] |
Tian XH, Wang PL, Li T, et al. Self-assembled natural phytochemicals for synergistically antibacterial application from the enlightenment of traditional Chinese medicine combination[J]. Acta Pharm Sin B, 2020, 10: 1784-1795. DOI:10.1016/j.apsb.2019.12.014 |
| [19] |
Gross M, Cramton SE, Götz F, et al. Key role of teichoic acid net charge in Staphylococcus aureus colonization of artificial surfaces[J]. Infect Immun, 2001, 69: 3423-3426. DOI:10.1128/IAI.69.5.3423-3426.2001 |
| [20] |
Helka J, Terhi O, Anni M, et al. Protein and bacterial interactions with nanostructured polymer coatings[J]. Colloids Surf B, 2015, 136: 527-535. DOI:10.1016/j.colsurfb.2015.09.061 |
 2021, Vol. 56
2021, Vol. 56


