2. 南京中医药大学附属南京医院临床科研中心, 江苏 南京 210003;
3. 江苏康缘药业股份有限公司, 江苏 连云港 222001;
4. 中药制药过程新技术国家重点实验室, 江苏 连云港 222001
2. Clinical Research Center, Nanjing Hospital affiliated to Nanjing University of Chinese Medicine, Nanjing 210003, China;
3. Jangsu Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China;
4. State Key Laboratory of New-tech for Chinese Medicine Pharmaceutical Process, Lianyungang 222001, China
麻杏石甘汤出自汉代张仲景的《伤寒论》, 用于治疗外感邪热壅肺证。现代医学证据显示该方在治疗呼吸道感染性疾病及相关发热症方面有很好的疗效[1]。目前对其药效物质的研究大多集中在单体化学成分, 对成分间的互作关系和存在形式较少涉及, 这很难体现和揭示方药的配伍要义和协同起效内涵[2]。
“结构中药学”理论认为, 中药药效物质包含化学和物理双重属性, 中药起效除了与其所含化学成分有关, 还与成分的存在形式和物相状态有关, 后者即中药起效的物理基础[3]。近年来, 已有大量证据显示化学分子的互作及其形成的特定物理结构对中药疗效的发挥起关键作用[4, 5]。如黄连解毒汤中的化学成分小檗碱与黄芩苷形成球形纳米粒使抗菌活性明显增强, 而与同系物汉黄芩苷相互作用则形成纳米纤维结构使活性减弱[6]。相似地, 小檗碱与肉桂酸相互作用可形成蝶形纳米结构, 能抑制耐药金葡菌, 但单用二者则无此效果[7]。这些现象均显示中药的药效不仅仅与其成分有关。这不禁让学者重新思考使用有机溶剂法提取中药成分的合理性。该法基于极性原理虽能获得较纯的化学成分, 但可能会破坏中药的“活性物理结构”, 这可能是导致中药“越纯化越无效”以及单体成分普遍存在生物利用度问题的重要原因。
为尽可能完整地保留中药“活性物理结构”, 李永吉课题组[8]采用差速离心和透析法分离白虎汤, 并由此得到与全方解热作用相当的活性纳米相态。用类似方法将生脉饮按分散状态分成混悬相态、胶体相态和真溶液, 并分别作用于心衰大鼠, 显示只有胶体相和全汤有疗效[9]。上述研究表明中药汤剂中存在与药效关联的特定相态, 采用无损分离法能够较好地保留这种活性相态。而对中药汤剂自沉淀现象的研究已经证实中药各单体组分的互作是构成不同相态的化学基础[6, 10]。尽管中药汤剂活性相态的现象已被发现, 其组装机制也取得一定进展, 但目前仍不能明确揭示特定聚集相态优于单体的活性究竟是来源于不同成分的药效协同还是特定物理结构的贡献, 对此还需要提供更为直接可靠的证据。
本课题组多年来一直关注和从事天然分子的互作研究, 探明了多酚与多肽类成分互作的主要作用力为疏水相互作用, 研究了不同分子聚集形式对药效活性的影响[11-13]。本研究以经典方剂麻杏石甘汤为对象, 采用离心法无损分离获得不同相态, 对其组成和形貌进行表征, 评价了不同相态的抗菌活性, 并采用化学干扰剂研究了活性相态内的作用力类型, 探究了相态结构与抗菌活性间的关联性, 为麻杏石甘汤及其他中药复方活性形态的研究提供新思路和参考。
材料与方法药材与试剂 麻黄(产地: 甘肃, 批号190720)、苦杏仁(产地: 河北, 批号181031)、炙甘草(产地: 内蒙古, 批号180803)、石膏(产地: 湖南, 批号180501) 均购自南通三越中药饮片有限公司, 经南京中医药大学胡杨老师鉴定为相应药材; 乙腈和甲醇(HPLC级, Thermo Fisher公司); 磷酸(色谱级, 上海沪试化工有限公司); 麻黄碱对照品(纯度≥98%, 南京中医药大学资产处提供); 苦杏仁苷对照品、甘草酸对照品(纯度≥98%)、尿素(urea)、氯化钠(NaCl) (上海源叶生物科技有限公司); Tween 20 (Sangon Biotech公司)。
菌株、线虫及培养基 金葡菌(S. aureus, ATCC29213)、铜绿假单胞杆菌(P. aeruginosa, ATCC27853)、鲍曼不动杆菌(A. baumannii, ATCC19606)、大肠杆菌(E.coli, ATCC25922), 由附属南京医院临床科研中心提供; 大肠杆菌OP50、N2野生型秀丽隐杆线虫、线虫生长培养基(nematode growth medium, NGM) (秀丽隐杆线虫遗传中心); 胰蛋白胨(OXOID公司); 酵母抽提物(BBI Life Sciences公司); 琼脂(Sangon Biotech公司)。
仪器 Milli-Q超纯水仪(Thermo Scientific公司); U3000高效液相色谱仪(HPLC)、Fresco 21冷冻高速离心机(Thermo Fisher公司); Nanosight NS300纳米颗粒跟踪分析仪(NTA, 英国Malvern公司); 自动煎药壶(佛山小熊电器股份有限公司); 22331 Hamburg紫外微量分光光度计(Eppendorf公司); Synergy H1酶标仪(BioTek公司); JEM 200PLUS透射电镜(TEM, JEOL公司)。
麻杏石甘汤水煎液的制备 称取麻黄9 g和石膏18 g, 倒入煎煮锅并加入超纯水336 mL (8倍量), 室温浸泡30 min, 武火煮沸后文火煎煮30 min; 再加杏仁9 g和炙甘草6 g, 继续煎煮40 min, 并分别于共煎0、10、20和40 min时取溶液2 mL, 用NTA测定样品粒径和浓度。煎毕, 过4层纱布得粗滤液F。
麻杏石甘汤的相态分离 调整不同离心力以筛选并获得粒径区分度最佳的分离条件, 确定离心力和时间。取粗滤液F, 于5 000 ×g离心10 min, 所得沉淀记作P-5000; 上清液进一步于13 500 ×g离心10 min, 沉淀记作P-13500, 上清液记作S-13500。
有机和无机成分的含量测定 称取对照品盐酸麻黄碱0.40 mg、苦杏仁苷0.28 mg和甘草酸0.48 mg, 溶于1 mL溶剂(1.44%磷酸∶甲醇=1∶4) 中制备成混合对照品溶液[14]。P-5000和P-13500加入上述溶剂超声溶解得供试品溶液。HPLC测定药物含量(外标法), 条件如下: 色谱柱: Acclaim 120 C18 (5 μm, 250 mm×4.6 mm); 以乙腈为流动相A, 0.1%磷酸溶液为流动相B, 于207 nm波长处检测盐酸麻黄碱和苦杏仁苷, 于237 nm处检测甘草酸; 柱温: 30 ℃; 流速: 1 mL·min-1。梯度洗脱程序: 0~15 min, 5% A; 15~20 min, 5%~6% A; 20~27 min, 6% A; 27~33 min, 6%~8% A; 33~43 min, 8%~30% A; 43~46 min, 35% A; 46~59 min, 35%~51% A; 59~61 min, 51%~70% A; 61~65 min, 70% A; 65~70 min, 70%~5% A。样品的无机成分送南京大学分析测试中心检测。
体外抗菌活性评价 取等体积两份粗滤液F, 一份经分离获得P-5000、S-13500和P-13500, 另一份作对照。用纯水校准体积后制备成含药固体培养基(含10 g·L-1氯化钠、10 g·L-1胰蛋白胨、5 g·L-1酵母抽提物和25 g·L-1琼脂), 灭菌后倒平板备用。分别取金葡菌、铜绿假单胞杆菌、鲍曼不动杆菌和大肠杆菌菌液涂布于各含药培养基, 对照组为涂布等体积相应菌液的1×LB固体培养基平板。将各组置于37 ℃恒温培养箱中培养过夜, 次日观察结果并拍照。
化学干扰剂对粒径和形貌的影响 前期已测试不同浓度化学干扰剂对结构及药效的影响, 以下实验中选用浓度1.5 mmol·L-1既能明显改变样品粒子粒径, 又对细菌生长及线虫生存无明显抑制作用。取S-13500样品4份, 分别加入等体积纯化水以及1.5 mmol·L-1的Tween 20、NaCl和尿素溶液, 37 ℃孵育1 h。用NTA测定样品粒径, TEM观察形貌。
化学干扰剂对体外抗菌活性的影响 将128 mg·mL-1的S-13500溶液分别与纯水、1.5 mmol·L-1 Tween 20、NaCl和尿素溶液等体积混合, 37 ℃孵育1 h。加入金葡菌菌液2 mL, 置于37 ℃摇床中震荡培养过夜、取样滴板培养后观察。纯水、空白干扰剂和菌液作对照。
线虫抗菌活性评价 将若干条同期化的L4期线虫挑至长有金葡菌菌苔的平板上, 感染8 h, 建立感染模型; 然后分别挑20条线虫于含有50 μL的S-13500 (64 mg·mL-1)、S-13500 + 1.5 mmol·L-1 Tween 20溶液、S-13500 + 1.5 mmol·L-1 NaCl溶液和S-13500 + 1.5 mmol·L-1尿素溶液且长有大肠杆菌OP50菌苔的NGM平板进行治疗, 以0.5%青链霉素组为阳性对照, 模型组为仅长有大肠杆菌OP50菌苔的NGM平板(大肠杆菌OP50为线虫食物), 以未感染线虫为对照。每组设置3个平板作为平行, 各平板中加有抑制线虫繁殖的5-FUdR。每12 h观察并记录各板中存活的线虫数目, 线虫变成直线型、无移动或用铂金丝轻触无反应判为死亡。前期实验已测试证明本实验条件下S-13500及加化学干扰剂后各组样品对线虫生存无明显影响。
统计学分析 实验数据采用平均值±标准差表示, 以GraphPad Prism 8软件进行统计学分析, 组间比较采用单因素方差分析, P < 0.05表示差异有统计学意义。
结果 1 麻杏石甘汤中颗粒粒径随煎煮时间的变化中药复方煎煮过程中化学物质随时间不断溶出和相互作用, 最终达到热力学平衡状态, 期间会伴随溶液性质和粒子尺度的变化[15]。传统的动态光散射仪受大颗粒影响较大, 不适宜多分散体系的粒度监测, 易出现较大偏差[16]。本文采用NTA技术对单颗粒进行示踪计数, 将反映中药煎液的真实分散状态。由图 1可知, 麻杏石甘汤共煎10 min时, 汤液中的颗粒粒径在120~680 nm宽幅区域呈多点分布; 共煎20 min后, 粒径分布范围变窄但仍呈现多分散性; 共煎至40 min时, 粒径分布明显减小并集中于170 nm附近, 继续延长煎煮时间, 粒度分布不再明显变化, 表明体系达到平衡状态。目前关于中药最适煎煮时长并无定论, 一般以有效成分最大溶出时为煎煮终点。由于中药成分复杂, 不同成分的溶出规律差别较大, 这给煎煮终点的判定带来难度。本实验显示, 煎煮过程中颗粒的混杂度呈现下降趋势, 粒度分布变窄并最终稳定, 这为指示煎煮适宜时长提供了新的非成分依赖的判据。
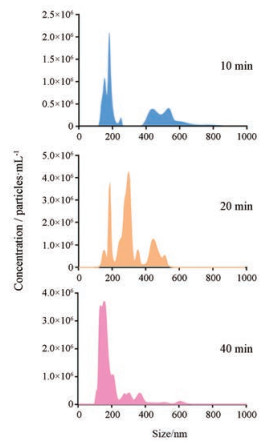
|
Figure 1 Size distribution (NTA) of decoction during boiling |
本文分别选择抗菌代表性量丰成分麻黄碱、苦杏仁苷和甘草酸[17, 18], 采用HPLC对各相态组成进行定量。由图 2可知, S-13500含有麻黄碱、苦杏仁苷和甘草酸的浓度分别为245.6 ± 3.55、647.7 ± 6.86和245.2 ± 2.17 μg·mL-1, 与粗滤液F的谱图特征基本一致; 而P-5000和P-13500几乎不含上述3种成分, 表明有机成分在汤液中并非均匀分布, 而是伴随特定相态的形成而重新分布。
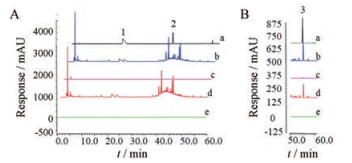
|
Figure 2 Organic composition analysis of different phase states by HPLC with double-wavelength detection. A: 207 nm; B: 237 nm. a: Standard solution; b: Crude aqueous filtrate (F); c: Precipitate isolated by 5 000 ×g centrifugation (P-5000); d: Supernatant isolated by 13 500 ×g centrifugation (S-13500); e: Precipitate isolated by 13 500 ×g centrifugation (P-13500). 1: Ephedrine hydrochloride; 2: Amygdalin; 3: Glycyrrhizic acid |
用电感耦合等离子体质谱(ICP-MS) 分析各相态中的无机元素含量, 结果如图 3。麻杏石甘汤及各相态中主要含Ca、K、Mg、Fe、Na、Zn和Cu等金属元素, 这也是各药味中常见的元素[19]。其中Ca是几乎所有样品中含量最多的元素(S-13500除外), 其次是K、Mg和Na, 但各相态中元素的占比和丰度顺序均不同(表 1), 提示各无机元素在汤液中也进行了重新分配, 可能存在不同的状态和形式。有研究报道甘草酸、麻黄碱可与石膏中的Ca2+、Fe2+、Zn2+等形成不同稳定程度的络合物[20]。
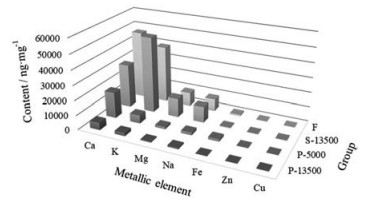
|
Figure 3 Metallic element content of different phase states |
| Table 1 Normalized abundance of metallic element of different phase states. n = 3, x±s |
采用不同菌种考察各相态的体外抗菌活性。如图 4所示, 粗滤液F和S-13500对4种菌种均有良好的抑制效果, S-13500组完全无细菌生长; P-5000对金葡菌和鲍曼式不动杆菌的抑制作用较明显, 但对铜绿假单胞杆菌和大肠杆菌的抑制效果差; P-13500对4种菌均无抑制作用。结果表明, 麻杏石甘汤不同相态的抗菌活性差异很大。现有研究认为, 麻杏石甘汤中的麻黄碱、苦杏仁苷和甘草酸等小分子化合物是其活性药效物质[17, 18, 21], 而前述实验已表明这些成分主要分布于S-13500中, 故S-13500的抗菌活性与其有机成分的含量存在关联性。但P-5000的抗菌效果与几种有机成分无明显关联, 可能存在其他机制。
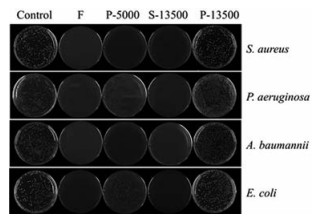
|
Figure 4 Components of Ma-Xing-Shi-Gan Decoction against four different bacteria |
中药汤液各相态是由不同化学成分通过弱键作用形成的, 这些弱键主要包括疏水相互作用、离子键和氢键等[22, 23]。选择Tween 20、NaCl和尿素分别作为上述对应3种弱键的干扰剂来破坏对应的相互作用力, 处理S-13500后测定粒径变化[24]。如图 5A所示, 加入Tween 20后样品由澄明溶液变成乳状液, 而NaCl和尿素处理后无明显变化。NTA测得粒径结果显示, 加入Tween 20后粒径较S-13500组减小了23.4%, 加入尿素后粒径增大了77.3%, 而NaCl处理组粒径基本不变(图 5B)。透射电镜亦观察到类似结果(图 5C), S-13500为粒径150 nm左右的球形粒子, 表面粗糙; 加入Tween 20后, 粒子粒径变小, 约130 nm, 且表面光滑、边缘清晰; 加入尿素后, 颗粒呈现非球形聚集体, 粒径明显增加至300 nm以上; 加入NaCl后, 粒径变化不明显, 表面粗糙度有一定改变。上述结果初步判断S-13500中分子互作的主要形式为疏水相互作用和氢键作用。
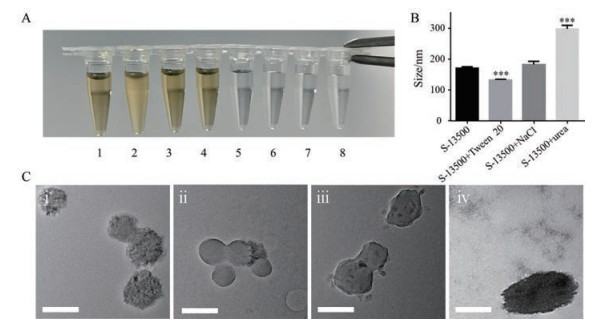
|
Figure 5 The appearance, size determined by NTA, and morphology by TEM of S-13500 after adding chemical interfering agents, Tween 20, NaCl, and urea. A: Optical images of each sample. 1: S-13500 + ultrapure water; 2: S-13500 + Tween 20; 3: S-13500 + NaCl; 4: S-13500 + urea; 5: Ultrapure water; 6: Tween 20; 7: NaCl; 8: Urea; B: Size changes of each group after different treatments. n = 3, x±s. ***P < 0.001 vs S-13500 group; C: The morphology of nanoparticles determined by TEM. i: S-13500; ii: S-13500+Tween 20; iii: S-13500 + NaCl; iv: S-13500 + urea. The scale bars were 200 nm |
考察S-13500的抗菌活性是否与其物理结构有关。如图 6A所示, 64 mg·mL-1 S-13500可以完全抑制细菌生长, 但加入干扰剂Tween 20、NaCl和尿素后抗菌活性明显下降, 表明干扰剂对S-13500的抗菌活性有显著影响。图 5表明NaCl的加入并未引起S-13500粒径的改变, 但抗菌活性的降低提示可能存在其他关联因素, 值得深入研究。进一步将秀丽隐杆线虫作为模型考察S-13500的抗菌效果[25]。如图 6B所示, 被金葡菌感染的线虫若不予治疗, 则会在108 h内全部死亡。而不同药物干预组均能不同程度地延长线虫的存活时间。其中, S-13500在受试组中治疗效果最佳, 加入干扰剂后治疗效果均有不同程度下降, 特别是Tween 20处理组的治疗效果下降最明显。

|
Figure 6 The in vitro and in vivo antimicrobial assay. A: The antimicrobial activity of S-13500, and interfered by Tween 20, NaCl and urea. 1: S-13500; 2: S-13500 + Tween 20; 3: S-13500 + NaCl; 4: S-13500 + urea; 5: Control (S. aureus suspension); 6: Tween 20; 7: NaCl; 8: Urea. B: Survival curves of C. elegans infected by S. aureus after treatments |
汤剂是中药最普遍的临床应用形式。中药煎煮过程中, 化学成分不断溶解、溶出并发生相互作用, 最终达到平衡状态, 实现了方药配伍的分子衍化, 奠定了中药体内起效的物质基础。长期以来, 中医药学者一直非常重视中药汤剂的研究, 致力于阐明中药煎煮过程中的物质与功能传递规律, 取得了一定的进展[26-28]。但现有研究仍存在一些问题和缺陷未能解决, 主要表现为: ① 在研究中药单煎与合煎时仅关注成分类型和含量的变化, 忽视了多成分物理相态的改变; ② 将组方比例与药效高低的关联性归结为化学成分的协同增效, 而未考虑多成分相态对生物利用度的影响; ③ 虽然中药煎液自沉淀现象早已为人熟知, 但缺乏对沉淀成分和结构的深入探究, 未获得自沉淀与药效、毒效关联的直接证据; ④ 对中药化学成分(包括小分子和大分子)互作关系的研究提供了先进的研究方法和技术, 但仍不能反映真实的中药互作体系, 特别是体内转运过程中的相态变化与成分迁移规律。上述这些问题是“结构中药学”关注和研究的重点内容, 也是明晰中药物质基础和起效机制的关键问题[3]。本文旨在探明麻杏石甘汤抗菌活性与其多成分物理相态的关系。研究结果表明, 麻杏石甘汤煎煮过程中化学成分交织互作, 形成了新的聚集形式和物理相态, 粒度分布不断变窄均化, 有机和无机成分迁移重排, 最终导致汤剂成分分布的空间异质性。这一变化使某些特定的物理相态成为抗菌活性的主要形式。使用化学干扰剂破坏活性相态间的作用力导致抗菌活性显著降低, 说明中药活性并非仅与其化学成分有关, 这为中药物质基础的两面性特征提供了直接证据[3]。
中药多成分物理相态是中药起效的物理基础, 其对药效的贡献形式可以是直接构效关联或通过影响溶出、吸收和生物利用度等因素改变药物的量效关系, 但无论何种, 中药多成分物理相态与活性化学成分宛如舟楫关系, 共同决定了中药药效的发挥和起效特色, 值得业界关注和深入研究。
作者贡献: 朱耀萱负责部分实验设计和实施、统计分析结果和撰写论文; 陈伟负责体内外抗菌实验指导; 王振中负责实验经费保障和提供行业指导; 乔宏志和狄留庆负责研究思路的提出、实验设计与修订论文。
利益冲突: 本文所有作者声明不存在利益冲突。
| [1] |
Wei L, Guo Y, Fei Y, et al. A randomized, double-blind, placebo-controlled, multicenter clinical trial for efficacy and safety of traditional Chinese medicine combined with antibiotics in the treatment of bacterial pneumonia in children[J]. Medicine (Baltimore), 2020, 99: e23217. DOI:10.1097/MD.0000000000023217 |
| [2] |
Jia X, Chen Y, Li X, et al. New thoughts and methods of studying material base of traditional Chinese herbal formula[J]. Chin J Tradit Chin Med Pharm (中华中医药杂志), 2008, 23: 420-425. |
| [3] |
Qiao HZ, Di LQ, Ping QN, et al. Structural Chinese medicine: a new research field on the pharmacodynamic substance basis of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2021. DOI:10.19540/j.cnki.cjcmm.20210129.20210601 |
| [4] |
Li W, Wang ZJ, Liu XJ, et al. Based on weak bond chemistry, the interaction mechanism between glycyrrhiza protein and berberine in water decocting process of Rhizoma Coptidis and Liquorice was investigated[J]. Acta Pharm Sin (药学学报), 2021. DOI:10.16438/j.0513-4870.2021-0258 |
| [5] |
Cheng JJ, Yang X. Self-assembly performance of triterpene natural small molecules and their application in synergistic anti-tumor chemotherapy[J]. Acta Pharm Sin (药学学报), 2021. DOI:10.16438/j.0513-4870.2021-0617 |
| [6] |
Li T, Wang PL, Guo WB, et al. Natural berberine-based Chinese herb medicine assembled nanostructures with modified antibacterial application[J]. ACS Nano, 2019, 13: 6770-6781. DOI:10.1021/acsnano.9b01346 |
| [7] |
Huang XM, Wang PL, Li T, et al. Self-assemblies based on traditional medicine berberine and cinnamic acid for adhesion-induced inhibition multidrug-resistant Staphylococcus aureus[J]. ACS Appl Mater Interfaces, 2020, 12: 227-237. DOI:10.1021/acsami.9b17722 |
| [8] |
Lü S, Su H, Sun S, et al. Isolation and characterization of nanometre aggregates from a Bai-Hu-Tang decoction and their antipyretic effect[J]. Sci Rep, 2018, 8: 12209. DOI:10.1038/s41598-018-30690-5 |
| [9] |
Zhou J, Gao G, Chu Q, et al. Chromatographic isolation of nanoparticles from Ma-Xing-Shi-Gan-Tang decoction and their characterization[J]. J Ethnopharmacol, 2014, 151: 1116-1123. DOI:10.1016/j.jep.2013.12.029 |
| [10] |
Dou J, Zhang X, Wang L, et al. Research of effective iterative phase state and pharmacodynamic verification of Shengmai Yin from perspective of effective phase[J]. Chin Tradit Herb Drug (中草药), 2021, 52: 993-999. DOI:10.1134/S0020168521070062?utm_source=xmol&utm_medium=affiliate&utm_content=meta&utm_campaign=DDCN_1_GL01_metadata |
| [11] |
Qiao H, Sun M, Su Z, et al. Kidney-specific drug delivery system for renal fibrosis based on coordination-driven assembly of catechol-derived chitosan[J]. Biomaterials, 2014, 35: 7157-7171. DOI:10.1016/j.biomaterials.2014.04.106 |
| [12] |
Li J, Zhang C, He W, et al. Coordination-driven assembly of catechol-modified chitosan for the kidney-specific delivery of salvianolic acid B to treat renal fibrosis[J]. Biomater Sci, 2018, 6: 179-188. DOI:10.1039/C7BM00811B |
| [13] |
Qiao H, Fang D, Zhang L, et al. Nanostructured peptidotoxins as natural pro-oxidants induced cancer cell death via amplification of oxidative stress[J]. ACS Appl Mater Interfaces, 2018, 10: 4569-4581. DOI:10.1021/acsami.7b18809 |
| [14] |
Jiang L, Li H, Zhang Q, et al. Simultaneous determination of 5 components in Maxing Shigan Decoction with HPLC method[J]. Chin J Tradit Chin Med Pharm (中华中医药杂志), 2015, 30: 537-540. |
| [15] |
Li X, Ma J, Li N, et al. Study on phase state of Danggui Buxue Decoction[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2011, 17: 1-5. |
| [16] |
Bhattacharjee S. DLS and zeta potential-what they are and what they are not?[J]. J Control Release, 2016, 235: 337-351. DOI:10.1016/j.jconrel.2016.06.017 |
| [17] |
He W, Ma J, Chen Y, et al. Ephedrine hydrochloride protects mice from Staphylococcus aureus-induced peritonitis[J]. Am J Transl Res, 2018, 10: 670-683. |
| [18] |
Zhao X, Zhang H, Gao Y, et al. A simple injectable moldable hydrogel assembled from natural glycyrrhizic acid with inherent antibacterial activity[J]. ACS Appl Bio Mater, 2020, 3: 648-653. |
| [19] |
Ren X, Wu D, Wang Y, et al. Determination of thirteen metal elements in Prunus Dulcis and Semen Armeniacae Amarum by FAAS[J]. Chin J Spec Lab (光谱实验室), 2009, 26: 403-406. |
| [20] |
Chen Q, Wu B, Cui W. Studies on a traditional Chinese medical prescription Ma Xing Shi Gan Tang by bio-coordination chemistry[J]. J Chin Pharm Sci, 1993, 2: 85-87. |
| [21] |
Ma J. Extraction of amygdalin from semen persicae and its antibacterial activity[J]. Food Ind (食品工业), 2015, 36: 116-120. |
| [22] |
Tao D, Huang B, Xu Y, et al. Interactions among different herbs in Shengmai San[J]. Prog Nat Sci (自然科学进展), 2002, 12: 27-32. |
| [23] |
Xu X. Study on computer simulation for Chinese traditional compound medicine[J]. Prog Chem (化学进展), 1999, 11: 96-98. |
| [24] |
Chung J, Tan S, Gao S, et al. Self-assembled micellar nanocomplexes comprising green tea catechin derivatives and protein drugs for cancer therapy[J]. Nat Nanotechnol, 2014, 9: 907-912. DOI:10.1038/nnano.2014.208 |
| [25] |
Yang Z, Ma X, Le Y, et al. In vivo antibacterial effects of 43 traditional Chinese medicines were observed by using Caenorhabditis elegans[J]. Shizhen J Tradit Chin Med Res (时珍国医国药), 2010, 21: 1174-1175. |
| [26] |
Qiao S, Wang X, Li G, et al. Dissolution rule of Siwu Decoction by different decocting methods based on chemistry holography[J]. Chin Tradit Herb Drug (中草药), 2020, 51: 4960-4971. |
| [27] |
Shao J, Du L, Sun Z, et al. Effect of decoction forms and compatibility proportion of Codonopsis pilosula and Astragalus membranaceus compound on immunomodulatory[J]. Chin J Clin Pharmacol (中国临床药理学杂志), 2017, 33: 917-920, 938. |
| [28] |
Zhang J, Fu C, He Y, et al. Comparison on chemical components in sediments of Aconiti Lateralis Radix Preparata-Glycyrrhizae Radix et Rhizoma before and after their compatibility[J]. Chin Tradit Herb Drug (中草药), 2013, 44: 165-169. |
 2021, Vol. 56
2021, Vol. 56


