天然产物是目前已被批准或新药候选试剂最基本的抗癌原材料[1, 2]。由于这类物质通常来自于生物体次级代谢物(如传统中药), 同时兼具良好的生物降解性和生物相容性, 加之本身特殊的生物活性(如抗癌作用), 其在药物研发和药物设计中的应用越来越受到关注[3, 4]。正是因为天然产物在医药中的重要性, 当前普遍的研究主要集中在化合物的分离纯化、合成修饰和生物活性评估等方面[5], 这些工作为推动天然产物乃至中药的发展起着积极作用。然而, 随着结构中药学概念的提出, 研究维度不再局限于孤立的药物分子或组合, 而是深入探讨存在非共价键相互作用所形成特定结构的活性相态[6]。基于这种弱的超分子作用力, 天然产物能够自组装形成有序纳米或微米结构的功能也逐渐被发现和报道。
近年来, 一系列萜类小分子具有超分子自组装(self-assembly) 的能力相继被报道[7-9], 因其结构中含有羧基、羟基、碳碳双键、烷基侧链及刚性骨架等结构, 能使其在氢键、π-π作用和范德华力等弱的作用力驱动下形成有序结构的纳米自组装体[10]。在前期研究中, 本团队利用其自组装性质率先构建了兼具生物活性的天然小分子纳米载药体系, 用于协同化疗及光动力治疗癌症研究, 如五环三萜类[11-14]: 熊果酸、白桦脂酸和白桦酯酮酸等; 四环三萜类[15]: 豆甾醇、麦角甾醇和β-谷甾醇等; 三环二萜类[16]: 枞酸和脱氢枞酸等。由于多数的萜类小分子均呈现令人喜悦的抗癌活性, 将其作为药物输送体系不仅实现高效协同抗肿瘤效应, 同时也表现出优异的生物安全性如降低组织损伤等功能[11, 17]。作为潜在的活性药物成分, 兼具生物相容和抗癌活性的萜类天然纳米材料是继无机物、聚合物、小分子多肽和脂质体又一新型的有望用于临床研究的药物输送体系。当前, 天然药物输送体系的研究工作报道较少, 且对分子自组装结构机制缺乏深入系统性的研究和探讨。探索药效成分的互助结构关系和存在形式对揭示天然化合物发挥疗效机制有积极的作用[6]。因而进一步深入研究其自组装行为、充分证实其作为活性药物成分及输送体系的价值意义十分必要。
基于此, 本研究以四环三萜麦角甾醇(ergosterol, ET)、豆甾醇(stigmasterol, ST) 为主要研究对象, 以五环三萜甘草次酸(glycyrrhetinic acid, GA)、熊果酸(ursolic acid, UA) 为佐证物, 深入探讨了三萜类小分子自组装机制及其分子结构排布规律, 研究表明萜类小分子共面排布结构在驱动球、杆或片层状自组装体的形成过程中发挥着主导作用。此外, 前期研究报道的多数三萜、二萜小分子均与紫杉醇(paclitaxel, PTX) 呈现显著的协同抗肿瘤效应[11, 16]。因此, 本研究随后进一步以抗癌活性良好的ET为代表物装载PTX构建纳米药物ET-PTX NPs, 用于协同抗癌研究。结果表明, ET NPs通过氢键及π-π共轭相互作用成功包埋了PTX, 所制备的纳米药物具备显著增强的抗癌活性及优异的生物安全性, 再次证实萜类天然小分子作为药物输送体系潜在的价值, 为开发活性天然生物相容性纳米药物输送体系提供宝贵参考价值。
材料与方法药品与试剂 四环三萜类ET (5%)、ST (95%) 及五环三萜类GA (95%)、UA (98%) 均购自南京春秋生物工程有限公司; 4, 6-二氨基-2-苯基吲哚(DAPI) (Alfa Aesar公司, HPLC > = 98%); 二氯甲烷、甲醇(分析纯, 国药集团化学试剂有限公司); MTT [3-(4, 5)-dimethylthiahiazo(-2)-3, 5-diphenytetrazoliumromide]、Tween 80、异硫氰酸荧光素(FITC, 90%) (Sigma-Aldrich公司); 聚乙烯醇(polyvinyl alcohol, PVA, Mw = 30 000~40 000) 和PTX (98%) (Aladdin公司); RPMI 1640培养基、胎牛血清(FBS)、青霉素/链霉素(美国Gibco公司)。所有试剂均直接使用而未经任何处理。
仪器 Quanta 200FEG扫描电子显微镜(SEM)、Nicolet iS5傅立叶变换红外(FT-IR) 光谱仪(美国Thermo Fisher公司); TU-1900紫外分光光度计(北京普析公司); 激光粒度分析仪(英国马尔文公司); Agilent 1260高效液相色谱仪(美国Agilent公司); 荧光倒置显微镜(DSY-2000X, 北京中显恒业公司); AMR-100酶标仪(杭州奥盛仪器有限公司)。
萜类小分子组装体的制备 采用乳化-溶剂挥发法构建萜类小分子自组装体。将5 mg相应的萜类小分子(ET、ST、GA、UA) 样品溶解在1 mL CH2Cl2中, 随后加入到4 mL 2.5% PVA水溶液中涡旋1 min。采用超声破碎仪在冰水浴低温下继续乳化60 s (10 s off, 10 s on, 功率40%) 后, 将混合液加入到30 mL 0.3% PVA水溶液中, 并在室温下搅拌(转速400 r·min-1) 12 h直到有机试剂完全挥发。然后, 通过离心(11 000 r·min-1, 40 min) 得到相应的自组装纳米粒, 并用去离子水洗涤3次, 以除去残留的PVA, 随后冻干保存待用。
协同抗肿瘤试剂ET-PTX NPs的制备 为制备协同抗肿瘤试剂ET-PTX NPs, 5 mg ET溶解在1 mL CH2Cl2中, 并加入50 μL PTX (30 mg·mL-1) 甲醇溶液混匀, 然后采用上述相同操作的乳化-溶剂挥发法制备得到ET-PTX NPs。其他不同PTX投料比下的纳米粒制备均严格采用相同的方法。此外, 为制备FITC标记的ET-PTX NPs, 取20 μL FITC (25 mg·mL-1) 甲醇溶液加入到ET与PTX中并混匀, 随后采用相同的操作制备即得。
载药量及包封率的测定 精密称取冻干后的ET-PTX NPs固体样品, 使用DMSO将其裂解, 通过HPLC测定样品中药物浓度, 并依据标准曲线计算PTX实际含量, 分别采用公式(1) 和(2) 计算包封率(encapsulation efficiency, EE) 和载药量(drug loading, DL)。此外, 色谱条件如下, 色谱柱: 反相TC-C18 column (250 mm×4.6 mm i.d., Agilent Technologies, USA); 流动相: 乙腈-水溶液(65∶35, v/v); 流速: 1.0 mL·min-1; 柱温: 30 ℃; 进样体积: 20 μL; 检测波长: 227 nm。
| $ \mathrm{EE}(\%)=\frac{W_{1}}{W_{2}} \times 100 \% $ | (1) |
| $ \mathrm{DL}(\%)=\frac{W_{1}}{W_{0}} \times 100 \% $ | (2) |
其中, W1是实际的PTX含量, W2是初始PTX投药量, W0是纳米样品实际总重量。
分子动力学模拟 首先采用Materials Studio 2019 (MS)TM Dmol3模块进行所有分子的几何优化, 得到相应能量最低结构方法选择B3LYP (Becke-3-Lee-YangParr), 基组选择double numeric with polarization (DNP)。随后采用MS构建简化的分子动力学模型, 并在经典的COMPASS立场下进行计算。首先利用Amorphous Cell建立3.7×3.7×3.7 nm3的水盒子, 然后将12个相应的密度泛函理论(density functional theory, DFT) 几何优化后的萜类小分子(ET、ST、GA、UA) 及1 400个水分子随机放置于盒子中, 密度设置为1.0 g·cm-3。首先对整个盒子进行能量最小化以消除可能的构象重叠[1 000步, 最速下降法(steepest decent)], 随后采用Forcite模块在NVE (原子数、体积、能量均恒定) 系综下进行20 ps的退火处理。紧接着在NVT (原子数、体积、温度均恒定) 系综下运行5 ns的分子动力学模拟, 模拟步长为2 fs, 每隔100 ps记录动力学轨迹信息。控温方法选择Berendsen热浴法, 选择Particle-Mesh Ewald法处理长程静电相互作用, 非键相互作用的截断半径设置为12.5 Å。
体外药物释放 采用透析法测定ET-PTX NPs在不同pH值的磷酸盐缓冲盐溶液(PBS) 中PTX的体外药物释放(n = 3)。具体如下: 将5 mL ET-PTX NPs (等当量PTX: 100 μg·mL-1) PBS悬浮液转移至透析袋中(截留分子量7 kDa), 随后将透析袋移至500 mL含Tween 80 (0.5%, v/v) 的PBS (pH 7.4或6.5) 中, 在37 ℃下缓慢搅拌(100 r·min-1), 并在设定的时间点, 用上述HPLC方法测定透析袋中剩余PTX含量。
细胞培养 人源MCF-7及鼠源4T1乳腺癌细胞均购于中国科学院上海细胞库。MCF-7和4T1的培养液均是RPMI 1640, 但分别添加10% FBS和20% FBS, 以及1%青霉素/链霉素, 并在37 ℃、5% CO2条件下进行培养。
细胞摄取 将4T1细胞接种在6孔板中(105个/孔), 在37 ℃下培养直至贴壁。然后将FITC标记的ET-PTX NPs (25 μg·mL-1) 与细胞共同孵育5、30 min和2 h。随后吸弃药液, 洗涤细胞, 进行固定和DAPI染色, 并在荧光倒置显微镜下成像。
MTT毒性评估 将4T1 (104) 细胞(或MCF-7) 接种在96孔板中, 并培养24 h。待细胞贴壁后, 将200 μL不同浓度梯度的药物加入至细胞中, 孵育24和48 h。随后加入10 μL MTT染料(5 mg·mL-1), 4 h后终止培养。然后, 吸弃培养基并加入150 μL DMSO, 采用酶标仪记录每孔在492 nm处吸光度值, 并依此计算细胞存活率。此外, 利用CompuSyn 2.0软件计算相应的协同指数(combination index, CI)。
实验动物 雌性BALB/c小鼠(18~22 g, 6~7周龄) 购自哈尔滨医科大学第二附属医院, 所有动物实验均根据哈尔滨医科大学实验动物研究中心批准的方案进行。为构建4T1肿瘤模型, 首先将4T1细胞消化、离心, 并配制细胞数0.5~1.0×108个/mL的培养基分散液, 随后在小鼠右侧背部皮下注射100 μL, 当肿瘤体积长至约75 mm3时, 用于实验。
体内抗肿瘤评估 采用4T1荷瘤小鼠考察ET-PTX NPs的体内抗癌疗效。当肿瘤体积长至约75 mm3时, 荷瘤小鼠分成4组, 分别是生理盐水组(saline)、游离PTX组、载体ET NPs组及ET-PTX NPs组, 每组5只。连续7天(1天1次) 对相应组别小鼠进行静脉注射治疗, 给药剂量为等当量PTX 4 mg·kg-1 (小鼠体重), 并指定第1次给药为第0天, 每隔1天记录小鼠肿瘤体积及体重变化, 持续监测22天, 根据以下公式计算肿瘤体积V = a×b2×0.5, 其中a和b分别代表肿瘤的长径和短径。随后, 处死小鼠并解离肿瘤, 精密称取瘤重, 按公式(3) 计算肿瘤抑制率(tumor inhibition rate, TIR)。
| $ \mathrm{TIR}=\left(1-W_{\rm{i}} / W\right) \times 100 \% $ | (3) |
其中, Wi和W分别代表治疗组和对照组的平均瘤重。
此外, 收集小鼠血液进行实时血常规分析, 从而评价纳米药物潜在的生物安全性或毒性。
统计学方法 除非特殊说明, 所有数据均以平均值±方差(x±s) 表示, 采用IBM SPSS Statistics 22.0进行统计处理, P < 0.05具有统计学差异。
结果与讨论 1 萜类小分子的自组装性能自组装的萜类天然产物具有优异的生物易降解性及生物相容性, 以及良好的抗癌活性, 作为新型的药物递送体系表现出显著的协同抗肿瘤效应、降低组织损伤等高效低毒的优点[15]。在前期的研究中, 作者发现, 无论是三环二萜酸[16]、五环三萜白桦脂酮酸[13], 还是氧化刺激响应功能化修饰的熊果酸[18]、白桦脂酸[14]均呈现相似规律的分子自组装特性, 即这类化合物自组装结构中分子有序的共面排布有利于驱动长杆状、片层状和纤维状等纳米形貌的形成; 而分子垂直交叉排布能够驱动球状、短杆状纳米粒子的形成。为进一步探讨这一规律性, 本研究中, 首先考察了四环三萜ET、ST及五环三萜GA、UA小分子的自组装形貌(图 1)。在相同的制备条件下, 4种小分子分别形成形貌均一、尺寸各异的短棒状(ET)、杆状(ST)、片层状(GA) 及球状(UA) 的自组装纳米结构(图 1A)。尤其是, 具有相似母环结构的ET与ST所形成的自组装纳米粒(NPs) 在尺寸上有很大区别(图 1B), ET NPs的平均水合直径为210 nm, 而ST NPs的粒径尺寸达到755 nm。类似地, 五环三萜酸GA NPs形成微米尺寸的片层体, 而UA NPs是直径约为162 nm的球状结构。这提示分子结构排布的差异性的确对形貌的形成起着至关重要的作用。

|
Figure 1 SEM images (magnify ×20K, ×50K) of tricyclic triterpenes ergosterol (ET), stigmasterol (ST) and pentacyclic triterpenes glycyrrhetinic acid (GA), ursolic acid (UA) self-assembled nanomaterials (A). Characterization of the corresponding small molecule self-assemblies (B) |
为进一步揭示其自组装机制并可视化分子排布结构, 随后采用简化的动力学模型考察了相应分子自组装体可能的结构(图 2)。首先, 选择结构相似、形貌差异显著的四环三萜ET和ST为研究对象。由于前期的研究利用红外和紫外光谱已经证实氢键和π-π共轭等非共价弱作用力是驱使ET自组装的主要驱动力[15]。因此, 本研究中直接借助动力学观察ET和ST可能的分子排布结构。在ET的自聚体中(图 2A), 在区域region Ⅰ和Ⅱ中不仅能发现部分共面平行排布的分子(图 2B), 同时可观察到同等程度的垂直交叉分子排布结构, 并且存在水桥结构的氢键通过1分子H2O桥连ET二聚体(图 2C), 类似的水桥结构同样稳定出现在另外的三萜松苓新酸(dehydrotrametenolicacid, DTA) 晶体中[9]。此外, 共面排布的ET分子间存在明显的π-π共轭作用力(图 2D), 直观证实π-π共轭是构建ET自组装的驱动力。相反, 在相似结构的ST自聚体结构中(图 2E), 发现多数ST分子主要是以交叉共面形式排布(图 2F), 且在形成的ST二聚体中同样存在水桥氢键(图 2G) 和π-π共轭(图 2H) 等弱作用力。虽然部分垂直排布的分子也存在于体系中, 但ST分子共面排布结构占据主导地位。基于此, 推测ST形成长杆状的纳米粒子而结构非常类似的ET形成短棒状的自聚体结构的可能原因是: 对于ST NPs而言, ST分子主要以共面的方式有规律地排列, 且分子间水桥氢键和π-π共轭为聚集体共面或者横向生长(单一方向排布) 提供了更多的可能性, 因此形成长杆状的纳米结构; 相比之下, 对于类似结构的ET NPs, 虽然ET分子呈现出部分有序的共面排布, 即使同样存在水桥氢键和π-π共轭, 但由于同等程度的垂直交叉排布的结构的存在, 降低了ET分子横向生长的趋势, 因而形成短棒状的自组装体。所有研究表明, 四环三萜类小分子共面排布的趋势可能的确更有利于分子横向生长, 形成长径纳米自组装体, 这再次丰富和佐证了先前关于分子排布趋势决定纳米形貌潜在的规律性。

|
Figure 2 Structures of ET (A) and ST (E) self-assemblies obtained by molecular dynamics (MD) simulation for 5 ns with a simplified model containing twelve ET or ST molecules and 1 400 H2O molecules using Materials Studio 2019 (MS) software. The line and stick models were separately used for the H2O and ET or ST molecules. Possible molecular arrangement in ET (B) or ST (F) self-assemblies. Intermolecular π-π stacking and water bridge H-bond information in ET self-assemblies (C, D) and ST self-assemblies (G, H) |
为进一步验证这种规律的普遍性, 考察了五环三萜GA (片层状) 及UA (球状) 的分子模拟自组装结构(图 3)。经过5 ns的动力学模拟, GA能够快速地形成完整的自聚体(图 3A)。在GA NPs的结构中(图 3B), 同样可以观察到非常明显的分子交叉共面排布结构, 且有明显成对共面排布的二聚体(dimer) 存在于体系中, 这与前期在二硫键化学修饰白桦脂酸(BASS) 的自组装结构中发现的现象一致[14]。此外, 水桥结构的氢键也同样出现在GA组装体中(图 3C)。相反, 不同于快速聚集的GA分子, UA NPs由3个分散的区域组成(图 3D), 表明GA与ET、ST一样, 相比于UA, 更容易在水中组装聚集。在UA NPs的结构中(图 3E), 分子垂直交叉排布的趋势似乎比GA更为明显, 可以清晰地发现结构1和2中的UA分子呈现显著交叉垂直排布; 在结构3中, 6分子UA围绕1个UA分子构成类似“环状球形”。且这些分子呈现显著的相互垂直交叉排布, 尽管有部分共面结构存在其中, 但相比GA来说, 共面堆叠结构只占少数。同样地, 在UA自组装体中也能观察到水桥结构的氢键(图 3F)。以上研究结果表明, 以共面排布为主的GA分子, 在分子间水桥氢键及疏水相互作用下组装成微米尺度的长片层状结构, 而在以分子交叉垂直排布为主导作用的UA自组装体中, 显然这种共面排布导致分子横向生长的趋势明显减弱, 因而形成球状的纳米结构。整体而言, 共面分子排布结构是驱动萜类小分子横向生长成长径自组装体的一个可能因素, 究其形成杆或片层、纤维的原因有待进一步考察。
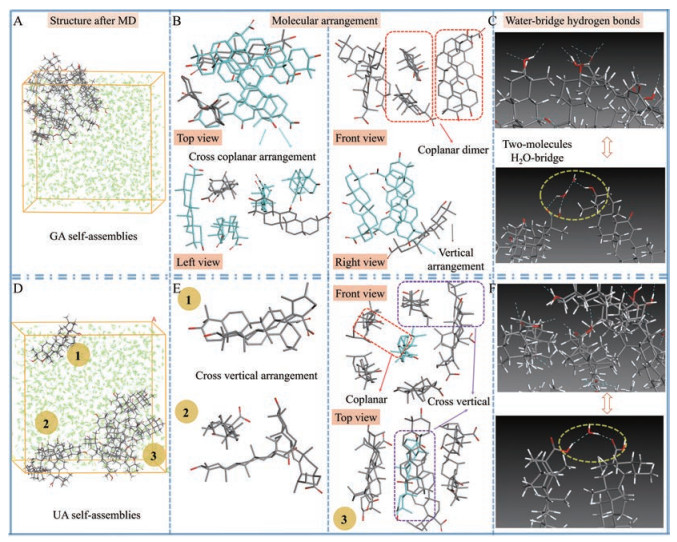
|
Figure 3 Structures of GA (A) and UA (D) self-assemblies obtained by molecular dynamics (MD) simulation for 5 ns with a simplified model containing twelve ET or ST molecules and 1 400 H2O molecules. The line and stick models were separately used for the H2O and GA or UA molecules. Possible molecular arrangement in GA (B) or UA (E) self-assemblies. Intermolecular water bridge H-bond information in GA self-assemblies (C) and ST self-assemblies (F) |
一般纳米药物粒径小于200 nm具备良好的高渗透性和滞留效应(enhanced permeability and retention effect, EPR), 可有效增加药物在肿瘤组织中的聚集[13], 考虑到ET NPs合适的粒径尺寸及ET分子优良的抗癌活性[19], 因此选择ET为代表性载体来递送PTX, 从而构建ET-PTX NPs。以药物载药量和包封率为指标, 考察了不同PTX投药量的影响(图 4A), 结果表明, 随着PTX含量的增加, ET-PTX NPs的载药量和包封率呈现增加的趋势; 当投入比达到40%时, 可以明显观察到大的固体块状颗粒(图 4B), 且其包封率降低; 其他投料比并不改变ET NPs原先的形貌。所有配比下的ET-PTX NPs均呈棒状纳米结构。因此, 选择30% PTX投药量作为优化的比例进行后续深入研究。在这一优化条件下, 采用HPLC检测ET-PTX NPs中PTX的载药量为11.5% (图 4A), 且纳米粒呈现窄的尺寸分布, 平均亲水性直径约为258 nm (图 4C), 明显高于SEM中直接观测到的尺寸(约182 nm)。此外, 红外光谱(图 4D) 显示, 单独的ET NPs并没有明显的C=O振动峰及苯环C=C-H峰, 而当PTX引入后, PTX的C=O伸缩振动峰出现在ET-PTX NPs中, 由原先的1 735 cm-1变为1 737 cm-1; 且PTX中的C=C-H (1 711 cm-1) 同样出现在ET-PTX NPs中, 证实PTX的成功装载。同时, 将纳米粒分散在PBS (pH 7.4) 中, 在持续10天的监测时间内, 并没有观察到明显的尺寸和电位改变, 表明ET-PTX NPs具备良好的稳定性, 能够用于生物应用。
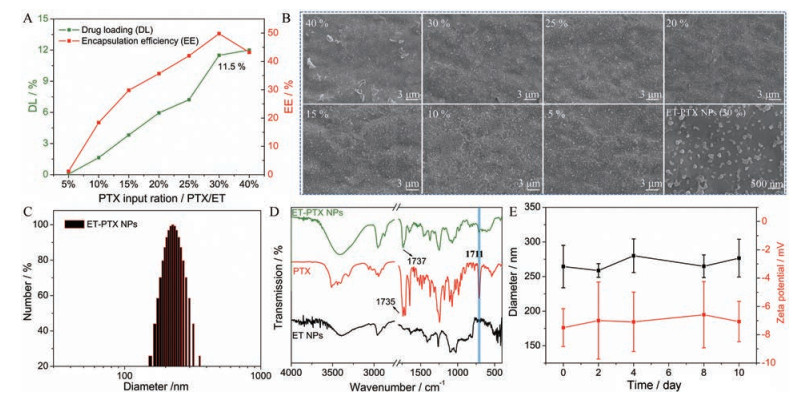
|
Figure 4 Fabrication and characterization of ergosterol-paclitaxel nanoparticles (ET-PTX NPs). A: The drug loading (DL) and encapsulation efficiency (EE) of PTX in ET-PTX NPs obtained at different input ratio of PTX to ET; B: The corresponding SEM images of ET-PTX NPs at different concentrations of PTX from 40% to 5%, as well as SEM image (magnify ×50K) of ET-PTX NPs at 30% PTX input; C: Size distribution of ET-PTX NPs prepared at 30% PTX input, measured by dynamic light scattering (DLS); D: FT-IR spectra of free PTX, ET self-assemblies and ET-PTX NPs; E: Size and zeta potential change of ET-PTX NPs over time in phosphate buffered saline (PBS) solutions |
为进一步可视化PTX的成功装载及揭示ET与PTX相互作用的机制, 同样进行了简化的分子动力学模拟研究。根据PTX的11.5%载药量, 将PTX与ET按照1∶16当量的比例随机放置于3.7×3.7×3.7 nm3水盒子中。经过5 ns的动力学模拟, ET与PTX能够很快地形成一个聚集体(图 5A)。并且PTX的酰胺键与ET的羟基间存在明显的氢键(键长: 2.063 Å, 键角: 140.3°) (图 5B)。更重要的是, PTX的苯环与ET分子的共轭双键形成明显的T-型(面对边) 的π-π相互作用, 两平面间距约为4.52 Å。为进一步证实这一潜在的π-π共轭, 考察了PTX装载前后ET NPs的紫外-可见吸收变化(图 5C)。游离PTX的紫外吸收为233 nm, 而ET-PTX NPs出现了明显红移的紫外峰(235 nm); 相比于单独的ET NPs在297 nm的吸收峰, ET-PTX NPs同样出现了轻微的红移298 nm, 这表明π-π共轭作用的确存在于ET-PTX NPs体系中, 也佐证了动力学模拟的结果。以上数据表明, 氢键和π-π共轭是驱动ET NPs成功装载PTX的主要弱作用力。此外, 在分子结构变化中(图 5D), PTX的引入并没有明显改变ET分子间的相互作用, 除了明显共面排列的结构外, ET分子交叉垂直排布的结构也十分明显, 这也与PTX引入未明显改变ET NPs形貌的结论相吻合。
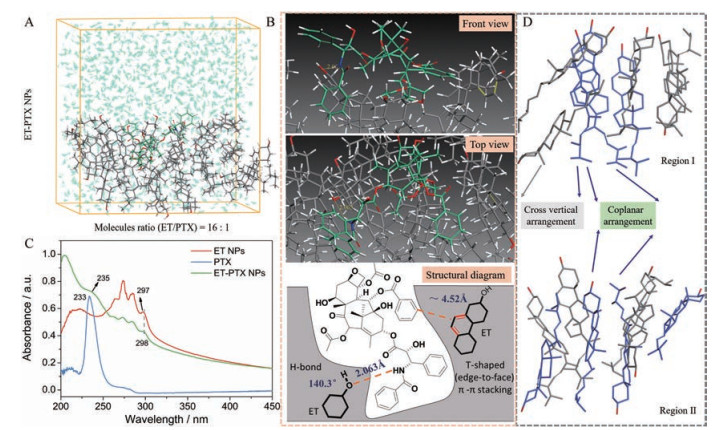
|
Figure 5 MD simulation and analyses of ET-PTX NPs. A: Structures of ET-PTX NPs after MD simulation for 5 ns using sixteen ET molecules and one PTX molecule as a structural unit; B: The intermolecular hydrogen bond information among ET and PTX viewed from top and front field, as well as corresponding detailed molecular structural diagram; C: Uv-vis absorption of ET NPs and ET-PTX NPs in water, as well as free PTX in methanol, respectively; D: The molecular arrangement configuration of ET in ET-PTX NPs |
为进一步评估协同抗肿瘤试剂ET-PTX NPs的抗肿瘤疗效, 首先考察了PTX的药物释放行为, ET-PTX NPs在pH 6.5酸性条件下24 h时PTX的释放量为34.2%, 明显高于中性pH 7.4环境下的13.8% (图 6A)。由于肿瘤微环境为弱酸性, 这一特点可能有利于ET-PTX NPs高效协同化疗, 类似的酸性刺激释放特性同样在相似结构的三环二萜酸运载PTX中被发现[16]。随后, 以FITC荧光标记ET-PTX NPs, 以4T1为肿瘤细胞株, 考察了纳米药物的吞噬能力(图 6B)。结果表明, 细胞内的绿色荧光与孵育时间呈正相关, 随着培养时间的延长, 细胞内药物聚集量逐渐增多, 也证实细胞对药物的摄取呈时间依赖性。有效的细胞吞噬效率是保障抗癌疗效的前提之一, 基于此, 本研究进一步采用MTT法考察了ET-PTX NPs对人源乳腺癌MCF-7及鼠源4T1的细胞毒性。如图 6C~F所示, 无论是PTX还是自组装的ET NPs都对癌细胞表现出浓度依赖性的细胞毒性, 且药物培养48 h后的细胞抑制率都明显高于24 h, 这可能是由于细胞摄取量的增加所致。此外, 当ET NPs成功装载PTX后, 相较于游离的PTX与ET NPs, ET-PTX NPs对4T1和MCF-7细胞的细胞毒性明显增强。在24 h时ET-PTX NPs对4T1和MCF-7细胞的半数抑制浓度(IC50) 分别为0.63和1.89 μg·mL-1 (等当量的PTX), 随着培养时间延长至48 h, IC50值分别降至0.46和1.13 μg·mL-1 (图 6G), 显著低于PTX在48 h对4T1细胞(29.29 μg·mL-1) 和MCF-7细胞(45.42 μg·mL-1) 的半数抑制浓度, 进一步表明ET-PTX NPs高效、增强的抗癌活性以及两种药物协同效应。而后, 进一步采用周-特氏联合指数法(Chou-Talalay)[20]研究PTX与ET NPs的协同效应作用(图 6H), 结果表明, 无论是孵育24 h还是48 h, 两种药物之间的联合指数(CI) 基本普遍小于1, 证实ET与PTX联合治疗中的协同性。

|
Figure 6 In vitro PTX release profiles from ET-PTX NPs in PBS (pH 7.4, 6.5) containing Tween 80 (0.5 %, v/v) at 37 ℃ (n = 3, x±s) (A). Cellular internalization of 4T1 cells after incubation with FITC-labelled ET-PTX NPs for 5 min, 30 min, and 3 h, imaged under fluorescent inverted microscope (scale bar: 20 μm) (B). Cell viability of 4T1 cells (C and D), MCF-7 cells (E and F) treated with PTX, ET NPs, and ET-PTX NPs at different equivalent PTX concentrations for 24 or 48 h. n = 6, x±s. The IC50 value of ET-PTX NPs against 4T1 and MCF-7 cells at 24 or 48 h (G). The combination index of PTX combined ET on 4T1 and MCF-7 cells after incubation for 24 and 48 h, respectively, calculated by Chou-Talalay theorem (H) |
基于ET-PTX NPs高效的体外抗癌活性, 利用4T1荷瘤BALB/c小鼠进一步研究了纳米药物的体内抗肿瘤疗效。如图 7A所示, PTX与ET NPs均表现出适度的肿瘤生长抑制作用, 而ET-PTX NPs组的肿瘤生长被明显抑制, 这表明ET-PTX NPs具备良好、增强的抗癌活性。ET-PTX NPs的肿瘤抑制率为52.3% (图 7B), 高于游离的PTX (29.4%) 和ET NPs (32.5%), 进一步表明两种药物协同抗肿瘤效应。此外, 在治疗22天后, 各组代表性小鼠肿瘤照片更直观地证实了上述结论, 即ET-PTX NPs组肿瘤生长抑制明显, 肿瘤体积最小(图 7C), 表明活性萜类小分子能够用于协同药物输送, 实现高效增强的抗肿瘤疗效。与此同时, 各组小鼠体重在治疗期间均无明显变化(图 7D), 表明生物安全性良好。为进一步验证ET-PTX NPs潜在的生物安全性, 进一步考察了各组小鼠在22天后的血常规, 结果表明, 除白细胞外, 各组间的其他血液指标均未见显著性的差异(图 7E、F)。相比于正常组, 所有荷瘤小鼠组白细胞的升高可能是由于肿瘤生长导致的免疫炎症反应。此外, 相比游离的PTX和ET NPs组, ET-PTX NPs组的白细胞数更趋近于正常组, 也证实了纳米药物的抗肿瘤效应。以上结果表明, ET-PTX NPs具有优异的生物安全性。
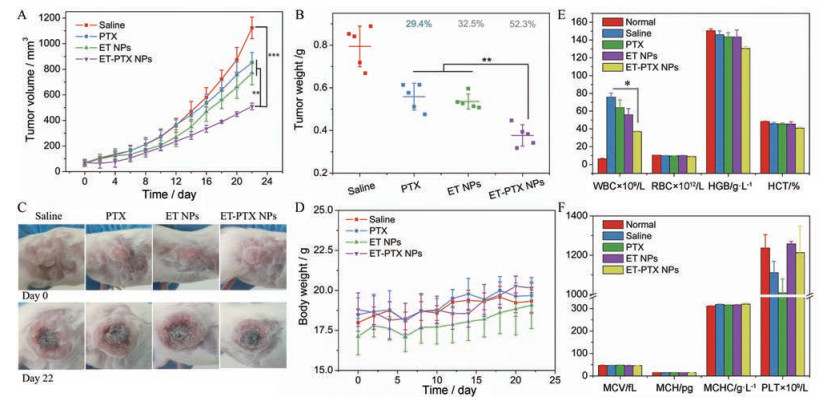
|
Figure 7 In vivo anticancer efficacy and biosafety evaluation of ET-PTX NPs. A: The tumor growth curves after different treatments; B: The excised tumors weight and corresponding tumor inhibition after 22 days of treatment in the indicated groups; C: The representative mice-bearing 4T1 tumor after various treatments at day 0 and 22; D: Body-weight of tumor-bearing mice during the treatment; E and F: Complete blood panel analysis after 22 days of treatment including white blood cells (WBC), red blood cells (RBC), hemoglobin (HGB), hematocrit (HCT), mean corpuscular volume (MCV), mean corpuscular hemoglobin (MCH), mean corpuscular hemoglobin concentration (MCHC), and platelet (PLT). n = 5, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 |
本研究以天然三萜类小分子为研究对象, 采用分子动力学模拟详细探讨了四环三萜麦角甾醇、豆甾醇分子自组装机制, 并以五环三萜甘草次酸、熊果酸为佐证物进一步揭示三萜类小分子共组装结构差异的共性规律。研究表明: 在这些萜类化合物中, 共平面分子排布构型更趋向于形成长径的杆状、片层状等纳米自组装体; 相反, 分子垂直交叉排布结构的存在会降低共面排布分子继续横向生长趋势, 促使短径棒状或球状纳米粒的形成。同时, 以活性麦角甾醇为代表物运载紫杉醇, 从而构建协同抗癌试剂, 证实氢键和π-π共轭作用是驱动紫杉醇成功装载的主要作用力。所制备的纳米药物不仅呈现高效的协同抗肿瘤效应, 同时也具备优异的生物安全性, 有望作为潜在的化疗试剂用于临床癌症治疗。总而言之, 这项工作清楚地表明天然自组装的、具有抗癌活性的萜类小分子是一种新型的药物输送体系, 能够实现安全高效的协同抗癌效应。相信未来, 更多具有自组装功能的天然生物材料将会持续被开发, 制备安全高效药物用于抗癌研究。
作者贡献: 杨鑫负责文章修改、思路构建并提供基金支持。程建军负责主要实验操作、文章数据整理分析及撰写。
利益冲突: 本文作者声明不存在任何利益冲突。
| [1] |
Rodrigues T, Reker D, Schneider P, et al. Counting on natural products for drug design[J]. Nat Chem, 2016, 8: 531-541. DOI:10.1038/nchem.2479 |
| [2] |
Zhang X, Meng LH. Progress in molecularly targeted anti-tumor drugs derived from natural products or their derivatives[J]. Acta Pharm Sin (药学学报), 2020, 55: 2491-2500. |
| [3] |
Harvey AL, Edrada-Ebel R, Quinn RJ. The re-emergence of natural products for drug discovery in the genomics era[J]. Nat Rev Drug Discov, 2015, 14: 111-129. DOI:10.1038/nrd4510 |
| [4] |
Zhi KK, Wang JC, Zhao HT, et al. Self-assembled small molecule natural product gel for drug delivery: a breakthrough in new application of small molecule natural products[J]. Acta Pharm Sin B, 2020, 10: 913-927. DOI:10.1016/j.apsb.2019.09.009 |
| [5] |
Zhi KK, Yang X. Natural product gels and their gelators[J]. Prog Chem (化学进展), 2019, 31: 1314-1328. |
| [6] |
Qiao HZ, Di LQ, Ping QN, et al. Structural Chinese medicine: a new research field on the pharmacodynamic substance basis of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2021. DOI:10.19540/j.cnki.cjcmm.20210129.601 |
| [7] |
Zhi KK, Zhao HT, Yang X, et al. Natural product gelators and a general method for obtaining them from organisms[J]. Nanoscale, 2018, 10: 3639-3643. DOI:10.1039/C7NR08368H |
| [8] |
Bag BG, Majumdar R. Self-assembly of renewable nano-sized triterpenoids[J]. Chem Rec, 2017, 17: 841-873. DOI:10.1002/tcr.201600123 |
| [9] |
Yang X, Ma C, Chen Z, et al. Single small molecule-assembled nanoparticles mediate efficient oral drug delivery[J]. Nano Res, 2019, 12: 2468-2476. DOI:10.1007/s12274-019-2470-0 |
| [10] |
Li X, Lee S, Yoon J. Supramolecular photosensitizers rejuvenate photodynamic therapy[J]. Chem Soc Rev, 2018, 47: 1174-1188. DOI:10.1039/C7CS00594F |
| [11] |
Wang JC, Zhao HT, Zhi KK, et al. Exploration of the natural active small-molecule drug-loading process and highly efficient synergistic antitumor efficacy[J]. ACS Appl Mater Interfaces, 2020, 12: 6827-6839. DOI:10.1021/acsami.9b18443 |
| [12] |
Wang JC, Zhao HT, Qiao WS, et al. Nanomedicine-cum-carrier by co-assembly of natural small products for synergistic enhanced antitumor with tissues protective actions[J]. ACS Appl Mater Interfaces, 2020, 12: 42537-42550. DOI:10.1021/acsami.0c12641 |
| [13] |
Cheng JJ, Zhao HT, Wang JC, et al. Bioactive natural small molecule-tuned coassembly of photosensitive drugs for highly efficient synergistic and enhanced type Ⅰ photochemotherapy[J]. ACS Appl Mater Interfaces, 2020, 12: 43488-43500. DOI:10.1021/acsami.0c13164 |
| [14] |
Cheng JJ, Li XY, Wang S, et al. Carrier-free triterpene prodrugs with glutathione response and biosafety for synergistically enhanced photochemotherapy[J]. ACS Appl Mater Interfaces, 2021, 13: 245-256. DOI:10.1021/acsami.0c19214 |
| [15] |
Cheng JJ, Zhao HT, Yao L, et al. Simple and multifunctional natural self-assembled sterols with anticancer activity-mediated supramolecular photosensitizers for enhanced antitumor photodynamic therapy[J]. ACS Appl Mater Interfaces, 2019, 11: 29498-29511. DOI:10.1021/acsami.9b07404 |
| [16] |
Cheng JJ, Fu SY, Qin Z, et al. Self-assembled natural small molecule diterpene acids with favorable anticancer activity and biosafety for synergistically enhanced antitumor chemotherapy[J]. J Mater Chem B, 2021, 9: 2674-2687. DOI:10.1039/D0TB02995E |
| [17] |
Tan SL, Zhang DZ, Jiang YY. Research progress of the natural small molecular products synergistically with antifungal agents to inhibit drug-resistant fungi[J]. Acta Pharm Sin (药学学报), 2014, 49: 1097-1104. |
| [18] |
Cheng JJ, Wang S, Zhao HT, et al. Exploring the self-assembly mechanism and effective synergistic antitumor chemophoto-therapy of a biodegradable and glutathione responsive ursolic acid prodrug mediated photosensitive nanodrug[J]. Biomater Sci, 2021, 9: 3762-3775. DOI:10.1039/D1BM00369K |
| [19] |
Li XM, Wu QP, Xie YZ, et al. Ergosterol purified from medicinal mushroom amauroderma rude inhibits cancer growth in vitro and in vivo by up-regulating multiple tumor suppressors[J]. Oncotarget, 2015, 6: 17832-17846. DOI:10.18632/oncotarget.4026 |
| [20] |
Chou TC. Theoretical basis, experimental design, and computerized simulation of synergism and antagonism in drug combination studies[J]. Pharmacol Rev, 2006, 58: 621-681. DOI:10.1124/pr.58.3.10 |
 2021, Vol. 56
2021, Vol. 56


