2. 江苏省中药高效给药系统工程技术研究中心, 江苏 南京 210023
2. Jiangsu Engineering Research Center for Efficient Delivery System of TCM, Nanjing 210023, China
植物来源囊泡样纳米粒(extracellular vesicle-like nanoparticles, EVNs) 是从植物鲜榨汁液中分离得到的一类纳米级膜性小泡, 含有脂质、蛋白质、多糖、核酸和其他小分子成分等[1]。2013年, Zhang课题组[2]从葡萄汁中分离到EVNs, 发现其能够靶向肠干细胞并介导肠组织重构, 从而拮抗葡聚糖硫酸钠(DSS) 诱导的结肠炎。由于EVNs分离简便、产率较高且活性明显, 引起业内广泛关注, 随后有多篇报道称从不同可食用鲜榨果蔬汁中可分离到EVNs, 并证明其具有与源植物类似的活性[3]。例如, 花椰菜中分离到的EVNs经口服后可以防治结肠炎, 其作用机制是通过介导腺苷-磷酸激活蛋白激酶(AMPK) 抑制了树突状细胞的激活[4]; 香菇EVNs能通过抑制NLRP3炎症小体的活化减轻D-半乳糖胺/脂多糖诱导的小鼠肝损伤[5]; 西柚EVNs能被肠道巨噬细胞选择性吸收并抑制肠道巨噬细胞产生白细胞介素1β (IL-1β) 和肿瘤坏死因子-α (TNF-α), 从而改善DSS诱导的小鼠结肠炎[6]。综合现有研究报道, 目前EVNs的研究对象主要集中在食品领域, 特别是可食用果蔬, 而药源性植物来源EVNs的研究鲜见报道。本课题组从2015年开始关注药食同源植物及其EVNs, 优化了EVNs的分离方法和储存条件[7], 探索了不同来源EVNs的药理活性[8], 丰富了人们对药食同源植物及其起效机制的认识。
本文选取4种常用的药食同源植物, 鲜姜黄、鲜百合、鲜黄精和鲜天麻, 以其药用部位榨汁分离EVNs, 考察了其粒径、组成、形貌和稳定性等理化性质, 研究了EVNs的抗氧化活性和细胞摄取行为。本研究旨在探索药食同源植物EVNs的制备方法和药学性能, 揭示其起效形式, 为阐明中药药效物质基础、促进药食同源植物的开发利用提供参考。
材料与方法实验仪器 WJE2802D榨汁机(广东美的集团公司); Amicon® Ultra-4 10 kDa超滤管(美国Millipore公司); Allegra X-15R贝克曼低速离心机、Optima XP1超速离心机、Gallios分析型流式细胞仪(美国Beckman Coulter公司); Nano ZS90激光粒度仪、Nanosight NS300纳米颗粒跟踪分析仪(Nanoparticle Tracking Analysis, NTA) (英国Malvern公司); H7650透射电镜(日本Hitachi公司); TU-1810紫外可见分光光度计(北京普析通用仪器有限公司)。
药材与试剂 鲜姜黄(Curcumae Longae Rhizoma, CLR, 购于广东高州姜黄产区, 为姜科植物Curcuma longa L.的新鲜根茎); 鲜百合(Lilii Bulbus, LB, 购于甘肃兰州百合产区, 为细叶百合Lilium Lancifolium DC.的新鲜根茎); 鲜黄精(Polygonati Rhizoma, PR, 购于广西桂林黄精产区, 为百合科植物Polygonatum sibiricum Red.的新鲜根茎); 鲜天麻(Gastrodiae Rhizoma, GR, 购于云南昭通天麻产区, 为兰科植物Gastrodia elata Bl.的新鲜根茎)。4种鲜药材均经南京中医药大学中药资源教研室胡杨老师鉴定; 甲醇(色谱纯)、氯仿(分析纯) (南京化学试剂有限公司); 磷酸氢二钾、磷酸二氢钾(上海沪试化工有限公司); 10×磷酸缓冲盐溶液(PBS)、DMEM培养基、胎牛血清(FBS) (南京迈博生物科技公司); RIPA裂解液、细胞膜橙红色荧光染料DiD (江苏凯基有限公司); Triton X-100 (广州赛国生物科技有限公司); BCA试剂盒(上海碧云天生物技术有限公司); 总抗氧化能力检测试剂盒、DPPH (1, 1-diphenyl-2-picrylhydrazyl radical) 自由基清除试剂盒、羟自由基试剂盒、抑制与产生超氧阴离子自由基测定试剂盒(南京建成生物工程研究所)。
EVNs的分离与制备 采用差速离心法分别提取4种EVNs。具体步骤如下: 取鲜中药材, 洗净, 切块后榨汁。将新鲜汁液按照1∶1 (v/v) 加入预冷1×PBS (pH 7.4), 第一步低速4 000 ×g、4 ℃离心1 h去除汁液中碎渣, 取上清; 第二步中速10 000 ×g、4 ℃离心1 h除去细胞碎片等, 取上清; 第三步将上清在高速120 000 ×g、4 ℃离心2 h, 弃上清, 沉淀用适量PBS分散重悬即得EVNs。将4种新鲜药食同源植物分离得到的相应EVNs, 依次命名为CLR-EVNs、LB-EVNs、PR-EVNs和GR-EVNs。分别取4种EVNs 1 mL, 加入甲醇20 mL混合均匀, 涡旋。氮气保护下于60 ℃蒸去溶剂, 称量干物质量, 以单位质量(kg) 药材所得EVNs干物质量(mg) 作为收率。
粒径、电位、多分散系数、粒子浓度测定 取EVNs适量, 1×PBS稀释至合适浓度, 在Nano ZS90自动模式下测定EVNs的粒径、多分散系数(polydispersity index, PDI) 及zeta电位。取EVNs适量, 1×PBS适当稀释, 在Nanosight NS300自动模式下测定各样品粒径和粒子浓度。
透射电镜(TEM)测试 取EVNs适量, 1×PBS稀释至适宜浓度, 取稀释液10 μL滴于铜网上, 静置4 min后用2%磷钨酸染色3 min, 室温干燥。将样品置于透射电镜200 kV电压下成像。
脂质、蛋白质和糖类含量测定 取EVNs适量, 加入甲醇-氯仿(2∶1, v/v) 混合溶液涡旋, 加入氯仿和超纯水各1 mL, 涡旋混匀。22 ℃、2 000 r·min-1离心10 min, 取有机层, 在氮气保护下60 ℃蒸去溶剂, 为EVNs总脂质[9]。取EVNs 1 mL, 加RIPA裂解液0.5 mL, 涡旋, 冰上静置15 min, 4 ℃、12 000 r·min-1离心15 min后取上清。利用BCA法测定EVNs中的蛋白含量[10]。取EVNs 1 mL, 加乙醇20 mL, 超声30 min, 4 000 r·min-1离心10 min, 沉淀于氮气保护下60 ℃蒸去溶剂, 即为总糖[11]。以每1011个EVNs粒子中所含脂质、蛋白质和糖类的质量(mg) 计。
稳定性测试 EVNs分装, 分别置于4 ℃和-80 ℃, 于第3、6、9、12和15天利用NTA测定粒径。将EVNs在pH 1.2 (模拟胃液) 和pH 6.5 (模拟肠液) 中孵育30 min, 以超纯水中的EVNs作为对照, 测定粒径[12]。
EVNs结构破坏 利用Triton X-100和探头超声分别对EVNs结构进行化学和物理破坏。取EVNs 1 mL, 加入Triton X-100 1 μL常温反应30 min, 进行化学解构。取EVNs 1 mL探头超声(60%, 开2 s, 关2 s, 总时间1 min), 进行物理解构[13]。
抗氧化能力检测 设置EVNs组、超声破坏组和Triton X-100破坏组, 分别检测总抗氧化力、抗超氧阴离子自由基能力、抑制羟自由基能力和DPPH清除率, 作为评价EVNs抗氧化能力的指标, 按照相应试剂盒的说明书操作[14]。
RAW264.7对EVNs的摄取 RAW264.7接种于含10% FBS的DMEM培养基中, 在37 ℃、5% CO2条件下培养。用DMSO将DiD制成浓度为5 mmol·L-1的储备液, 向新制备EVNs和结构破坏的EVNs中分别加入DiD储备液至终浓度为5 μmol·L-1, 37 ℃避光孵育30 min, 然后通过10 kDa超滤管, 4 ℃、3 500 r·min-1离心10 min去除游离染料, 得到标记的DiD-EVNs[12]。取DiD-EVNs 1 mL加入至已接种RAW264.7细胞(ATCC) 的12孔板内, 37 ℃、5% CO2培养1 h, 弃上清, 加入PBS洗涤2次后, 细胞再次重悬于1×PBS。细胞悬液过300目细胞筛至5 mL流式管内, 采用流式细胞仪分析[12]。
统计学分析 实验数据采用平均值±标准差表示, 以GraphPad Prism 8软件进行统计学分析, 组间比较采用单因素方差分析, P < 0.05表示差异有统计学意义。
结果 1 EVNs的制备与表征差速离心法是细胞外囊泡分离的“金标准”[15], 前期实验已证实该法适用于鲜药EVNs的制备。按此法制备的CLR-EVNs、LB-EVNs、PR-EVNs和GR-EVNs收率(干重计) 分别为1 242 ± 39、873 ± 41、1 716 ± 20和148.2 ± 23 mg·kg-1。此前, Wang等[16]曾报道使用差速离心法分离生姜、葡萄、西柚和西红柿的产率分别为48、1 760、2 200和400 mg·kg-1。因此, 本文制备的药食同源EVNs的收率在合理范围内。
借助激光粒度仪监测分离过程各环节样品的粒径, 发现经过差速离心可以去除鲜药汁中的细胞和细胞碎片等微粒, 得到较纯净的EVNs。4种EVNs的分离情况和理化性质如图 1和表 1所示。测试结果显示, 纯化后的EVNs粒径分布曲线对称性较好; PDI均小于0.2, 说明EVNs粒径分布较均匀; 不同EVNs的zeta电位不同, 但均呈负电荷, 主要集中于-20 ~ -10 mV内。NTA结果表明, EVNs粒径集中在150~200 nm之间, 每毫升的粒子数均达到1011。
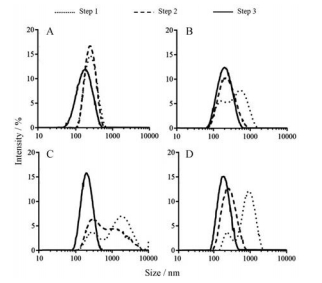
|
Figure 1 Size distribution of extracellular vesicle-like nanoparti‐ cles (EVNs) after different separation steps determined by Nano ZS90. A: CLR-EVNs; B: LB-EVNs; C: PR-EVNs; D: GR-EVNs. Step 1, Step 2, or Step 3 represents the sample obtained in each step. CLR: Curcumae Longae Rhizoma; LB: Lilii Bulbus; PR: Polygonati Rhizoma; GR: Gastrodiae Rhizoma |
| Table 1 Physical and chemical characterization of EVNs. Size and concentration were obtained from nanoparticle tracking analysis (NTA), polydispersity index (PDI), and zeta potentials were measured by Nano ZS90. n = 3, x ± s |
利用TEM对EVNs形貌进行表征, 结果如图 2所示。4种EVNs样品均含有大量纳米级颗粒, 粒径在150~200 nm之间, 多数纳米粒呈现细胞外囊泡经典的茶托样结构。综合上述测试结果, 证明采用超速离心方法能够实现对不同药源植物EVNs的分离和富集, 而且粒径和形态均与可食用植物囊泡的特征基本一致。
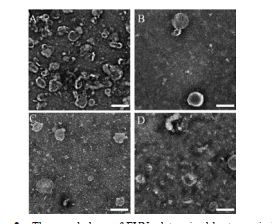
|
Figure 2 The morphology of EVNs determined by transmission electron microscopy (TEM). A: CLR-EVNs; B: LB-EVNs; C: PR-EVNs; D: GR-EVNs. The scale bars were 200 nm |
EVNs的脂质、蛋白和糖类成分的含量测定结果如表 2所示, 不同来源EVNs的成分组成存在明显差异, 体现出不同鲜药EVNs的种源差异。
| Table 2 Lipid, protein, and sugar contents of 1011 EVNs |
据文献报道, 哺乳动物来源EVNs在4 ℃可保存约2周, 而在-80 ℃可保存更长时间。如骨髓间充质干细胞EVNs在-80 ℃可保存长达6个月[17]; 牛奶EVNs在-80 ℃保存4周后, 物理性质未发生明显改变[18]。但植物来源EVNs在不同贮存温度下的稳定性尚缺报道。作者利用NTA监测4种EVNs在4 ℃和-80 ℃环境存放过程中的粒径变化, 结果如图 3所示。在4 ℃条件下, 只有CLR-EVNs的粒径未见明显变化, 其余3种EVNs随储存时间延长, 粒径出现不同程度的增加, 表明可能有聚集现象。在-80 ℃环境下, 4种EVNs放置15天粒径均未发生明显变化, 表明EVNs在-80 ℃条件下储存较稳定。
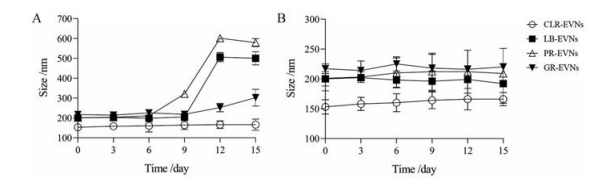
|
Figure 3 Particle size changes of four EVNs determined by NTA. A: EVNs are stored at 4 ℃; B: EVNs are stored at -80 ℃. n = 3, x± s |
为了评价EVNs在胃肠液中的稳定性, 分别配制pH 1.2和6.5的模拟胃液和肠液, 测定EVNs在上述条件下的粒径变化。结果如图 4所示, CLR-EVNs在水、pH 1.2和pH 6.5三种环境下均有较好的稳定性, 粒径基本未发生变化, 其余3种EVNs在pH 1.2溶液中粒径有不同程度的增加; 在pH 6.5下, 仅GR-EVNs的粒径有轻微增加。

|
Figure 4 Average size of CLR-EVNs, LB-EVNs, PR-EVNs, and GR-EVNs treated by ddH2O, pH 1.2 solution (stomach-like solution), and pH 6.5 solution (intestinal-like solution) determined by NTA. n = 3,x± s. **P < 0.01, ***P < 0.001 vs ddH2O group |
2, 2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸[2, 2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid), ABTS] 在氧化剂作用下会氧化成绿色ABTS+, 当存在抗氧化物时, 就会抑制ABTS+的产生。本实验以Trolox (维生素E类似物) 作为基准, 以EVNs相对Trolox的比值反映抗氧化能力。结果如图 5A所示, 4种不同药源植物EVNs的总抗氧化能力不同, 其中以LB-EVNs的总抗氧化能力最优, 与Trolox相当。超声处理EVNs后, 总抗氧化能力均出现不同程度下降, 其中LB-EVNs和GR-EVNs最为明显, 前者下降23.3%, 后者下降40.8%。4种EVNs被Triton X-100处理后, 总抗氧化能力也明显下降, PR-EVNs、LB-EVNs、GR-EVNs和CLR-EVNs分别下降55.0%、20.1%、41.4%和40.7%。

|
Figure 5 Antioxidant activities of EVNs. A: Antioxidant effects of EVNs and structurally damaged EVNs. Total antioxidant capacity of EVNs; B: 1, 1-Diphenyl-2-picrylhydrazyl radical (DPPH) radical scavenging activity of EVNs; C: Anti-superoxide anion ability of EVNs; D: Ability of EVNs to inhibit hydroxyl free radicals. n = 3, x± s. *P < 0.05, **P < 0.01, ***P < 0.001 vs EVNs group |
DPPH自由基在517 nm处有强吸收, 醇溶液呈紫色。当存在自由基清除剂时, 与DPPH单电子配对致使其吸收消失。如图 5B所示, 4种EVNs均具有清除DPPH自由基的能力。超声破坏使得CLR-EVNs清除能力下降11.5%, 而对其他3种EVNs清除DPPH的能力影响不明显。GR-EVNs和LB-EVNs被Triton X-100破坏后, 对DPPH的清除能力显著下降, 分别下降36.8%和23.1%。
4.3 抑制超氧阴离子能力黄嘌呤和黄嘌呤氧化酶反应会产生超氧阴离子自由基, 加入显色剂可使体系呈紫红色。当抗氧化物加入时, 紫红色变浅。通过比色法可以判断形成物的颜色深浅, 从而计算出抑制超氧阴离子的能力。EVNs抑制超氧阴离子能力如图 5C所示, 其中LB-EVNs抑制作用最佳。当EVNs被超声解构后, 其抑制超氧阴离子能力略有下降, 但并不明显。Triton X-100处理后, PR-EVNs、LB-EVNs、GR-EVNs和CLR-EVNs抑制超氧阴离子的能力显著下降, 分别下降8.1%、6.3%、12.3%和12.7%。
4.4 抑制羟自由基活力H2O2/Fe2+通过Fenton反应产生羟基自由基, 并将Fe2+氧化为Fe3+, 导致536 nm吸光度降低。体系在536 nm吸光度降低时的抑制率可以反映EVNs的羟自由基清除能力。如图 5D所示, LB-EVNs清除羟自由基的能力最强, 当经过超声或者Triton X-100处理后, 活性显著降低, 分别下降16.5%和28.7%; GR-EVNs经Triton X-100处理后抗氧化活性下降18.3%; PR-EVNs和CLR-EVNs经物理或化学结构处理后, 活性未见明显变化。
综合上述实验结果, LB-EVNs在4种EVNs中抗氧化能力最强。当采用物理或化学解构方法处理后, 均不同程度地减弱了EVNs的抗氧化能力, 提示EVNs的结构完整性与其抗氧化活性有较大的关联。
5 RAW264.7对EVNs的摄取为了进一步评价4种EVNs性能之间的区别, 选择RAW264.7考察4种EVNs的摄取情况。如图 6A、B所示, 4种EVNs均能被RAW264.7摄取, 其中CLR-EVNs的摄取量最多, PR-EVNs的摄取最少。
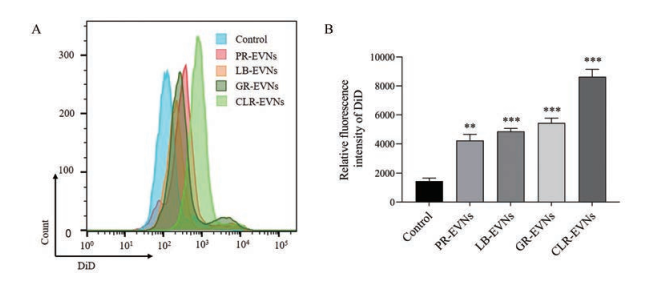
|
Figure 6 The uptake of EVNs by RAW264.7. A: Uptake of DiD-labeled EVNs detected by flow cytometry. Intracellular fluorescence intensity after treated with four DiD-labeled EVNs; B: Quantification of cellular uptake after incubation with four DiD-labeled EVNs. n = 3, x± s. **P < 0.01, ***P < 0.001 vs control group |
为了论证EVNs结构和性能之间的关系, 分别利用探头超声和Triton X-100对EVNs进行结构破坏, 并通过流式细胞术分析RAW264.7细胞对结构破坏前后EVNs的摄取变化。实验过程中发现, 破坏EVNs所需Triton X-100的浓度为0.1% (v/v), 而该条件可造成RAW264.7细胞大量死亡, 于是后续实验未采用Triton X-100破坏EVNs。结果如图 7所示, RAW264.7对超声破坏后的EVNs摄取显著降低, 证明超声处理对EVNs的细胞摄取有较大影响, 进一步反映EVNs结构与其转运性能可能存在一定的关联性。
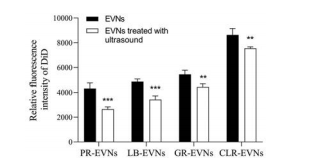
|
Figure 7 Uptake of DiD-labeled EVNs and structurally damaged EVNs treated with ultrasonic probe were detected by flow cytometry. n = 3, x± s. **P < 0.01, ***P < 0.001 vs EVNs group |
植物来源囊泡样纳米粒是借鉴细胞外囊泡的分离方法从新鲜采集的植物榨汁液中分离到的一类纳米结构。由于其提取过程未区分植物微观结构, 因此所得EVNs的生源较复杂, 不适合作为植物生理学的研究对象。但是, 由于植物资源广泛、分离收率较高、操作简便, 且EVNs表现出明显的药理活性和作为药物载体的潜力而适用于植物深加工或其他生物医学应用领域[19-21]。对药源性植物来说, EVNs制备过程未使用有机溶剂和破坏性分离方法, 较好地体现了原生中药多成分、多途径起效的特点, 且结构和功能独立, 便于监测和评价。同时由于脂质、蛋白等初级代谢产物的存在以及纳米化的尺度, 常有助于解决中药单体化合物溶解性、渗透性等生物利用度问题, 适宜作为中药整体药效物质形式开展相关研究[22-24]。
本文选择4种药食同源植物的新鲜药用部位, 采用差速离心法分离获得EVNs, 并利用粒度仪、NTA和TEM等技术对其进行表征, 证明了EVNs的普遍存在; 评价不同储存温度和pH环境对EVNs粒径的影响, 显示不同来源EVNs可能具有不同的稳定性。事实上, 在实验中发现部分EVNs在不同pH条件下孵育30 min即出现粒径改变。由于EVNs成分中包含脂质、蛋白等两性分子, 其粒度、电荷、结构可能受pH等因素影响较大, 单纯依赖粒径结果尚不足以判定EVNs的稳定性, 因此没有再延长测试时间。此外, 单纯评价粒度和形态不能支持环境因素对EVNs活性的影响, 有必要增加相关活性检测; 若想考察胃肠道真实条件对EVNs的影响, 还需开展更为深入的体内转运研究, 但目前上述研究都比较缺乏。与动物来源胞外囊泡类似, 植物EVNs源于鲜榨汁液提取物, 其稳定性和保存方法的确是制约其产业化应用的关键技术问题。作者前期对此开展了一些探索, 表明冻干处理可能是一种有效的保存方式[7]。本文的研究亮点之一是通过抗氧化和细胞摄取实验证明EVNs的活性和跨膜能力与自身结构有较大关联, 提示中药多成分起效的协作关系。
长期以来, 以中药化学为基础的中药研究为揭示中药活性化学成分奠定了坚实基础, 而决定中药起效的另一关键因素, 即化学成分相互作用形成的物理结构及其与药效的关联性亟待被揭示[22]。这既是阐明包括鲜药在内的中药功效物质基础的需要, 也是开发药食同源产品、提高中药资源利用率的有效途径。
作者贡献: 李思敏负责部分实验设计与实施、统计分析结果和撰写论文; 何凤军负责部分实验实施和统计分析结果; 秦琳茜和杨凯宇负责部分实验实施; 乔宏志负责研究思路的提出、实验设计与修订论文。
利益冲突: 本文所有作者均声明不存在利益冲突。
| [1] |
Zhao M, Li SM, Zhang L, et al. Research progress of plantderived vesicles and their biomedical applications[J]. Acta Pharm Sin (药学学报), 2020. DOI:10.16438/j.0513-4870.2020-1514 |
| [2] |
Ju S, Mu J, Dokland T, et al. Grape exosome-like nanoparticles induce intestinal stem cells and protect mice from DSS-induced colitis[J]. Mol Ther, 2013, 21: 1345-1357. DOI:10.1038/mt.2013.64 |
| [3] |
Dad HA, Gu TW, Zhu AQ, et al. Plant exosome-like nanovesicles: emerging therapeutics and drug delivery nanoplatforms[J]. Mol Ther, 2021, 29: 13-31. DOI:10.1016/j.ymthe.2020.11.030 |
| [4] |
Deng Z, Rong Y, Teng Y, et al. Broccoli-derived nanoparticle inhibits mouse colitis by activating dendritic cell AMP-activated protein kinase[J]. Mol Ther, 2017, 25: 1641-1654. DOI:10.1016/j.ymthe.2017.01.025 |
| [5] |
Liu B, Lu Y, Chen X, et al. Protective role of shiitake mushroomderived exosome-like nanoparticles in D-galactosamine and lipo-polysaccharide-induced acute liver injury in mice[J]. Nutrients, 2020, 12: 477. DOI:10.3390/nu12020477 |
| [6] |
Wang B, Zhuang X, Deng ZB, et al. Targeted drug delivery to intestinal macrophages by bioactive nanovesicles released from grapefruit[J]. Mol Ther, 2014, 22: 522-534. DOI:10.1038/mt.2013.190 |
| [7] |
Qiao HZ, Li SM, Lv Q. Preparation and application of plantderived exosomes-like products: CN, 112451488A[P/OL]. 2021-03-09.
|
| [8] |
Zhang L, He F, Gao L, et al. Engineering exosome-like nanovesicles derived from asparagus cochinchinensis can inhibit the proliferation of hepatocellular carcinoma cells with better safety profile[J]. Int J Nanomedicine, 2021, 16: 1575-1586. DOI:10.2147/IJN.S293067 |
| [9] |
Liu NJ, Wang N, Bao JJ, et al. Lipidomic analysis reveals the importance of GIPCs in arabidopsis leaf extracellular vesicles[J]. Mol Plant, 2020, 13: 1523-1532. DOI:10.1016/j.molp.2020.07.016 |
| [10] |
RutterB D, Innes RW. Extracellular vesicles isolated from the leaf apoplast carry stress-response proteins[J]. Plant Physiol, 2017, 173: 728-741. DOI:10.1104/pp.16.01253 |
| [11] |
Wang C, Su JY, Cai JY, et al. Response surface analysis for the optimization of extraction condition for polysaccharides from Epimedium polysaccharides and studies on its tumor immune activities[J]. Acta Pharm Sin (药学学报), 2016, 51: 1464-1471. |
| [12] |
Chen QB. The Study of Tea Flower-derived Lipid Nanovesicles in the Treatment of Breast Cancer (茶树花衍生纳米囊泡在乳腺癌治疗中的研究) [D]. Chongqing: Southwest University, 2019.
|
| [13] |
Cao M, Yan H, Han X, et al. Ginseng-derived nanoparticles alter macrophage polarization to inhibit melanoma growth[J]. J Immunother Cancer, 2019, 7: 326. DOI:10.1186/s40425-019-0817-4 |
| [14] |
Chen C, Lin BB, Xu YM, et al. Analysis of active components and antioxidant activity of aqueous extract of Gastrodia elata[J]. Sci Technol Food Ind (食品工业科技), 2019, 40: 17-22. |
| [15] |
Li P, Kaslan M, Lee SH, et al. Progress in exosome isolation techniques[J]. Theranostics, 2017, 7: 789-804. DOI:10.7150/thno.18133 |
| [16] |
Wang Q, Zhuang X, Mu J, et al. Delivery of therapeutic agents by nanoparticles made of grapefruit-derived lipids[J]. Nat Commun, 2013, 4: 1867. DOI:10.1038/ncomms2886 |
| [17] |
Mendt M, Kamerkar S, Sugimoto H, et al. Generation and testing of clinical-grade exosomes for pancreatic cancer[J]. JCI Insight, 2018, 3: e99263. DOI:10.1172/jci.insight.99263 |
| [18] |
Zonneveld MI, Brisson AR, van Herwijnen MJ, et al. Recovery of extracellular vesicles from human breast milk is influenced by sample collection and vesicle isolation procedures[J]. J Extracell Vesicles, 2014, 3: 24215. DOI:10.3402/jev.v3.24215 |
| [19] |
Liu S, da Cunha AP, Rezende RM, et al. The host shapes the gut microbiota via fecal microRNA[J]. Cell Host Microbe, 2016, 19: 32-43. DOI:10.1016/j.chom.2015.12.005 |
| [20] |
Wang Q, Zhuang X, Mu J, et al. Delivery of therapeutic agents by nanoparticles made of grapefruit-derived lipids[J]. Nat Commun, 2013, 4: 1867. DOI:10.1038/ncomms2886 |
| [21] |
Zhang M, Viennois E, Xu C, et al. Plant derived edible nanoparticles as a new therapeutic approach against diseases[J]. Tissue Barriers, 2016, 4: e1134415. DOI:10.1080/21688370.2015.1134415 |
| [22] |
Qiao HZ, Di LQ, Ping QN, et al. Structural Chinese medicine: a new research field on the pharmacodynamic substance basis of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2021. DOI:10.19540/j.cnki.cjcmm.20210129.20210601 |
| [23] |
Sundaram K, Miller DP, Kumar A, et al. Plant-derived exosomal nanoparticles inhibit pathogenicity of porphyromonas gingivalis[J]. iScience, 2020, 23: 100869. DOI:10.1016/j.isci.2020.100869 |
| [24] |
Chen X, Zhou Y, Yu J. Exosome-like nanoparticles from Ginger Rhizomes inhibited NLRP3 inflammasome activation[J]. Mol Pharm, 2019, 16: 2690-2699. DOI:10.1021/acs.molpharmaceut.9b00246 |
 2021, Vol. 56
2021, Vol. 56


