2. 江西中医药大学, 江西 南昌 330004;
3. 南京中医药大学, 江苏 南京 210023
2. Jiangxi University of Chinese Medicine, Nanchang 330004, China;
3. Nanjing University of Chinese Medicine, Nanjing 210023, China
中药研究的不断进步带来一系列结构丰富的制剂产品[1-8]。中药制剂重视药辅合一, 其剂型和辅料的运用蕴含着丰富的方药配伍智慧, 但目前中药制剂在结构方面的研究较少[9]。中药活性成分从剂型里溶出、释放受制于制剂的结构, 并影响其疗效的发挥。制剂结构的创新也是中药制剂的发展趋势, 在以缓控释制剂和靶向给药系统等为代表的新剂型发展过程中, 制剂结构发挥着重要作用。中药的成分复杂, 存在着药效物质基础、质量评价和制备工艺等方面的难点[10, 11], 注重中药制剂的结构研究和创新, 充分应用结构药剂学等新理论和新技术, 开展符合中药特点的制剂结构研究, 表征和控制中药制剂的结构属性, 对中药制剂的创新和质量评价也有方法学意义。
本文首先对药物制剂的结构研究进行归纳和总结, 介绍了药物制剂进行结构研究的最新技术。在此基础上, 系统总结了中药制剂结构研究的进展, 以期阐明中药制剂结构的特殊性和进行评价创新的必要性。
1 药物制剂的结构特征作为剂型特征的核心要素, 制剂的结构影响其释药机制, 决定药物疗效的发挥。因此, 明晰制剂的宏观和微观结构, 阐明缓控释制剂内部的物质分布和物质转移的机制, 为优化制剂处方工艺、提升制剂质控指标和指导新剂型设计具有重要的意义。应用上海光源大科学装置, 我国率先开展制剂的3D结构研究, 提出以精细的内部结构为主要对象的结构药剂学理论, 将制剂结构分为从剂型(一级) 到制剂中间体(二级)、动态结构(三级) 和分子结构(四级) 等四级结构, 并在静态结构和动态结构等方面开展制剂结构研究, 初步形成了科学完整的制剂结构研究方法并应用于多种剂型[12]。
1.1 剂型的结构特征各种剂型的尺度复杂, 有的属于微米结构, 有的可达厘米。例如, 不同结构的片剂类型丰富多彩, 既有粉体微粒的微米尺度的精细结构, 也有宏观的片剂结构。采用表面成像来研究片剂的固态结构性质, 与药物释放过程不同步, 缺乏立体结构的特异性。因此, 研究片剂内部结构特征, 特别是与药物释放同步的内部结构变化, 对阐明其体外释放、体内生物利用度的限制因素具有本质意义[13]。
渗透泵片是典型的缓控释制剂[14], 其结构具有复杂性与多样性。经过多年的发展, 渗透泵片由早期诞生的Rose-Nelson型、Higuchi-Leeper型、Theeuwes型和可移植的迷你型发展出一系列新结构类型(图 1A), 实现不同性质药物的控释给药。其特有的结构复杂性与多样性赋予了渗透泵制剂特殊的释放特征。因此, 结构是缓控释给药系统的核心要素, 基于结构的创意设计是推动渗透泵制剂发展创新的源动力。目前上市的渗透泵片以片芯、包衣膜和释药孔结构组成的单层/双层渗透泵为主。对非洛地平渗透泵片进行三维结构成像, 并利用分形原理在盒维数基础上, 建立了渗透泵片体积和表面积的分形维度指标, 发现释放过程中片芯结构的复杂特征可以用片剂表面积分形维度进行描述, 为非洛地平渗透泵片质量评价与控制提供了新思路[15]。包衣膜和释药孔的设计也影响渗透泵片的释放。包衣膜是控制药物释放速率的因素之一[16], 卡托普利单层渗透泵片的包衣膜在扫描电子显微镜(scanning electron microscopy, SEM) 和原子力显微镜(atomic force microscopy, AFM) 下呈现表面不均匀、伴有椭圆形的凸起结构和无微孔结构(图 1B)。包衣膜在药物释放介质里的水化过程中, 其表面平滑度增加, 且出现一些圆孔状的结构, 包衣膜中聚乙二醇(PEG) 快速溶解形成微孔释放药物。研究阐明, PEG溶解引起的膜结构变化是引发渗透泵药物释放的关键过程。释药孔是控制渗透泵片药物释放的另一关键结构。研究发现, 尽管激光打孔时初始设置的图形为规则的圆形, 但呈现在包衣膜上形成的释药孔接近椭圆形, 且释药孔的边缘也并非光滑状态、沿着孔的边缘分布着细微结构。此外, 释药孔的三维结构呈现为圆锥形, 而非一般主观想象的圆柱体, 锥体部分的表面粗糙, 同时分布着一些微细的孔状结构, 锥角深入片芯内部, 表明释药孔穿透了包衣膜(图 1C)。该研究展现了释药孔的三维立体结构, 有助于进行渗透泵制剂的一致性评价和设计[17]。
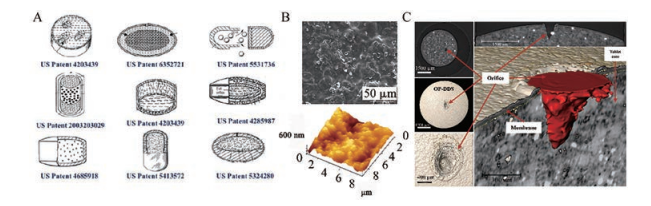
|
Figure 1 The structural characteristics of osmotic pump tablets. A: Some classic structures of osmotic pump tablets; B: The scanning electron microscopy (SEM) and atomic force microscopy (AFM) micrographs of the isolated membranes. (Adapted from Ref. 16 with permission. Copyright © 2016 Elsevier); C: The 3D structures of laser drilled orifices from osmotic pump tablets imaged by synchrotron radiation X-ray micro-computed tomography (SR-μCT). (Adapted from Ref. 17 with permission. Copyright © 2016 Elsevier). OP-DDS: Osmotic pump drug delivery system |
微丸压制片是由可持续释药微丸与适宜辅料混合后压制成的制剂, 压片后具有体积小、可刻痕和可分剂量使用等优点[18, 19]。对微丸压制片的三维微结构与药物、辅料的空间分布的研究, 有助于进行深度的质量评价与控制。茶碱微丸片(THEODUR®) 为24 h骨架型缓释制剂, 微丸在片剂径向上的分布均匀, 但在轴向上存在明显的微丸富集区。片剂内部呈现3种不同的区域: 基质层、保护缓冲层与载药微丸, 基质层和保护缓冲层并无特定的结构, 两层依次包裹在微丸周围。基质层主要分布有茶碱、蔗糖、乳糖和十二烷基硫酸钠, 而单硬脂酸甘油酯主要存在于缓冲层[20] (图 2A)。琥珀酸美托洛尔微丸片(倍他乐克®) 遇介质快速崩解成单个微丸, 持续释放药物24 h。其中, 微丸在片剂内均匀分布, 且呈光滑球形, 具三层球形结构。此外, 片剂中基质并非十分紧实, 基质中以及基质和微丸之间均有一些空隙, 这不仅有利于片剂在介质中快速崩解, 也保证微丸在压片过程中结构的完整性[21] (图 2B)。另外, 肠溶型微丸压制片的结构研究也有报道, 如埃思奥美拉唑微丸片(耐信®)[22]。

|
Figure 2 The 3D structures of pellets compressed tablets imaged using SR-μCT. A: Theophylline multiple-unit pellet system tablets. (Adapted from Ref. 20 with permission. Copyright © 2018 American Chemical Society); B: Metoprolol succinate sustained-release tablets. (Adapted from Ref. 21 with permission. Copyright © 2020 Elsevier). THEO: Theophylline; SUC: Sucrose; LAC: Lactose; SLS: Sodium lauryl sulfate; GEM: Glyceryl monostearate |
骨架片是指药物和一种或多种骨架材料通过压制、融合等技术手段制成的制剂, 药物以分子或结晶状态分散在骨架结构中, 其在释放介质或生理液体中能够维持或转变成整体式骨架结构。非洛地平凝胶骨架片的水化层和片芯的结构清晰可见, 且药物释放过程中的溶蚀层与溶胀层发生相对移动[23] (图 3A)。多阴离子-多阳离子聚合物骨架片具有特殊的结构控释机制, 在释药过程中, 该骨架片的干燥核心外形成了厚厚的水化层, 随着释药时间的延长, 骨架片显现出渗透层、溶胀层、交联层和溶蚀层[24] (图 3B)。上述研究中, 在遇到介质后, 骨架片的结构均展现出有规律的转变, 呈现出清晰的多层结构。因此, 通过合理的设计使骨架片在遇介质后发生可控的结构转变, 实现缓控释效果, 为缓控释制剂的研究与开发提供新的思路。
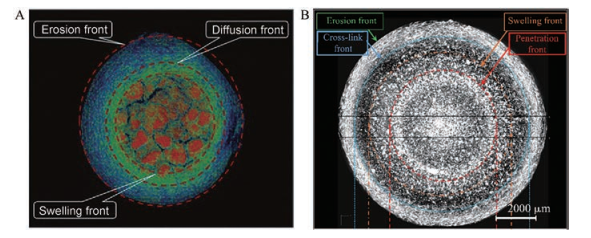
|
Figure 3 The 3D structures of matrix tablets imaged using SR-μCT. A: Felodipine gel-forming matrix tablets. (Adapted from Ref. 23 with permission. Copyright © 2013 American Association of Pharmaceutical Scientists); B: Chitosan-anionic polymers based matrix tablets. (Adapted from Ref. 24 with permission. Copyright © 2020 Elsevier) |
冻干片是将药物与辅料溶解或分散在水中, 并置于模具中, 冷冻干燥制成的制剂。冻干片拥有多孔结构, 在水或体液中能够快速溶解并释放药物[25]。由于不同制备工艺、处方制备的口腔崩解片内部精细结构不同, 在崩解与脆性方面存在显著差异。模制冻干片相比于低温直压冻干片具有更为完整的网状刚性结构, 因此脆性良好; 但模制冻干片缺少低温直压片中疏松多孔的毛细结构, 其崩解时限变长。在相同的低温直接压制工艺下, 加入预冻乳糖粉末的冻干片因其内部存在独立分散、能有效传递脆性测试冲击力的乳糖小颗粒, 因此相对不加预冻乳糖粉末的冻干片能承受更大的冲击力[26]。此外, 由于冻干片的多孔结构, 其比压制片释药更快更完全, 能在15 s内完全释放药物至溶液中[27]。
微丸是指药物溶解、分散和吸附在球形或类球形骨架中的实体小球, 直径通常为0.25~2.5 mm。SEM下的微丸大多呈球形并具有连续、光滑且均匀的表面[28]。有研究将微丸的形状分为球型、哑铃型和双球型[29]。与球型微丸相比, 双球型微丸和哑铃型微丸的表面缺陷较多, 且哑铃型微丸的颈部区域有较薄的聚合物膜, 提高了微球的释放速率。微丸是多单元制剂的重要组成单元, 一般设计成缓、控释型或肠溶型, 其结构特征直接影响了制剂整体的质量。微丸的结构研究主要集中在分层结构, 缺少对各层结构的准确定量, 以及其中的精细结构认知和定量。盐酸坦索罗辛缓释胶囊(哈乐®) 是由微丸和胶囊壳组成, 微丸的三维重构结构模型显示存在空心和实心两种类型(图 4A), 且空心微丸大约占一半。该微丸尺寸有较宽的范围, 多数微丸比表面在0.007~0.035 μm-1。此外, 多数微丸较圆整, 球形度接近1, 越小的微丸球形度越好, 只有部分微丸形状不规则[30]。茶碱微丸片(THEODUR®) 内部的载药微丸是三层球状结构, 包括丸膜、含药层和丸芯(图 4B)。片剂中微丸的尺寸在0.5~1.2 mm。其中, 丸膜较紧实(丸膜中未发现空隙)且厚度均匀, 约为100 μm; 相比之下, 微丸的丸芯较疏松, 可见明显空隙[20]。琥珀酸美托洛尔缓释片(倍他乐克®) 中微丸为不规则球形, 微丸体积为0.09 ± 0.01 mm3, 直径0.55 ± 0.03 mm, 球形度为0.87 ± 0.06。该微丸的结构层次清晰, 分为丸芯、含药层及外膜(图 4C)。微丸丸芯为二氧化硅, 占微丸体积的(7.26 ± 1.84)%, 且丸芯的形态在一定程度上会影响微丸的形态[21]。艾司奥美拉唑镁肠溶片(耐信®) 和阿斯利康的奥美拉唑镁肠溶片(洛赛克®) 是目前较难仿制的两种多单元固体口服制剂, 内含有多个肠溶微丸, 从外到内分别是肠溶衣层、隔离衣层、药物层和蔗糖丸芯(图 4D)。肠溶微丸压制片的制备工艺复杂, 蔗糖丸芯由喷雾干燥或喷雾凝固技术制备; 原料药与黏合剂和其他成分(如表面活性剂、崩解剂等) 混合, 并涂覆在丸芯表面, 形成药物层; 在制备过程中肠溶微丸含药层与肠溶衣中间包有隔离衣, 其目的是防止酸性的肠溶衣接触到酸敏感的药物。两种肠溶微丸球形度较高, 趋近于1, 层次清晰且结构较为致密, 微丸内部未见明显大孔隙, 孔体积和孔隙率趋近于0[22]。
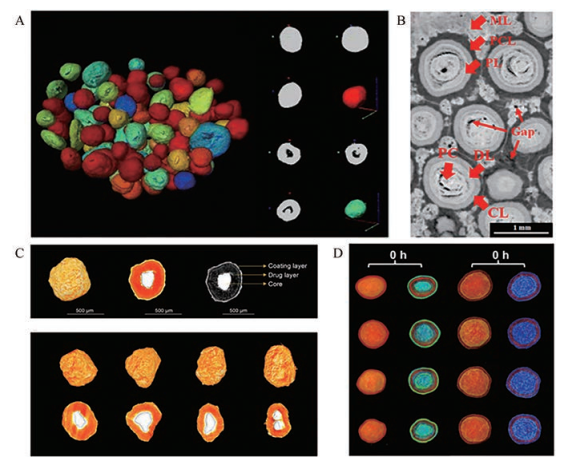
|
Figure 4 The 3D precise structures of pellets imaged using SR-μCT. A: Tamsulosin hydrochloride sustained-release pellets. (Adapted from Ref. 30 with permission. Copyright © 2014 American Association of Pharmaceutical Scientists); B: Partial magnification of a 2D slice of the theophylline multiple-unit pellet system tablet (ML: Matrix layer, PCL: Protective cushion layer, PL: Pellets, PC: Pellet core, DL: Drug layer, CL: Coating layer). (Adapted from Ref. 20 with permission. Copyright © 2018 American Chemical Society); C: Metoprolol succinate sustained-release single pellets. (Adapted from Ref. 21 with permission. Copyright © 2020 Elsevier B.V.); D: Esomeprazole magnesium enteric coated pellets (left) and omeprazole magnesium enteric coated pellets (right). (Adapted from Ref. 22 with permission. Copyright © 2021 Chinese Pharmaceutical Association and Institute of Materia Medica, Chinese Academy of Medical Sciences. Production and hosting by Elsevier B.V.) |
颗粒是最常见的固体制剂中间体, 其结构直接影响制剂产品的质量。采用原位熔融流化床制粒法制备颗粒时, 黏合剂、粒子的大小和用量对颗粒的粒径和内部结构有显著影响。核-壳结构颗粒的平均壳厚取决于黏合剂与核粒子比, 核的体积与黏合剂颗粒粒径成正比, 当黏合剂粒径小于一定值时核壳结构消失[31]。在颗粒的混合过程中, 粒径或形状不同的颗粒体系易出现分离或分层现象; 通过对粒子或粒子群的结构监测, 选择合适的工艺参数、达到均匀混合的效果。混合颗粒体系的分离度随振动时间的增加而提高, 混匀度随着旋转时间的增加而增加[32] (图 5A)。此外, 格列吡嗪片中硬脂酸(stearic acid, SA) 颗粒的结构和空间分布受预处理和压片过程的影响, 热熔法优化的SA制备的片剂中, SA颗粒与参比药片中的SA颗粒非常相似, 具有均匀的形态和粒径, 且球形度、硬度与原研片中的SA更相近, 而未经修饰的SA片剂中的SA颗粒分布不均匀。研究表明, 硬脂酸颗粒的形态影响其在片剂中的空间分布, 选择颗粒圆整度好, 形态均匀的硬脂酸作为片剂中的润滑剂可以确保高质量的片剂[33] (图 5B)。
|
Figure 5 The 3D structures of particles imaged using SR-μCT. A: Influence of the time of rotations on the mixed granular system. (Adapted from Ref. 32 with permission. Copyright © 2013 Elsevier B.V.); B: The 3D images of stearic acid (SA) particles in different kinds of glipizide tablets, location of the total SA particles in tablets (a, c, e), a partial enlarged view of SA particles (b, d, f). SA in reference listed drug (a, b), unmodified (c, d) and reprocessed tablets (e, f), respectively. (Adapted from Ref. 33 with permission. Copyright © 2019 Shenyang Pharmaceutical University. Published by Elsevier B.V.) |
微囊和微球外部通常都为球形, 区别主要在于内部结构。微球的内部结构分为实心型和空心型两种, 其活性成分直接分散在聚合物基质中。而微囊类似一种“核-壳”结构, 除具有壳层、中间保护层和中心颗粒基本结构外[34] (图 6A), 还通过将活性成分分别包裹在单个中空室、多个中空室或在聚合物壳层的基质中, 而存在单涂层、多涂层和基质型3种形式[35]。制备工艺对微囊和微球的结构有较大影响, 传统工艺制备的微囊极易发生球形度差、壳层中存在空隙、颗粒群偏离中心或壳层表面粗糙等缺陷[36]。研究发现, 经过空气冷凝、水冷凝和柠檬酸溶液冷凝3种喷雾冷凝方式所制备的微球结构不同。其中经空气冷凝处理的微球表面最粗糙, 外部凹陷与内部孔洞较多; 而采用柠檬酸溶液冷凝过程制备的微球, 具有规则的球形结构, 表面光滑, 且由于较高的界面张力使其内部结构稳定, 孔洞与体积较小(图 6B)。这些由于生产过程不同所造成的结构差异显著影响微球和微囊的释放行为和掩味等其他特性。因此, 从结构入手剖析微粒生产工艺带来的问题, 对提高微粒制剂的质量具有重要意义[37]。

|
Figure 6 The 3D images of microcapsules and microspheres by SR-μCT. A: The internal structures of microcapsules. (Adapted from Ref. 34 with permission. Copyright © 2018 Elsevier B.V. All rights reserved); B: The images of air-cooling microsphere (a, d), water-cooling microspheres (b, e) and citric acid solution-cooling microsphere (c, f). (Adapted from Ref. 37 with permission. Copyright © 2018 Shenyang Pharmaceutical University. Published by Elsevier B.V.) |
在药物释放过程中, 固体制剂的内部结构如外层半透膜或聚合物基质、含药片芯的体积和表面积等不断变化, 尺度分布范围从纳米到毫米。通过对渗透泵片、凝胶骨架片和微丸压制片等缓控释制剂的动态结构研究, 发现动态结构特征是阐释药物释放机制的有效方法, 并且药物制剂在溶出过程中的释放行为与制剂的内在质量紧密相关, 可为最终的产品质量评价提供指导。随着药物释放, 单室型渗透泵控释片内部的三维结构保持动态变化。非洛地平缓释片在3 h后, 可观察到固体内容物从片芯中分离出来。这是由于水化作用使片剂的核心产生空隙, 形状开始变得不规则。在释药孔附近的形状改变更加明显, 说明了释药孔附近具有更快的药物释放。8 h后可观察到一些聚集体黏附在片材内壁上, 揭示了非洛地平缓释片在前8 h的释药速率保持恒定, 而8 h后速率突然减慢现象的可能原因[38] (图 7A)。非洛地平缓释片片芯的三维体积与片剂中残留的药物量有很好的相关性, 且在药物释放过程中其三维表面积几乎是恒定的, 表明该给药系统实现零级释放的内在释药机制, 可作为单室型渗透泵片剂产品质量评价的重要分析因素[15]。

|
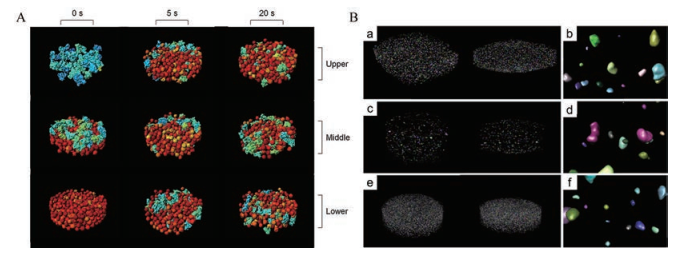
Figure 7 Dynamic structural features of formulations visualized by SR-μCT. A: The 3D images of felodipine monolithic osmotic tablets at different sampling time. (Adapted from Ref. 38 with permission. Copyright © 2012 Elsevier B.V.); B: The 3D images of the hydration layer of felodipine gel-forming matrix tablets during dissolution. (Adapted from Ref. 23 with permission. Copyright © 2013 American Association of Pharmaceutical Scientists); C: The quantitative analysis of the hydration layer of felodipine gel-forming matrix tablets during dissolution. (Adapted from Ref. 23 with permission. Copyright © 2013 American Association of Pharmaceutical Scientists); D: The 3D images and hydration dynamics of chitosan-λ-carrageenan (CS-λ-CG) matrix tablets during dissolution. (Adapted from Ref. 24 with permission. Copyright © 2020 Elsevier B.V.); E: Dynamic structure of single pellets of metoprolol succinate sustained-release tablets at different sampling time. (Adapted from Ref. 21 with permission. Copyright © 2020 Elsevier B.V.); F: Dynamic structure of omeprazole magnesium enteric coated pellets during dissolution. (Adapted from Ref. 22 with permission. © 2021 Chinese Pharmaceutical Association and Institute of Materia Medica, Chinese Academy of Medical Sciences. Production and hosting by Elsevier B.V.) |
凝胶骨架片在溶出过程中最重要的特征是水化层的三维结构演变, 非洛地平凝胶型骨架片的释放受溶蚀与溶胀的双重主导。开始时, 骨架片的水化层厚度变化不大, 说明其具有恒定的释药速率。其3D图显示水化层的体积减少比整个片剂的体积减少慢, 表明药物释放速率决定基质溶蚀的影响(图 7B和C)。通过计算片剂表面积、水化层表面积与片芯表面积参数和药物释放速率之间的相关性, 发现片芯表面积是决定药物恒速释放的关键因素之一, 即基质溶胀对药物释放动力学具有控制的作用[23]。壳聚糖-λ-卡拉胶(chitosan-λ-carrageenan, CS-λ-CG) 骨架片的溶出特征不同于以往亲水性凝胶骨架片, 在药物释放过程中其表面会形成一层强度和致密性都较高的网状层, 保护片芯的内层免受快速侵蚀。在药物释放过程中, 随着溶剂的渗透, 未水解的片芯的体积减小, 致密凝胶层的厚度变大。而水化层倾向于凝固成规则疏松的网状结构, 其在显微断层图像上表现出较高的强度。这种高强度的结构可以保护片剂免受快速的侵蚀和崩解, 也证实了CS-λ-CG骨架片会转变为类似薄膜包衣片的特殊控释过程, 以延长药物的释放期[24] (图 7D)。
琥珀酸美托洛尔缓释片中的单个微丸在溶出过程中总体保持球形的形态, 局部表面出现凹陷。在药物溶出过程中, 首先在微丸的药物层和膜之间出现空隙, 药物层逐渐变为蜂窝状孔隙结构, 同时向膜侧迁移, 导致核心周围出现空隙, 直到药物完全释放。虽然单个微丸之间的药物含量、各微丸的释放动力特征有很大差异, 一些微丸释放快, 另一些微丸释放缓慢, 从而产生互补效应[21] (图 7E), 导致以片剂为整体评价时, 片剂之间的溶出特征的相似性高。同样, 奥美拉唑肠溶微丸在药物溶出过程中也表现出相似的特征[22] (图 7F)。因此, 多单元缓释制剂中各单元之间的释放差异并不影响其整体的药物释放特性。
1.4 分子结构特征分子水平的制剂结构指的是活性分子和非活性分子的介观或微观结构, 尺寸分布从Å到纳米级。类似药物-药物分子之间的作用、药物-辅料之间的相互作用都在四级结构的范围中。相比于单分子层面的相互作用, 本文更关注这些作用在更大尺度上引起的结构特征变化。
为获取药物和辅料的空间分布信息, 利用同步辐射傅里叶变换红外光谱仪(synchrotron radiation-based Fourier-transform infrared spectromicroscopy, SR-FTIR) 技术, 发展了单个微球内药物分布定量表征的新方法。并通过建立光程归一化法和相对强度比值法等数学分析方法, 读取多肽类药物、聚合物辅料的吸收数据矩阵, 计算同一点的相对强度比值, 首次得到了多肽药物-聚合物辅料在单个微球中的分布特征[39] (图 8A)。SR-FTIR成像技术也已用于膜结构研究。与SEM和AFM相比, SR-FTIR可以更加直观、灵敏地表征渗透泵型控释制剂的半透性包衣膜结构。以自制的卡托普利渗透泵制剂为研究对象, 测定其剥离包衣膜及原位包衣膜经不同时间溶出后的化学成分迁移, 不仅获得了样品的高质量单谱, 而且采用绘图模式(mapping) 进行化学成像, 从而获得了特定组分的空间分布, 直观揭示包衣膜结构的控释机制[16] (图 8B)。采用SR-FTIR研究包衣处理后的布洛芬脂质微丸横切面及包衣膜的物质分布, 其中膜结构经过壳聚糖与明胶通过阴阳离子的交互作用、层层自组装包衣形成。通过单谱分析各物质的红外吸收及微丸表面膜组成物质的红外吸收, 再对微丸横切面进行SR-FTIR mapping成像分析, 证实交替包裹壳聚糖与明胶时, 明胶与壳聚糖均存在于膜上, 通过静电作用吸附在微丸表面沉积形成包衣膜, 延缓药物在口腔中的释放, 掩盖药物的不良口感[40]。

|
Figure 8 Substances distribution of single microspheres (MS) and osmotic pump coating membrane derived using synchrotron radiation-based Fourier-transform infrared spectromicroscopy (SR-FTIR) mapping. A: The distribution of drugs and excipients in single microspheres based on spectral images constructed using the relative ratio. (Adapted from Ref. 39 with permission. Copyright © 2015 Chinese Pharmaceutical Association and Institute of Materia Medica, Chinese Academy of Medical Sciences. Production and hosting by Elsevier B.V.); B: The spectra and chemical mapping of the membranes in osmotic pump. (Adapted from Ref. 16 with permission. Copyright © 2016 Elsevier B.V.) |
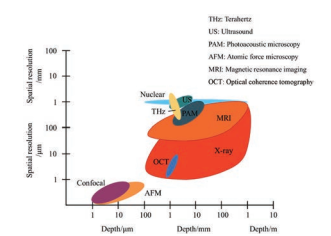
在药物制剂结构的研究中, 成像技术作为最直观的表征手段显得尤为重要, 得益于灵敏度高的独特优势, 仅需要微量的样品便能获取药物制剂的结构信息。光源作为成像系统中最重要的部分, 所使用的光源的特性决定了成像技术理论上所能穿透样品的最大深度和能达到的极限空间分辨率(图 9), 进而限制了这项技术所能检测的样品尺寸和成像维度。光学显微镜使用的可见光、红外、紫外、X射线和太赫兹辐射(terahertz, THz) 等不同波长的电磁波作为典型的成像光源均获得了广泛的应用[41] (图 10)。电子显微镜以电子作为光源来成像, 由于其更短的波长, 相比光学显微镜能够实现更高的分辨率。此外, 还有基于核磁共振原理的核磁共振成像技术(magnetic resonance imaging, MRI)。根据对光源的调制和成像模态的不同, 同一种光源可能应用于不同的成像技术, 但是能达到的最大分辨率和成像深度是相同的。
|
Figure 9 Light source applied in various imaging technologies |

|
Figure 10 Spectra of electromagnetic waves. (Adapted from Ref. 41 with permission. Copyright © 2007 Pharmaceutical Press) |
通过显微成像技术表征药物制剂的形态结构的方法已经由最简单的光学显微镜扩展到SEM、透射电子显微镜(transmission electron microscopy, TEM)、AFM、共焦拉曼显微镜、MRI、拉曼成像、THz成像、超声成像和SR-μCT等技术, 对药物制剂结构的研究也由二维结构转变到三维精细结构。
2.1 2D为主的成像技术传统的成像手段主要以光学、电子显微镜观测药物颗粒及载体的大小和形状, 常用于结构研究的电子显微镜包括TEM、SEM和AFM等。TEM的分辨率可达0.1~0.2 nm, 放大倍数为几万至几十万倍, 能够用于观察微粒内部的超微结构及微生物和生物大分子的全貌, 相比之下, 普通光学显微镜的极限分辨率仅有0.2 μm。TEM的成像模式要求电子需要穿过样本, 通常样本要求非常薄(50~100 nm)。如果样品太厚或过密, 则图像的对比度就会下降, 甚至会因吸收电子束的能量而被损伤或破坏。SEM是使用最广泛的观察药物剂型和粉末外表面结构的方法, 如形貌、粒度分布[42]。SEM的电子束无需穿透样品, 仅以聚焦电子束逐点扫描样本。因此, 对样品厚度没有要求。图像反映样品的表面结构, 可用于观察制剂表面形态。AFM是由Quate和Gerber在20世纪80年代末提出的, 目的是制造一种能够测量单个原子微粒的微小作用的仪器[43]。AFM是在纳米尺度上成像、测量物质的最重要的工具之一, 是一种高分辨率的扫描探针显微镜, 显示的分辨率在纳米数量级。随着AFM技术已经发展到可以产生亚纳米分辨率的图像及可用于分析分子间相互作用力, 其最大优点之一是在生物样品成像方面可以在液体中工作。因此, 可以在接近生理的条件下进行实验[44]。AFM是许多相关扫描探针技术的主要成员, 这些技术可以提供样品的高分辨率成像或局部表面属性[45], 近年来也被广泛用于表征纳米粒和纳米纤维等药物输送载体的结构特征, 并从成像尺度、颗粒表面粗糙程度和纳米粒性能等方面总结了AFM的应用[46]。例如, 在药学领域的实例研究中, AFM已经用于研究单斜醋氨酚的表面黏附和形态随相对湿度(RH) 的变化[47]。
2.2 3D结构表征新技术目前可用于制剂三维结构表征的手段有THz成像、MRI、拉曼成像、激光共聚焦成像和SR-μCT等, 其中SR-μCT是最理想的三维成像技术。
MRI是一种主要用于医疗领域对人体内部进行高质量成像的技术。质子具有一种叫做自旋的性质, 可以被认为是一个很小的磁场, 使原子核产生核磁共振信号, MRI便是利用此种性质对氢核的核磁共振信号进行成像。近年来, 随着计算机和软件系统的改进及脉冲梯度场和各种新型探针的出现, 核磁共振技术的灵敏度得到了很大的改善, 分辨率也得到了很大提高, 这使得不可区分的信号在低磁场下可以分离, 以便获得更多的信号。因此, MRI可广泛用于有机化合物的结构分析和定性分析, 且在确定化合物的纯度和含量方面也有很多优点。如今, MRI已经超越了断层成像技术, 发展到了体积成像技术, 并采用了与CT中类似的反投影技术。在药学领域有研究者应用核磁共振波谱研究了羟丙基纤维素骨架片的溶出过程[48]。
THz成像在制药领域的应用, 已发展到如多晶型的识别和定量、相变监测和水合物形态的表征等方面[49-51]。THz由国际电联指定的0.3~3 THz频段内的电磁波组成, 波长范围为0.1~1 mm。THz可以穿透许多材料, 如聚合物、陶瓷和无定形制药材料, 并可以从反射或透射两种形式的辐射中提取图像或化学数据。除了能够测量剂型的层厚度、包衣均匀性和空间包衣分布外, THz成像还可以检测片剂内的裂缝和分层, 以及片剂结构的错位。THz能够穿透药物制剂的深度在1~3 mm, 这使得表征药物制剂内部的精细结构成为可能[49]。THz 2D和3D化学成像在药学中有广泛的应用, 包括多晶型筛选、新包衣技术的验证和开发、创新固体控释剂型的表征及解决复杂的生物等效性问题等[41]。
激光共聚焦拉曼显微镜(laser scanning confocal Raman microscopy, LSCRM) 作为一种非侵入式的三维成像技术, 具有超高的分辨率和灵敏度, 能够保证很高的空间分辨率。拉曼效应是基于光与样品分子的相互作用, 当光子撞击到被测分子上时, 光子和分子产生非弹性碰撞, 光子的能量经碰撞后增加或减少, 即拉曼散射。LSCRM可以获得化合物在样品中的空间分布以及确定组分的相对量、应力和应变状态、结晶度或多晶型结构等特征[52]。然而, 由于激光能量较高, 当使用高功率的激光作为激发光源时, 存在样品烧毁的可能。此外, 具有荧光效应的样品产生的荧光信号也会导致光谱失真, 使一些弱信号无法识别[53]。
X射线断层显微成像技术(X-ray microtomography, X-μCT), 利用X射线的穿透能力对物体进行扫描, 然后将所得信号利用计算机进行处理进而获取图像, X射线计算机显微层析成像是一种非侵入性技术, 可以研究各种物体的内部三维结构。在制药研究中, X射线计算机显微断层扫描可以用于探索在不同成分和压实压力下制备的片剂的断裂模式, 并确定片剂的密度分布[54-56]。X-μCT作为一种强大的工具, 可用于表征涂层粒子的形态, 用于测定涂层的密度、孔隙率、表面/体积比和厚度等参数, 可以提供高水平的微观和宏观尺度的细节[57]。
如前文所述, 光源对于成像技术来讲有着重要的作用, 采用SR-μCT, 将同步辐射光源与高分辨的X射线探测器相结合, 是目前最理想的制剂结构表征技术。同步辐射是一种来自径向加速带电粒子的电磁辐射, 其特点是偏振, 在一个狭窄的锥体中发射, 频率范围覆盖整个电磁谱。同步辐射利用弯转磁铁, 强迫高能电子束在环形的同步加速器中以接近光速做回旋运动, 电子束在改变运动方向时沿切线方向辐射出电磁波。同步辐射的相干性好、亮度高, 获得的图像能够取得更佳的衬度, 空间分辨率也更高[12]。SR-μCT就是用同步辐射X射线波段扫描, 利用旋转样品台从不同角度采集一系列的二维数据, 然后对这些二维数据进行图像处理和配准进行三维重构。在制剂结构的研究分析中, SR-μCT可原位、无损伤地观测制剂或粉体、颗粒等药剂学中间体的结构。相比于其他3D技术手段, SR-μCT能多层次多角度地观测制剂内部结构, 更好地表征制剂内部复杂和不规则的精细结构[58]。结合三维重建与定量分析技术, SR-μCT可获取定量结构参数, 对制剂立体形态进行定量表征, 研究制剂内部粒径分布、晶型、原辅料空间分布和释药过程中的结构变化等。
2.3 药物制剂结构属性的其他表征方法除通过成像方法研究药物制剂结构外, 还可以采用一些间接测定方法如粉末X射线衍射(powder X-ray diffraction, PXRD) 和小角X射线散射(small angle X-ray scattering, SAXS) 等技术获得结构测定的补充信息。
PXRD在药物结构分析中常用于药物多晶型结构鉴定, 可区分药物的不同晶型和无定形状态, 提供有关晶体结构、平均微晶尺寸、取向参数、结晶度和晶体缺陷等信息[59]。PXRD是基于X射线衍射原理, 光在传播过程中遇到障碍物或小孔时, 会偏离直线传播路径而绕到障碍物后面传播, 称为光的衍射。当X射线入射到晶体时, 晶体中规则排列的原子散射的X射线互相干涉, 在特殊方向上产生强X射线衍射, 衍射线在空间分布的方位和强度, 与晶体结构密切相关, 每种晶体所产生的衍射都反映出该晶体内部的原子分布规律。在中药鉴定分析中, PXRD可根据不同种类的中药成分衍射图谱的指纹特征不同, 实现对不同种类中药的微观鉴定, 实现真伪、优劣、分类和药材质量控制目的[60]。
SAXS技术利用了X射线的散射性质。若样品内部纳米尺度的电子密度不均匀, 则散射X射线波长会发生改变, 从样品的不同部分散射的X射线相互干扰, 在检测器上生成空间变化的散射强度模式[61]。SAXS的检测是非破坏性的, 适合测定尺寸为1~1 000 nm数量级范围的结构, 样品可以是气体、液体或固体, 制样简单, 测试快速。利用SAXS可表征颗粒的尺寸、形状和分布等几何参数, 研究颗粒内部封闭的孔洞、缺陷等, 比如活性炭中的小孔, 也可观测纳米给药系统的自组装等动态过程[62]。SAXS揭示了更多样品局部的信息, 是其他结构表征手段的有力补充[63]。
2.4 制剂结构研究技术的特点及其适用范围在药物制剂结构表征方面, 各种二维技术的应用日臻成熟, 近年发展起来的3D表征技术, 能够不破坏药物制剂原始的3D结构, 实现无损检测(表 1)。此外, 荧光显微光学断层成像系统(fluorescence-micro-optical sectioning tomography, f-MOST) 作为一种结构表征新技术, 目前主要应用在神经科学领域, 为今后药物制剂结构研究也提供了一种可能方案[64]。
| Table 1 The classification, features and application range of technologies in structure study. PXRD: Powder X-ray diffraction; SAXS: Small angle X-ray scattering; MRI: Magnetic resonance imaging; LSCRM: Laser scanning confocal Raman microscopy; MOST: Micro-optical sectioning tomography |
为全面认识中药药效的物质基础, 催生出了从结构出发的中药理论和实践[65]。中药制剂的结构药剂学从宏观和微观层面探究制剂结构及其对中药药效发挥的影响。现代中药制剂, 如六味地黄胶囊、藿香正气软胶囊、牡荆油滴丸和微囊片等[66], 不但改善了中药剂型传统的粗放外观, 其更加复杂的内部结构在一定程度上可起到掩味、减少挥发性成分挥发等的效果。因此, 中药制剂结构也是中药质量评价的重要组成内容, 中药制剂结构的研究, 对于中药制剂中间体和制剂的有效性、安全性和质量可控, 尤其是批间均一性, 发挥着积极的作用。
中药制剂结构与化药制剂的结构药剂学特征同中有异。现代中药制剂结构研究与化药制剂在宏观结构上有一定的相似之处, 中药制剂在一、二、三级结构上可充分利用结构药剂学的进展, 加强中药制剂的结构研究; 而因中药的多组分特征, 中药制剂的四级结构(由分子结构为主决定的制剂结构性质)则显著有别于化药制剂。化学药物和辅料多以各种不同的晶型存在, 晶体特征对制剂的精细结构及产品性能有决定性的影响。而中药制剂常出现“药辅合一”的现象, 其制剂成型与药效发挥既与辅料、制剂工艺有关, 也取决于中药; 且中药成分复杂、多以无定型状态存在, 各成分间相互作用, 对制剂结构及释药行为亦有着更复杂的影响。目前, 中药制剂结构研究聚焦在固体制剂及其制剂中间体, 如颗粒剂、片剂、粉体与粒子等, 定量表征中间体与剂型结构, 探索结构对中药制剂产品质量及释药行为的影响, 可有利于对中药制剂结构的认知; 而如何开展多组分中药制剂的分子性质为主的结构药剂学研究, 仍是相对空白的领域。
3.1 中药剂型的结构传统中药制剂技术与现代药物制剂技术相结合形成的现代中药制剂拥有众多剂型, 如丸剂、片剂和胶囊剂等, 各剂型结构迥异。其结构决定了制剂的释放行为、药物疗效等, 是中药制剂设计和评价的关键因素, 因此中药制剂结构研究是现代中药制剂研究的核心要素之一。将制剂的结构划分为四级结构, 并具体阐述各级结构的含义, 从制剂结构的角度为制剂一致性评价提出了新的策略[12]。这反映了制剂结构研究的重要性与现实意义, 也为中药制剂结构研究给出了新方向。
中药颗粒剂是广泛应用的剂型之一。由于制粒工艺与设备不同, 相同处方所制备的颗粒的外在形态和内部结构也存在显著差异, 引起粉体学性质的改变, 从而影响中药制剂的质量, 因此对颗粒的结构研究具有现实意义。现有的技术一般通过SEM、AFM、表面元素分析、PXRD、SR-FTIR和拉曼光谱等对颗粒表面形态、结构和物质组成进行表征。此外, 利用LSCRM、SR-μCT等技术对颗粒精细三维结构的研究方兴未艾, 并展现出巨大的优势。利用SR-μCT对摇摆制粒、流化床制粒及高速搅拌制粒工艺制备的中药颗粒的结构特征进行了定量研究。研究发现3种颗粒在外观形态、真密度、振实密度、堆密度等常规参数上不尽相同, 且利用这些参数并不能轻松辨别不同工艺制备的颗粒。但基于SR-μCT技术和分形学原理建立实体分形维度和表面分形维度参数, 用于表征复杂的不规则颗粒后, 可展现多个常规结构参数所集成反应的结构特征信息, 为中药颗粒的结构表征和工艺评价提供新方法[58]。
中药片剂是传统中草药与现代制剂技术结合的典范, 现阶段有关中药片剂结构研究的报道相对较少, 由于中药片剂与西药片剂有着基本相似的制备工艺, 借鉴西药片剂结构研究的方法与理念, 可以为中药片剂的研究与开发带来一定的启示。在中药制剂生产过程中易出现松片、裂片和崩解迟缓等诸多质量问题, 限制了中药片剂的发展与应用。利用拉曼光谱和SR-μCT等先进的技术对其进行制剂结构研究, 可获得中药片剂的超精细结构, 掌握其活性组分和辅料在片剂内的空间分布状态, 并研究其体外释放过程中中药制剂结构的动态变化[56, 67]。拉曼光谱和SR-μCT等先进技术具有常见显微成像技术不可比拟的优势, 其在中药制剂超精细结构研究中的应用, 有助于研究者从新视角认识中药片剂、解决现有中药片剂难题, 以制备性能更优的中药片剂, 如具有缓释、靶向等功能的中药新型片剂。同时, 仍需加强中药片剂微观内部结构研究, 如片剂内部孔隙度、孔隙分布和孔隙的连通性等, 探索片剂结构与质量的内在关联, 为中药片剂的设计、研发提供理论指导[68]。利用SR-μCT可原位无损地测定蜂胶软胶囊的结构及其内部微粒分布, 从制剂结构层面评价软胶囊的内在质量[69]。在此研究中, 同一批蜂胶软胶囊被分为两组并分别进行6个月的长期试验与加速试验, 两组试验中胶囊囊壁结构均未呈现明显差异, 但胶囊内部结构却显著不同: 相比于长期试验组, 加速试验组胶囊囊壁大部分区域变薄, 且胶囊压缝处变薄现象最为明显。此外, 两组试验中胶囊内容物中均可见大量结晶性微粒析出, 且加速试验组胶囊中析出微粒明显较多, 密集分布在囊壁附近并分层形成空腔结构。该研究展现了软胶囊在长期试验和加速试验下胶囊囊壁和内容物微粒结构及微粒分布的变化, 为软胶囊制剂的逆向工程研究和质量评价提供新方法。
3.2 中药制剂中间体的结构中药粉体是中药固体制剂的重要中间体, 是影响制剂成型的关键因素。中药粉体的结构表征: 在粉体层面包含质构参数等[70, 71]; 在粒子层面包含粒子大小与形态、孔隙率与表面积等; 在分子层面包含无定型状态、晶型等。其结构的差别决定了中药粉体基本性质的不同, 从而引起功能性质迥异, 最终显著影响中药制剂的体内吸收、临床疗效和使用安全性。
中药粉体的质构参数对片剂成型有显著影响。现有中药粉体质构参数的表征包括黏附性(adhesiveness, Ad)、弹性(springiness, Sp)、硬度(hardness, Ha) 和内聚性(cohesiveness, Co)。研究发现, 中药粉体的压缩成型性随着其Co的增加而增加, 其压缩成型性和Ha之间也具有相似的相关性; 中药片剂的快速弹性复原率与中药粉体的Sp具有较高的正相关性; 中药片剂制备过程中的出片力和中药粉体的Ad有较强的相关性, 且随着Ad绝对值的增加而增加。片剂的快速弹性复原率和出片力越大, 表明片剂在制备过程中裂片和黏冲的趋势越明显。因此, 粉体的Ha和Co、Sp与Ad可以分别用作预测片剂压缩成型性、裂片趋势和黏冲现象的结构学参数, 且上述参数均可以通过质构仪的全质构分析(texture profile analysis, TPA) 模式在压片之前进行测试和分析, 操作简便[70, 71]。
中药粉体的制备方法对其结构有显著影响。普通粉碎、研磨和超微粉碎是获取中药粉体的常用手段。加工的时间和程度不同, 粉体的粒度、显微形貌、比表面积等都存在很大的区别。与普通粉碎相比, 经研磨制备的普通中药粗粉, 其粉体颗粒较大且不均匀, 能明显观察到团块状物, 呈现植物组织结构, 如黄芩粗粉微观结构中粒径大小不一, 形状各异且多为圆锥形或束形, 表面较粗糙, 孔沟粗, 并清晰可见其结构组织[72]; 而超微粉碎技术采用现代粉碎工艺, 把中药饮片进行超微粉化(平均粒径≤15 μm), 经超微粉碎后, 中药粉体粒度更加细微、粒径分布均匀且破坏了其原有细胞壁及粗纤维的致密网状结构[73]。中药粉体随着粉碎时间的增加, 粒径不断变小且逐渐变得均匀, 粉体的比表面积和孔隙率不断增大, 有利于有效成分的释放。然而粉碎到一定程度后, 随着粒径的减小, 相关中药粉体的功能性质会朝着不利的方向发展[72, 74]。因此, 应加强粉体性质及药效变化的研究, 确定最优的粉碎工艺与程度。
不同干燥工艺制备的中药粉体在结构上亦有显著差别。喷雾干燥与冷冻干燥所得的六味地黄浸膏粉具有较小的黏性且粉粒较细小、圆整, 压缩度、抗张强度均比真空干燥的大[75]。不同的干燥方式会导致粉体学性质的差异, 继而影响产物的微观形状, 应根据不同制备的需求选择不同的制备工艺。
在分子水平上, 中药粉体成分较复杂, 多以无定型状态存在且易成亚稳定状态。粉体特征容易发生明显的改变, 各成分之间或成分与环境之间会发生吸潮、黏结等[76]。
中药颗粒作为颗粒剂、胶囊剂和片剂的制剂中间体, 其制备工艺显著影响颗粒的结构和形态, 进而影响中药固体制剂后续的分装、压片和灌装过程等, 是决定中药固体制剂质量的主要因素之一。对摇摆制粒、流化床制粒及高速搅拌制粒3种湿法制粒工艺制备的健胃消食颗粒的立体形态及内部精细结构进行定量研究发现, 高速搅拌制粒获得的球形度最好, 表面相对比较光滑, 颗粒内部存在大量空腔; 而用摇摆制粒得到的颗粒多为扁平的不规则形状, 且表面粗糙, 存在大量凸起及凹陷结构, 内部同样存在少量空腔; 流化床制粒三维形态最为复杂和粗糙, 形态结构介于上述两种制粒方法得到的颗粒之间, 类似于两种颗粒的混合体系[58]。
中药微粒制剂不断涌现, 成为中药新型给药系统研究的重要组成部分。微粒的微观形貌和内部结构受到制备过程的显著影响, 决定药物的释放行为和掩味效果, 从而为中药微粒给药系统的制备奠定基础[37]。对中药制剂进行结构改造后的微囊、微球等载药体系相对于原料药有更好的流动性、吸湿性等性质[77, 78]。中药的成分复杂, 难以描述其释放过程, 而中药微粒制剂研究的重点是证明活性成分被微粒包裹并携带至靶器官发挥药效[79], 对结构的研究有助于分析释放过程和证明中药微粒给药系统的实现。中药微囊常发生微囊壁的黏连、塌陷和异常褶痕等现象。因此, 在制备过程中可以通过观察微囊的结构如表面的光滑程度及微囊壁的变化等现象来判定制备的工艺条件是否合适[80]。虽然SEM可以观察到微囊的壁厚和横截面壁面形态, 但测量过程是破坏性的[81]。共聚焦激光扫描显微镜分析技术这一非破坏性方法通常用于囊膜的表征和药物在微囊内部分布状态的观察[82, 83]。通过对中药制剂的结构研究逆向剖析中药微粒给药系统的制备工艺, 为中药制剂的设计和评价提供依据。
脂质体对许多不溶于水或有较大的毒副作用的中药或中药有效成分在增效减毒方面有显著的效果, 能够提高中药在体内的靶向性和稳定性[84], 目前, 已有多种中药成分如喜树碱、紫杉醇、小檗碱、人参皂苷和川芎嗪等被制成脂质体, 在中药制剂中具有重要的开发前景[85-87]。然而由于中药脂质体易发生凝集、融合、渗漏和氧化破裂等现象[88], 大大限制了其作为药物载体的应用, 可借鉴表征微粒结构的技术进行脂质体制剂的结构研究, 为增强中药脂质体的稳定性和制备工艺的优化寻求突破口。
3.3 具有新颖结构的中药制剂产品目前, 关于中药制剂结构药剂学的研究主要集中在微观结构层面, 如片剂内粒子的分布、颗粒剂中黏合剂的分布等[58]; 从宏观结构设计的中药制剂产品, 如具有螺旋桨结构的环形中药泡腾片, 取得了很好的成效[89]。市售中药泡腾片通常为传统的片剂形状, 且由于中药浸膏粉体黏性较强, 导致中药泡腾片崩解速度慢, 影响中药泡腾片的应用。通过制备具有螺旋桨结构的环形中药泡腾片, 可以加速中药泡腾片的崩解与溶出。该环形片由若干分片组成, 各分片之间设置有容易断裂的连接带, 形成螺旋桨结构。在泡腾过程中, 崩解剂从环形片内外两个方向与水作用, 增大了崩解剂与水的接触面积, 使泡腾片在短时间内完全崩解; 同时, 各分片间的连接带断裂后可进一步加快崩解速度[89] (图 11)。

|
Figure 11 Traditional Chinese medicine effervescent tablets with innovative structure. A: Schematic structural image of a ring form punched effervescent tablets with connecting bands; B: The physical map of effervescent tablets |
制剂的结构是特定处方与生产工艺技术共同作用的结果, 并对制剂产品的性质有重要影响。未来可建立更完善、系统的结构表征体系, 从多层次、多维度定量表征制剂原料、制剂中间体和制剂产品的结构参数, 为基于制剂结构的评价研究奠定坚实的基础。
中药制剂的组成复杂, 中药制剂结构研究更具有挑战性, 随着中药物质基础研究和新型中药制剂研究的深入, 中药制剂物质基础逐渐清晰化、制剂结构逐渐精细化, 通过精准调控中药制剂结构, 有望实现对中药制剂从释放特征到制剂结构的优化, 实现证-方-剂对应。中药制剂原料、提取物和中间体等的化学组成和物理结构异质性强, 对中药制剂产品性能的影响有别于化学药物制剂, 开展中药制剂分子层次的制剂结构研究, 是中药制剂结构研究的难点, 仍需发展新颖、有效的方法学。针对中药制剂原料、中间体和制剂产品, 进一步探索并建立具有中药特色的新型结构表征技术, 有助于促进中药制剂现代化的发展, 推进中药制剂的智能化设计。
作者贡献: 杨婷、李哲、冯道明和张莹负责文献查阅和论文撰写; 李晶和许慧鹏协助论文撰写、图片和表格的制作; 许慧鹏和吴文婷负责英文与文本修改; 伍丽、殷宪振、张继稳和朱卫丰确定论文的设计与修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Xu LY, Tao JS, Feng Y, et al. Developments in pharmacy of Chinese herbal medicine in retrospect[J]. Chin Tradit Pat Med (中成药), 2000, 22: 6-21. |
| [2] |
Liu HN, Yang SL, Yang M, et al. Modernization of traditional Chinese medicine manufacturing: research and application of key technologies in industrialization of solid preparations[J]. Mod Chin Med (中国现代中药), 2020, 22: 155-161. |
| [3] |
Wang GZ, Liu J, Huang CB, et al. Effects of Huangqin Qingre Chubi capsule united with Furong ointment on the efficacy and cytokines of acute gouty arthritis[J]. Chin J Clin Healthcare (中国临床保健杂志), 2021, 24: 209-213. |
| [4] |
Pan GY, Ma R, Zhang XL, et al. Network meta-analysis of effect of traditional Chinese medicine injections in adjuvant treatment of mycoplasma pneumonia in children[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 425-435. |
| [5] |
Shou XF, Fan CL. Application of chitosan/alginate biomicro-capsule in sustained release preparation of extraction of traditional Chinese herbs[J]. Prog Mod Biomed (现代生物医学进展), 2008, 8: 955-957. |
| [6] |
Li Y, Pang XC, Yang SS. Study on the molding process and preliminary evaluation of traditional Chinese medicine compound granules modified by Qinggan decoction[J]. West China J Pharm Sci (华西药学杂志), 2019, 34: 573-576. |
| [7] |
Sun WF, Sun RL, Jiang WL, et al. Compound Cordyceps Sinensis liposome oral liquid in treatment of patients with chronic hepatitis B[J]. China Pharm (中国药师), 2003, 6: 438-439. |
| [8] |
Li WH, He Y. Research progress of microparticles as drug delivery system for traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2007, 32: 371-374. |
| [9] |
Zhang DK, Fu CM, Ke XM, et al. Study on theory and application value of "unification of medicines and excipients" in Chinese materia medica preparations[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1921-1929. |
| [10] |
Liu Y, Feng L, Jia XB. Explore and analyze influence factors of quality control on traditional Chinese medicine preparation[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 1808-1813. |
| [11] |
Zeng LH, Wu ZF, Wang F, et al. Status, problems and warranty strategy of quality uniformity for traditional Chinese medicine preparations[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 3826-3830. |
| [12] |
Zhang JW, Meng FY, Xiao TQ. Structure-based strategy for consistency evaluation of dosage forms[J]. Acta Pharm Sin (药学学报), 2017, 52: 659-666. |
| [13] |
Yang S, Yin XZ, Li HY, et al. Research progress on architecture of dosage forms using synchrotron radiation X-ray microtomography[J]. Chin Bull Life Sci (生命科学), 2013, 25: 794-802. |
| [14] |
Huang T, Sun YY, Lin H, et al. Progress in oral osmotic pump preparations of Chinese materia medica[J]. Drugs Clin (现代药物与临床), 2012, 27: 642-646. |
| [15] |
Yin XZ, Li HY, Liu RH, et al. Fractal structure determines controlled release kinetics of monolithic osmotic pump tablets[J]. J Pharm Pharmacol, 2013, 65: 953-959. DOI:10.1111/jphp.12056 |
| [16] |
Wu L, Yin XZ, Guo Z, et al. Hydration induced material transfer in membranes of osmotic pump tablets measured by synchrotron radiation based FTIR[J]. Eur J Pharm Sci, 2016, 84: 132-138. DOI:10.1016/j.ejps.2016.01.020 |
| [17] |
Wu L, Wang LB, Wang SX, et al. Three dimensional structural insight of laser drilled orifices in osmotic pump tablets[J]. Eur J Pharm Sci, 2016, 93: 287-294. DOI:10.1016/j.ejps.2016.08.039 |
| [18] |
Abdul S, Chandewar AV, Jaiswal SB. A flexible technology for modified-release drugs: multiple-unit pellet system (MUPS)[J]. J Control Release, 2010, 147: 2-16. DOI:10.1016/j.jconrel.2010.05.014 |
| [19] |
Cao C, Li Y, Li J, et al. Progress of tableting of coated pellets[J]. Chin J Pharm (中国医药工业杂志), 2017, 48: 631-637. |
| [20] |
Zhang L, Wu L, Wang CF, et al. Synchrotron radiation microcomputed tomography guided chromatographic analysis for displaying the material distribution in tablets[J]. Anal Chem, 2018, 90: 3238-3244. DOI:10.1021/acs.analchem.7b04726 |
| [21] |
Sun X, Wu L, Maharjan A, et al. Static and dynamic structural features of single pellets determine the release behaviors of metoprolol succinate sustained-release tablets[J]. Eur J Pharm Sci, 2020, 149: 105324. DOI:10.1016/j.ejps.2020.105324 |
| [22] |
Sun HY, He SY, Wu L, et al. Bridging the structure gap between pellets in artificial dissolution media and in gastrointestinal tract in rats[J]. Acta Pharm Sin B, 2021. DOI:10.1016/j.apsb.2021.05.010 |
| [23] |
Yin XZ, Li HY, Guo Z, et al. Quantification of swelling and erosion in the controlled release of a poorly water-soluble drug using synchrotron X-ray computed microtomography[J]. AAPS J, 2013, 15: 1025-1034. DOI:10.1208/s12248-013-9498-y |
| [24] |
Yin XZ, Li L, Gu XQ, et al. Dynamic structure model of poly-electrolyte complex based controlled-release matrix tablets visualized by synchrotron radiation micro-computed tomography[J]. Mater Sci Eng C Mater Biol Appl, 2020, 116: 111137. DOI:10.1016/j.msec.2020.111137 |
| [25] |
Tran PHL, Lee BJ, Tran TTD. Strategies and formulations of freeze-dried tablets for controlled drug delivery[J]. Int J Pharm, 2021, 597: 120373. DOI:10.1016/j.ijpharm.2021.120373 |
| [26] |
Liu CB, Guo Z, Li B, et al. Investigation of microstructures of freeze-dried orally disintegrating tablets by synchrotron radiation X-ray computed microtomography[J]. J China Pharm Univ (中国药科大学学报), 2014, 45: 48-53. |
| [27] |
Lund K, Kito H, Skydtsgaard MB, et al. The importance of tablet formulation on allergen release kinetics and efficiency: comparison of freeze-dried and compressed grass pollen sublingual allergy immunotherapy tablet formulations[J]. Clin Ther, 2019, 41: 742-753. DOI:10.1016/j.clinthera.2019.02.008 |
| [28] |
Sun ZY, Zhao HN, Liu ZM. Optimization of 1-deoxynojirimycin controlled-release pellets preparation and its pharmacokinetics study[J]. Biomass Chem Eng (生物质化学工程), 2020, 54: 45-53. |
| [29] |
Nevsten P, Borgquist P, Axelsson A, et al. XEDS-mapping for explaining release patterns from single pellets[J]. Int J Pharm, 2005, 290: 109-120. DOI:10.1016/j.ijpharm.2004.11.022 |
| [30] |
Yang S, Yin XZ, Wang CF, et al. Release behaviour of single pellets and internal fine 3D structural features co-define the in vitro drug release profile[J]. AAPS J, 2014, 16: 860-871. DOI:10.1208/s12248-014-9611-x |
| [31] |
Ansari MA, Stepanek F. Formation of hollow core granules by fluid bed in situ melt granulation: modelling and experiments[J]. Int J Pharm, 2006, 321: 108-116. DOI:10.1016/j.ijpharm.2006.05.012 |
| [32] |
Liu RH, Yin XZ, Li HY, et al. Visualization and quantitative profiling of mixing and segregation of granules using synchrotron radiation X-ray microtomography and three dimensional reconstruction[J]. Int J Pharm, 2013, 445: 125-133. DOI:10.1016/j.ijpharm.2013.02.010 |
| [33] |
Zhang L, Shakya S, Wu L, et al. Multi-dimensional visualization for the morphology of lubricant stearic acid particles and their distribution in tablets[J]. Asian J Pharm Sci, 2020, 15: 60-68. DOI:10.1016/j.ajps.2019.01.001 |
| [34] |
Wu L, Qin W, He YZ, et al. Material distributions and functional structures in probiotic microcapsules[J]. Eur J Pharm Sci, 2018, 122: 1-8. DOI:10.1016/j.ejps.2018.06.013 |
| [35] |
Bale S, Khurana A, Reddy ASS, et al. Overview on therapeutic applications of microparticulate drug delivery systems[J]. Crit Rev Ther Drug Carrier Syst, 2016, 33: 309-361. DOI:10.1615/CritRevTherDrugCarrierSyst.2016015798 |
| [36] |
Li Z, Wu F, Zhao LJ, et al. Evaluation of fundamental and functional properties of natural plant product powders for direct compaction based on multivariate statistical analysis[J]. Adv Powder Technol, 2018, 29: 2881-2894. DOI:10.1016/j.apt.2018.08.009 |
| [37] |
Qin W, He YZ, Guo Z, et al. Optimization of taste-masking onibuprofen microspheres with selected structure features[J]. Asian J Pharm Sci, 2019, 14: 174-182. DOI:10.1016/j.ajps.2018.05.003 |
| [38] |
Li HY, Yin XZ, Ji JQ, et al. Microstructural investigation to the controlled release kinetics of monolith osmotic pump tablets via synchrotron radiation X-ray microtomography[J]. Int J Pharm, 2012, 427: 270-275. DOI:10.1016/j.ijpharm.2012.02.017 |
| [39] |
Wang ML, Lu XL, Yin XZ, et al. Synchrotron radiation-based Fourier-transform infrared spectromicroscopy for characterization of the protein/peptide distribution in single microspheres[J]. Acta Pharm Sin B, 2015, 5: 270-276. DOI:10.1016/j.apsb.2015.03.008 |
| [40] |
Feng J, Guo Z, Wu L, et al. Taste-masking mechanism of layerby-layer self-assembly coating investigated by synchrotron radiation-based Fourier-transform infrared spectromicroscopy[J]. Acta Pharm Sin (药学学报), 2016, 51: 985-990. |
| [41] |
Zeitler JA, Taday PF, Newnham DA, et al. Terahertz pulsed spectroscopy and imaging in the pharmaceutical setting——a review[J]. J Pharm Pharmacol, 2007, 59: 209-223. |
| [42] |
Lyon RC, Lester DS, Lewis EN, et al. Near-infrared spectral imaging for quality assurance of pharmaceutical products: analysis of tablets to assess powder blend homogeneity[J]. AAPS PharmSciTech, 2002, 3: 1-15. |
| [43] |
Binnig G, Quate CF, Gerber C. Atomic Force Microscope[M]. New Jersey: John Wiley & Sons, Ltd., 2001.
|
| [44] |
Edwardson JM, Henderson RM. Atomic force microscopy and drug discovery[J]. Drug Discov Today, 2004, 9: 64-71. DOI:10.1016/S1359-6446(03)02905-2 |
| [45] |
Lamprecht C, Hinterdorfer P, Ebner A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery[J]. Expert Opin Drug Deliv, 2014, 11: 1237-1253. DOI:10.1517/17425247.2014.917078 |
| [46] |
Smith JR, Olusanya TOB, Lamprou DA. Characterization of drug delivery vehicles using atomic force microscopy: current status[J]. Expert Opin Drug Deliv, 2018, 15: 1211-1221. DOI:10.1080/17425247.2018.1546693 |
| [47] |
Pingali KC, Shinbrot T, Cuitino A, et al. AFM study of hydrophilicity on acetaminophen crystals[J]. Int J Pharm, 2012, 438: 184-190. DOI:10.1016/j.ijpharm.2012.08.029 |
| [48] |
Zhang QL, Gladden L, Avalle P, et al. In vitro quantitative H-1 and F-19 nuclear magnetic resonance spectroscopy and imaging studies of fluvastatinTM in Lescol®XL tablets in a USP-Ⅳ dissolution cell[J]. J Control Release, 2011, 156: 345-354. DOI:10.1016/j.jconrel.2011.08.039 |
| [49] |
Zeitler JA, Shen YC, Baker C, et al. Analysis of coating structures and interfaces in solid oral dosage forms by three dimensional terahertz pulsed imaging[J]. J Pharm Sci, 2007, 96: 330-340. DOI:10.1002/jps.20789 |
| [50] |
Haaser M, Naelapaa K, Gordon KC, et al. Evaluating the effect of coating equipment on tablet film quality using terahertz pulsed imaging[J]. Eur J Pharm Biopharm, 2013, 85: 1095-1102. DOI:10.1016/j.ejpb.2013.03.019 |
| [51] |
Niwa M, Hiraishi Y. Quantitative analysis of visible surface defect risk in tablets during film coating using terahertz pulsed imaging[J]. Int J Pharm, 2014, 461: 342-350. DOI:10.1016/j.ijpharm.2013.11.051 |
| [52] |
Costa SGD, Richter A, Schmidt U, et al. Confocal Raman microscopy in life sciences[J]. Morphologie, 2019, 103: 11-16. DOI:10.1016/j.morpho.2018.12.003 |
| [53] |
Zhang X. Development of Methods for Analyzing Raman Imaging Data from Plant Cell Wall and Its Applications (植物细胞壁拉曼光谱成像数据分析方法构建及其应用) [D]. Beijing: Beijing Forestry University, 2018.
|
| [54] |
Busignies V, Leclerc B, Porion P, et al. Quantitative measurements of localized density variations in cylindrical tablets using X-ray microtomography[J]. Eur J Pharm Biopharm, 2006, 64: 38-50. DOI:10.1016/j.ejpb.2006.02.007 |
| [55] |
Sinka IC, Burch SF, Tweed JH, et al. Measurement of density variations in tablets using X-ray computed tomography[J]. Int J Pharm, 2004, 271: 215-224. DOI:10.1016/j.ijpharm.2003.11.022 |
| [56] |
Tokudome Y, Ohshima H, Otsuka M. Non-invasive and rapid analysis for observation of internal structure of press-coated tablet using X-ray computed tomography[J]. Drug Dev Ind Pharm, 2009, 35: 678-682. DOI:10.1080/03639040802587807 |
| [57] |
Perfetti G, Van De Casteele E, Rieger B, et al. X-ray micro tomography and image analysis as complementary methods for morphological characterization and coating thickness measurement of coated particles[J]. Adv Powder Technol, 2010, 21: 663-675. DOI:10.1016/j.apt.2010.08.002 |
| [58] |
Lu XL, Zheng Q, Yin XZ, et al. Quantitative structure characteristics and fractal dimension of Chinese medicine granules measured by synchrotron radiation X-ray computed micro tomography[J]. Acta Pharm Sin (药学学报), 2015, 50: 767-774. |
| [59] |
Pandey A, Dalal S, Dutta S, et al. Structural characterization of polycrystalline thin films by X-ray diffraction techniques[J]. J Mater Sci Mater Electron, 2021, 32: 1341-1368. DOI:10.1007/s10854-020-04998-w |
| [60] |
Chang Y, Zheng QT, Lv Y. The application of X-ray diffraction analysis in pharmaceutical research[J]. Physics (物理), 2007, 36: 452-459. |
| [61] |
Tian YW, Jacobs E, Jones DS, et al. The design and development of high drug loading amorphous solid dispersion for hot-melt extrusion platform[J]. Int J Pharm, 2020, 586: 119545. DOI:10.1016/j.ijpharm.2020.119545 |
| [62] |
Esra IA, Burcu Y, Gizem B, et al. Advances in microfluidic synthesis and coupling with synchrotron SAXS for continuous production and real-time structural characterization of nano-selfassemblies[J]. Colloids Surf B Biointerfaces, 2021, 201: 111633. DOI:10.1016/j.colsurfb.2021.111633 |
| [63] |
Lombardo D, Calandra P, Kiselev MA. Structural characterization of biomaterials by means of small angle X-rays and neutron scattering (SAXS and SANS), and light scattering experiments[J]. Molecules, 2020, 25: 5624. DOI:10.3390/molecules25235624 |
| [64] |
Sun X, Zhang XC, Ren XH, et al. Multiscale co-reconstruction of lung architectures and inhalable materials spatial distribution[J]. Adv Sci, 2021, 8: 2003941. DOI:10.1002/advs.202003941 |
| [65] |
Qiao HZ, Di LQ, Ping QN, et al. Structural Chinese medicine: new research field on the pharmacodynamic substance basis of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2021, 46: 2443-2448. |
| [66] |
Zhang Q, Wu FL. Pharmaceutics (药剂学)[M]. Beijing: Peking University Medical Press, 2005.
|
| [67] |
Jelcic Z, Hauschild K, Ogiermann M, et al. Evaluation of tablet formation of different lactoses by 3D modeling and fractal analysis[J]. Drug Dev Ind Pharm, 2007, 33: 353-372. DOI:10.1080/03639040701199241 |
| [68] |
Li YN, Wu ZF, Wan N, et al. Current situations and problem analysis of influencing factors of traditional Chinese medicine tablets on forming quality[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 1547-1553. |
| [69] |
Xiong T, Wu L, Peng H, et al. In situ characterization of structural change and internal particle distributions of soft capsules based on synchrotron radiation X-ray micro computed tomography[J]. Acta Pharm Sin (药学学报), 2020, 55: 1030-1034. |
| [70] |
Li Z. Design, Tableting Performance Improvements, and Mechanism Analysis about TCM-Based Composite Particles (中药复合粒子设计及其压片关键性能改善与机制研究) [D]. Shanghai: Shanghai University of Traditional Chinese Medicine, 2019.
|
| [71] |
Li Z, Zhou MM, Wu F, et al. Direct compaction properties of Zingiberis Rhizoma extracted powders coated with various shell materials: improvements and mechanism analysis[J]. Int J Pharm, 2019, 564: 10-21. DOI:10.1016/j.ijpharm.2019.04.021 |
| [72] |
Wang NM, Zhang DK, Yang M, et al. Influence of superfine grinding on micromeritic properties of Scutellaria baicalensis[J]. J Chin Med Mater (中药材), 2013, 36: 640-644. |
| [73] |
Li YB, Li J, Liu BY, et al. Application overview on traditional Chinese medicine with ultra-fine powder[J]. China J Tradit Chin Med Pharm (中华中医药杂志), 2020, 35: 4568-4570. |
| [74] |
Xu JR, Zhang QD, Jiang QY, et al. Particle characterization of Ophiopogon japonicus ultra-fine powder[J]. Southwest China J Agri Sci (西南农业学报), 2008, 21: 1676-1678. |
| [75] |
Hu RF, Lv XP, Zhang L, et al. Evaluation of powder properties of the drying process, Liuwei Dihuang extract[J]. Chin J Biochem Pharm (中国生化药物杂志), 2012, 33: 594-596. |
| [76] |
Pan YP, Zhang ZH, Jiang YR, et al. Advances in studies on modification technology of traditional Chinese medicine powders[J]. China J Chin Mater Med (中国中药杂志), 2013, 38: 3808-3813. |
| [77] |
Han J, Li Z, Liu CB, et al. Preparation and characterization of tiamulin-fumarate masking microcapsule by spray drying[J]. Chin J Antibiot (中国抗生素杂志), 2008, 33: 359-362. |
| [78] |
Feng Y, Zhang Y, Yang Y, et al. Influence factors on preparation of Citrus Volatile oil microcapsules by spray drying technique[J]. Chin Tradit Herb Drugs (中草药), 2007, 38: 1480-1484. |
| [79] |
Zhang YH, Xu JC, Xiao L, et al. Application and development of microencapsulation technique in Chinese materia medica preparation[J]. Chin Tradit Herb Drugs (中草药), 2005, 36: 455-458. |
| [80] |
Han LL, Bi LW, Zhao ZD, et al. Research progress in application and characterization of microcapsules[J]. New Chem Mater (化工新型材料), 2013, 41: 178-180. |
| [81] |
Torras C, Pitol L, Garcia-Valls R. Two methods for morphological characterization of internal microcapsule structures[J]. J Membr Sci, 2007, 305: 1-4. DOI:10.1016/j.memsci.2007.06.056 |
| [82] |
Han WY, Zhao YX, Gong P. Development of the structures and characteristics of microcapsules[J]. China Biotechnol (中国生物工程杂志), 2010, 30: 104-110. |
| [83] |
Chen HM, Ouyang W, Lawuyi R, et al. A new method for microcapsule characterization-use of fluorogenic genipin to characterize polymeric microcapsule membranes[J]. Appl Biochem Biotechnol, 2006, 134: 207-221. DOI:10.1385/ABAB:134:3:207 |
| [84] |
Gao CF, Xia JX, Zhu Y, et al. Application of nanotechnology in improving druggability of active ingredients of Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2018, 49: 2754-2762. |
| [85] |
Watanabe M, Kawano K, Toma K, et al. In vivo antitumor activity of camptothecin incorporated in liposomes formulated with an artificial lipid and human serum albumin[J]. J Control Release, 2008, 127: 231-238. DOI:10.1016/j.jconrel.2008.02.005 |
| [86] |
Cui YQ, Yang P, Sun P, et al. Preparation of PEGylated liposomal ginsenoside; formulation design and in vitro evaluation[J]. Indian J Pharm Sci, 2020, 82: 149-156. |
| [87] |
Yang YH, Wang QQ, Li J, et al. Ligustrazine-loaded stealth liposomes: cellular uptake in murine phagocyte cell model and pharmacokinetics in rats[J]. Lat Am J Pharm, 2016, 35: 32-37. |
| [88] |
Zhu YQ, Shi SL. Progress in the study of stability of Chinese medicine liposomes[J]. Acta Pharm Sin (药学学报), 2009, 44: 1211-1215. |
| [89] |
Rao XY, Luo XJ, Liu HN, et al. Counterflow cold effervescent tablets: CN, 102100902A[P/OL]. 2011-06-22.
|
 2021, Vol. 56
2021, Vol. 56


