中药活性成分在临床治疗中可提高疗效和安全性, 对维护人类健康做出了重要贡献[1]。然而中药中60%以上的化学成分存在如溶解度低、熔点高和稳定性差等问题, 使其难以经口服吸收, 生物利用度低, 严重制约了中药活性成分的研发与制剂开发。如葛根素具有抗氧化、保肝、抗癌和雌激素样作用等药理活性, 但葛根素属于生物药剂学分类系统(biopharmaceutics classification system, BCS) Ⅳ药物, 水溶性与渗透性差是导致其口服生物利用度低的主要因素[2]; 灯盏花素具有抗炎、抗氧化、抗纤维化、抗肿瘤和改善心脑缺血损伤等生物活性, 但水溶性差和半衰期短等问题不利于口服给药[3]。丹参酮IIA已被证实具有增加冠脉流量、缩小心肌梗死面积、抗心肌缺血及抑制血小板聚集等作用, 但水溶性差、生物利用度低及稳定性差等问题限制了其在心脑血管疾病中的应用[4]。
药学研究者采取了许多制剂学的手段解决以上问题, 如固体分散体技术、自乳化技术、环糊精包合技术和磷脂复合技术等改善中药活性成分的溶解度及生物利用度。尽管这些技术在一定程度上解决了中药活性成分溶解性差的问题, 但以上技术依旧存在缺陷。如固体分散体存在久贮易产生老化现象及体内外相关性差等问题[5], 自乳化系统存在大量表面活性剂导致的毒性及处方的多样性对给药系统性质的影响等问题[6], 环糊精包合物技术存在不适宜工业化大生产、载药量低等问题。因此, 解决中药活性成分溶解度低、熔点高和稳定性差等问题仍是药学研究者面临的一个挑战, 是中药活性成分研究的热点。
除上述制剂技术外, 药物的存在形式也对改善中药活性成分的理化特性具有重要影响, 如晶型结构和存在相态等[7]。其中, 药物晶型结构在改善中药活性成分的理化特性或功效方面具有重要作用。由于药物分子在晶格中的空间排列和构象的多样性, 药物的晶型也有很大差异。药物的晶型差异可影响其溶解度、溶出速率、吸湿性、稳定性和生物利用度等理化性质或特性, 以及药物的药效和安全性等性质[8]。随着晶体工程学的发展, 研究发现药物晶体结构可在不改变药物分子结构的前提下, 优化药物的物理化学性质, 提高其生物性能[9]。根据结晶药物分子构象、分子排列和组分种类的不同, 可将其分为多晶型、共晶型、无定形、共无定形和纳米晶体等固体形态[10], 固体晶型形态见图 1。本文从以上几个方面总结了几种晶型在中药活性成分方面的研究进展, 综述了晶型结构对中药活性成分物理和化学性质变化的影响, 为中药活性成分制剂研究和开发提供依据。
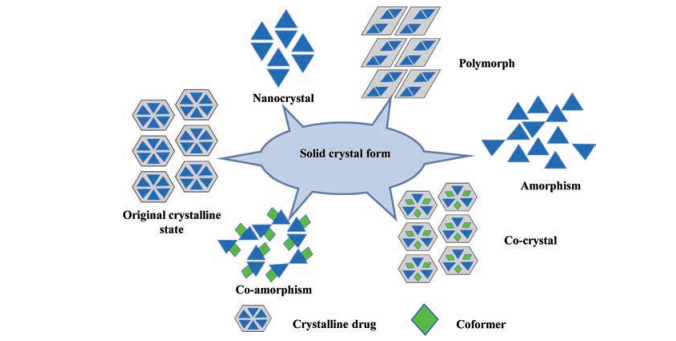
|
Figure 1 The morphology of solid crystal form |
多晶型是指具有恒定的化学成分, 且能够存在于多个晶体结构中的晶体, 是制药工业中常见的一种现象[11]。药物多晶型产生的原因主要为药物分子的排列不同、分子构象不同及结晶水、晶体溶剂的介入等。一般认为药物多晶型包括构象多晶型、构型多晶型、色多晶型和假多晶型4种类型。这种内部结构的差异会导致不同晶型表现出不同的物理性质, 如溶解度、溶出速度、密度、熔点和硬度等, 以及特定的物理化学稳定性和可加工性(粉体流动性、压缩性、吸湿性等), 同时药物多晶型对药物的生物药剂学性质也有影响, 包括生物利用度、疗效、生物活性、不良反应和生物降解性等。多晶型在中药活性成分中也较为常见, 因此研究和掌握中药活性成分多晶型性质对中药活性成分制剂提高稳定性、生物利用度及降低毒副作用具有重要意义(表 1)[12-18]。
| Table 1 Polymorphs of active components in traditional Chinese medicine. API: Active pharmaceutical ingredient; NA: Not available; ↑: Increase; ↓: Decrease |
药物共晶是指活性药物成分(active pharmaceutical ingredient, API) 和共晶形成物在氢键或其他非共价键的作用下形成具有特定理化性质的新型共结晶物。近年来, 通过药物共晶的方法可在不改变API分子间共价键的情况下, 使药物达到改善药物物理化学性质的作用(如溶解度、溶出度、生物利用度和稳定性等)[19, 20]。共晶的形成为无定形或难结晶的API转变为易处理、稳定的固体结晶提供了空间。然而近期研究发现, 影响候选药物进入临床试验的主要原因为药物成药性差和生物利用度低, 而不是药物的毒性与缺乏药效[21]。尽管非晶型API被广泛使用并制备成越来越多的剂型种类, 但晶型药物因其更易表征, 具有可重复性、更低的吸湿性及更好的化学稳定性而受到普遍青睐。同时, 药物共晶的形成也为水溶性差的API制剂成型提供了较大的空间[22]。因此共晶技术在中药活性成分中得到了广泛应用(表 2)[23-33]。
| Table 2 Co-crystals of active components in traditional Chinese medicine |
无定形态是一种特殊的物质晶型状态, 无定形在热力学上属于亚稳态, 易转化为较稳定的晶型。与晶型药物不同, 无定形药物由于分子缺乏长程有序, 在分子水平上其物理结构更加无序, 增加了吉布斯(Gibbs) 自由能, 降低了溶解过程中所需的晶格能。因此, 无定形药物比晶型药物具有更高的溶解度和溶出速率[34]。正如Hancock和Parks[35]所报道, 无定形药物溶解度可比晶型药物溶解度高10倍或数百倍, 无定形药物饱和溶解度的显著增加可导致口服生物利用度显著提高。基于无定形药物不稳定性的缺点及共晶药物的原理, 近年来又出现了一种新的药物固体形态即共无定形。共无定形是一种单相无定形二元体系, 既能提高药物的稳定性, 又能改善药物的溶解度与溶出速率; 同时可将两种具有协同作用的药物组合, 提高其临床疗效, 减少药物的毒副作用。根据组成成分的不同, 可将共无定形药物分为两类: ① API-药用辅料共无定形; ② API1-API2共无定形(API1为活性药物成分, API2为与活性药物成分具有协同药理作用或联合用药活性药物成分)[36]。表 3[37-42]概述了无定形/共无定形技术在中药活性成分中应用的情况。
| Table 3 Amorphous and co-amorphous of active components in traditional Chinese medicine. CA: Co-amorphous |
| Table 4 Nanocrystals of active components in traditional Chinese medicine. NC: Nanocrystal; NG: Nanocrystal in situ gel; PM: Physical mixture; NP: Nanosuspension powder |
近年来, 为解决难溶性药物的溶解和溶出速率等问题, 纳米技术与药学相结合, 从而衍生出纳米药物, 如脂质体、纳米乳和纳米粒等多种技术。而在这些纳米技术中, 纳米晶体技术受到了广泛关注[43]。纳米晶体是在高强度机械力作用下使药物粒径由微米级别减小至纳米级别, 并在少量稳定剂的作用下形成纳米晶体颗粒, 药物颗粒的理化性质发生改变, 使药物具有不同于其他普通制剂的特殊理化性质, 如可显著提高药物的可润湿性、溶解度及溶出速度, 因其具有巨大的表面积, 可增强与生物膜之间的黏附性, 延长在体内的滞留时间, 从而提高药物的生物利用度[44]。目前, 纳米晶体在许多给药系统中表现出巨大的优势, 如口服给药系统、静脉给药系统、经皮给药系统和靶向给药系统。迄今为止, 基于纳米晶体技术的商业药物产品大约有10种, 超过20种产品处于不同的临床阶段。因此, 将纳米晶体技术运用于中药活性成分具有巨大的市场前景。表 4[3, 45-51]概述了纳米晶体技术在中药活性成分中应用的情况。
2 药物晶型结构对中药活性成分理化性质的影响 2.1 药物晶型结构对中药活性成分熔点的影响 2.1.1 多晶型对中药活性成分熔点的影响影响药物熔点的主要因素包括药物分子的晶型结构、空间构象、化学结构和分子间作用力等。一般来说, 熔点高的药物稳定性好, 但溶解度及溶出度相对较差, 导致药物的生物利用度低, 无法满足临床的用药需求。但药物熔点太低则会对药物的加工处置、干燥及稳定性产生一定影响。Nie等[15]以无水的脱水穿心莲内酯和含水的升麻素苷为例, 利用差热分析和红外光谱扫描技术, 结合显微和熔点测定, 对中药化学对照品的多晶型现象进行了初探。分别取脱水穿心莲内酯对照品和升麻素苷对照品各2批次, 编号为T1、T2和S1、S2。熔点测定结果表明, T1、T2的熔点范围分别为204.2~205.1 ℃和189.5~190.6 ℃; S1、S2的熔点范围分别为124.7~126.9 ℃和129.6~132.8 ℃, 故晶型的不同可能导致熔点的差异。
2.1.2 共晶对中药活性成分熔点的影响共晶是由于另一种组分的引入, 晶体内分子间作用力发生改变, 因此与原药相比会发生熔点的变化。Schultheiss等[52]对50种共晶的熔点进行研究, 26/50 (52%) 共晶的熔点介于API和客分子之间, 而19/50 (38%) 共晶的熔点低于API或客分子, 只有3/50 (6%) 共晶的熔点较高, 2/50 (4%) 共晶的熔点与API和客分子相同。Karki等[26]采用研磨法制备了青蒿素(ART) 与间苯二酚(RES) 或3, 5-二羟基甲苯(ORC) 的共晶化合物ART-RES与ART-ORC。差示扫描量热分析(differential scanning calorimetry, DSC) 检测结果表明, 两种晶型的熔点分别为103和110 ℃ (已知两种青蒿素无定形态的熔点分别为152与110 ℃)。Xue等[27]筛选了没食子酸(GA) 的两种共晶: GA-对氨基苯甲酸(共晶A) 和GA-氨基乙酸(共晶B)。DSC检测结果表明, 没食子酸、对氨基苯甲酸(PABA) 和共晶A的熔点分别为272.7、192.7和179.9 ℃, 表明共晶A的熔点低于没食子酸与PABA。没食子酸、氨基乙酸(AAA) 与共晶B的熔点分别为272.7、268和164 ℃, 表明共晶B的熔点低于没食子酸与AAA, 与共晶A的结果类似。
2.1.3 纳米晶体对中药活性成分熔点的影响纳米晶体主要是无定形态和结晶态之间的转化, 药物由于晶型不同, 其理化性质如熔点和溶解性等也有所差异。而这个转化过程受温度、分散介质、稳定剂与晶粒等因素的影响[53]。Wang等[45]采用P188制备姜黄素纳米晶体, DSC研究表明, 姜黄素原料药的熔点为180 ℃, 姜黄素纳米晶体冻干粉的熔点为125 ℃。熔点的降低可能是由于姜黄素纳米晶体冻干粉中P188含量较高所致。Xiong等[46]采用反溶剂沉淀法制备白藜芦醇纳米晶体, DSC结果表明白藜芦醇原料药、物理混合物和白藜芦醇纳米晶体的熔点均为230 ℃, 表明白藜芦醇为晶体形态。
2.2 药物晶型对中药活性成分溶解/溶出度的影响 2.2.1 多晶型对中药活性成分溶解溶出度的影响溶解度是影响药物生物利用度最关键和最重要的参数之一, 中药活性成分多晶型内部结构的差异会导致不同晶型间表面化学性质的不同, 从而导致中药活性成分溶解度及溶出度的差异[54]。Yang等[16]研究表明芒果苷有5种晶型, 包括已报道的无水和水合物, 以及3种新多晶型, 分别命名为晶型Ⅰ、Ⅱ、Ⅲ、Ⅳ和Ⅴ。溶解度实验结果表明, 由于晶型Ⅴ为无定形状态, 在第一阶段(60 min前) 晶型Ⅴ的溶解速率快于晶型Ⅰ、Ⅱ。在60 min后, 晶型Ⅴ的溶解速率达到平台。在盐酸溶液(pH 1.0) 介质中, 晶型Ⅰ的溶解速率介于晶型Ⅱ和晶型Ⅴ之间, 可以达到与晶型Ⅴ相同的溶解度, 比晶型Ⅱ的溶解速率高20%。在纯水介质中(pH 7.0), 晶型Ⅴ的溶出速率最高, 但晶型Ⅱ的溶出速率稍快于晶型Ⅰ。尽管不同晶型溶出速率存在差异, 但在300 min后所有芒果苷的晶型几乎达到了相同的溶解度。Gong等[17]研究得到鬼臼毒素2种晶型结构, 分别命名为晶型Ⅰ和Ⅱ, 由固有溶出速率实验结果(溶出介质为pH 4.5缓冲液及pH 7.0纯水介质) 可知, 在两种溶出介质中非晶型鬼臼毒素在第一阶段(90 min前) 比晶型Ⅰ和Ⅱ的溶出速率更快, 90 min后非晶型鬼臼毒素的溶出速率达到平台。这种现象推测, 非晶态多晶型具有最高能量, 因而较易达到平衡, 药物的溶解度与晶体中晶格堆积方式密切相关。晶型Ⅱ在两种介质中的溶解度均高于晶型Ⅰ, 表明晶型Ⅱ可提高其口服生物利用度。
2.2.2 共晶对中药活性成分溶解溶出度的影响研究表明, 共晶也是有效改善药物溶解度与溶出速率的方法之一。由于形成共晶后药物原有的晶格堆积和分子排列方式发生了变化, 药物溶解时与溶剂之间的相互作用发生改变, 特别是溶液中共晶的形成可能会影响这种溶质-溶剂相互作用或改变原溶剂的一些性质, 如pH值。因此, 共晶形成后药物的溶解度可能会得到提高。Sowa等[24]采用溶剂滴磨法成功制备了染料木素和咖啡因摩尔比为1∶1的共晶, 并采用溶液蒸发法分离。在50∶50乙醇-水介质中的溶出度研究表明, 染料木素的溶解度从0.588 mg·mL-1提高到0.861 mg·mL-1。Bethune等[28]成功将紫檀芪和哌嗪制成共晶产物, 溶解度结果表明, 紫檀芪和哌嗪共晶的溶解度约是原料药的6倍。Chen等[31]对难溶性天然药物化合物黄曲霉毒素(XT) 进行了全面的共晶研究, 得到了黄曲霉毒素-对氨基苯甲酸(XT-PABA) 和黄曲霉毒素-草酸(XT-OA) 共晶。动力学溶解度研究表明, 在盐酸缓冲溶液中, XT在60 min内达到平台, 质量浓度约为78 μg·mL-1, 而XT-OA和XT-PABA的表观溶解度分别为94和86 μg·mL-1。同时, XT-OA和XT-PABA共晶在盐酸缓冲溶液中出现了“弹跳-伞降”现象。药物共晶的“弹跳-伞降”模型可有效提高难溶性药物的溶解度、溶出速率与生物利用度等。
2.2.3 无定形共无定形对中药活性成分溶解溶出度的影响无定形药物的粒子表面容易水化, 水化后产生的水化膜具有反絮凝作用。无定形使药物更易于分散, 增大药物粒子与溶剂之间的接触面积可改善药物的溶解度和溶出速率。将药物从晶态转变成无定形态成为提高难溶性药物溶解度和溶出速率最常用的策略之一。为提高无定形药物的稳定性, 可利用载体材料的抑晶作用和较高的玻璃化转变温度使无定形药物稳定存在。无定形固体分散体在接触胃肠液后可迅速溶出而显著改善药物的溶解特性。Wu等[37]以烟酰胺(NIC) 为配体通过减压旋蒸法制备了葛根素(PUE)-NIC共无定形体系。饱和溶解度结果表明, 与PUE晶体相比, 在溶出过程中共无定形不仅发生“液-液相分离”现象, 并且PUE与NIC还可形成摩尔比为1∶1与1∶2的Ap型络合物, 这有利于显著增加PUE的溶解度, 并能维持长时间的药物过饱和态的优势, 有利于药物吸收。Uchiyama等[39]采用高温熔融猝灭法制备柚皮素-橙皮素无定形复合物。研究结果表明, 柚皮素-橙皮素无定形复合物可显著改善柚皮素和橙皮素在水中的溶解度。此外, 柚皮素-橙皮素无定形复合物可增强柚皮素和橙皮素在油组分中的溶解度。
2.2.4 纳米晶体对中药活性成分饱和溶解度溶出度的影响由Ostwald-Freundlich和Noyes-Whitney方程可知, 纳米粒的半径减少可使药物饱和溶解度、比表面积及溶出速度增加[55]。同时Prandtl方程表明, 纳米粒扩散层厚度减小, 也可加快溶出[56]。Zhang等[47]采用超临界反溶剂法制备了芹菜素纳米晶体, 体外溶出度结果表明, 芹菜素原料药与纳米晶体的溶出度均在45 min达到平台, 但芹菜素纳米晶体的溶出速度更快且累计溶出浓度更大, 该结果可归因于其粒径显著减小导致的饱和溶解度增大的现象。Chen等[48]采用高压均质法制备灯盏花素纳米晶体混悬液, 并采用喷雾干燥技术对灯盏花素纳米晶体混悬液进行固化得到灯盏花素固体纳米晶体。体外释放结果表明, 将灯盏花素制备为纳米晶体可显著提高灯盏花素的溶出度。
2.3 药物晶型对中药活性成分稳定性的影响 2.3.1 多晶型对中药活性成分稳定性的影响药物的稳定性是除溶解度以外药物最重要的性质, 不同晶型药物的稳定性也不同[57]。如化合物具有多晶型, 而多晶型药物就可能存在多个熔点, 低熔点的亚稳态晶型在加热过程中可能会再结晶和再熔融[58], 在给定温度下只有一个晶型是热力学稳定的。因此可通过某种晶型和混合晶型的比例以提高药物的稳定性和活性。多晶型通常具有不同的自由能和物理化学性质, 根据热力学可知稳定的多晶型具有最低的Gibbs自由能, 因此在任何溶剂中的溶解度最低。Wang等[12]研究表明莽草酸有3种晶型, 分别为晶型A、B和C。其中莽草酸晶型B和C属于亚稳晶型, 在高湿及高温条件下会缓慢地向晶型A转化。但晶型A为晶型物质, 稳定性较好。Li等[14]对银杏内酯B进行多晶型筛查, 并制备了6种不同的晶型(A~F型), 不同晶型进行表征分析结果表明, 无溶剂晶型F型为稳定晶型。Ding等[18]研究发现20(R)-25-甲氧基-达玛烷-3, 12, 20-三醇(从水解的三七总皂苷中分离得到一种新的三萜皂苷) 具有3种晶型, 分别为晶型Ⅰ、Ⅱ及Ⅲ。稳定性研究表明, 在室温条件下晶型Ⅱ可转变为晶型Ⅰ, 推测晶型Ⅰ较晶型Ⅱ更稳定。晶型ⅡⅠ的稳定性要弱于晶型Ⅰ和晶型Ⅱ。
2.3.2 共晶对中药活性成分稳定性的影响研究表明, 许多药物分子具有能与客分子相互作用的官能团, 故可通过引入合适的客分子来改变药物酸碱微环境以提高API的稳定性[59]。例如, 将易水解的药物制备为药物共晶后, 形成新的原子空间排列方式、顺序和空间三维结构堆积, 使其化学稳定性提高。Liu等[30]成功制备了大黄酸赖氨酸共晶, 建立大黄酸赖氨酸定量分析模型考察了高温、高湿、光照及以水为黏合剂制粒过程中大黄酸赖氨酸的量变化。结果表明, 在不同环境因素影响下, 大黄酸赖氨酸共晶的性能保持稳定, 同时其在模拟湿法制粒过程中也能保持稳定。Suresh等[33]利用溶剂辅助研磨法对穿心内酯和共晶配体(香草醛、香草酸、水杨酸、间苯二酚、愈创木酚) 进行多晶型筛选。结果表明, 穿心莲内酯-水杨酸共晶完全抑制了穿心莲内酯向无活性硫酸盐代谢物的化学转化, 提高了穿心莲内酯原料药的化学稳定性, 且其溶出比穿心莲内酯原料药快3倍, 药物释放量比穿心莲内酯原料药高2倍。
2.3.3 无定形共无定形对中药活性成分稳定性的影响无定形药物由于其亚稳态结构, 导致无定形药物的稳定性较差。相较于无定形药物, 将药物制成共无定形后, 可提高无定形药物的物理稳定性[60]。Liu等[38]通过喷雾干燥法制备葛根素-水飞蓟宾共无定形(PUE-SLB CA), 稳定性实验结果表明PUE-SLB CA中的SLB物理稳定性显著高于无定形SLB, 表明共无定形系统能显著提高其稳定性。Uchiyama等[39]制备了柚皮素-橙皮素无定形复合物, 研究结果表明, 柚皮素-橙皮素无定形复合物可提高柚皮素和橙皮素的物理稳定性。Chen等[40]分别采用水杨酸(SAA)、2, 3-二羟基苯甲酸(23DHB) 和2, 4-二羟基苯甲酸(24DHB) 3种酚酸作为共无定形形成剂, 制备了3种二元青藤碱(SIN)-酚酸共无定形体系。研究结果表明, 在3种共无定形体系中, SIN-24DHB在低湿度和加速贮藏条件下均表现出较好的物理化学稳定性; 与晶型青藤碱相比, 3种共无定形态更易溶解。
2.3.4 纳米晶体对中药活性成分稳定性的影响纳米晶体混悬液属于热力学与动力学不稳定体系, 因此其物理稳定性差, 在贮存过程中会产生晶体长大、粒子聚集与沉降的现象。纳米粒的产生过程消耗自由能, 因此粒子有自动聚集以减少体系表面能的趋势, 增加粒子碰撞的机会, 同时粒子之间存在强烈的相互吸引, 粒子容易发生不可逆的聚集以减少其表面能。纳米晶体混悬液因其具有物理稳定性差的特点严重限制了其在临床的应用。将固化技术(喷雾干燥、冷冻干燥等) 运用于纳米晶体混悬液的固化过程中, 使纳米晶体混悬液固化为固体纳米晶体, 不仅可克服纳米晶体混悬液的热动力不稳定状态, 以提高系统稳定性, 同时方便患者携带和使用[61]。Chen等[49]采用高压均质法制备了穿心莲内酯纳米晶体混悬液, 并采用冷冻干燥技术将纳米晶体固化为穿心莲内酯固体纳米晶体, 短期稳定性研究结果表明, 穿心莲内酯纳米晶体在贮藏条件下的再分散性变化不大, 表明其稳定性良好。Jin等[50]成功制备了黄芩苷纳米晶体混悬液, 并采用流化床法固化为黄芩苷固体纳米晶体。稳定性研究结果表明, 经过流化床固化后的黄芩苷纳米晶体具有良好的稳定性。
3 药物晶型技术改善中药活性成分功效方面的研究进展 3.1 多晶型技术药物分子的固体存在形态可影响药物分子空间排列的顺序, 进而影响药物的溶出速率和溶出程度, 故会对药物的生物利用度产生影响, 从而直接影响中药活性成分功效的强弱。Li等[14]对银杏内酯B进行多晶型筛查, 并制备了6种不同的晶型(A~F型), 研究银杏内酯B晶型A和F对谷氨酸诱导PC12细胞损伤的保护作用, 使用钙超载、细胞膜通透性及氧化应激等分子机制比较银杏内酯B晶型A和F的药理作用, 实验结果表明, 银杏内酯B原药与晶型F均能显著降低谷氨酸导致的细胞内钙离子浓度升高, 且银杏内酯B晶型F的抑制作用更加明显。银杏内酯B原药与晶型F均能显著抑制谷氨酸导致的PC12细胞乳酸脱氢酶(lactate dehydrogenase, LDH) 的释放, 但原药与晶型F相比无显著性差异; 银杏内酯B原药与晶型F均能显著降低谷氨酸导致的细胞内丙二醛(malonaldehyde, MDA) 水平的升高, 且银杏内酯B晶型F的抑制作用更加明显, 确定晶型F为优势药用晶型。Gong等[62]研究表明虎杖苷具有2种晶型, 分别命名为晶型A和B。药动学结果表明, 晶型B比晶型A的吸收更快、吸收峰较大。晶型B在动物体内可长期维持, 吸收约为晶型A的1.5倍。Ding等[18]研究发现20(R)-25-甲氧基-达玛烷-3, 12, 20-三醇具有3种晶型, 分别为晶型Ⅰ、Ⅱ及Ⅲ。药动学结果表明, 3种晶型的绝对生物利用度分别为6.17% (Ⅰ)、4.17% (Ⅱ) 和5.42% (Ⅲ), 说明即使在多晶型中药物具有相同的构型, 但不同的构象、相互作用及堆积方式直接影响中药活性成分的生物利用度。通常稳定型晶型具有高熔点、晶格能大的优势, 但其溶解度及溶出速率低; 不稳定晶型则恰好相反, 但在制备或贮存过程中, 不稳定晶型易转变为稳定晶型或亚稳晶型; 亚稳晶型则介于两者之间, 易受外界因素(湿度、压力、温度等) 影响转变为稳定晶型, 从而导致药物溶解度降低而影响药物的疗效。因此, 在制剂开发中常选择热力学最稳定的晶型进行产品开发。但对于BCS Ⅱ类药物, 为提高药物的溶解度及生物利用度, 也常采用亚稳晶型进行开发[10]。
3.2 共晶技术研究表明, 药物共晶可在不破坏药物分子化学结构的前提下提高药物在体内的生物利用度[63]。Luo等[29]采用液体辅助研磨法成功制备了木犀草素-异烟肼共晶和木犀草素-咖啡因共晶。药动学结果显示, 木犀草素-异烟肼共晶与木犀草素原药相比, 可显著提高木犀草素的生物利用度。但从统计学结果分析木犀草素-咖啡因提高木犀草素原药的生物利用度效果不明显。Jiang等[32]采用溶剂挥发法制备柚皮素-异烟酰胺共晶(NGN-INT)。体内药动学结果表明, NGN-INT共晶可显著提高柚皮素在体内的吸收。并研究了NGN-INT对蛋氨酸-胆碱缺乏(MCD) 饮食诱导的非酒精性脂肪肝小鼠的保肝作用。血清谷丙转氨酶和谷草转氨酶测定结果表明, 与MCD饮食诱导组相比, 柚皮素原药组(100 mg·kg-1·d-1, NGN 100) 可显著降低血清谷氨酸氨基转移酶(ALT) 水平, 但低剂量柚皮素原料药组(50 mg·kg-1·d-1, NGN 50) 效果不显著。等剂量(50 mg·kg-1·d-1) NGN-INT 50组中NGN-INT可显著逆转MCD饮食诱导的小鼠血清ALT升高。NGN-INT 50组甚至表现出比NGN 100组更好的血清ALT下降效果。值得注意的是, 无论是NGN原料药还是NGN-INT对小鼠血清谷草转氨酶(AST) 水平均无明显影响。肝脏脂肪含量实验结果表明, NGN 50组的小鼠肝脏脂质沉积未见明显衰减, 但NGN 100组小鼠肝脂肪变性得到有效缓解。同时, NGN-INT 50组的小鼠可观察到抑制肝脂肪变性的作用。NGN 50组对MCD饮食诱导的肝脏甘油三酯(TG) 水平升高没有抑制作用, 而等剂量的NGN-INT 50组则使肝脏TG水平显著下降, NGN-INT 50组的降TG作用甚至比NGN 100更显著。因此, NGN-INT可显著提高柚皮素对MCD饮食诱导小鼠肝脂肪变性的抑制作用。Kruthiventi等[64]采用溶剂结晶法和研磨法制备了诺氟沙星-咖啡因共晶体, 体外抑菌活性研究表明, 共晶在低浓度下对金葡菌、大肠埃希菌等细菌的抑制作用更好。尽管共晶技术能通过改善药物的理化特性, 提高药物在体内的生物利用度与药效, 以解决难溶性药物在临床上的诸多应用问题, 但共晶技术还存在过饱和状态的不稳定性、共晶配体的选择和体内吸收机制尚不明确等问题亟待解决。
3.3 无定形/共无定形技术无定形状态具有晶体类似的刚性与流体类似的各向同性, 较晶型药物而言, 具有较高的溶解度和溶出速度, 能显著提高中药活性成分的生物利用度与药效作用。Sunagawa等[41]成功制备了姜黄素无定形制剂, 称为curcuRougeTM。根据血药浓度-时间曲线下面积(AUC) 计算, curcuRougeTM在大鼠体内的生物利用度是Theracurmin® (姜黄素) 的3.7倍。并进行了单剂量、双盲和双向交叉研究, 比较12名志愿者(8名男性, 4名女性) curcuRougeTM和Theracurmin® (姜黄素90 mg) 的生物利用度。结果表明, curcuRougeTM的生物利用度是Theracurmin®的3.4倍, 而且curcuRougeTM比Theracurmin®在更短的时间内达到峰浓度(Cmax)。Wu等[42]采用液体抗溶剂沉淀法, 以水飞蓟素(SLN) 为模型药物, 以多孔淀粉(PS) 为载体, 制备了水飞蓟素-多孔淀粉共无定形制剂(SLN-PS)。药动学结果表明, SLN-PS的Cmax和AUC(0–t)分别为(87.71 ± 7.24) μg·L-1与(439.55 ± 8.76) μg·L-1·h-1, 而SLN的Cmax和AUC(0–t)分别为(26.08 ± 1.43) μg·L-1与(102.63 ± 7.15) μg·L-1·h-1, 显示SLN-PS改善了SLN药动学特性的能力。Mohapatra等[65]前期研究表明, 乙酰水杨酸(ASA, 100 mg·kg-1) 与姜黄素(CU, 200 mg·kg-1) 在较高剂量下联合使用对炎症/关节炎有显著疗效。由于ASA和CU在水中溶解度均较低, 增强其溶出度是增强其药效、减少剂量的可行途径, 因此制备了ASA与CU的共无定形物。抗炎实验结果表明, 与对照相比, 12.5 mg·kg-1 ASA对大鼠足肿胀抑制率为1.1%; 25 mg·kg-1 CU对大鼠足肿胀无抑制作用(0.51%); ASA与CU联用4 h时抑制率为2.33%; 物理混合物的抑制率相对较高(4.66%); 共无定形物在此剂量水平下表现出约5倍的抑制率(20.29%)。抗溃疡性能评价结果表明, 雷尼替丁可明显抑制ASA引起的溃疡, 其保护指数 > 82%, 共无定形物的保护指数 > 75%, 而物理混合物的保护指数为56%。胃组织形态学和组织学检查结果表明, 对照组未见损伤; ASA组黏膜损伤严重, 黏膜下层出现深度坏死、水肿和严重炎症; 物理混合物组中度黏膜损伤和黏膜下层轻度炎症; 共无定形组轻度黏膜损伤, 且观察到明显的恢复。以上结果表明ASA与CU共无定形可增强抗炎活性且可降低胃毒性。尽管无定形/共无定形技术在中药活性成分中得到了广泛的应用, 但在储存与溶出过程中, 容易向其晶态发生转变。无定形药物的快速结晶对于控制无定形态药物制剂的稳定性极为不利。因此, 如何在无定形药物体系中更好地抑制药物分子的动能, 降低表面分子的自由扩散速率和表面暴露面积等策略, 可为提高无定形态药物制剂的稳定性提供思路[66]。
3.4 纳米晶体技术纳米晶体由于其饱和溶解度大、溶解速度快、黏附时间延长并提高了局部剂量, 因此纳米晶体可提高药物的生物利用度与功效。Huang等[51]制备了紫杉醇(paclitaxel, PTX) 纳米晶体(nanocrystal, NC), 并包裹了聚多巴胺(polydopamin, PDA) 涂层, 随后采用RGD肽及聚乙二醇(polyethylene glycol, PEG) 对其进行表面修饰得到NC@PDA-PEG-RGD。体外稳定性研究结果表明, NC@PDA-PEG-RGD在血浆中具有良好的稳定性。Chen等[3]制备了灯盏花素纳米晶体离子型原位凝胶(BRE-NG), 体内药动学结果表明, 经鼻腔给予BRE-NG后灯盏花素生物利用度显著提高。组织病理学研究表明, 与正常组比较, 模型组脑部出现明显的病理改变, 主要表现在大脑皮层, 如不同程度水肿、灶性坏死、正常结构消失、皮层胶质增生增多和炎性细胞大量浸润等。中剂量(10 mg·kg-1)、高剂量(20 mg·kg-1) 药物组和阳性对照药物组的水肿脑组织损伤明显减轻, 未见明显炎性细胞浸润。结果表明, 鼻腔给药后BRE-NG能减轻缺血再灌注脑损伤。将固体纳米晶体技术广泛运用于难溶性药物, 提高生物利用度及顺应性具有广阔的前景。然而, 如何提高药物纳米化过程中的稳定性、维持固体纳米晶体再分散仍呈纳米状态, 以及影响其再分散稳定性的机制研究仍是亟待解决的关键问题[67]。
4 总结与展望中药活性成分普遍存在如溶解度低、熔点高和稳定性差等问题, 使其临床应用受到了极大的限制。近年来, 基于晶体工程学技术在优化中药活性成分的物理化学性质、提高其生物活性方面具有很好的应用前景。本文就多晶型、共晶型、无定形/共无定形和纳米晶体等晶型结构特性进行了综述, 阐述以上几种晶型对中药活性成分熔点、溶解/溶出度、稳定性及生物利用度的影响研究进展。随着晶体工程学研究理论的不断深化, 越来越多的基于中药活性成分晶型结构的制剂开发研究将进入临床应用阶段, 这将扩大中药活性成分的研究和应用范围, 为开发新型中药活性成分制剂提供有价值的思路。
作者贡献: 陈颖翀负责文献调研及起草、撰写文章; 周伟成、雷方方和黄丽珍负责文献调研、参与撰写文章; 郑琴和杨明负责文章的修改与校对; 岳鹏飞负责指导撰写思路与文章修改。
利益冲突: 所有作者声明本文无任何利益冲突。
| [1] |
Liu JH, Cheng YY, Hsieh CH, et al. Identification of a multicomponent traditional herbal medicine by HPLC-MS and electron and light microscopy[J]. Molecules, 2017, 22: 2242. DOI:10.3390/molecules22122242 |
| [2] |
Xia DZ, Zhang PH, Fu Y, et al. Hepatoprotective activity of puerarin against carbon tetrachloride-induced injuries in rats: a randomized controlled trial[J]. Food Chem Toxicol, 2013, 59: 90-95. DOI:10.1016/j.fct.2013.05.055 |
| [3] |
Chen Y, Liu Y, Xie J, et al. Nose-to-brain delivery by nanosuspensions-based in situ gel for breviscapine[J]. Int J Nanomedicine, 2020, 15: 10435-10451. DOI:10.2147/IJN.S265659 |
| [4] |
Meng Z, Meng L, Wang K, et al. Enhanced hepatic targeting, biodistribution and antifibrotic efficacy of tanshinone IIA loaded globin nanoparticles[J]. Eur J Pharm Sci, 2015, 73: 35-43. DOI:10.1016/j.ejps.2015.03.002 |
| [5] |
Szafraniec J, Antosik A, Knapik-Kowalczuk J, et al. The selfassembly phenomenon of poloxamers and its effect on the dissolution of a poorly soluble drug from solid dispersions obtained by solvent methods[J]. Pharmaceutics, 2019, 11: 130. DOI:10.3390/pharmaceutics11030130 |
| [6] |
Park H, Ha ES, Kim MS. Current status of supersaturable selfemulsifying drug delivery systems[J]. Pharmaceutics, 2020, 12: 365. DOI:10.3390/pharmaceutics12040365 |
| [7] |
Qiao HZ, Di LQ, Ping QN, et al. Structural Chinese medicine: a new research field on the pharmacodynamics substance basis of traditional Chinese medicine[J]. China J Chin Mater Med (中国中药杂志), 2021, 46: 2443-2448. |
| [8] |
Ciomek A, Dzitko J, Cielecka-Piontek J. Benefits and limitations of polymorphic and amorphous forms of active pharmaceutical ingredients[J]. Curr Pharm Des, 2016, 22: 4975-4980. DOI:10.2174/1381612822666160804100036 |
| [9] |
Gunnamm A, Nangia A. High solubility salts of multiple sclerosis drug teriflunomide[J]. Cryst Growth Des, 2019, 19: 5407-5417. DOI:10.1021/acs.cgd.9b00914 |
| [10] |
Weng XY, Pang ZT, Qian S, et al. Druggability enhancement by modification of physicochemical properties of drugs via crystal engineering[J]. Acta Pharm Sin (药学学报), 2020, 55: 2883-2891. |
| [11] |
Anwar J, Zahn D. Polymorphic phase transitions: macroscopic theory and molecular simulation[J]. Adv Drug Deliv Rev, 2017, 117: 47-70. DOI:10.1016/j.addr.2017.09.017 |
| [12] |
Wang FF, Yang DZ, Lv Y. Polymorphism of shikimic acid[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2861-2863. |
| [13] |
Zhang Y, Liu Q, Zhang D, et al. Polymorphism, crystal structure and crystal habit of β-artemether[J]. CIESC J (化工学报), 2011, 62: 2958-2963. |
| [14] |
Li Q, Sun T, Wang D. Polymorphism preparation and characterization of ginkgolide B[J]. Chin J Pharm (中国药剂学杂志), 2019, 17: 100-106. |
| [15] |
Nie LX, Zhang Y, Dai Z, et al. Preliminary investigation on poly-morphs of two traditional Chinese medicine reference substances[J]. China J Chin Mater Med (中国中药杂志), 2015, 40: 3245-3248. |
| [16] |
Yang S, Zhou Q, Zhang B, et al. Screening, characterization and evaluation of mangiferin polymorphs[J]. Nat Prod Bioprospect, 2020, 10: 187-200. DOI:10.1007/s13659-020-00247-z |
| [17] |
Gong N, Yang D, Jin G, et al. Structure, characterization, solubility and stability of podophyllotoxin polymorphs[J]. J Mol Struct, 2019, 1195: 323-330. DOI:10.1016/j.molstruc.2019.05.048 |
| [18] |
Ding M, Xu L, Zhang Y, et al. Polymorphic characterization and bioavailability of 20(R) -25-methoxyl-dammarane-3β, 12β, 20-triol, a novel dammarane triterpenoid saponin, as anticancer agents[J]. J Pharm Biomed Anal, 2017, 145: 773-782. DOI:10.1016/j.jpba.2017.08.007 |
| [19] |
Aaltonen J, Allesø M, Mirza S, et al. Solid form screening——a review[J]. Eur J Pharm Biopharm, 2009, 71: 23-37. DOI:10.1016/j.ejpb.2008.07.014 |
| [20] |
Springuel G, Robeyns K, Norberg B, et al. Cocrystal formation between chiral compounds: how cocrystals differ from salts[J]. Cryst Growth Des, 2014, 14: 3996-4004. DOI:10.1021/cg500588t |
| [21] |
Aakeröy CB, Forbes S, Desper J. Using cocrystals to systematically modulate aqueous solubility and melting behavior of an anticancer drug[J]. J Am Chem Soc, 2009, 131: 17048-17049. DOI:10.1021/ja907674c |
| [22] |
Good D, Rodríguez-Hornedo N. Solubility advantage of pharmaceutical cocrystals[J]. Cryst Growth Des, 2009, 9: 2252-2264. DOI:10.1021/cg801039j |
| [23] |
Zhang Y, Yin H, Zhang Y, et al. Synthesis and characterization of pharmaceutical co-crystal of luteolin with 4, 4'-dipyridy[J]. J Northeast Agric Univ (东北农业大学学报), 2015, 46: 72-78. |
| [24] |
Sowa M, Ślepokura K, Matczak-Jon E. Solid-state characterization and solubility of a genistein-caffeine cocrystal[J]. J Mol Struct, 2014, 1076: 80-88. DOI:10.1016/j.molstruc.2014.07.036 |
| [25] |
Aitipamula S, Das S. Cocrystal formulations: a case study of topical formulations consisting of ferulic acid cocrystals[J]. Eur J Pharm Biopharm, 2020, 149: 95-104. DOI:10.1016/j.ejpb.2020.01.021 |
| [26] |
Karki S, Friscic T, Fábián L, et al. New solid forms of artemisinin obtained through cocrystallisation[J]. CrystEngComm, 2010, 12: 4038-4041. DOI:10.1039/c0ce00428f |
| [27] |
Xue N, He B, Jia Y, et al. The mechanism of binding with the α-glucosidase in vitro and the evaluation on hypoglycemic effect in vivo: cocrystals involving synergism of gallic acid and conformer[J]. Eur J Pharm Biopharm, 2020, 156: 64-74. DOI:10.1016/j.ejpb.2020.08.024 |
| [28] |
Bethune S, Schultheiss N, Henck JO. Improving the poor aqueous solubility of nutraceutical compound pterostilbene through cocrystal formation[J]. Cryst Growth Des, 2011, 11: 2817-2823. DOI:10.1021/cg1016092 |
| [29] |
Luo Y, Chen S, Zhou J, et al. Luteolin cocrystals: characterization, evaluation of solubility, oral bioavailability and theoretical calculation[J]. J Drug Deliv Sci Technol, 2019, 50: 248-254. DOI:10.1016/j.jddst.2019.02.004 |
| [30] |
Liu SG, Zhang WW, Hua Y, et al. Study on quality control of pharmaceutical cocrystal by NIRS[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 2683-2687. |
| [31] |
Chen JY, Wu H, Guo CY, et al. Enhancing the solubility of natural compound xanthotoxin by modulating stability via cocrystallization engineering[J]. Int J Pharm, 2019, 572: 118776. DOI:10.1016/j.ijpharm.2019.118776 |
| [32] |
Jiang J, Wang A, Zhang X, et al. The isonicotinamide cocrystal promotes inhibitory effects of naringenin on nonalcoholic fatty liver disease in mice[J]. J Drug Deliv Sci Technol, 2020, 59: 101874. DOI:10.1016/j.jddst.2020.101874 |
| [33] |
Suresh K, Goud NR, Nangia A. Andrographolide: solving chemical instability and poor solubility by means of cocrystals[J]. Chem Asian J, 2013, 8: 3032-3041. DOI:10.1002/asia.201300859 |
| [34] |
Wang B, Liu F, Xiang J, et al. A critical review of spray-dried amorphous pharmaceuticals: synthesis, analysis and application[J]. Int J Pharm, 2021, 594: 120165. DOI:10.1016/j.ijpharm.2020.120165 |
| [35] |
Hancock BC, Parks M. What is the true solubility advantage for amorphous pharmaceuticals?[J]. Pharm Res, 2000, 17: 397-404. DOI:10.1023/A:1007516718048 |
| [36] |
Guo H, Miao N, Li T, et al. Pharmaceutical coamorphous——a newly defined single-phase amorphous binary system[J]. Prog Chem (化学进展), 2014, 26: 478-486. |
| [37] |
Wu XJ, Pang ZT, Yang ST, et al. Mechanistic study on the solubility enhancement of puerarin by coamorphous technology[J]. Acta Pharm Sin (药学学报), 2021, 56: 585-592. |
| [38] |
Liu H, Zhao GW, Jiang QY, et al. Co-amorphous technology to improve the dissolution behavior and physical stability of silybin[J]. China J Chin Mate Med (中国中药杂志), 2021. DOI:10.19540/j.cnki.cjcmm.20210511.301 |
| [39] |
Uchiyama H, Ando T, Kadota K, et al. The formation of an amorphous composite between flavonoid compounds: enhanced solubility in both oil components and aqueous media[J]. J Drug Deliv Sci Technol, 2021, 62: 102410. DOI:10.1016/j.jddst.2021.102410 |
| [40] |
Chen X, Li D, Zhang H, et al. Sinomenine-phenolic acid coamorphous drug systems: solubilization, sustained release, and improved physical stability[J]. Int J Pharm, 2021, 598: 120389. DOI:10.1016/j.ijpharm.2021.120389 |
| [41] |
Sunagawa Y, Miyazaki Y, Funamoto M, et al. A novel amorphous preparation improved curcumin bioavailability in healthy volunteers: a single-dose, double-blind, two-way crossover study[J]. J Funct Foods, 2021, 81: 104443. DOI:10.1016/j.jff.2021.104443 |
| [42] |
Wu W, Wang L, Wang S. Amorphous silibinin nanoparticles loaded into porous starch to enhance remarkably its solubility and bioavailability in vivo[J]. Colloids Surf B Biointerfaces, 2021, 198: 111474. DOI:10.1016/j.colsurfb.2020.111474 |
| [43] |
Yue PF, Liu Y, Xie J, et al. Review and prospect on preparation technology of drug nanocrystals in the past thirty years[J]. Acta Pharm Sin (药学学报), 2018, 53: 529-537. |
| [44] |
Li W, Quan P, Zhang Y, et al. Influence of drug physicochemical properties on absorption of water insoluble drug nanosuspensions[J]. Int J Pharm, 2014, 460: 13-23. DOI:10.1016/j.ijpharm.2013.10.038 |
| [45] |
Wang T, Qi J, Ding N, et al. Tracking translocation of self-discriminating curcumin hybrid nanocrystals following intravenous delivery[J]. Int J Pharm, 2018, 546: 10-19. DOI:10.1016/j.ijpharm.2018.05.020 |
| [46] |
Xiong S, Liu W, Zhou Y, et al. Enhancement of oral bioavailability and anti-Parkinsonian efficacy of resveratrol through a nanocrystal formulation[J]. Asian J Pharm Sci, 2020, 15: 518-528. DOI:10.1016/j.ajps.2019.04.003 |
| [47] |
Zhang J, Huang Y, Liu D, et al. Preparation of apigenin nanocrystals using supercritical antisolvent process for dissolution and bioavailability enhancement[J]. Eur J Pharm Sci, 2013, 48: 740-747. DOI:10.1016/j.ejps.2012.12.026 |
| [48] |
Chen Y, Gui Y, Luo Y, et al. Design and evaluation of inhalable nanocrystals embedded microparticles with enhanced redispersibility and bioavailability for breviscapine[J]. Powder Technol, 2021, 377: 128-138. DOI:10.1016/j.powtec.2020.08.040 |
| [49] |
Chen Y, Liu Y, Xu J, et al. A natural triterpenoid saponin as multifunctional stabilizer for drug nanosuspension powder[J]. AAPS PharmSciTech, 2017, 18: 2744-2753. DOI:10.1208/s12249-017-0756-7 |
| [50] |
Jin SY, Han J, Jin SX, et al. Characterization and evaluation in vivo of baicalin-nanocrystals prepared by an ultrasonic-homogenization-fluid bed drying method[J]. Chin J Nat Med, 2014, 12: 71-80. |
| [51] |
Huang ZG, Lv FM, Wang J, et al. RGD-modified PEGylated paclitaxel nanocrystals with enhanced stability and tumor-targeting capability[J]. Int J Pharm, 2019, 556: 217-225. DOI:10.1016/j.ijpharm.2018.12.023 |
| [52] |
Schultheiss N, Newman A. Pharmaceutical cocrystals and their physicochemical properties[J]. Cryst Growth Des, 2009, 9: 2950-2967. DOI:10.1021/cg900129f |
| [53] |
Xie XY, Chen C, Liao XR, et al. Physical stability of nanosuspensions: research advances[J]. J Int Pharm Res (国际药学研究杂志), 2011, 38: 369-374. |
| [54] |
Censi R, Di Martino P. Polymorph impact on the bioavailability and stability of poorly soluble drugs[J]. Molecules, 2015, 20: 18759-18776. DOI:10.3390/molecules201018759 |
| [55] |
Murdande SB, Shah DA, Dave RH. Impact of nanosizing on solubility and dissolution rate of poorly soluble pharmaceuticals[J]. J Pharm Sci, 2015, 104: 2094-2102. DOI:10.1002/jps.24426 |
| [56] |
Liu J, Tu L, Cheng M, et al. Mechanisms for oral absorption enhancement of drugs by nanocrystals[J]. J Drug Deliv Sci Technol, 2020, 56: 101607. DOI:10.1016/j.jddst.2020.101607 |
| [57] |
Pindelska E, Sokal A, Kolodziejski W. Pharmaceutical cocrystals, salts and polymorphs: advanced characterization techniques[J]. Adv Drug Deliv Rev, 2017, 117: 111-146. DOI:10.1016/j.addr.2017.09.014 |
| [58] |
Amat GM, Ardanuy EB, Carrera FC, et al. Novel polymorphic crystal forms of 5-(2-1-(r) -hydroxyethyl) -8-hydroxyquinolin-2(1h) -one, heminapadisytlate as agonist of the beta2 adrenergic receptor: US, 20150057256[P]. 2015-02-26.
|
| [59] |
Chow K, Tong HHY, Lum S, et al. Engineering of pharmaceutical materials: an industrial perspective[J]. J Pharm Sci, 2008, 97: 2855-2877. DOI:10.1002/jps.21212 |
| [60] |
Gao Y, Liao J, Qi X, et al. Coamorphous repaglinide-saccharin with enhanced dissolution[J]. Int J Pharm, 2013, 450: 290-295. DOI:10.1016/j.ijpharm.2013.04.032 |
| [61] |
Yue PF, Wang J, Hu PY, et al. Research progress and thinking on solidification nanosuspensions drug delivery system of Chinese materia medica[J]. Chin Tradit Herb Drugs (中草药), 2012, 43: 625-629. |
| [62] |
Gong N, Wang X, Wang Y, et al. Control over polymorph formation of polydatin in binary solvent system and structural characterization[J]. J Pharm Biomed Anal, 2020, 190: 113260. DOI:10.1016/j.jpba.2020.113260 |
| [63] |
Shan N, Zaworotko MJ. The role of cocrystals in pharmaceutical science[J]. Drug Discov Today, 2008, 13: 440-446. DOI:10.1016/j.drudis.2008.03.004 |
| [64] |
Kruthiventi AK, Roy S, Goud R, et al. Synergistic pharmaceutical cocrystals: WO, 2009136408 A1[P]. 2009-11-12.
|
| [65] |
Mohapatra TK, Moharana AK, Swain RP, et al. Coamorphisation of acetyl salicylic acid and curcumin for enhancing dissolution, anti-inflammatory effect and minimizing gastro toxicity[J]. J Drug Deliv Sci Technol, 2021, 61: 102119. DOI:10.1016/j.jddst.2020.102119 |
| [66] |
Shi Q, Cai T. Recent progress on crystallizations of amorphous pharmaceutical solids[J]. J China Pharm Univ (中国药科大学学报), 2017, 48: 654-662. |
| [67] |
Liu Y, Xie J, Xu J, et al. Research progress of key factors influencing stability of solid nanocrystals[J]. Chin J Pharm (中国医药工业杂志), 2018, 49: 1073-1082. |
 2021, Vol. 56
2021, Vol. 56


