糖基化是由糖基转移酶(glycosyltransferase enzyme, GT) 催化, 在某些大分子合成过程中将供体的糖基添加到受体的羟基或其他功能基团上的细胞修饰反应[1]。GT基因是一类序列上高度进化、功能上高度分歧的多基因家族。因其利用尿苷二磷酸的5'端糖基作为供体而被称为UDPGT (UDP-糖基转移酶, UDP-glucosyltransferase)[2, 3]。UDPGT可以参与多种糖基受体的生物合成, 包括次生代谢产物如类黄酮、萜类、甾醇等[4-6]和植物激素如脱落酸、生长素、细胞分裂素、水杨酸等[7, 8], 以调控植物的生长发育、病原防御和与生长环境的适应性[9]。这些基因序列的N端变异较大被认为是特异性结合苷元底物的区域, C端包含一个由44个氨基酸组成的较为保守区域PSPG (植物次生代谢产物糖基转移酶, plant secondary product glycosyltransferase) 作为糖基识别中心。
目前已有研究报道了拟南芥(Arabidopsis thaliana) 的UDPGT基因家族成员为107个, 水稻(Oryza sativa) 为180个, 以及其他100多种二倍体植物如碧桃(Prunus persica)、甘蓝(Brassica oleracea)、玉米(Zea mays)、葡萄(Vitis vinifera)、大豆(Glycine max) 等[10-12]。而大花红景天及红景天属其他物种多分布于海拔较高(3 500~5 000 m) 的山区、丘陵一带, 使得对其采集和研究工作均十分困难, 关于红景天UDPGT的报道较少[13, 14]。截止到2020年, NCBI中收录的红景天属不同种UDPGT序列数量依然较少[15], Ma等[16]成功克隆了库叶红景天(Rhodiola sachalinensis) RsUGT73B6基因(AY547304), 并证明过表达该基因能够提高根部活性成分红景天苷的积累。常凯等[17]利用hiTAIR-PCR技术获得了大花红景天(Rhodiola crenulata) UDPGT基因, 并利用生物信息学对其编码区和启动子进行了分析。以上结果对于深入开展红景天UDPGT基因功能研究还相差甚远, 特别是大花红景天, 作为红景天属的药用植物之一, 也是中国药典规定的唯一入药种, 当前研究还十分薄弱[18, 19]。
因此, 本研究以西藏大花红景天为研究对象, 成功克隆了RcUDPGTs家族基因的18个成员, 对其氨基酸序列进行分析, 并利用qRT-PCR对其组织表达特异性、非生物胁迫和植物激素诱导表达模式进行鉴定, 同时构建RcUDPGT的酵母双杂交诱饵载体筛选互作蛋白, 以期进一步了解大花红景天RcUDPGTs家族, 为深入开展基因功能研究奠定基础。
材料与方法实验材料 本研究以西藏大花红景天(Rhodiola crenulata) 为材料, 于2015年7月采集自西藏地区米拉山山脉, 其海拔4 868.4 m, 经度92.34°, 纬度29.78°。经南开大学宋文芹教授鉴定为景天科药用植物大花红景天。部分材料经液氮速冻后保存于-80 ℃; 其余材料以叶片为外植体进行组织培养, 利用无菌再生苗进行非生物胁迫诱导实验。
基因序列来源 RcUDPGTs基因序列来源于本实验室已完成的转录组数据库, 基于de novo拼接的unigene注释信息, 以UDP-glucosyltransferase/UDPGT为关键词对数据库进行检索, 获得RcUDPGTs序列。
RNA提取与cDNA第一条链的合成 大花红景天不同组织的总RNA提取依照改良CTAB-异丙醇法进行[20]。cDNA第一条链的合成利用M-MLV反转录酶(TaKaRa, Japan) 进行, 产物用无核酸酶无菌dd H2O稀释10倍后, -20 ℃保存。
生物信息学分析 利用生物信息学在线网站对获得的RcUDPGTs基因氨基酸序列进行分析。利用blastx (https://blast.ncbi.nlm.nih.gov/Blastx) 进行序列验证; 利用ORF Finder (http://www.bioinformatics.org/sms2/orf_find.html) 获得编码框; 利用blastp (https://blast.ncbi.nlm.nih.gov/Blastp) 获得同源基因; 利用DANMAN计算RcUDPGTs与各自同源基因的同源性比值; 利用MEGA 7.0中Clustal W对大花红景天、红景天和拟南芥UDPGT序列进行比对, 构建N-J进化树; 利用在线软件TMHMM sever v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/) 和Procomp (http://linux1.softberry.com) 分析跨膜结构域和亚细胞位置; 利用ExPASy (https://web.expasy.org/protparam/) 分析蛋白质分子量、等电点、稳定性、脂肪系数、亲水系数和磷酸化位点; 利用MEME (http://meme-suite.org/tools/meme) 分析保守结构域; 利用SWISS-MODEL (https://swissmodel.expasy.org/interactive) 预测三级结构模型[21]。
表达模式分析 组织特异性表达模式分析, 以组培再生苗的根、茎、叶为材料。低温、紫外、植物激素诱导表达模式均以整株的无性繁殖苗为材料。选择处于同一生长状态的再生苗, 置于0 ℃的冰水混合物中, 保持0、3、7天以模拟低温胁迫; 置于234 nm的紫外灯管下模拟紫外胁迫, 光周期为紫外处理16 h, 黑暗8 h; 置于含有50 μmol·L-1脱落酸(ABA)、100 μmol·L-1生长素(IAA)、100 μmol·L-1茉莉酸甲酯(MeJA) 的1/4 MS液体培养基中, 24 ℃、60 r·min-1振荡6 h以模拟ABA、IAA和MeJA。将上述处理后的材料用无菌水洗净, 液氮速冻过夜, -80 ℃超低温保存。不同胁迫处理材料的叶片用以提取RNA。以上处理均含有3个生物学重复[22]。
实时定量PCR 利用Bio-RAD公司的iQ5完成实时定量PCR (qRT-PCR)。反应体系为20 μL, 包含10 ng cDNA、10 μL SYBRGreen (TaKaRa, Japan)、各0.8 μL上下游引物, 以RcGAPDH为内参基因, 每个样品包含3个生物学重复[23]。
RcUDPGT自激活鉴定与互作蛋白筛选 酵母双杂交拟南芥文库的筛选方法依Clontech公司Matchmaker Gold Yeast Two-Hybrid System User Manual说明书进行。首先构建载体, 以NCBI中公布的RcUDPGT基因(JX228125.1) 为参照, 利用无缝克隆技术连入诱饵载体pGBKT7载体, 并通过LiTE/PEG法转化Y2H Gold菌株。对诱饵载体进行自激活和毒性验证, 以排除基因本身对杂交结果的影响。然后进行文库筛选, 将诱饵载体与文库混合后涂布于SD/-Trp-Leu-His培养基进行初筛, 7 d后挑选阳性克隆滴于SD/-Trp-Leu+β-gal培养基, 并挑选蓝斑菌落摇菌提取质粒。利用T7/3'AD进行扩增和测序, 根据测序结果确定互作基因。第三, 互作蛋白验证。根据上述测序结果合成该基因引物并依无缝克隆法连入pGADT7载体, 与pGBKT7-RcUDPGT诱饵载体共同转化Y2H Gold, 并以pGBKT7-RcUDPGT+pGADT7、pGBKT7-53+pGADT7-T作为阴阳性对照。将阳性菌液分别培养至OD = 0.5, 取6 μL分别滴于SD/-Trp-Leu、SD/-Trp-Leu+β-gal、SD/-Trp-Leu-His培养基, 30 ℃培养3 d后拍照。
结果与分析 1 大花红景天RcUDPGTs基因序列分析通过筛选转录组注释数据库共得到75条编码UDP-glucosyltransferase/UDPGT基因的unigene序列, 去除表达丰度较低且不具有完整开放阅读框的序列, 最终获得18条序列信息并已提交到NCBI Genbank, 分别命名为RcUDPGT1~RcUDPGT18, 登录号为MW579350~MW579367。RcUDPGTs基因核苷酸序列长度均为1 400 bp左右, 编码452~498个氨基酸。利用Blastp检索到其同源基因主要为双子叶植物如Rhodiola rosea、Rhodiola sachalinensis、Quercus sube、Theobroma cacao、Vitis vinifera等。RcUDPGTs基因中仅4条与已公布的Rhodiola rosea UDPGT同源性较高在92%以上, 其余基因的同源性较低为55%左右, 如表 1。说明大花红景天RcUDPGTs基因的氨基酸序列变异程度较大。
| Table 1 RcUDPGTs genes information in Rhodiola crenulata |
利用Mega 7.0构建大花红景天、红景天和拟南芥UDPGT基因的N-J进化树, 结果显示红景天(Rhodiola rosea) RrUDPGTs基因主要集中于第一亚组, 大花红景天(Rhodiola crenulata) RcUDPGTs聚类较为分散, 分属于7个亚组, 其中仅第5组的两对基因(RcUDPGT8与RcUDPGT9、RcUDPGT10与RcUDPGT11) 遗传距离最近, 见图 1。ExPASy在线分析结果显示RcUDPGTs基因编码的蛋白质大小为5.0 kDa左右, 其中RcUDPGT5最小约为4.8 kDa, RcUDPGT14最大约为5.6 kDa。等电点主要集中于5.5~6.1之间, 其中RcUDPGT14最高为6.26, RcUDPGT12最低为4.97。RcUDPGTs基因中仅7个成员的不稳定系数小于40, 说明这些RcUDPGTs蛋白质结构较稳定。脂肪系数主要集中在85~95之间, 亲水系数为0.0左右, 说明RcUDPGTs一级结构的亲水性、疏水性差异不是特别显著, 仅RcUDPGT2的差异较大, 脂肪系数为77.01、亲水系数为-0.329, 说明其为疏水蛋白。对RcUDPGTs蛋白磷酸化位点进行预测, 结果显示均含有28个位点以上, 说明这些蛋白可能受到磷酸化酶或去磷酸化酶的修饰, 见表 2。此外, TMHMM和Procomp预测结果显示, 18个RcUDPGTs的11个成员具有跨膜结构域, 亚细胞位置主要定位于细胞膜或细胞器膜。说明一些成员为膜结合蛋白(如RcUDPGT1、RcUDPGT2、RcUDPGT10、RcUDPGT11、RcUDPGT15、RcUDPGT18)。一些成员为跨膜蛋白, 仅RcUDPGT12以游离蛋白质的形式存在(表 1)。
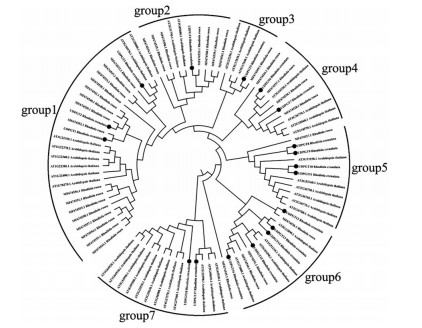
|
Figure 1 Phylogenetic tree of RcUDPGTs proteins sequences |
| Table 2 The result of RcUDPGTs proteins physical and chemical properties |
利用在线MEME预测RcUDPGTs基因的保守motif。结果显示N端的保守性较低, C端呈现3个保守结构域, 不同基因间保守motif存在的位置相似, 这些motif的氨基酸序列与其他物种报道的PSPG motif一致, 表现为Rossmann折叠的特征结构α/β/α (图 2)。SIWSS-MODEL预测的蛋白质三级结构显示, RcUDPGTs蛋白中心具有相同的UDP糖供体识别结合位点, 该区域主要由C端的结构域残基构成, PSPG的Cα3、Cβ4和Cα5的N末端残基都指向UDP供体。N端的变异较大, 具有对结合苷元底物识别的特异性。RcUDPGTs蛋白质三级结构均存在特异性, 说明了其所发挥的生物学功能是多样的。

|
Figure 2 Conserve motif prediction of RcUDPGTs. A: Conserved domains; B: Motif sequences; C: Sugar donor region; D: PSPG region sequence |
基因发挥功能的主要场所, 决定了其在不同组织内表达模式的特异性[24]。因此, 利用qRT-PCR对RcUDPGTs在大花红景天营养生长过程中主要器官根、茎、叶的表达水平进行了鉴定。结果显示RcUDPGTs基因在3个不同器官中均有表达, 10个RcUDPGTs基因在叶片中的表达量明显高于茎和根, 3个基因在根中的表达量明显高于叶和茎(RcUDPGT9、RcUDPGT10、RcUDPGT14), 2个基因在茎中高表达(RcUDPGT5、RcUDPGT11), 3个基因在不同组织内均有较高水平的表达, 差异较小(RcUDPGT8、RcUDPGT12、RcUDPGT13)。对于遗传距离最近的RcUDPGT8和RcUDPGT9具有相似的表达模式, 说明了这两个基因在功能上可能存在互补(图 3)。

|
Figure 3 The figure of RcUDPGTs tissue-specific expression.*P < 0.05, **P < 0.01 vs control. Note: Repeat 3 samples, each for 3 times |
由于大花红景天的生长环境极为特殊, 在其生活史中持续的面临低温、低氧、强紫外线等非生物胁迫。因此, 对RcUDPGTs基因在低温、紫外胁迫下的表达模式进行了分析, 以进一步了解其在大花红景天生命过程中的意义。结果显示, 低温胁迫能够影响RcUDPGTs基因的表达量, 除RcUDPGT12外, 其他基因的表达水平均出现显著的变化。随着胁迫时间的延长, 4个基因的表达量持续下降(RcUDPGT1、RcUDPGT4、RcUDPGT13、RcUDPGT15); 5基因的表达量持续上升(RcUDPGT8、RcUDPGT9、RcUDPGT10、RcUDPGT11、RcUDPGT14); 2个基因的表达水平先下调再上调(RcUDPGT3、RcUDPGT18); 其余基因的表达水平表现为先上调然后下调的趋势(图 4)。相比于低温胁迫, 紫外处理对RcUDPGTs表达量的影响更为显著, 并且均呈现上调表达模式。8个基因在胁迫第3天即出现最高表达水平, 随后出现下调; 10个基因在胁迫第5天出现最高表达水平, 其中6个基因表现为先下调再上调的表达模式, 即在胁迫第3天时表达量有所降低, 胁迫第5天时显著提高(RcUDPGT2、RcUDPGT3、RcUDPGT4、RcUDPGT5、RcUDPGT15、RcUDPGT18) (图 5)。

|
Figure 4 The expression levels of RcUDPGTs under cold treatment condition by qRT-PCR. *P < 0.05, **P < 0.01 vs control. Note: Repeat 3 samples, each for 3 times |
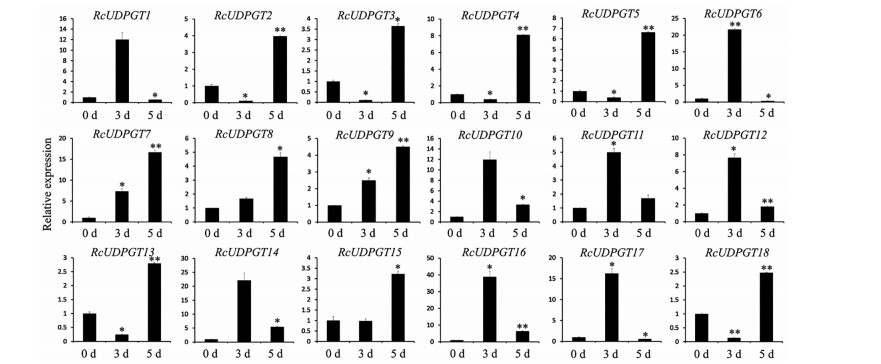
|
Figure 5 The expression levels of RcUDPGTs under UV treatment condition by qRT-PCR. *P < 0.05, **P < 0.01 vs control. Note: Repeat 3 samples, each for 3 times |
植物激素是一种重要的信号分子, 是机体应对外界环境变化、调控生长发育的重要手段。UDPGT对于许多内源激素的合成与降解具有不可替代的作用。因此, 为了进一步分析RcUDPGTs与植物激素之间的关系, 对其在ABA、IAA和MeJA胁迫下的表达量进行了鉴定。结果显示大部分基因都可以受到外源激素的诱导表达, 但也出现抑制表达的情况如RcUDPGT2、RcUDPGT3和RcUDPGT18。并且同一基因在不同激素处理下的表达模式不同如RcUDPGT5、RcUDPGT7、RcUDPGT15、RcUDPGT16, ABA处理后上调表达MeJA处理后下调表达。此外, 外源ABA会诱导15个RcUDPGTs基因表达, 而抑制3个RcUDPGTs基因的表达量; IAA能够显著提高RcUDPGT10、RcUDPGT11基因的表达水平; MeJA除对RcUDPGT1基因的表达水平影响不明显外, 能够显著诱导10个RcUDPGTs基因表达(图 6)。
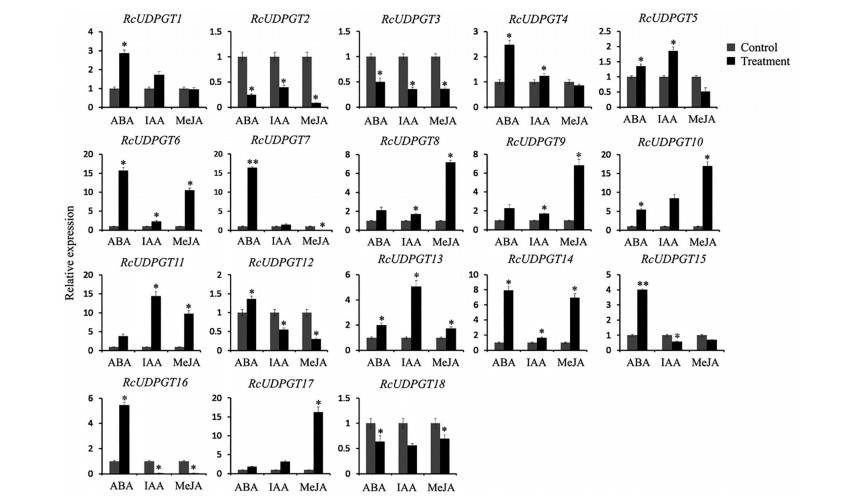
|
Figure 6 The expression levels of RcUDPGTs under plant hormones treatment conditions. *P < 0.05, **P < 0.01 vs control. Note: Repeat 3 samples, each for 3 times |
为了进一步研究RcUDPGTs基因功能, 对前人已报道的, 直接参与红景天苷合成代谢途径的RcUDPGTs家族成员RcUDPGT (JX228125.1) 进行克隆, 并筛选拟南芥文库。首先验证其自激活活性和细胞毒性。如图 7所示, 转化pGBKT7-RcUDPGT的酵母细胞在SD/-Trp培养基上能正常生长, 但在SD/-Trp-His培养基上无法生长, 阴性对照pGBKT7在SD/-Trp-His培养基上无法生长, 阳性对照在SD/-Trp-His培养基上正常生长, 表明RcUDPGT蛋白没有自主激活活性和细胞毒性。

|
Figure 7 Transcription activity and toxicity detection of RcUDPGT |
通过拟南芥酵母文库筛选和点对点滴板验证, 如图 8所示, 筛选到了2个与RcUDPGT互作明显的蛋白, 分别为AtKCR1 (AT1G67730.1) 和AtSNL4 (AT1G70060)。根据拟南芥文库数据库收录的基因功能描述可知, AtKCR1编码β-酮酰还原酶(KCR), 在超长链脂肪酸延伸过程中催化第一次还原反应。AtSNL4则编码转录抑制因子SIN3的同源物, 该基因可参与ABA激素信号调控途径, 并增强拟南芥AP2/EREBP类因子的转录抑制活性。说明RcUDPGT基因能够参与大花红景天的生长发育和植物激素调控途径, 其体内次生代谢产物红景天苷的积累, 可能受到多种调控机制的影响。

|
Figure 8 Validation of interaction proteins for RcUDPGT |
大花红景天是一种常见的药用植物, 应用于传统中医与藏医已有数千年的历史。据晶珠本草、藏医图鉴和本草纲目等记载, 大花红景天干燥根具有祛邪恶气、补诸不足的功效。现代药理学证明其具有抗衰老、抗疲劳、抗辐射、预防高原反应等作用, 因此也被称为高原人参[25, 26]。近年来, 随着对药用产品和保健产品的开发, 其需求量也与日俱增, 据统计每年需求红景天干燥根达1 000吨之多。由于目前仍无法进行人工栽培只能开采野生资源, 长此以往必然造成资源的枯竭[27]。另外相关研究报道也较少, 这极大阻碍了大花红景天的利用和可持续发展[28]。本研究通过对18个RcUDPGTs基因序列进行分析, 丰富了该基因家族的研究成果, 为了解大花红景天与高原环境的适应性机制, 同时为深入研究其次生代谢产物红景天苷的合成积累提供一定理论基础。
UDPGT基因的分离是研究其生物学功能的前提, 但是该家族成员的氨基酸序列相似性很低, 即使是认为较为保守的C端PSGP序列也只有43%~78%的相似性, 其他区域的同源性更低。另一方面, UDPGT主要参与次生代谢途径, 而植物的次生代谢产物多由环境诱导合成, 在植物体内负责其生物合成关键基因的表达丰度常常较低, 因此通过同源扩增的方式获得基因序列存在一定困难[29]。基于de novo拼接技术可以快速获得基因序列, 避免同源扩增和race的繁琐[30]。本研究获得的18条RcUDPGTs基因序列, 仅4条与已公布的33条Rhodiola rosea的UDPGT基因序列相似, 在构建的N-J进化树中, 与拟南芥AtUDGPTs相比, RcUDPGTs和RrUDPGTs也并不是明显聚为一类, 说明这些基因的遗传距离比较远, 是大花红景天特异的UDPGT基因序列。
RcUDPGTs也可以受到植物激素ABA、IAA和MeJA的诱导表达, 一方面说明了其可能参与上述激素的合成或分解代谢, 另一方面也说明了这些基因启动子区可能存在特定激素识别的信号元件。基因的组织特异性和胁迫(低温/紫外) 诱导表达模式说明该家族的成员能够广泛的参与生长发育, 并在调节大花红景天应对高原气候的过程中扮演举足轻重的角色[31]。如RcUDPGT6、RcUDPGT11、RcUDPGT17基因在叶片中表达量最高, 且能够受到3种激素的诱导表达, 说明其基因功能可能与响应外界环境变化有直接联系。此外, 大花红景天根部次生代谢产物为红景天苷, 该类物质的合成途径最后一步反应是由RcUDPGTs催化酪醇和UDP合成[32, 33]。因此RcUDPGTs是红景天苷合成的关键基因。本研究中, RcUDPGT9、RcUDPGT10、RcUDPGT14在根中表达量最高, 且能够明显受到ABA、MeJA激素诱导, 说明这些基因可能与红景天苷的合成与积累有关。
β-酮酰还原酶(KCR) 参与合成的超长链脂肪酸(VLCFAs) 对真核生物的生存至关重要。有研究表明, VLCFAs参与植物体内三酰基甘油、磷脂、蜡和鞘脂等的合成[34]。且植物能够通过增加这些脂质中极低分子量VLCFAs的含量增强对干旱、缺氧、紫外线辐射和病原体感染等各种环境胁迫的抗性[35, 36]。此外, 转录抑制因子SNL4 (SIN3-LIKE4) 对植物的生存也很重要。研究表明SIN2/3/4、HDA19和HDC1突变体在长日照条件下开花晚于野生型或与野生型相似, 短日照条件下开花早于野生型[37]。AtSIN3通过与APETALA2/EREBP型转录抑制因子AtERF7相互作用导致过表达AtERF7的拟南芥植株对ABA的敏感性减弱, 对干旱胁迫的耐受性降低; 而降低AtERF7表达的植株对ABA的敏感性增加、促进种子萌发和幼苗生长[38]。以上结果说明RcUDPGT能够与KCR或SIN3同源物相互作用, 合成多种脂肪酸并参与ABA信号途径, 进而增强大花红景天对低温、低氧和强紫外线等高原环境的适应性。这与常凯等[17]分析发现RcUDPGT基因启动子区域存在植物发育、激素响应、光响应、厌氧响应、低温响应和压力与防御响应等元件的结果一致。以上结果进一步证实了RcUDPGTs家族成员能够广泛的参与生长发育, 并在调节大花红景天应对高原气候的过程中扮演举足轻重的角色。同时说明大花红景天体内次生代谢产物红景天苷的积累, 可能受到多种调控机制的影响。在后续的研究中, 可以利用转基因技术改变RcUDPGTs基因的表达量, 以进一步了解其生物学功能, 为人工合成红景天苷提供一定理论基础。
作者贡献: 通讯作者张力鹏负责实验设计、数据分析及论文修改, 同时负责完成了RcUDPGTs基因家族成员的克隆、生物信息学分析和不同胁迫下的表达分析实验; 第一作者王宏鹏负责构建RcUDPGT (JX228125.1) 的诱饵载体以及筛选拟南芥酵母文库中互作蛋白实验、数据分析及论文撰写; 成璐路、滕彦娇参与前期RcUDPGTs基因家族成员的序列分析和表达模式分析实验及数据分析; 陈成彬参与样品采集和部分数据分析。
利益冲突: 本文所有的作者之间不存在利益冲突。
| [1] |
He Y, Ahmad D, Zhang X, et al. Genome-wide analysis of family-1 UDP glycosyltransferases (UGT) and identification of UGT genes for FHB resistance in wheat (Triticum aestivum L.)[J]. BMC Plant Biol, 2018, 18: 67-87. DOI:10.1186/s12870-018-1286-5 |
| [2] |
Chen L, Sun P, Zhou F, et al. Synthesis of rebaudioside D, using glycosyltransferase UGTSL2 and in situ UDP-glucose regeneration[J]. Food Chem, 2018, 259: 286-291. DOI:10.1016/j.foodchem.2018.03.126 |
| [3] |
Yin Q, Shen G, Di S, et al. Genome-wide identification and functional characterization of UDP-glucosyltransferase genes involved in flavonoid biosynthesis in Glycine max[J]. Plant Cell Physiol, 2017, 58: 1558-1572. DOI:10.1093/pcp/pcx081 |
| [4] |
Zhong Y, Xue X, Liu Z, et al. Developmentally regulated glucosylation of bitter triterpenoid in cucumber by the UDP-glucosyltransferase UGT73AM3[J]. Mol Plant, 2017, 10: 1000-1003. DOI:10.1016/j.molp.2017.02.005 |
| [5] |
Zhang TT, Liang HC, Gong T, et al. Studies on the enzymatic synthesis of a new PPT-type ginsenoside via UDP-glycosyltransferase PgUGT74AE2 from Panax ginseng[J]. Acta Pharm Sin (药学学报), 2018, 53: 304-312. |
| [6] |
Song C, Zhao S, Hong X, et al. A UDP-glucosyltransferase functions in both acylphloroglucinol glucoside and anthocyanin biosynthesis in strawberry (Fragaria x ananassa)[J]. Plant J, 2016, 85: 730-742. DOI:10.1111/tpj.13140 |
| [7] |
Liu Z, Yan JP, Li DK, et al. UDP-glucosyltransferase71c5, a major glucosyltransferase, mediates abscisic acid homeostasis in Arabidopsis[J]. Plant Physiol, 2015, 167: 1659-1670. DOI:10.1104/pp.15.00053 |
| [8] |
Dong T, Hwang I. Contribution of ABA UDP-glucosyltransferases in coordination of ABA biosynthesis and catabolism for ABA homeostasis[J]. Plant Signal Behav, 2014, 9: e28888. DOI:10.4161/psb.28888 |
| [9] |
Hu B, Zhang SH, Ren MM, et al. The expression of Spodoptera exigua P450 and UGT genes: tissue specificity and response to insecticides[J]. Insect Sci, 2019, 26: 199-216. DOI:10.1111/1744-7917.12538 |
| [10] |
Wu B, Gao L, Gao J, et al. Genome-wide identification, expression patterns, and functional analysis of UDP glycosyltransferase family in peach (Prunus persica L. Batsch)[J]. Front Plant Sci, 2017, 8: 1-14. |
| [11] |
Yu J, Hu F, Dossa K, et al. Genome-wide analysis of UDP-glycosyltransferase super family in Brassica rapa and Brassica oleracea reveals its evolutionary history and functional characterization[J]. BMC Genomics, 2017, 18: 474-482. DOI:10.1186/s12864-017-3844-x |
| [12] |
Li Y, Li P, Wang Y, et al. Genome-wide identification and phylogenetic analysis of family-1 UDP glycosyltransferases in maize (Zea mays)[J]. Planta, 2014, 239: 1265-1279. DOI:10.1007/s00425-014-2050-1 |
| [13] |
Zhang JQ, Meng SY, Allen GA, et al. Rapid radiation and dispersal out of the Qinghai-Tibetan Plateau of an alpine plant lineage Rhodiola (Crassulaceae)[J]. Mol Phylogenet Evol, 2014, 77: 147-158. DOI:10.1016/j.ympev.2014.04.013 |
| [14] |
Zhang JQ, Meng SY, Wen J, et al. Phylogenetic relationships and character evolution of Rhodiola (Crassulaceae) based on nuclear ribosomal its and plastid trnL-F and psbA-trnH sequences[J]. Syst Bot, 2014, 39: 441-451. DOI:10.1600/036364414X680753 |
| [15] |
Lan X, Chang K, Zeng L, et al. Engineering salidroside biosynthetic pathway in hairy root cultures of Rhodiola crenulata based on metabolic characterization of tyrosine decarboxylase[J]. PLoS One, 2013, 8: e75459. DOI:10.1371/journal.pone.0075459 |
| [16] |
Ma LQ, Liu BY, Gao DY, et al. Molecular cloning and overexpression of a novel UDP-glucosyltransferase elevating salidroside levels in Rhodiola sachalinensis[J]. Plant Cell Reports, 2007, 26: 989-999. DOI:10.1007/s00299-007-0317-8 |
| [17] |
Chang K, Ma LL, Wang YW, et al. Genomic DNA cloning and analysis of uridine diphosphate-glucosyltransferase gene from Rhodiola crenulata[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 736-743. |
| [18] |
Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[M]. Beijing: China Medical Science Press, 2015.
|
| [19] |
Fu Y, Li L, Hao S, et al. Draft genome sequence of the Tibetan medicinal herb Rhodiola crenulata[J]. Gigascience, 2017, 6: 1-5. |
| [20] |
Zhang LP, Zhang YX, Song WQ, et al. A highly efficient method of RNA extraction from Rhodiola plant[J]. J Nankai Univ (Nat Sci) (南开大学学报·自然科学版), 2017, 50: 48-53. |
| [21] |
Zhang LP, Han XY, Cheng LL, et al. Isolation and expression analysis of Cyp450 genes in Tibet Rhodiola renulata[J]. North Hort (北方园艺), 2019, 18: 116-127. |
| [22] |
Wei T, Deng K, Gao Y, et al. Arabidopsis DREB1B in transgenic Salvia miltiorrhiza increased tolerance to drought stress without stunting growth[J]. Plant Physiol Biochem, 2016, 104: 17-28. DOI:10.1016/j.plaphy.2016.03.003 |
| [23] |
Zhang LP, Yu DS, Teng YJ. Isolation and investigation of glutathione s-transferase genes in Tibet Rhodiola renulata[J]. North Hort (北方园艺), 2019, 18: 18-27. |
| [24] |
Li YM, Zhang N, Shen X, et al. Identification and expression analysis of four CIPKs genes froma rare and medicinal plant, Dendrobium officinale[J]. Acta Pharm Sin (药学学报), 2018, 53: 304-312. |
| [25] |
Chen SF, Tsai HJ, Hung TH, et al. Salidroside improves behavioral and histological outcomes and reduces apoptosis via PI3K/Akt signaling after experimental traumatic brain injury[J]. PLoS One, 2012, 7: e45763. DOI:10.1371/journal.pone.0045763 |
| [26] |
Kelly GS. Rhodiola rosea: a possible plant adaptogen[J]. Altern Med Rev, 2001, 6: 293-302. |
| [27] |
Zhang LP, Wu M, Yu DS, et al. Identification of glutathione peroxidase (GPX) gene family in Rhodiola crenulata and gene expression analysis under stress conditions[J]. Int J Mol Sci, 2018, 19: 3329-3346. DOI:10.3390/ijms19113329 |
| [28] |
Zhang JQ, Meng SY, Wen J, et al. DNA barcoding of Rhodiola (Crassulaceae): a case study on a group of recently diversified medicinal plants from the Qinghai-Tibetan Plateau[J]. PLoS One, 2015, 10: e0119921. DOI:10.1371/journal.pone.0119921 |
| [29] |
Lee HI, Raskin I. Purification, cloning, and expression of a pathogen inducible UDP-glucose: salicylic acid glucosyltransferase from tobacco[J]. J Biol Chem, 1999, 274: 36637-36642. DOI:10.1074/jbc.274.51.36637 |
| [30] |
Ain M, Chen H, Wu B, et al. Computational identification and systematic classification of novel cytochrome P450 genes in Salvia miltiorrhiza[J]. PLoS One, 2014, 9: e115149. DOI:10.1371/journal.pone.0115149 |
| [31] |
Pasquet JC, Changenet V, Macadré C, et al. A brachypodium UDP-glycosyltransferase confers root tolerance to deoxynivalenol and resistance to fusarium infection[J]. Plant Physiol, 2016, 172: 559-574. DOI:10.1104/pp.16.00371 |
| [32] |
Gyorgy Z, Jaakola L, Neubauer P, et al. Isolation and genotype-dependent, organ-specific expression analysis of a Rhodiola rosea cDNA encoding tyrosine decarboxylase[J]. J Plant Physiol, 2009, 166: 1581-1586. DOI:10.1016/j.jplph.2009.03.016 |
| [33] |
Zhang JX, Ma LQ, Yu HS, et al. A tyrosine decarboxylase catalyzes the initial reaction of the salidroside biosynthesis pathway in Rhodiola sachalinensis[J]. Plant Cell Reports, 2011, 30: 1443-1453. DOI:10.1007/s00299-011-1053-7 |
| [34] |
Bach L, Faure JD. Role of very-long-chain fatty acids in plant development, when chain length does matter[J]. C R Biol, 2010, 333: 361-370. |
| [35] |
De Bigault Du Granrut A, Cacas JL. How very-long-chain fatty acids could signal stressful conditions in plants?[J]. Front Plant Sci, 2016, 7: 1490-1503. |
| [36] |
Park CS, Go YS, Suh MC. Cuticular wax biosynthesis is positively regulated by WRINKLED4, an AP2/ERF-type transcription factor, in Arabidopsis stems[J]. Plant J, 2016, 88: 257-270. |
| [37] |
Ning YQ, Chen Q, Lin RN, et al. The HDA19 histone deacetylase complex is involved in the regulation of flowering time in a photoperiod-dependent manner[J]. Plant J, 2019, 98: 448-464. |
| [38] |
Song CP, Agarwal M, Ohta M, et al. Role of an Arabidopsis AP2/EREBP-type transcriptional repressor in abscisic acid and drought stress responses[J]. Plant Cell, 2005, 17: 2384-2396. DOI:10.1105/tpc.105.033043 |
 2021, Vol. 56
2021, Vol. 56


