微针作为一种新型经皮给药技术[1], 主要通过突破皮肤角质层屏障, 而不损伤表皮与真皮层中的神经末梢, 使药物通过皮肤达到全身循环, 而不会在达到目标的过程中损失药物, 提高了生物利用度, 改善了药物的持续释放, 最大程度地减少了不良反应, 并改善了生理和药理反应[2]。可溶性微针采用可生物降解材料[3], 刺入皮肤后自行降解, 从而达到药物递送目的。这解决了金属或硅微针等生物相容性不好、断裂后的材料留在皮内造成不良影响等问题[4]。然而, 与金属或硅微针相比, 可溶性微针机械强度较弱, 并且药物的负载会进一步降低微针的机械强度[5, 6], 这将会降低可溶性微针的药物递送效率。因此, 进一步提高可溶性微针的机械强度是亟需解决的问题。
目前, 主要提升可溶性微针机械强度的方法是通过两种及以上的微针基质材料共混, 从而达到韧脆性材料优势互补的增强效果[3], 如Li等[7]采用聚乙烯吡咯烷酮(polyvinyl pyrrolidone, PVP K30) 和聚乙烯醇(polyvinyl alcohol, PVA 217) 作为微针基质材料构建可溶性微针。除此之外, Liu等[8]在采用纳米碳酸钙与微针结合递送药物过程中发现负载胰岛素的纳米碳酸钙与微针结合, 一定程度上提高了微针的机械强度。但已报道的研究并未见纳米粒不同种类、粒径和处方占比对可溶性微针机械性能的影响进行系统比较研究, 且纳米粒作为一种外置添加物, 与微针结合, 是否对皮肤具有刺激性等安全问题, 尚未有研究报道。本实验将以此为研究目的, 以期进一步提高可溶性微针的机械性能且具有足够生物安全性, 满足临床应用的需要。
材料与方法仪器 G200纳米压痕仪(Agilent公司); WD-200N微机控制电子万能试验机、WD-5230-3D显微镜[微缔医药科技(杭州) 有限公司]; 场发射扫描电子显微镜(日本Hitachi公司); TDL-5M低速冷冻离心机(上海卢湘仪离心机仪器有限公司); 电热恒温鼓风干燥箱(上海森信实验仪器有限公司)。
试剂与材料 聚乙烯吡咯烷酮(PVP K30, 广东粤美化工有限公司); 乙烯基吡咯烷酮-乙酸乙烯酯共聚物(PVP/VA 64, 广东粤美化工有限公司); 聚乙烯醇(PVA 224, 日本可乐丽株式会社); 纳米碳酸钙(CaCO3)、纳米羟基磷灰石(Hap) (北京德科岛金科技有限公司); 纳米二氧化硅(SiO2, 上海麦克林生化科技有限公司); 金属微针及微针专用给药器[微缔医药科技(杭州) 有限公司]。
动物 新西兰兔, 雄性, 体重2.5 kg, 购自杭州余杭科联兔业专业合作社, 合格证编号: 20210113Cezz0104020208, 生产许可证号: SYXK (浙) 2017-0001。动物饲养环境: 温度20~25 ℃、相对湿度50%~60%, 12 h昼夜明暗交替。动物实验已获得浙江工业大学实验动物福利与伦理委员会批准。
可溶性微针制备 以PDMS制备微针阴模具, 采用分段倒模浇筑法[9]制备可溶性微针。微针针体液由微针基质材料、去离子水及纳米粒组成, 其中, 微针基质材料为PVP和PVP/VA中的一种, 纳米粒为纳米碳酸钙、纳米羟基磷灰石和纳米二氧化硅中的一种。微针背衬液由33.3% PVP/VA 64、6.7% PVA 224和60%去离子水组成。取上述微针针体液置于阴模具中, 离心入模后, 刮除针孔外多余溶液, 随后, 将微针背衬液置于阴模具中, 再次离心。完成上述操作后, 将其置于40 ℃电热恒温鼓风干燥箱中, 干燥后脱模即得。
微针形态观察 采用3D显微镜进行微针宏观观察, 场发射扫描电子显微镜(SEM) 进行微针针体的微观观察。
弹性模量及硬度的测定 采用纳米压痕仪进行微针基质材料与纳米粒共混形成的微针的弹性模量及硬度考察。使用三棱锥金刚石压痕器以恒定应变率(0.05 s-1) 从样品表面压入材料至深度为3 000 nm。将单一微针基质材料形成的微针所测得的弹性模量及硬度作为对照组, 探究不同纳米粒、粒径及其质量占比与微针基质材料共混后, 对其弹性模量及硬度影响。
压变性能考察 采用微机控制电子万能试验机[10]进行可溶性微针的压变性能考察。将可溶性微针针面朝上放置, 使针与探头的轴向平行, 进行压变性能测定, 记录过程中位移与微针针体受到的压力。
微针穿刺性能考察 采用石蜡膜穿刺法测定可溶性微针的穿刺性能, 将8层石蜡膜固定在泡沫板上模拟皮肤, 使用给药器将制备好的微针刺入人工皮肤中, 然后将穿刺好的石蜡膜置于显微镜下, 观察孔洞数, 计算刺入深度(深度= ∑D×a/A (a为孔洞数; A为微针的总含针数; D为单层石蜡膜厚度, 118 μm)。
皮肤刺激性考察 家兔[11]背部两侧除毛, 左侧皮肤用记号笔作“#”标记, 面积为16 cm2, 作为完整皮肤组; 右侧用消毒后的手术刀划破(呈“#”字型, 面积为16 cm2), 至渗血为度, 作为破损皮肤组。将8只家兔随机分为两组: 一组为实验组(编号为1、2、3、4); 另一组为空白对照组(编号为5、6、7、8)。24 h后, 实验组中在家兔两侧特定皮肤区, 使用给药器施用含纳米粒的可溶性微针; 空白对照组使用给药器施用空白可溶性微针。4 h后除去微针及附着物, 分别于1、24和72 h拍下给药部位照片, 肉眼观察并记录给药部位红斑、水肿等刺激反应发生情况, 按皮肤刺激反应评分标准(表 1) 及皮肤刺激强度评价标准(表 2) 进行刺激反应评分, 并评价含纳米粒的微针对皮肤的刺激强度。
| Table 1 The assessment of skin irritation degree |
| Table 2 The evaluation of skin irritation degree |
统计学分析 实验数据用SPSS 21.0统计软件进行分析, 数据以x±s表示, 组间检验采用t检验, P < 0.05具有统计学意义。
结果 1 微针的外观形态表征如图 1A、B所示, 含纳米粒的可溶性微针针型良好, 纳米粒主要集中在微针针体前端, 且对微针针尖锐度没有造成影响。从图 1C微针的断面图可知, 纳米粒与微针基质材料相互共混完全, 并没有造成针体内出现空隙。

|
Figure 1 The appearance (A, B) and morphology (C) of microneedles |
将测得的基质材料与纳米粒共混形成的微针在纳米压痕仪压入样品过程中所受的负载力对位移作图, 得到位移-负载曲线以及其弹性模量、硬度柱状图。从图 2可知, 当微针基质材料为PVP时, 纳米碳酸钙对其弹性模量及硬度具有显著性提高(P < 0.001), 而纳米羟基磷灰石与二氧化硅对其影响不大, 甚至PVP与纳米羟基磷灰石共混后, 降低了硬度。从图 3可知, 当微针基质材料为PVP/VA时, 纳米羟基磷灰石对其弹性模量及硬度具有显著性提高(P < 0.001), 其他纳米粒对其影响不大。从上述结果分析可知, 不同微针基质材料需要选择特定的纳米粒, 才能增强其弹性模量与硬度。
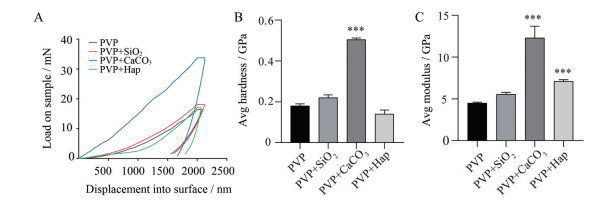
|
Figure 2 Measurement results of elastic modulus and hardness of thin sheets formed by polyvinyl pyrrolidone (PVP) and different nanoparticles. A: Load force versus displacement diagram; B: Hardness test results; C: Elastic modulus measurement results. Hap: Nano-hydroxyapatite; Avg: Average. n = 6, x±s.***P < 0.001 vs PVP group |
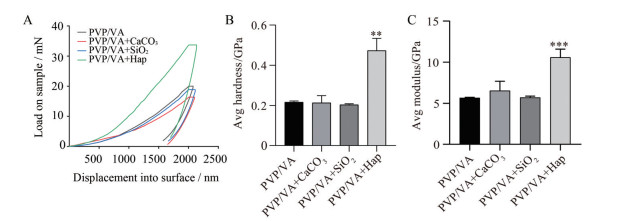
|
Figure 3 Measurement results of elastic modulus and hardness of thin sheets formed by poly(1-vinylpyrrolidone-co-vinyl acetate) (PVP/VA) and different nanoparticles. A: Load force versus displacement diagram; B: Hardness test results; C: Elastic modulus measurement results. n = 6, x±s.**P < 0.01, ***P < 0.001 vs PVP/VA group |
本实验主要探究纳米粒的粒径这一单因素对微针性能的影响, 故选择PVP/VA 64作为微针基质材料与不同粒径的纳米羟基磷灰石制备可溶性微针, 通过纳米压痕仪测定其弹性模量与硬度, 结果如图 4所示。

|
Figure 4 Measurement results of elastic modulus and hardness of thin slices formed by PVP/VA and Hap of different particle sizes. A: Load force versus displacement diagram; B: Hardness test results; C: Elastic modulus measurement results. n = 6, x±s.*P < 0.05, **P < 0.01, ***P < 0.001 vs 100 nm group |
纳米粒的粒径与微针弹性模量与硬度的关系呈负相关, 随粒径的增大, 微针的弹性模量与硬度越低, 可能由于初始粒径的增大, 纳米粒本身存在团聚现象, 导致在微针制备过程中纳米粒过度团聚, 粒径呈几何倍增长, 从而使微针整体呈疏松状态, 降低了其弹性模量与硬度。
2.3 纳米粒不同处方质量占比对微针弹性模量与硬度影响本实验主要探究纳米粒处方含量这一单因素对微针性能的影响, 故选择PVP/VA 64作为微针基质材料与不同处方含量的纳米羟基磷灰石制备可溶性微针, 通过纳米压痕仪测定其弹性模量与硬度, 结果如图 5所示。

|
Figure 5 Elastic modulus and hardness test results of nanoparticles with different proportions. A: Load force versus displacement diagram; B: Hardness test results; C: Elastic modulus measurement results. n = 6, x±s.*P < 0.05, **P < 0.01, ***P < 0.001 vs 2% Hap group |
当纳米粒质量占比从2%提升至6%, 弹性模量与硬度具有显著性提高, 但继续提升纳米粒质量占比, 对其影响不大, 反而有一定下降趋势。
综上所述, 添加纳米粒能有效提高微针的弹性模量与硬度, 但需要基于微针基质材料的选择, 综合考虑何种纳米粒、粒径大小及处方占比, 从而最大限度提升微针的弹性模量与硬度。
3 压变性能考察选择PVP/VA作为微针基质材料, 溶菌酶作为模型药物, 纳米羟基磷灰石(20 nm) 作为纳米粒材料进行微针制备, 并考察其压变性能, 将测得的可溶性微针在压变过程中所受的力对位移作图, 得到微针的位移-力曲线。从图 6可知, 随下压位移的增加, 由PVP/VA与Hap组成的微针所能承受的轴向应力更大, 使可溶性微针在刺入皮肤过程中不容易发生断裂, 更有利于微针刺入皮肤。同时, 也阐明了可溶性微针弹性模量、硬度与微针的机械应力呈正相关关系。

|
Figure 6 Results of the investigation of the compressive performance of a single microneedle. n = 6, x±s.***P < 0.001 vs PVP/VA group |
微针的刺入性能比较结果, 由表 3可知, 纳米增强的可溶性微针实际刺入深度, 相较于常规可溶性微针而言, 具有显著性提高, 这说明了可溶性微针压变性能的提高, 有效地提高了微针的刺入性能, 从而进一步提高微针的药物递送效率。
| Table 3 Investigation results of microneedle penetration performance. n = 3. ***P < 0.001 vs dissolving microneedles |
皮肤刺激性评价如表 4和表 5所示。由上述刺激性实验数据结果可知, 纳米增强的可溶性微针和空白微针均对正常完整皮肤无刺激性, 纳米增强的可溶性微针对破损皮肤具有轻度刺激性, 且随时间增长, 皮肤红斑与水肿逐渐消退, 至72 h刺激性反应消失。
| Table 4 The result of skin irritation. n = 4 |
| Table 5 The evaluation results of skin irritation. n = 4 |
本实验主要通过纳米压痕仪测定不同纳米粒(种类、粒径) 以不同占比与微针基质材料共混形成的微针的弹性模量及硬度, 探究纳米粒种类、粒径以及处方占比对微针的影响。结果表明, 纳米碳酸钙对PVP微针性能具有显著性提升, 而其他纳米粒对PVP微针性能影响不大。可能是因为纳米碳酸钙的钙离子与PVP的羰基(C=O) 发生相互作用, 使两相结合更加紧密, 也可能是钙离子与PVP之间形成了氢键, 通过黏滑机制提升了微针性能[12]; 对于PVP/VA微针, 纳米羟基磷灰石对其性能提升最显著, 而其他纳米粒对其性能影响不大。可能是因为纳米羟基磷灰石与PVP/VA形成氢键, 从而使两者结合更紧密。但具体什么原因使微针性能提升, 需进一步实验验证。
结果说明, 选择何种纳米粒增强可溶性微针性能取决于构建可溶性微针的基质材料。而文献[3]中提及微针不同的材料之间组合以及材料与药物的组合, 会导致可溶性微针机械性能具有差异。因此, 制备可溶性微针需综合考虑所负载药物特性, 选择相应的基质材料, 并以此再筛选合适的纳米粒来进一步提高微针的机械性能。
除此之外, 本实验中纳米粒主要集中在微针针体前端, 有效提升了微针的压变性能与刺入性能。然而, 有专利[13]报道, 纳米粒需良好分布于微针针体中, 才能有效优化微针性能, 而纳米粒位于或接近微针针体前端, 将不会具有所谓的微针机械强度的提升。这可能是由于本实验采用低粒径对微针性能优化, 即使纳米粒在微针针体内发生团聚现象, 粒径仍远小于微针针尖直径(20~30 μm), 如图 1所示, 纳米粒与微针基质材料结合紧密, 且微针针体尖锐度不受影响。
可溶性微针作为新型经皮递送系统与纳米粒结合进行药物递送, 已经被广泛研究。如Liu等[8]采用纳米碳酸钙与PVP形成的微针进行胰岛素的递送; Mönkäre等[14]、Su等[15]和Zaric等[16]使用PLGA负载药物与微针结合进行药物递送。然而, 可溶性微针突破角质层屏障进行药物递送时, 往往是微针针体前中端才能充分接触组织液进行溶解释放微针内储存药物。因此, 若能通过筛选合适纳米粒及其粒径, 使负载药物的纳米粒既能集中在微针针体前端部分, 又能有效提高微针性能, 将大大提高微针的药物递送能力。
纳米增强的微针与空白微针均对正常完好皮肤无刺激性, 而应用于破损皮肤后呈现轻微水肿及红斑, 说明发生了轻微炎症反应, 经过48~72 h后该刺激性反应完全消失。然而, 这种轻微的炎症反应, 一定程度上激活了机体内巨噬细胞、淋巴细胞及细胞因子等, 可能诱导产生炎症免疫反应(IIR)[17], 需要重视和关注, 值得进一步研究。
综上所述, 本研究揭示了微针性能的提升, 需根据微针具体所用基质材料, 选择特定的纳米粒、粒径及处方占比, 才能达到最优提升效果, 从而进一步提升微针的药物递送效率。
作者贡献: 包阳阳是本实验研究的执行人; 包阳阳和刘哲完成数据分析与论文初稿的写作; 包阳阳、刘哲和刘勇参与具体实验过程和实验结果分析; 马凤森是项目的构思者及负责人, 负责实验设计、指导实验、数据分析和论文写作与修改。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Zhan HH, Hang YC, Ma FS. Quality evaluation of lidocaine hydrochloride rapid onset local anesthesia preparation based on microneedles technology[J]. Acta Pharm Sin (药学学报), 2018, 53: 184-189. |
| [2] |
Al-Japairai KAS, Mahmood S, Almurisi SH, et al. Current trends in polymer microneedle for transdermal drug delivery[J]. Int J Pharm, 2020, 587: 119673. |
| [3] |
Zhang J, Ma FS, Zhan HH, et al. Matrix materials and their composites for dissolvable microneedle construction: a review[J]. Mater Rev (材料导报), 2017, 31: 129-134, 161. |
| [4] |
Huang YC, Ma FS, Zhan HH, et al. Microneedle array used for transdermal delivery of biomacromolecules[J]. Prog Biochem Biophys (生物化学与生物物理进展), 2017, 44: 757-768. |
| [5] |
Donnelly RF, Morrow DIJ, Singh TRR, et al. Processing difficulties and instability of carbohydrate microneedle arrays[J]. Drug Dev Ind Pharm, 2009, 35: 1242. DOI:10.1080/03639040902882280 |
| [6] |
Lee JW, Park JH, Prausnitz MR. Dissolving microneedles for transdermal drug delivery[J]. Biomaterials, 2008, 29: 2113-2124. DOI:10.1016/j.biomaterials.2007.12.048 |
| [7] |
Li RR, Wang Y, Ma FS, et al. Effects of metal or dissolving microneedles and its parameters of operation on the formation and closure of skin microchannels[J]. Acta Pharm Sin (药学学报), 2021, 56: 1163-1169. |
| [8] |
Liu DP, Jiang GH. Fabrication of composite microneedles integrated with insulin-loaded CaCO3 microparticles and PVP for transdermal delivery in diabetic rats[J]. Mat Sci Eng C Mater, 2018, 125: 180-188. |
| [9] |
Yang HG, Wu XJ, Zhou ZZ, et al. Enhanced transdermal lymphatic delivery of doxorubicin via hyaluronic acid based transfersomes/microneedle complex for tumor metastasis therapy[J]. Int J Biol Macromol, 2018, 125: 9-16. |
| [10] |
Zhao X. Construction of Hyaluronic Acid Microneedles for Transdermal Drug Delivery (透明质酸微针介导药物经皮传递的研究)[D]. Hangzhou: Zhejiang University, 2018.
|
| [11] |
Zhang JP, Wei YH. Dermal Irritation and long-term toxicity of total alkaloid of sophora alopecuroides thermo-sensitive gel[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2015, 32: 1180-1184. |
| [12] |
Libonati F, Nair AK, Vergani L, et al. Mechanics of collagen-hydroxyapatite model nanocomposites[J]. Mech Res Commun, 2014, 58: 17-23. DOI:10.1016/j.mechrescom.2013.08.008 |
| [13] |
Chen XF. Mechanically enhanced fast-dissolving microneedles suitable for transdermal drug and vaccine delivery: CN, 103816611[P]. 2018-10-23.
|
| [14] |
Mönkäre J, Pontier M, van Kampen EEM, et al. Development of PLGA nanoparticle loaded dissolving microneedles and comparison with hollow microneedles in intradermal vaccine delivery[J]. Eur J Pharm Biopharm, 2018, 129: 111-121. DOI:10.1016/j.ejpb.2018.05.031 |
| [15] |
Su LC, Chen MC. Efficient delivery of nanoparticles to deep skin layers using dissolvable microneedles with an extended-length design[J]. J Mater Chem B, 2017, 5: 3355-3363. |
| [16] |
Zaric M, Lyubomska O, Touzelet O, et al. Skin dendritic cell targeting via microneedle arrays laden with antigen-encapsulated poly-D, L-lactide-co-glycolide nanoparticles induces efficient antitumor and antiviral immune responses[J]. ACS Nano, 2013, 7: 2042-2055. |
| [17] |
Wei W. Soft regulation of inflammatory immune responses[J]. Chin Pharmacol Bull (中国药理学通报), 2016, 32: 297-303. |
 2021, Vol. 56
2021, Vol. 56


