2. 江苏省中医药研究院, 国家中医药管理局中药释药系统重点研究室, 江苏 南京 210028;
3. 中国药科大学中药学院, 江苏 南京 211198
2. Key Laboratory of New Drug Delivery Systems of Chinese Materia Medica, Jiangsu Provincial Academy of Chinese Medicine, Nanjing 210028, China;
3. School of Traditional Chinese Pharmacy, China Pharmaceutical University, Nanjing 211198, China
肺癌是全球范围内与癌症相关的死亡率的主要原因[1]。其主要的治疗方法有放化疗、手术和免疫疗法等。尽管在早期检测和治疗标准的选择方面有了进展, 但是化学疗法仍然是主要的标准疗法, 而吉西他滨(gemcitabine, GEM) 则是临床上用于肺癌化疗的首选药物之一, 尽管短期效果显著, 但肺癌的5年相对生存率仍只有17%[2]。这部分原因一是由于GEM骨髓抑制的不良反应降低了机体免疫力, 二是化疗后肿瘤微环境(tumor microenvironment, TME) 发生改变, 宿主保护性抗肿瘤免疫力被TME中的非恶性白细胞谱系所抑制, 从而显著影响了长期疗效。
TME是由肿瘤细胞、免疫细胞和肿瘤基质细胞之间相互作用形成的结果。当肿瘤细胞和免疫细胞存在时, TME会表现出免疫抑制特征, 诱导多种细胞因子的产生。通过这些细胞因子, 髓源性抑制细胞(myeloid-derived suppressor cells, MDSC) 被招募到TME中, 产生转化生长因子-β (transforming growth factor-β, TGF-β) 和arginase-1等, 抑制了T细胞以及其他抗肿瘤细胞的激活与扩增。同时, 在肿瘤中单核细胞来源的髓源性抑制细胞(monocytic-MDSCs, M-MDSC) 比粒细胞来源的髓源性抑制细胞(granulocytic-MDSCs, G-MDSC) 更突出并且具有更高的免疫抑制活性, M-MDSC可分化为免疫抑制性肿瘤相关巨噬细胞(tumor-associated macrophages, TAM), 即M2样的巨噬细胞, 介导免疫逃逸[3, 4]。此外, 这些细胞因子也是抑制荷瘤小鼠中抗肿瘤应答和MDSC介导Foxp3+调节性T细胞(Treg) 细胞发育所必需的[5]。因此, MDSC也可以通过促进肿瘤中Treg的发展和积累, 间接影响T细胞功能并阻碍抗肿瘤免疫[6]。因此, 靶向MDSC的扩增、调节TME与化疗结合在癌症中的重要性得到了广泛的重视。
灵芝孢子粉作为一种药食两用的中药已经在中国、日本和韩国使用数十年, 且其胶囊剂作为临床上辅助化疗增强免疫力的药物已被国家食品药品监督管理局(SFDA) 审批上市。多糖作为灵芝孢子粉主要成分之一, 已经被证明具有免疫调节活性。然而, 其辅助肿瘤化疗的免疫调节机制有待进一步阐明。在本研究中, 考察了PGSG在体外的免疫调节活性, 体内辅助GEM对LLC肿瘤模型的治疗作用及其对脾脏和肿瘤中各种免疫细胞的调节作用。
材料与方法药品与试剂 灵芝孢子粉(江苏省东台市神农保健食品有限公司, 破壁率≥98%); PGSG (由本实验室提取); cell activation cocktail (with brefeldin A)、ELISA试剂盒(IL-6、TNF-α、IL-12、IL-4和IL-10)、荧光抗体fixable viabilitiy dye-780 (FVD780)、CD45-Percp、CD4-FITC、CD8-APC、interferon-γ (IFN-γ)-PE、CD11b-FITC、Gr-1-PE、CD25-APC、Foxp3-PE、F4/80-APC、CD206-PE-Cy7、major histocompatibility antigens complex-II (MHC-II)-FITC、CD40-PE、CD80-PE、CD86-FITC、CD11c-APC、Ly6G-PE、Ly6C-Percp、PE-mouse-isotype-ctrl和FITC-mouse-isotype-ctrl (加拿大Biolegend公司); 注射用盐酸吉西他滨(江苏豪森药业集团有限公司); DMEM不完全培养基(含双抗)、RPMI 1640不完全培养基(含双抗)、2-mercaptoethanol (德国Sigma公司); 胰酶-含乙二胺四乙酸、胎牛血清(杭州四季青生物公司); 磷酸缓冲盐溶液(phosphate buffer saline, PBS) (江苏凯基生物技术公司); Percoll (美国GE Healthcare公司); 细胞因子GM-CSF (granulocyte-macrophage colony stimulating factor)、IL-4 (美国Pepro Tech公司); 荧光素二氯三嗪(fluorescein dichlorotriazine, DTAF, 上海皓鸿生物医药科技有限公司)。
仪器 Hera cell 150 CO2培养箱(美国Thermo公司); 5430R冷冻离心机(德国Eppendorf公司); BD FACS VERSE流式细胞仪(美国BioLegend公司); IX51 Olympus显微镜(日本Olympus公司); 扫描电子显微镜(SEM, S-3400N, 日本日立公司)。
动物与细胞株 雄性C57BL/6J小鼠, 6~8周, 由斯贝福(北京) 生物技术有限公司提供, 许可证号: SCXK (京) 2019-0010, 在江苏省中医药研究院实验中心饲养, 且获得江苏省中医药研究院伦理委员会的批准。Lewis lung cancer细胞株购自中国科学院细胞库。动物实验获得江苏省中医药研究院伦理委员会的批准。
PGSG的制备 称取灵芝孢子粉40 g, 置于装有500 mL 1 mol·L-1 NaOH的圆底烧瓶中, 80 ℃下搅拌回流提取1 h。冷却至25 ℃后, 将提取物转移至50 mL离心瓶中, 然后以2 000 r·min-1离心30 min, 弃去上清液, 将沉淀物重悬于水中, 离心, 洗涤数次。用盐酸将悬浮液的pH调节至6~8, 然后重复洗涤步骤以除去形成的盐[7]。40 ℃下将H2O2逐滴加入溶液进行脱色反应至无色溶液[8]。提取后, 将上述沉淀物转移到透析袋中, 并在4 ℃的条件下每天更换5 L去离子水透析1周; 透析后, 通过Sevage试剂(氯仿-正丁醇= 4∶1, v/v) 去蛋白[9]。最后, 将上述沉淀物重新悬浮于少量水中, 并在冷冻干燥机中冻干。
去除脂多糖 (LPS) 为了去除LPS的干扰, 准确称取PGSG 10 mg, 将其在室温下悬浮于0.2 mol·L-1 NaOH中20 min, 然后在无LPS的水中洗涤数次, 最后重悬于PBS中, 调节质量浓度至10 mg·mL-1。参照前期的研究[10], 使用此法可使得LPS < 0.1 EU·mL-1。
PGSG的扫描电镜图像 (SEM) 取干燥的PGSG 2 mg, 在高真空条件下以10.0 kV的加速电势和1 000~10 000倍的放大倍率观察样品, 获得PGSG的SEM图像[11]。
PGSG的傅里叶变换红外光谱测定 (FTIR) 称取PGSG样品并与干燥的KBr粉末混合, 研磨均匀, 按照要求进行压片, 在400~4 000 cm-1波长范围内进行红外扫描测量。
PGSG上调巨噬细胞共刺激因子的表达 首先获取腹腔巨噬细胞[10], 接种于24孔板中, 然后给予PGSG (100 μg·mL-1), 24 h后收取巨噬细胞的上清, 细胞刮收集细胞于流式管中, 2 000 r·min-1离心5 min, 去上清, 每管加入PBS重悬细胞150 μL, 准备染色。分为2组: ①用荧光抗体CD45-Percp、F4/80-APC、CD40-PE和CD86-FITC标记; ②用CD45-Percp、F4/80-APC、CD80-PE和MHC-II-FITC标记。同型对照管(isotype, Iso): CD45-Percp、F4/80-APC、PE-mouse-Isotype-ctrl和FITC-mouse-Isotype-ctrl, 冰浴暗处染色20 min, 每隔10 min振摇一次以充分染色。染色结束后直接加入PBS 2 mL, 2 000 r·min-1离心5 min, 弃上清, 加入200 μL PBS重悬细胞, 流式细胞仪检测CD40、CD86、CD80和MHC-II的中位荧光强度(MFI%)。
PGSG增强巨噬细胞结合和吞噬DTAF-PGSG能力 首先将PGSG用DTAF标记, 并培养巯基乙酸盐诱导的巨噬细胞[10]。对于结合作用的测定, 取巨噬细胞5×105个置于离心管中, 给予DTAF-PGSG终浓度为20 μg·mL-1, 置于冰上30 min, F4/80-APC用来标记巨噬细胞, 流式细胞术检测巨噬细胞结合DTAF-PGSG的比例。
吞噬作用的测定 取巨噬细胞5×105个接种于24孔板中, 并给予DTAF-PGSG, 终质量浓度为20 μg·mL-1, 于37 ℃培养箱中孵育1 h, 然后收集细胞于流式管中, 采用1 mL PBS清洗数次以除去未被吞噬的DTAF-PGSG, 加入荧光染料抗体F4/80-APC以标记巨噬细胞, 流式细胞术检测巨噬细胞吞噬DTAF-PGSG的比例。
PGSG增强巨噬细胞对中性红的吞噬能力 将巨噬细胞悬液接种于96孔板中, 分别设为空白组、LPS组和PGSG浓度梯度组, 分别为25、50、100、200、400和800 μg·mL-1, 每组设6复孔, 置于细胞培养箱中培养24 h, 然后加入0.05%中性红溶液100 μL, 于细胞培养箱中孵育30 min, 然后PBS洗涤数次, 加入100 μL裂解液裂解, 将被吞噬的中性红释放出来, 在540 nm下用酶标仪检测吸光度值。
ELISA检测巨噬细胞对IL-6、TNF-α、IL-4和IL-10的释放 取medium和PGSG (100 μg·mL-1) 组巨噬细胞培养上清, 2 000 r·min-1离心5 min。按照ELISA试剂盒的说明书操作以检测IL-6、TNF-α、IL-4和IL-10的浓度。
LLC模型的建立 取健康SPF级的雄性C57小鼠, 于右侧前肢皮下注射Lewis肺癌细胞1×106个/只, 随机分为PBS组、GEM组及PGSG联合GEM组(简称联合组), 每组6只。于第7天左右可触及肿瘤形成时给药, PBS组小鼠每天灌胃(ig) 给予PBS 0.2 mL, GEM组和联合组每隔3天腹腔注射(ip) 1次GEM (60 mg·kg-1), 同时联合组小鼠每天灌胃800 μg·mL-1 PGSG 0.2 mL。每隔3天称量1次体重并用游标卡尺测量肿瘤长径与短径。在化疗4次后, 肿瘤长径达到15 mm时处死小鼠, 在无菌环境下完整剥离肿瘤与脾脏, 并对肿瘤进行称重。按照公式(1) 计算各肿瘤体积(V, mm3)。
| $ V=L \times W^{2} / 2 $ | (1) |
其中, L为肿瘤直径(mm), W为肿瘤短径(mm)。
免疫组化检测LLC荷瘤小鼠肿瘤组织中Ki67蛋白表达 取上述剥取的部分肿瘤组织, 保存于福尔马林中, 石蜡包埋, 切片脱蜡, 抗原修复, 一抗二抗结合和染色等步骤后, 中性树脂封片, 于显微镜下观察[12]。
脾脏单细胞悬液的制备 取小鼠脾脏, 在70 μm的尼龙筛网中研磨, 用RPMI 1640培养基重悬, 2 000 r·min-1离心2 min, 弃上清, 加入1 mL的ACK裂解液裂解约30 s, 加入5 mL的RPMI 1640完全培养基终止裂解, 离心弃上清, 5 mL的RPMI 1640完全培养基重悬, 即制得脾脏单细胞悬液。
肿瘤单细胞悬液的制备 取小鼠的肿瘤, 在表面皿中剪碎。重悬于4.5 mL的RPMI 1640培养基中, 加入0.5 mL 10 ×肿瘤消化酶, 置于37 ℃旋转摇床上孵育40~60 min, 2 000 r·min-1离心2 min, 加入空白培养基洗涤2次。再用5 mL 30% Percoll重悬, 缓慢加入到2 mL 60%的Percoll中, 2 000 r·min-1离心20 min, 吸取中间层, 用不完全RPMI 1640培养基洗涤数次, 即制得肿瘤单细胞悬液。
流式细胞仪检测LLC荷瘤小鼠脾脏与肿瘤中Treg、M1/M2及MDSC的分布 取上述脾脏细胞1×106个和肿瘤单细胞悬液200 μL置于流式管中, 2 000 r·min-1离心5 min, 弃上清, 用150 μL PBS重悬细胞, 分别标记荧光抗体CD45-Percp、CD4-FITC、F4/80-APC、Gr-1-PE、MHC-II-FITC、CD11b-APC、Ly6G-PE、Ly6C-Percp Cy5.5表染20 min, 每隔10 min振摇1次; 直接加入PBS 2 mL, 2 000 r·min-1离心5 min, 弃上清, 固定, Perm Buffer破细胞膜和细胞核膜, 150 μL Perm Buffer重悬细胞, 加入CD206-PeCy7和Foxp3-PE进行胞染和核染, 染色30 min, 每隔10 min振摇1次; 200 μL Perm Buffer重悬, 流式细胞仪检测CD4+Foxp3+、F4/80+MHC-II+/CD206+、CD11b+Gr-1+和CD11b+Ly6G-Ly6Chigh的比例。
流式细胞仪检测LLC荷瘤小鼠脾脏与肿瘤中Th1与CTL的分布 分别取上述脾脏细胞1×106个和肿瘤单细胞悬液200 μL, 接种到含有RPMI 1640完全培养基的24孔板中, 使得终体积为1 mL, 同时加入2 μL cell activation cocktail刺激剂培养4~6 h。收集细胞于流式管中, 用荧光抗体FVD-780、CD45-Percp、CD4-FITC、CD8-APC、IFN-γ-PE标记, 置于冰浴暗处染色20 min, 每隔10 min振摇1次以充分染色。染色结束后直接加入PBS 2 mL, 2 000 r·min-1离心5 min, 弃上清, 加入200 μL PBS重悬细胞, 流式细胞仪检测CD4+IFN-γ+和CD8+IFN-γ+的比例。
统计学方法 采用SPSS19.0软件进行分析, 通过单因素方差one-way ANOVA分析比较多组间的值以确定统计学上显著性差异, 数据表示为x±s, P < 0.05被认为具有统计学意义。
结果 1 PGSG的表征 1.1 SEM图像扫描电镜图像显示了PGSG的物理形态。如图 1A所示, 未经提取的灵芝孢子为褐色、卵形, 具有双层壁结构。经过高温碱性条件提取后, 灵芝孢子壁破碎。在1 000~10 000放大倍率下, PGSG的SEM图像显示出状颗粒聚集、性质紧密和表面多孔, 且直径约为2~6 μm。
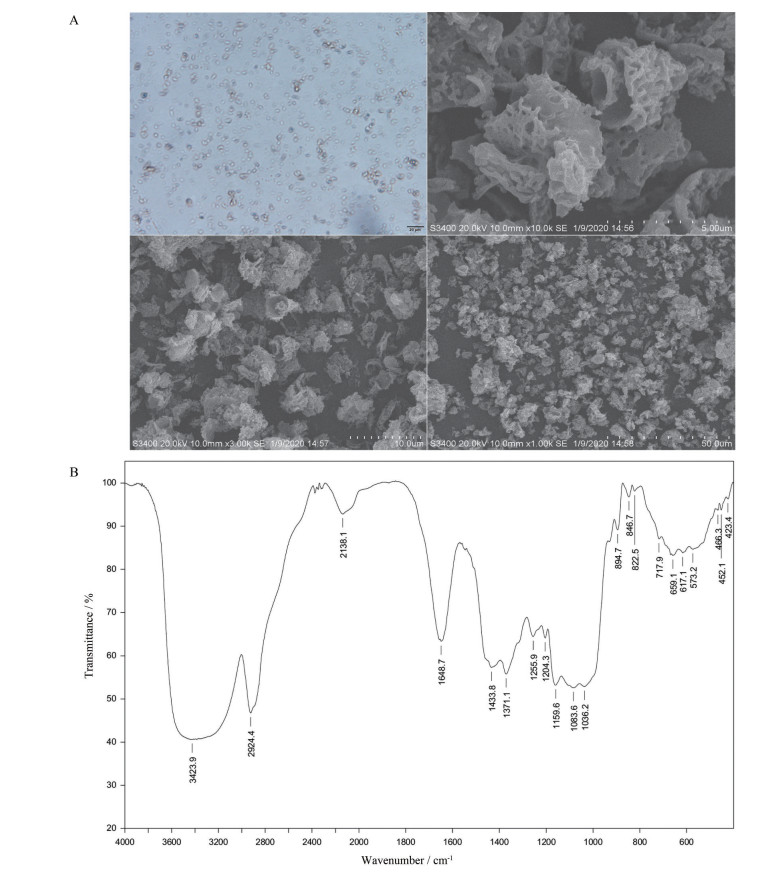
|
Figure 1 Scanning electron microscope imagines of micro-particulate Ganoderma lucidum spore β-glucan (PGSG) (A) and Fourier transform infrared spectroscopy of PGSG (B) |
PGSG的傅里叶红外变换光谱如图 1B所示。葡聚糖的特征吸收峰发生在3 600~3 200 cm-1和2 926~2 853 cm-1, 3 423.9和2 924.40 cm-1处的红外光谱带分别为羟基拉伸振动和CH拉伸振动[13]。在1 648.7和1 433.8 cm-1处有比较强的吸收峰, 也表明多糖的红外吸收特征[14]。1 371.1 cm-1处的吸收峰是C-H的弯曲振动引起的。1 255.9和1 204.3 cm-1的吸收峰是由-COOH中C=O的对称伸缩振动引起的。在1 159.6、1 083.6和1 036.2 cm-1处的峰是PGSG的D-吡喃糖环非对称伸缩振动[15]。在894.7 cm-1处表现出明显的吸收峰, 这是多糖中β构型的特征吸收峰[16]。PGSG的894.7、1 159.6和1 371.1cm-1处的吸收峰归属于β-1, 3-葡聚糖链[17]。因此, PGSG为β-1, 3-D-葡聚糖。
2 PGSG对腹腔巨噬细胞活性的影响巨噬细胞是体内分布最广的抗原递呈细胞。为了观察PGSG对腹腔静息巨噬细胞成熟、活化及其功能的影响, 首先检测了巨噬细胞表面共刺激因子的表达(图 2A), PGSG上调了巨噬细胞表面CD40、CD86、CD80和MHC-II的表达, 表明PGSG能够促进巨噬细胞的成熟。巨噬细胞激活的最显著特征之一是吞噬活性的增强, 而PGSG能够明显增加与巨噬细胞的结合作用(图 2B) 并增强巨噬细胞对DTAF-PGSG的吞噬作用(图 2C), 且对中性红的吞噬作用具有浓度依赖性(图 2D)。巨噬细胞是先天免疫系统的核心组成部分。这个系统是人体抵抗感染的第一道防线。真菌β-葡聚糖的功能是作为一种病原体相关分子模式(pathogen-associated molecular patterns, PAMPs), 在与模式识别受体(pattern recognition receptor, PRR) 接触后触发宿主免疫应答。先天免疫系统利用识别PAMPs的PRR来诱导巨噬细胞内的细胞因子分泌(图 2E)。因此, PGSG能够促进巨噬细胞的成熟、活化, 并增加细胞因子IL-6、TNF-α、IL-4和IL-10的分泌。

|
Figure 2 Effects of PGSG on macrophage activities. A: Co-stimulators expressions of macrophage. MFI: Median fluorescent intensity; ISO: Isotype ctrl; B: PGSG binding on the macrophages; C: Effect of PGSG on the phagocytosis of fluorescein dichlorotriazine-PGSG (DTAF-PGSG) in macrophages; D: Effects of PGSG on the phagocytosis of neutral red in macrophages. LPS: Lipopolysaccharide. n = 6, x±s.*P < 0.05, **P < 0.01, ***P < 0.001 vs medium group; E: PGSG promoted the release of inflammatory factors by macrophages. IL-6: Interleukin-6; TNF-α: Tumor necrosis factor-α. n = 3, x±s |
为了观察PGSG联合GEM是否能够进一步延缓LLC荷瘤小鼠肿瘤的发展, 按图 3A所示建立了Lewis肺癌小鼠模型并给予PBS (ig)、GEM (ip) 和PGSG (ig), 测量并记录小鼠的肿瘤体积及体重。如图 3B、C所示, 与GEM组相比, PGSG联合GEM的治疗显著降低了肿瘤的体积并减小了GEM引起的体重下降的不良反应。在处死小鼠后, 剥取小鼠的肿瘤(图 3D) 并称重(图 3E), 联合组的小鼠肿瘤重量明显下降。Ki67蛋白的表达能够反映癌细胞数量和活跃程度, Ki67蛋白表达量越高, 肿瘤细胞越活跃。如图 3F所示, 联合组Ki67蛋白表达量明显低于PBS组[10]。提示PGSG能够协同GEM发挥抗肿瘤作用, 同时降低GEM的不良反应。
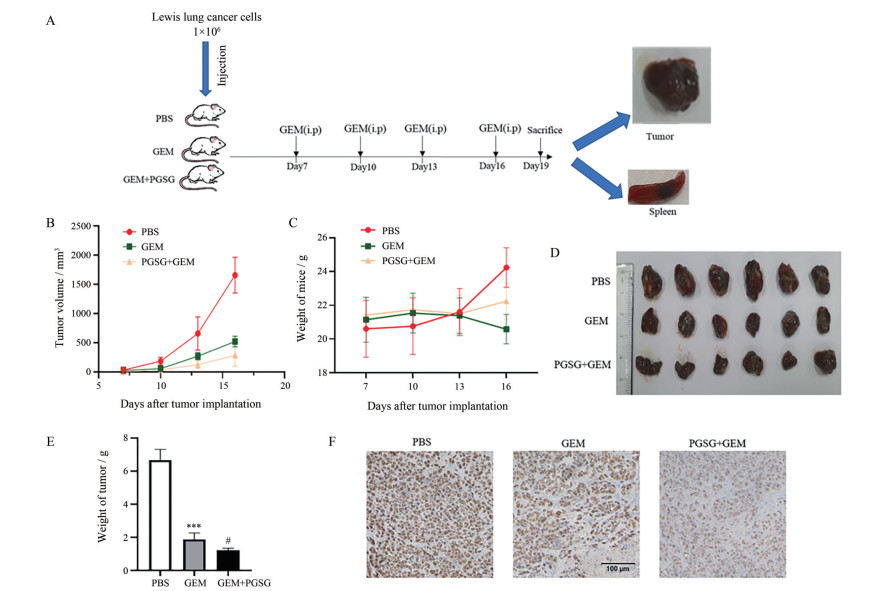
|
Figure 3 The effect of PGSG on tumor burden, body weight and tumor volume of LLC tumor-bearing mice. A: Experimental protocols used in this experiment; B: Tumor volume-time curve of LLC tumor-bearing mice; C: Body weight-time curve of LLC tumor-bearing mice; D: Tumor outlooks of different mice in different groups; E: Tumor weight of LLC tumor-bearing mice; F: Expression of Ki67 protein in tumor tissues of C57 mice subcutaneous xenograft detected by immunohistochemical staining. PBS: Phosphate buffer saline; GEM: Gemcitabine. n = 6, x±s. ***P < 0.001 vs PBS group, #P < 0.05 vs GEM group |
MDSC浸润程度高的癌组织与患者预后差和对各种疗法的耐药性相关[18, 19]。因此, 使用流式细胞术观察了PGSG对GEM化疗后肿瘤与脾脏中MDSC及其亚群分布的影响。检测结果显示(图 4), 单独化疗后肿瘤中MDSC的比例约是PBS组和联合组的2倍, 而联合给药组的MDSC明显下降(图 4A)。同时, 单独化疗组的脾脏中M-MDSC的数量增加了5 %左右, M-MDSC被认为与发挥免疫抑制作用的M2巨噬细胞密切相关, 而PGSG能够显著降低化疗引起的免疫抑制细胞M-MDSC的增加(图 4B)。这些数据表明, PGSG可以降低化疗后TME中MDSC的分布, 以调节TME。

|
Figure 4 Effects of PGSG on myeloid-derived suppressor cells (MDSC) distributions in tumor and spleen. A: MDSC (CD11b+Gr-1+) in tumor; B: The proportion of monocytic-MDSCs (M-MDSC, CD11b+Ly6G-Ly6Chigh) in spleen. n = 6, x±s. **P < 0.01, ***P < 0.001 |
M2样的肿瘤相关巨噬细胞在肿瘤进展、血管生成、转移和免疫抑制中的作用已得到很好的证明[20]。作者又分析了PGSG是否能够调节TAM, 降低M2巨噬细胞比例的同时升高具有有效免疫刺激活性的M1样表型。因此, 在给予PGSG后, 检测了小鼠肿瘤与脾脏中M1与M2的分布。结果如图 5所示, GEM单独化疗后, M2 (F4/80+CD206+) 的比例增加了3%, 在给予PGSG后, 肿瘤与脾脏中的M2比例明显下降, 脾脏中M1比例明显上升。奇怪的是, 作者发现肿瘤中M1的比例未见明显上升, 具体原因仍然未知。
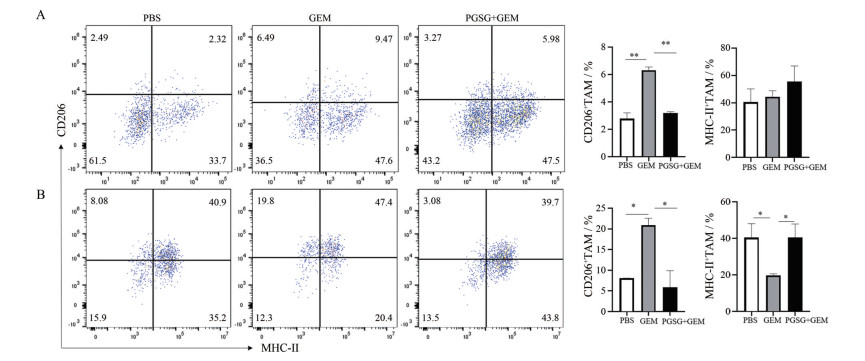
|
Figure 5 The influence of PGSG on the distribution of tumor associated macrophages (TAM) in tumor and spleen. A: Distribution of M1 (F4/80+MHC-II+)/M2 (F4/80+CD206+) in tumors; B: Distribution of M1 (F4/80+MHC-II+)/M2 (F4/80+CD206+) in spleen. n = 6, x±s. *P < 0.05, **P < 0.001 |
Foxp3+Treg细胞在肿瘤微环境中大量增加, 能抑制抗肿瘤免疫应答, 介导免疫抑制, 造成肿瘤的迁移。如图 6流式细胞实验结果所示, 单独化疗后, 小鼠肿瘤与脾脏中Foxp3+Treg细胞比例与PBS组相比均上升了约100%, 而在口服给予PGSG后, 联合组小鼠脾脏与肿瘤中Foxp3+Treg的分布均显著下降。这提示, PGSG能够减少Foxp3+Treg的分布, 减弱Treg引起的免疫抑制, 从而增强GEM的抗肿瘤作用。

|
Figure 6 PGSG reduces the expression of Treg (CD4+Foxp3+) in tumor (A) and spleen (B). n = 6, x±s. ***P < 0.001 |
T细胞免疫在抗肿瘤免疫中发挥了重要作用, 其中能够杀伤肿瘤细胞的主要是辅助性T细胞1 (Th1) 与细胞毒性T细胞(CTL)。GEM化疗后的细胞毒性造成了肿瘤中CD4+与CD8+T细胞耗竭, 如图 7A所示, 口服给予PGSG能够促进具有杀伤肿瘤细胞作用的Th1和CTL的增殖与分化, Th1比例从16.9%上升到26.7%, CTL则由35.7%上升到48.5%。脾脏是淋巴细胞接受抗原刺激并发生免疫应答的重要场所。尽管GEM具有显著的抗癌作用, 但GEM的作用机制不是肿瘤特异性的, 对正常炎症也有作用[21], 且反复GEM化疗引起MDSC增加, 已被证明能够阻断CTL的免疫监视, 从而导致肿瘤复发[22]。如图 7B所示, 单独化疗后, 脾脏中抗肿瘤Th1细胞与CTL细胞明显减少, 口服给予PGSG后, 能够促进脾脏T细胞增殖与分化, 增加CD4+IFN-γ+T细胞与CD8+IFN-γ+T细胞的比例。因此, 口服PGSG能够逆转GEM引起的T细胞耗竭, 增强抗肿瘤T细胞的增殖与分化, 进一步增强GEM的抗肿瘤作用。
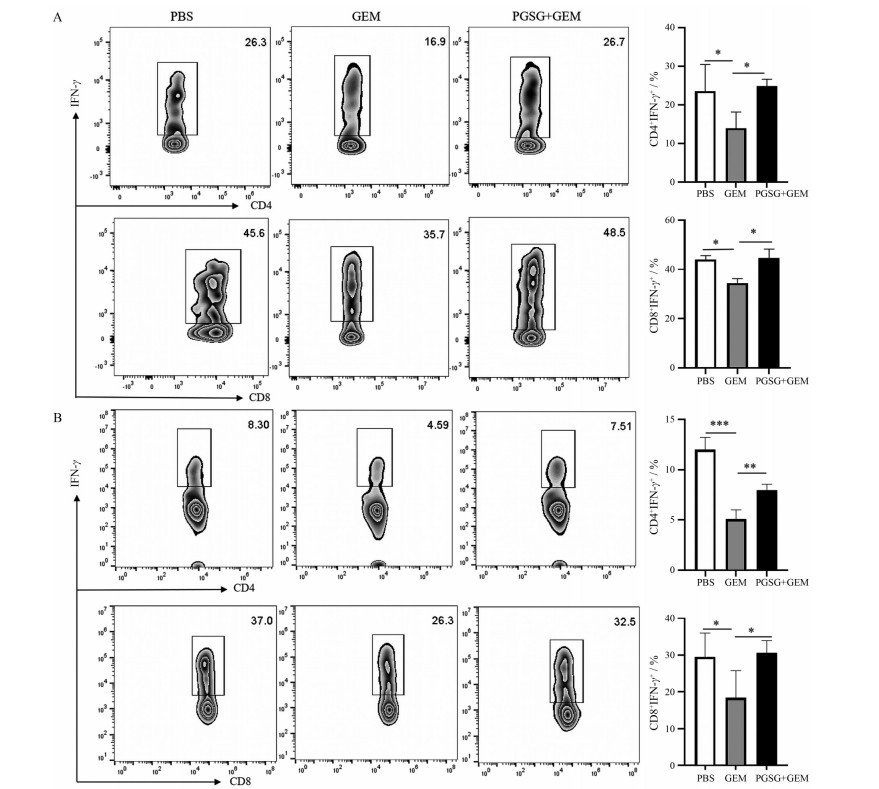
|
Figure 7 Distributions of helper T cell-1 (Th1) and cytotoxic T lymphocyte (CTL) in tumors (A) and spleen (B). n = 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 |
反复化疗后, 肿瘤微环境中产生了大量的细胞因子, 如白介素IL-6、IL-10、血管内皮生长因子(VEGF) 等, 这些细胞因子吸引MDSC向TME中募集, 导致MDSC的大量增加。MDSC产生氧化应激, MDSC的亚型之一, 即M-MDSC能够促进肿瘤的迁移与复发, 同时M-MDSC还能够转化为M2巨噬细胞, M2通过分泌VEGF促进肿瘤血管生成, 以及基质金属蛋白酶和局部免疫抑制因子, 促进肿瘤转移。与此同时, MDSC还可以通过多种方式诱导Treg的增加[23], 拮抗CD4+与CD8+T细胞的抗肿瘤作用。PGSG作为病原相关分子模式能够特异性地被MDSC表面的Dectin-1受体识别并结合、吞噬, 将MDSC从抑制性的表型转化为能够有效递呈抗原的抗原递呈细胞, 并进一步地促进CD4+与CD8+T细胞增殖活化, CD4+T细胞分泌促炎细胞因子如TNF-α和IFN-γ, CD8+T细胞分泌颗粒酶B、穿孔素和IFN-γ, 从而达到肿瘤抑制的效果(图 8)。
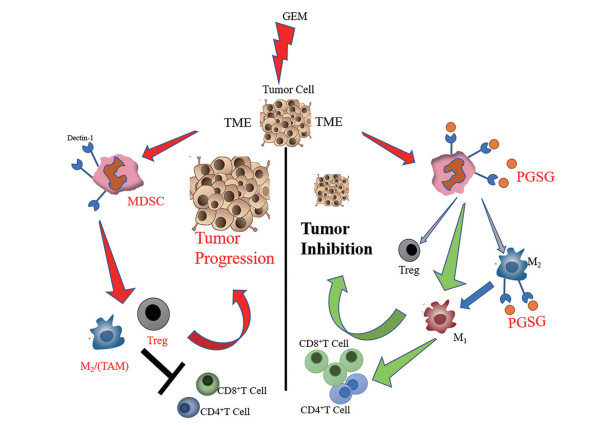
|
Figure 8 The modulation effects on immune cells in tumor immunosuppressive microenvironment by PGSG |
真菌类的β-葡聚糖在抗肿瘤的临床应用中发挥了不可或缺的作用。β-葡聚糖作为PAMP能够特异性地与巨噬细胞、树突状细胞以及MDSC表面的Dectin-1结合、吞噬, 将其分解为小片段的β-葡聚糖[21]。受到β-葡聚糖刺激后, Dectin-1可以直接募集并激活Syk激酶。随后, Syk触发Card9募集以形成Card9-Bcl10-Malt-1复合物, 该复合物激活IκB激酶复合物以进行NF-κB信号传导, 从而促进细胞因子的释放, DC细胞的成熟以及M2巨噬细胞的极化[20, 24, 25], 进而发挥葡聚糖间接抗肿瘤的效应。如酵母β-葡聚糖(WGP) 能够通过Dectin-1受体刺激Erk1/2磷酸化, 将MDSC转化为更为成熟的DC细胞, 诱导有效的Ag特异性T细胞应答, 调控TAM的极化, 降低IL-10和精氨酸酶的mRNA水平, 同时上调IL-12、TNF-α、IFN-γ以及穿孔素表达水平, 进而发挥抗肿瘤作用[26]。同时, Tian等[27]发现颗粒酵母菌衍生的β-葡聚糖通过Dectin-1/Syk途径增加mGITRL在小树突状细胞D2SC/1的表达, 促进其成熟, 通过D2SC/1细胞进而抑制Treg的抑制活性。因此, β-葡聚糖可能通过促进MDSC成熟为DC细胞, 减少MDSC的数量进而降低Treg的比例。然而β-葡聚糖是否能够直接作用于Treg仍然未知。
研究表明, 单剂量的GEM能够减少TME中的MDSC, 降低肿瘤的负荷[28], 而反复的GEM化疗却造成肿瘤细胞积聚、耐药和复发[29]。本实验结果证明了反复GEM化疗后, TME中MDSC、Treg及M2细胞急剧增加, 抗肿瘤T细胞耗竭, 这是造成肿瘤免疫逃逸和复发最主要的原因。而口服给予PGSG后, 介导免疫逃逸的髓源性抑制细胞明显下降, 抗肿瘤T细胞明显增加。因此, PGSG能够重塑免疫抑制微环境辅助GEM化疗, 增强抗肿瘤作用, 同时也阐明了灵芝孢子粉在临床上作为辅助用药的作用机制, 为其更广泛应用提供了合理的依据。
作者贡献: 陈菲菲、魏梦佳丽和马倩负责实验处理; 陈菲菲、李畅分析实验数据; 宋捷、封亮和贾晓斌提供指导性支持; 罗毅和谭晓斌负责提供研究经费、实验材料等; 陈菲菲和谭晓斌负责研究思路、实验设计方案和论文撰写与修改。
利益冲突: 所有作者声明均不存在利益冲突。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66: 7-30. DOI:10.3322/caac.21332 |
| [2] |
Guimaraes PPG, Tan M, Tammela T, et al. Potent in vivo lung cancer Wnt signaling inhibition via cyclodextrin-LGK974 inclusion complexes[J]. J Control Release, 2018, 290: 75-87. DOI:10.1016/j.jconrel.2018.09.025 |
| [3] |
Zhang Y, Bush X, Yan B, et al. Gemcitabine nanoparticles promote antitumor immunity against melanoma[J]. Biomaterials, 2019, 189: 48-59. DOI:10.1016/j.biomaterials.2018.10.022 |
| [4] |
Xiao H, Guo Y, Li B, et al. M2-like tumor-associated macrophage-targeted codelivery of STAT6 inhibitor and IKKβ siRNA induces M2-to-M1 repolarization for cancer immunotherapy with low immune side effects[J]. ACS Cent Sci, 2020, 6: 1208-1222. DOI:10.1021/acscentsci.9b01235 |
| [5] |
Huang B, Pan PY, Li Q, et al. Gr-1+CD115+ immature myeloid suppressor cells mediate the development of tumor-induced T regulatory cells and T-cell anergy in tumor-bearing host[J]. Cancer Res, 2006, 66: 1123-1131. DOI:10.1158/0008-5472.CAN-05-1299 |
| [6] |
Sun H, Gong L, Yu Z, et al. Advances in anti-tumor therapy of myeloid-derived suppressor cells combined with immunological checkpoint inhibitors[J]. Cancer Res (肿瘤防治研究), 2020, 47: 716-721. |
| [7] |
Mirza Z, Soto ER, Dikengil F, et al. Beta-glucan particles as vaccine adjuvant carriers[J]. Methods Mol Biol, 2017, 1625: 143-157. |
| [8] |
Wang J. Structure and Bioactivities of Polysaccharides From Ganoderma Lucidum (灵芝多糖的结构及生物活性研究)[D]. Wuhan: Wuhan University, 2010.
|
| [9] |
Su CH, Tseng YT, Lo KY, et al. Differences in anti-inflammatory properties of water soluble and insoluble bioactive polysaccharides in lipopolysaccharide-stimulated RAW264.7 macrophages[J]. Glycoconj J, 2020, 37: 565-576. DOI:10.1007/s10719-020-09934-y |
| [10] |
Zhang JJ, Chen FF, Yan ZP, et al. Alkali extraction of Ganoderma lucidum β-glucan and its anti-tumor immune regulation[J]. Acta Pharm Sin (药学学报), 2020, 55: 512-521. |
| [11] |
Xu C, Qin N, Yan C, et al. Isolation, purification, characterization and bioactivities of a glucan from the root of Pueraria lobate[J]. Food Funct, 2018, 9: 2644-2652. DOI:10.1039/C7FO01921A |
| [12] |
Liu BJ, Ning Q, Zhong RL, et al. Effect of lupeol on invasion and metastasis of human hepatoma HepG2 and SK-HEP-1 cells and its mechanism[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 6028-6035. |
| [13] |
Zhang J, Meng G, Zhai G, et al. Extraction, characterization and antioxidant activity of polysaccharides of spent mushroom compost of Ganoderma lucidum[J]. Int J Biol Macromol, 2016, 82: 432-439. DOI:10.1016/j.ijbiomac.2015.10.016 |
| [14] |
Wang Y, Liu Y, Yu H, et al. Structural characterization and immuno-enhancing activity of a highly branched water-soluble β-glucan from the spores of Ganoderma lucidum[J]. Carbohydr Polym, 2017, 167: 337-344. DOI:10.1016/j.carbpol.2017.03.016 |
| [15] |
Wang C, Hua D, Yan Y. Structural characterization and antioxidant activities of a novel fructan from Achyranthes bidentata blume, a famous medicinal plant in China[J]. Ind Crops Prod, 2015, 70: 427-434. DOI:10.1016/j.indcrop.2015.03.051 |
| [16] |
Wang J, Yuan Y, Yue T. Immunostimulatory activities of β-D-glucan from Ganoderma Lucidum[J]. Carbohydr Polym, 2014, 102: 47-54. DOI:10.1016/j.carbpol.2013.10.087 |
| [17] |
Farinha I, Duarte P, Pimentel A, et al. Chitin-glucan complex production by Komagataella pastoris: downstream optimization and product characterization[J]. Carbohydr Polym, 2015, 130: 455-464. DOI:10.1016/j.carbpol.2015.05.034 |
| [18] |
Diaz-Montero CM, Salem ML, Nishimura MI, et al. Increased circulating myeloid-derived suppressor cells correlate with clinical cancer stage, metastatic tumor burden, and doxorubicin-cyclophosphamide chemotherapy[J]. Cancer Immunol Immunother, 2009, 58: 49-59. DOI:10.1007/s00262-008-0523-4 |
| [19] |
Mantovani A. The growing diversity and spectrum of action of myeloid-derived suppressor cells[J]. Eur J Immunol, 2010, 40: 3317-3320. DOI:10.1002/eji.201041170 |
| [20] |
Liu M, Luo F, Ding C, et al. Dectin-1 activation by a natural product β-glucan converts immunosuppressive macrophages into an M1-like phenotype[J]. J Immunol, 2015, 195: 5055-5065. DOI:10.4049/jimmunol.1501158 |
| [21] |
Chae JS, Shin H, Song Y, et al. Yeast (1→3)-(1→6)-β-D-glucan alleviates immunosuppression in gemcitabine-treated mice[J]. Int J Biol Macromol, 2019, 136: 1169-1175. DOI:10.1016/j.ijbiomac.2019.06.009 |
| [22] |
Terabe M, Matsui S, Park JM, et al. Transforming growth factor-beta production and myeloid cells are an effector mechanism through which CD1d-restricted T cells block cytotoxic T lymphocyte-mediated tumor immunosurveillance: abrogation prevents tumor recurrence[J]. J Exp Med, 2003, 198: 1741-1752. DOI:10.1084/jem.20022227 |
| [23] |
Lu J, Wang S. Mechanisms of myeloid inhibitory cells inducing the production of regulatory T cells[J]. J Cell Mol Immunol (细胞与分子免疫学杂志), 2016, 32: 1707-1710. |
| [24] |
Sancho D, Reis e Sousa C. Signaling by myeloid C-type lectin receptors in immunity and homeostasis[J]. Annu Rev Immunol, 2012, 30: 491-529. DOI:10.1146/annurev-immunol-031210-101352 |
| [25] |
Pandya U, Dhuldhaj U, Sahay NS. Bioactive mushroom polysaccharides as antitumor: an overview[J]. Nat Prod Res, 2019, 33: 2668-2680. DOI:10.1080/14786419.2018.1466129 |
| [26] |
Geller A, Shrestha R, Yan J. Yeast-derived β-glucan in cancer: novel uses of a traditional therapeutic[J]. Int J Mol Sci, 2019, 20: 3618. DOI:10.3390/ijms20153618 |
| [27] |
Tian J, Ma J, Wang S, et al. Increased expression of mGITRL on D2SC/1 cells by particulate β-glucan impairs the suppressive effect of CD4+CD25+ regulatory T cells and enhances the effector T cell proliferation[J]. Cell Immunol, 2011, 270: 183-187. DOI:10.1016/j.cellimm.2011.05.003 |
| [28] |
Suzuki E, Kapoor V, Jassar AS, et al. Gemcitabine selectively eliminates splenic Gr-1+/CD11b+ myeloid suppressor cells in tumor-bearing animals and enhances antitumor immune activity[J]. Clin Cancer Res, 2005, 11: 6713-6721. DOI:10.1158/1078-0432.CCR-05-0883 |
| [29] |
Wu C, Tan X, Hu X, et al. Tumor microenvironment following gemcitabine treatment favors differentiation of immunosuppressive Ly6Chigh myeloid cells[J]. J Immunol, 2020, 204: 212-223. DOI:10.4049/jimmunol.1900930 |
 2021, Vol. 56
2021, Vol. 56


