2. 西南大学科学技术处, 重庆 400715;
3. 西南大学柑橘研究所, 重庆 400715
2. Science and Technology Division, Southwest University, Chongqing 400715, China;
3. Citrus Research Institute, Southwest University, Chongqing 400715, China
感染是指微生物在宿主体内生活时与宿主相互作用并导致不同程度的病理变化的过程。感染无处不在, 给人类造成很多烦恼和伤害, 甚至导致死亡。目前解决感染的医疗方法, 主要采用化学治疗。化学治疗药物种类繁多, 诸如抗生素类药物、抗细菌类药物、抗真菌类药物、抗结核类药物、抗病毒类药物等。这些药物, 适用于一种或多种感染, 能够解决感染性疾病的传播, 有效保护人类健康。
头孢菌素, 抗菌谱广、毒性低, 在感染治疗中得到了广泛的应用。目前头孢在临床中大致分为五代: 以头孢拉定、头孢唑林、头孢氨苄为代表的第一代头孢药物对革兰阳性菌作用强, 对革兰阴性菌作用较弱; 以头孢呋辛、头孢克洛、头孢替胺为代表的第二代头孢药物在保持对革兰阳性菌作用强的基础上, 增强了对革兰阴性菌的抗菌活性; 以头孢他啶、头孢曲松、头孢哌酮为代表的第三代头孢药物以及以头孢吡肟、头孢唑南、头孢匹罗为代表的第四代头孢药物对革兰阳性菌、革兰阴性菌以及厌氧菌均有广谱的抗菌活性, 且第四代头孢药物抗革兰阳性菌活性强于第三代、对肾脏无毒性; 第五代头孢药物包括头孢洛林酯、头孢托罗和头孢吡普, 抗菌超广谱且无肾毒性[1, 2]。分析头孢类上市药物分子的结构发现, 头孢药物分子由头孢母核、C-7位氨基修饰基团、C-3位取代基三部分组成; 头孢母核, 常见的有7-ACA、7-ACCA、7-ANCA、7-MAC和7-MCA (7-MAC脱除二苯甲基者) (结构见图 1); 头孢C-7位氨基修饰基团, 可以是简单的噻吩乙酰基、L-苯甘氨酰基、半胱氨酰基、氰甲基巯基乙酰基、氨基噻唑乙酰基等, 也可以是很复杂的结构片段2-呋喃基-(Z)-2-甲氧基亚胺基乙酰基、2-(4-氨基)噻唑-(Z)-2-甲氧基亚胺基乙酰基等。C-3位修饰基团, 较常见的有乙酰氧甲基、氯原子、甲巯基四氮唑甲基。五代头孢药物结构上的主要差别是C-7位氨基侧链以及C-3位基团的不同。
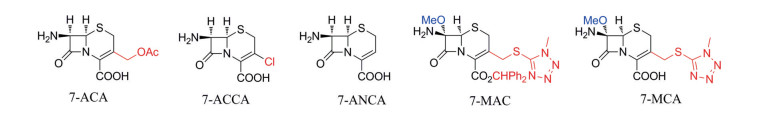
|
Figure 1 Structures of some cephalosporin parent nucleus |
对头孢类分子的研究, 虽然尚有结构改造或修饰的研究[3-6], 但目前主要集中在抗菌活性的研究[7-12]; 为提高头孢类药物的稳定性, 最常见的是对C-7位侧链取代基和C-3位取代基进行改造[1]。本研究室长期开展氟喹诺酮药物的衍生研究[13-18], 发现氟喹诺酮母核引入简单基团, 包括氯代酰基, 可以获得较其母核更好的抗菌活性、抗结核活性等[19], 有鉴于此, 尝试性地对头孢母核进行简单修饰, 希望发现较母核活性更好、或者较其结构相近的头孢药物活性更好、或者具有未报道活性的新分子, 由此设计了如下的分子模式及目标分子(图 2)。
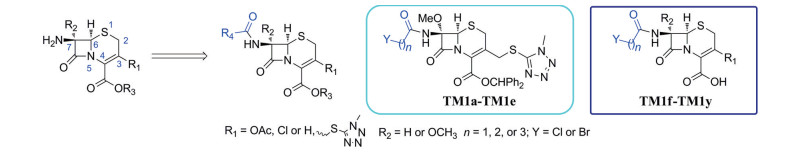
|
Figure 2 Model and their general structures of target molecules |
R4可以是简单基团, 也可以是复杂结构。作为研究伊始的尝试, 作者选取4种头孢母核和多种卤代酰氯, 设计了5个系列25个简单目标分子; 在测试目标分子对人致病菌、真菌的抗菌活性之后, 开展目标分子抑制柑橘溃疡病菌及病原真菌的活性研究。本研究既发现了高活性抗细菌分子, 也发现了强活性抗柑橘病原真菌分子。
结果与讨论 1 化学实验药物分子合成的难易, 主要取决于分子结构的复杂程度、溶解性和稳定性。本研究涉及7-MAC、7-ACA、7-ACCA及7-ANCA (后3者统称为7-AXCA) 头孢母核, 7-MAC为羧酸酯型母核, 7-AXCA为羧酸型母核, 它们的溶解性差异很大, 必须采用不同的合成方法。
1.1 7-MAC衍生物TM1a~TM1e的合成7-MCA是头孢美唑、头孢米诺等药物的母核, 其对应药物活性强、不良反应小; 7-MAC脂溶性强, 便于溶剂选择, 但7-氨基碳上连接甲氧基, 使氨基周围空间位阻大, 导致其修饰难度大于另外3种母核。借鉴本实验室的经验, 首先选择7-MAC进行设想分子的合成。鉴于β-内酰胺抗生素结构中C-4位的游离羧基是抗菌作用的必需基团、多数头孢药物为羧基型化合物, 因此将7-MAC卤代酰基衍生物TM1a~TM1e进一步水解, 获得相应的目标分子TM1f~TM1j。
从合成目标分子TM1a~TM1e和TM1f~TM1j考虑, 应该有两条路线(route 1, route 2) (合成路线1)。无论从路线长短、原料溶解性、反应选择性、反应难易还是后处理难度, route 1具有明显的优势。通过反应条件选取, 获得了合成路线2所示的路线及其反应条件。

|
Scheme 1 Synthetic routes of 7-MAC derivatives |

|
Scheme 2 Synthesis of 7-MAC derivatives |
卤代酰氯是双官能团分子, 反应的选择性必须控制。此外, 头孢母核衍生的主要问题在于母核的不稳定性, 强碱、强热、强还原条件等都会导致母核破环、双键移位、手性改变等[20, 21]。因此, 优化或弱化反应条件是必须开展的研究过程。
研究伊始, 采用氨基和酰氯反应的常规条件进行7-MAC的酰基化, 发现总是有两种产物, 且其Rf值接近, 因此进行反应条件探索。8种碱的平行实验结果表明, 吡啶的反应效果最好; 投料比平行实验显示, 7-MAC/Py、7-MAC/Py的摩尔比为1∶1.5时反应最好; 温度试验表明, 于低温反应器(-25 ℃)、冰浴(4 ℃) 中搅拌反应, 氯乙酰化都能在2 h完成, 但1H NMR表征显示, 4 ℃进行的反应其部分产物双键移位, 成为2-位双键(Δ2) 及3-位双键(Δ3) 异构体的混合物且分离困难, 而-25 ℃条件下的反应产物双键未移位。目前认为, 头孢菌素中的Δ3对抗菌活性至关重要, 如果Δ3移位至Δ2或将双键饱和, 抗菌活性就会减弱[1]; 当头孢菌素化合物以酯的形式出现时, 容易发生Δ2与Δ3的异构化[22, 23]。因此, 反应温度应控制为-25 ℃从而防止双键移位以确保分子的抗菌活性。
至此, 优化的反应条件为: 7-MAC与氯乙酰氯及吡啶的投料比为1∶1.5∶1.5, 在-25 ℃的二氯甲烷溶液中快速搅拌反应。采用此优化条件, 实现了目标分子TM1a~TM1e的有效合成(表 1), 收率高于85%, 且TM1c > TM1b > TM1a。
| Table 1 Synthetic results of TM1a-TM1e |
7-MAC衍生物脱二苯甲基, 工业生产上常采用AlCl3[24]。借此方法, 实验了TM1a的脱除效果, 发现操作不简便、含有杂质、收率不高; 选用多肽合成[25]中常用的三氟醋酸(TFA), 操作简单, 反应快速, 收率很高, 相关结果见表 2。
| Table 2 Synthetic results of TM1f-TM1j |
7-AXCA在常见有机溶剂中溶解度不好, 但是可溶于有机溶剂的碱性水溶液[26]。初步实验后, 选定了合成路线3所示的合成反应。
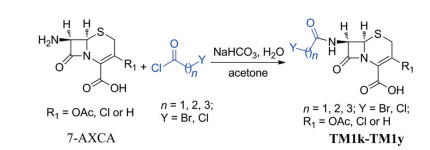
|
Scheme 3 Synthesis of 7-AXCA derivatives |
通过条件探索, 发现投料比7-AXCA/Y(CH2)nCOCl/NaHCO3为1∶1.5∶3最好, 在室温(4~19 ℃) 反应3.5~4 h, 反应已经结束。经过简单后处理, 得到目标分子TM1k~TM1y, 收率中等到优秀。相关实验结果见表 3。
| Table 3 Synthetic results of TM1k-TM1y |
人类被感染, 许多是被微生物攻击所致。医治感染疾病, 最好最简单的措施是药物对症治疗。寻找针对不同致病菌株的药物, 是药物研究的长期课题。作者采用本实验室常用的测试方法[27-29], 测试了目标分子TM1a~TM1y对4株革兰阴性菌株、4株革兰阳性菌株的抑菌能力, 相关结果见表 4。
| Table 4 Inhibitory activity of target molecule TM1 against human pathogenic bacteria |
目标分子的活性都强于或相当于母核分子、相当或弱于头孢上市药物; TM1f对所测试菌株的抑制活性整体最好; 目标分子对藤黄微球菌株的抑制活性整体最强。此外, 革兰阴性菌株对卤代酰基产物的敏感性整体为: 大肠杆菌 > 铜绿假单胞菌 > 沙门氏菌 > 鲍曼不动杆菌; 对革兰阳性菌株而言, 其敏感性整体为: 藤黄微球菌 > 枯草芽孢杆菌 > 金葡菌。
对大肠杆菌, 4个头孢母核本身均未显示出明显抑制活性, 而目标分子的整体活性是TM1f~TM1j > TM1k~TM1o > TM1a~TM1e > TM1u~TM1y > TM1p~TM1t, 对应母核依次为7-MCA、7-ACA、7-MAC、7-ANCA及7-ACCA; 卤代酰基碳链长度对化合物的抑菌活性整体表现为2C > > 3C ≈ 4C; 碳链长度相同时, 含氯者的活性一般强于含溴者。7-MAC卤代酰基产物TM1a~TM1e的活性弱于脱除二苯甲基后的产物TM1f~TM1j (7-MCA型), 说明C-4位羧基型分子的抗菌活性明显强于对应酯型分子。25个目标分子中有11个化合物MIC = 2~16 μg·mL-1, 活性强于或相当于上市药物头孢噻吩(16 μg·mL-1, MIC值, 后同); TM1f及TM1g与上市药物头孢西丁钠、头孢唑肟钠抑制活性(2 μg·mL-1) 相当, 是头孢噻吩的8倍。
对沙门氏菌, 上市药物头孢西丁钠及头孢唑肟钠、4个头孢母核以及绝大多数目标分子均未显示出明显抑制活性(≥ 256 μg·mL-1), 但是7-ACA卤代酰基产物TM1k/TM1n的抑制活性(32/64 μg·mL-1) 为上市药物头孢噻吩(64 μg·mL-1) 的2倍或相当。
对鲍曼不动杆菌, 4个头孢母核、头孢西丁钠及几乎所有目标分子都未显示出明显抑制活性, 然而TM1k与头孢噻吩、头孢唑肟钠相当(128 μg·mL-1)。
对铜绿假单胞菌, 虽然4个头孢母核及7-ANCA、7-ACCA、7-MAC的酰基衍生物活性很差(≥ 256 μg·mL-1), 但7-MCA和7-ACA的卤代酰基产物显示明显的抑制活性(4~128 μg·mL-1), 7-MCA卤代酰基产物TM1f~TM1j抑制活性为7-MAC卤代酰基产物TM1a~TM1e的4~8倍; 特别地, TM1f抑制活性(4 μg·mL-1) 为头孢西丁钠的4倍、头孢噻吩的8倍、头孢唑肟钠的16倍, 值得进一步研究。
对藤黄微球菌, 4种母核几乎无活性, 但25个卤代酰基产物均显示优秀的抑制活性, 其中16个化合物的MIC值为2 μg·mL-1, 与所测试3种头孢药物相当, 尤其是7-MCA衍生的TM1f~TM1j、7-ACA衍生的TM1k~TM1o, MIC值都为2 μg·mL-1, 整体活性很好。
对金葡菌ATCC25129、ATCC14125, 7-MCA卤代酰基产物普遍具有抑菌活性(8~128 μg·mL-1), 其中TM1f的抑菌活性强于所测试3种头孢药物; 7-MAC及7-ACA卤代酰基产物中的TM1a及TM1k具有较好抑菌活性(16~64 μg·mL-1), 而7-ACCA与7-ANCA卤代酰基产物几乎无抑菌活性。
对枯草芽孢杆菌, 7-MCA卤代酰基产物TM1f~TM1j都有较好抑菌活性(8~32 μg·mL-1), 7-MAC、7-ACA卤代酰基产物中连有氯乙酰基者(TM1a、TM1k) 的抑制活性(16、8 μg·mL-1) 分别为头孢噻吩的4倍和8倍, 且TM1a和TM1k的抑制活性分别与头孢西丁钠相当或其2倍; 7-ACCA、7-ANCA卤代酰基产物几乎无抑菌活性。
2.2 抗毕赤酵母菌活性呈酵母样或类酵母形态的单细胞真菌中, 有许多种属是动植物乃至人类的病原菌, 如隐球菌属Cuyitococcus真菌等, 易造成浅部或深部组织严重感染。巴斯德毕赤酵母菌Komagataella phaffii又称毕赤酵母Pichia pastoris, 是一种典型的单细胞真菌, 普遍作为生化研究和医学研究的标准模式生物。毕赤酵母对人和动植物基本无害, 基因组相对保守, 基因编辑工具多且方法成熟, 非常适合作为医学模型筛选药物靶标[30]。一般情况下, 毕赤酵母常作为模式物种初步评估药物分子或益生菌等对酵母样真菌的抑制和拮抗活性[31]。采用本实验室常用的测试方法[27-29], 作者测试了目标分子TM1a~TM1y的抑菌能力, 相关结果见表 5。
| Table 5 Inhibitory activity (MIC) of target molecule TM1 against Pichia pastoris |
表 5结果表明, 头孢母核、TM1b~TM1e、TM1y活性最差, TM1g~TM1m、TM1q~TM1x、头孢噻吩活性其次, 但是TM1a和TM1f显示明显的抑制活性, 分别为头孢噻吩的8倍及4倍。这类化合物对毕赤酵母菌的抑制活性整体较差, 表明该类化合物对毕赤酵母菌不敏感, 具有一定的选择性。
2.3 抗柑橘溃疡病菌和病原真菌活性柑橘溃疡病分布广泛, 可危害几十种芸香科植物, 是影响世界柑橘生产的重大检疫性病害。柑橘溃疡病菌系分化复杂、发病率高、传播快、寄主范围广, 防治柑橘溃疡病一直是一个世界性难题, 目前尚无一种方法可以根治[28]。采用本实验室常用的测试方法[27-29], 对目标分子进行了抗柑橘溃疡病菌的活性测试, 相关结果见表 6。
| Table 6 Inhibitory activity of target molecule TM1 (μg·mL-1) against Citrus-Canker and Citrus- pathogenic fungi (inhibition %) |
柑橘在全世界范围内具有长期的选育和栽培历史, 近百年来随着全球柑橘种质和苗木的频繁交流, 共同促进了柑橘真菌性病害起源和扩散。柑橘褐斑病和柑橘炭疽病对柑橘生长危害较严重, 每年必须做4~8次药剂防控, 而长期使用化学杀菌剂会导致病原菌产生抗药性, 并且大量喷洒杀菌剂也会造成环境污染。因此, 生产上需要一批低毒或无害且高效抑制柑橘真菌性病害的新药物[29]。采用本实验室常用的测试方法[27-29], 对目标分子进行了抗柑橘胶孢炭疽菌Co.3和柑橘褐斑病菌Al.6活性测试, 相关结果见表 6和表 7。
| Table 7 Second screening results of target molecule TM1 against Alternaria alternate, Al.6 |
表 6结果显示, 所合成的化合物抑制柑橘溃疡病菌活性随化合物浓度降低而减弱, 具有较好的活性-剂量关系; 在浓度为2、1 μg·mL-1下, 7-MCA卤代酰基产物TM1f~TM1j抑菌活性最好(抑制率分别为66%~71%、54%~70%), 强于同等浓度下的7-MAC卤代酰基产物TM1a~TM1e (17%~70%、-7%~45%), 也远强于头孢噻吩(12%、7%); 卤代酰基产物对应头孢母核的活性强弱顺序为7-MCA > 7-MAC > 7-ACA ≈ 7-ACCA > 7-ANCA。本研究首次报道, 某些头孢母核的酰基衍生物具有抑制柑橘溃疡病菌活性。
对柑橘病原真菌, 在浓度为2、4 μg·mL-1时, 绝大多数目标分子对柑橘胶孢炭疽菌Co.3及柑橘褐斑病菌Al.6无抑制活性, 但4 μg·mL-1浓度的TM1s对褐斑病菌Al.6的抑制率高达90%, 与阳性对照咪鲜胺相当, 强于同类药物头孢噻吩, 值得进一步研究。目前未见文献报道头孢卤代酰基产物对柑橘病原真菌具有强烈抑制活性。
3 结论提高头孢药物稳定性的措施之一是对头孢母核的C-7位侧链取代基和C-3位取代基进行改造。本研究选取C-3位取代基不同的4种头孢母核进行C-7位氨基修饰, 在优化的反应条件下, 以中等至高收率合成了相应目标分子, 所得25个卤代酰基衍生物的分子结构得到1H NMR及HR-MS的确证。大多数分子具有抗人致病菌活性, 其中7个化合物对于所测试的人致病菌活性强于或相当于上市药物头孢噻吩、头孢西丁钠、头孢唑肟钠, TM1f显示了最强最广的抑菌活性; 此外, TM1s对柑橘褐斑病菌Al.6特别敏感, 抑菌活性与阳性对照咪鲜胺相当, 且强于同类药物头孢噻吩。本研究发现了较头孢母核活性更好、或者较其结构相近的头孢药物活性更好、或者具有未报道活性的新分子。目标分子的后续衍生物及其生物活性会陆续报道。
实验部分 1 目标化合物的合成7-MAC、7-ACA、7-ACCA及7-ANCA (重庆天地药业有限责任公司赠送, AR); 氯乙酰氯、3-氯丙酰氯、4-氯丁酰氯和4-溴丁酰氯(上海达瑞精细化工有限公司, AR); 碳酸氢钠、吡啶(重庆市钛新化工有限公司, AR); 其余试剂均为市售化学纯或分析纯产品, 未经纯化直接使用。
磁力搅拌低温恒温水槽(PSL-1810, 上海爱朗仪器有限公司); 熔点测定仪(X-6, 北京福凯仪器有限公司); 自动旋光仪(WZZ-2S, 上海精密科学仪器有限公司); 核磁共振仪(AV-600, Bruker, USA; TMS为内标)。
TM1a~TM1e合成的操作示例:
100 mL圆底烧瓶中加入7-MAC 5 mmol、DCM 4 mL, 搅拌, 溶解完全后, 置于低温反应器中, 控温(-25 ℃) 搅拌, 溶解均匀后加入吡啶7.5 mmol, 搅拌20 min, 滴加酰氯7.5 mmol的DCM 1 mL溶液, 滴加速度约为每秒4滴。滴毕, -25 ℃下持续搅拌反应, TLC监测反应进程。反应结束, 加入冰冷的饱和食盐水20 mL和DCM 20 mL, 快速搅拌, 0.5 mol·L-1盐酸溶液调节pH = 2~3。移至分液漏斗, 分液, DCM萃取(20 mL×1) 水相, 合并有机相, 饱和食盐水洗涤(20 mL×2), 收集有机相, 无水Na2SO4干燥, 旋蒸, 真空干燥, 得到目标分子TM1a~TM1e。
TM1f~TM1j合成的操作示例:
100 mL圆底烧瓶中加入TM1a~TM1e 2.0 mmol、DCM 1.0 mL, 搅拌溶解, 加入苯甲醚2.0 mmol, 冰浴, 搅拌, 滴加TFA 1.0 mL。滴毕, 移至室温搅拌, TLC监测反应进程。反应结束, 慢加乙醚5 mL、石油醚20 mL, 搅拌, 冷冻, 析出固体后, 抽滤, 石油醚洗涤, 得固体粉末, 真空干燥, 得到目标分子TM1f~TM1j。
TM1k~TM1y合成的操作示例:
于100 mL反应瓶中依次加入7-AXCA (5 mmol)、丙酮5 mL和水1 mL, 室温搅拌, 加入碳酸氢钠(1.26 g, 1.5 mmol), 冰浴, 滴加酰氯(1.0 mmol), 搅拌。TLC监测反应进程。反应完全后, 加入冰冷2 mol·L-1盐酸调节pH = 7, 旋除溶剂丙酮, 冷冻析出固体, 加入冰冷2 mol·L-1 HCl调节pH = 3, 大量固体析出。抽滤, 干燥, 得固体TM1k~TM1y。
TM1系列化合物的表征数据如下:
TM1a: 淡黄色固体, mp 96~97 ℃, [α]D23 +228 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.68 (s, 1H), 7.54 (d, J = 7.5 Hz, 2H), 7.46 (d, J = 7.5 Hz, 2H), 7.36 (t, J = 7.5 Hz, 2H), 7.33 (t, J = 7.5 Hz, 2H), 7.29 (dd, J = 13.5, 7.3 Hz, 2H), 6.89 (s, 1H), 5.22 (s, 1H), 4.39 (d, J = 13.3 Hz, 1H), 4.22 (d, J = 3.8 Hz, 2H), 4.18 (d, J = 13.4 Hz, 1H), 3.88 (s, 3H), 3.76 (d, J = 17.9 Hz, 1H), 3.57 (d, J = 17.8 Hz, 1H), 3.44 (s, 3H)。HR-MS calcd. for C26H25ClN6O5S2, [M+H]+: 601.108 9, found: 601.108 7; [M+Na]+: 623.090 8, found: 623.090 6。
TM1b: 淡黄色固体, mp 96~97 ℃, [α]D23 +150 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.42 (s, 1H), 7.54 (d, J = 7.5 Hz, 2H), 7.46 (d, J = 7.6 Hz, 2H), 7.36 (t, J = 7.5 Hz, 2H), 7.33 (t, J = 7.5 Hz, 2H), 7.29 (dd, J = 14.1, 7.2 Hz, 2H), 6.88 (s, 1H), 5.18 (s, 1H), 4.37 (d, J = 13.3 Hz, 1H), 4.16 (d, J = 13.3 Hz, 1H), 3.87 (s, 3H), 3.79 (t, J = 6.2 Hz, 2H), 3.75 (d, J = 18.1 Hz, 1H), 3.55 (d, J = 17.9 Hz, 1H), 3.42 (s, 3H), 2.76 (tt, J = 12.3, 8.0 Hz, 2H)。HR-MS calcd. for C27H27ClN6O5S2, [M+H]+: 615.124 6, found: 615.124 5; [M+Na]+: 637.106 5, found: 637.106 4。
TM1c: 黄色油状物, [α]D23 +196 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.33 (s, 1H), 7.54 (d, J = 7.4 Hz, 2H), 7.45 (d, J = 7.5 Hz, 2H), 7.36 (t, J = 7.6 Hz, 2H), 7.32 (t, J = 7.5 Hz, 2H), 7.29 (dd, J = 14.2, 7.3 Hz, 2H), 6.87 (s, 1H), 5.16 (s, 1H), 4.37 (d, J = 13.3 Hz, 1H), 4.16 (d, J = 13.3 Hz, 1H), 3.88 (s, 3H), 3.74 (d, J = 17.9 Hz, 1H), 3.65 (t, J = 6.5 Hz, 2H), 3.55 (d, J = 17.9 Hz, 1H), 3.41 (s, 3H), 2.44~2.40 (m, 2H), 1.98~1.93 (m, 2H)。HR-MS calcd. for C28H29ClN6O5S2, [M+H]+: 629.140 2, found: 629.140 2; [M+Na]+: 651.122 1, found: 651.122 0。
TM1d: 黄色油状物, [α]D23 +104 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.41 (s, 1H), 7.54 (d, J = 7.5 Hz, 2H), 7.46 (d, J = 7.6 Hz, 2H), 7.36 (t, J = 7.5 Hz, 2H), 7.33 (t, J = 7.5 Hz, 2H), 7.29 (dd, J = 14.1, 7.2 Hz, 2H), 6.88 (s, 1H), 5.17 (s, 1H), 4.37 (d, J = 13.3 Hz, 1H), 4.16 (d, J = 13.3 Hz, 1H), 3.87 (s, 3H), 3.75 (d, J = 18.0 Hz, 1H), 3.64 (t, J = 6.3 Hz, 2H), 3.55 (d, J = 17.9 Hz, 1H), 3.43 (d, J = 5.0 Hz, 3H), 2.96~2.85 (m, 2H)。HR-MS calcd. for C27H27BrN6O5S2, [M+Na]+: 681.056 0, found: 681.055 6。
TM1e: 黄色油状物, [α]D23 +169 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.35 (s, 1H), 7.55 (d, J = 7.4 Hz, 2H), 7.47 (d, J = 7.6 Hz, 2H), 7.37 (t, J = 7.5 Hz, 2H), 7.33 (t, J = 7.5 Hz, 2H), 7.31~7.27 (m, 2H), 6.89 (s, 1H), 5.17 (s, 1H), 4.39 (d, J = 13.3 Hz, 1H), 4.17 (d, J = 13.4 Hz, 1H), 3.87 (d, J = 14.8 Hz, 4H), 3.76 (d, J = 17.9 Hz, 1H), 3.56 (dd, J = 12.3, 5.3 Hz, 2H), 3.46 (s, 3H), 2.45~2.40 (m, 2H), 2.05 (td, J = 13.5, 6.9 Hz, 2H)。HR-MS calcd. for C28H29BrN6O5S2, [M+Na]+: 695.071 6, found: 695.071 0。
TM1f: 淡黄色固体, mp 131~132 ℃, [α]D23 +180 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.61 (s, 1H), 5.14 (s, 1H), 4.36 (d, J = 13.4 Hz, 1H), 4.23 (d, J = 8.8 Hz, 1H), 4.19 (t, J = 10.7 Hz, 2H), 3.94 (s, 3H), 3.73 (d, J = 17.5 Hz, 1H), 3.49 (d, J = 17.9 Hz, 1H), 3.40 (s, 3H)。HR-MS calcd. for C13H15ClN6O5S2, [M+H]+: 435.030 7, found: 435.030 4; [M+Na]+: 457.012 6, found: 457.012 4。
TM1g: 淡黄色固体, mp 100~101 ℃, [α]D23 +213 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.36 (s, 1H), 5.10 (s, 1H), 4.35 (d, J = 13.4 Hz, 1H), 4.20 (d, J = 13.4 Hz, 1H), 3.94 (s, 3H), 3.78 (t, J = 6.2 Hz, 2H), 3.73 (d, J = 18.2 Hz, 2H), 3.48 (d, J = 17.9 Hz, 1H), 3.39 (s, 3H), 2.82~2.70 (m, 2H)。HR-MS calcd. for C14H17ClN6O5S2, [M+H]+: 449.046 3, found: 449.046 1; [M+Na]+: 471.028 2, found: 471.028 1。
TM1h: 淡黄色固体, mp 100~102 ℃, [α]D23 +125 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.28 (s, 1H), 5.09 (s, 1H), 4.36 (d, J = 13.4 Hz, 1H), 4.19 (d, J = 13.4 Hz, 1H), 3.94 (s, 3H), 3.72 (d, J = 17.8 Hz, 1H), 3.65 (t, J = 6.0 Hz, 2H), 3.48 (d, J = 17.9 Hz, 1H), 3.37 (s, 3H), 2.39 (dd, J = 16.0, 8.8 Hz, 2H), 1.95 (dt, J = 13.6, 6.7 Hz, 2H)。HR-MS calcd. for C15H19ClN6O5S2, [M+H]+: 463.062 0, found: 463.061 8; [M+Na]+: 485.043 9, found: 485.043 7。
TM1i: 淡黄色固体, mp 110~114 ℃, [α]D23 +248 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.36 (s, 1H), 5.10 (s, 1H), 4.35 (d, J = 13.5 Hz, 1H), 4.20 (d, J = 13.4 Hz, 1H), 3.94 (s, 3H), 3.75~3.69 (m, 2H), 3.63 (t, J = 6.2 Hz, 2H), 3.48 (d, J = 17.9 Hz, 2H), 3.39 (s, 3H), 2.95~2.84 (m, 2H)。HR-MS calcd. for C14H17BrN6O5S2, [M+Na]+: 514.977 7, found: 514.977 4。
TM1j: 淡黄色固体, mp 106~109 ℃, [α]D23 +108 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.29 (s, 1H), 5.09 (s, 1H), 4.36 (d, J = 13.4 Hz, 1H), 4.19 (d, J = 13.4 Hz, 1H), 3.94 (s, 3H), 3.73 (dd, J = 14.5, 7.5 Hz, 1H), 3.54 (t, J = 6.1 Hz, 2H), 3.48 (d, J = 17.9 Hz, 1H), 3.37 (s, 3H), 2.41 (dd, J = 16.6, 7.4 Hz, 2H), 2.04 (td, J = 13.6, 6.9 Hz, 2H)。HR-MS calcd. for C15H19BrN6O5S2, [M+Na]+: 528.993 4, found: 528.993 0。
TM1k: 白色固体, mp 182~185 ℃, [α]D23 +227 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 8.93 (d, J = 8.0 Hz, 1H), 5.68 (dd, J = 8.0, 5.0 Hz, 1H), 5.10 (d, J = 5.0 Hz, 1H), 5.00 (d, J = 12.8 Hz, 1H), 4.69 (d, J = 12.8 Hz, 2H), 4.17 (s, 2H), 3.55~3.47 (m, 2H), 2.03 (s, 3H)。HR-MS calcd. for C12H13ClN2O6S, [M+Na]+: 371.007 5, found: 371.007 5。
TM1l: 白色固体, mp 164~165 ℃, [α]D23 +144 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 13.53 (s, 1H), 9.01 (d, J = 8.2 Hz, 1H), 5.77~5.71 (m, 1H), 5.11 (d, J = 4.4 Hz, 1H), 5.01 (d, J = 12.8 Hz, 1H), 4.69 (d, J = 12.8 Hz, 1H), 3.79 (t, J = 6.0 Hz, 2H), 3.63 (d, J = 18.1 Hz, 1H), 3.49 (d, J = 18.1 Hz, 1H), 2.70 (s, 2H), 2.03 (s, 3H)。HR-MS calcd. for C13H15ClN2O6S, [M+Na]+: 385.023 1, found: 385.023 2。
TM1m: 白色固体, mp 189~192 ℃, [α]D23 +248 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 8.93 (d, J = 8.0 Hz, 1H), 5.69~5.66 (m, 1H), 5.09 (d, J = 4.7 Hz, 1H), 5.00 (d, J = 12.6 Hz, 1H), 4.69 (d, J = 12.6 Hz, 1H), 3.64 (s, 2H), 3.62 (d, J = 8.6 Hz, 1H), 3.49 (d, J = 18.2 Hz, 1H), 2.35 (t, J = 7.3 Hz, 2H), 2.03 (s, 3H), 1.95 (dd, J = 8.3, 5.2 Hz, 2H)。HR-MS calcd. for C14H17ClN2O6S, [M+Na]+: 399.038 8, found: 399.038 6。
TM1n: 白色固体, mp 153~156 ℃, [α]D23 +235 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 13.56 (s, 1H), 9.00 (d, J = 8.3 Hz, 1H), 5.73 (dd, J = 8.2, 4.8 Hz, 1H), 5.11 (d, J = 4.8 Hz, 1H), 5.01 (d, J = 12.8 Hz, 1H), 4.69 (d, J = 12.8 Hz, 1H), 3.65 (dd, J = 8.4, 3.6 Hz, 2H), 3.62 (d, J = 10.3 Hz, 1H), 3.49 (d, J = 18.1 Hz, 1H), 2.84 (dd, J = 12.8, 6.4 Hz, 2H), 2.03 (s, 3H)。HR-MS calcd. for C13H15BrN2O6S, [M+Na]+: 428.972 6, found: 428.972 4。
TM1o: 白色固体, mp 176~178 ℃, [α]D23 +232 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 8.93 (d, J = 8.0 Hz, 1H), 5.68 (dd, J = 8.0, 4.8 Hz, 1H), 5.10 (d, J = 4.8 Hz, 1H), 5.00 (d, J = 12.8 Hz, 1H), 4.69 (d, J = 12.8 Hz, 1H), 3.66~3.61 (m, 2H), 3.55~3.47 (m, 2H), 2.36 (t, J = 7.0 Hz, 2H), 2.25~2.13 (m, 1H), 2.04 (d, J = 7.3 Hz, 3H), 1.98~1.91 (m, 1H)。HR-MS calcd. for C14H17BrN2O6S, [M+Na]+: 442.988 3, found: 442.988 0。
TM1p: 淡黄色固体, mp 235~238 ℃, [α]D23 +164 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 13.95 (s, 1H), 9.10 (s, 1H), 5.75 (dd, J = 8.1, 4.8 Hz, 1H), 5.19 (d, J = 4.8 Hz, 1H), 4.17 (s, 2H), 3.97 (d, J = 18.0 Hz, 1H), 3.63 (d, J = 18.0 Hz, 1H)。HR-MS calcd. for C9H8Cl2N2O4S, [M+Na]+: 332.947 4, found: 332.945 2。
TM1q: 淡黄色固体, mp 236~237 ℃, [α]D23 +250 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 8.95 (d, J = 8.3 Hz, 1H), 5.72 (dd, J = 8.3, 4.9 Hz, 1H), 5.19 (d, J = 4.9 Hz, 1H), 3.97 (d, J = 18.0 Hz, 1H), 3.82 (ddd, J = 57.5, 16.8, 6.0 Hz, 2H), 3.68 (d, J = 18.0 Hz, 1H), 2.72 (t, J = 6.0 Hz, 2H)。HR-MS calcd. for C10H10Cl2N2O4S, [M+Na]+: 346.963 0, found: 346.962 9。
TM1r: 淡黄色固体, mp 237~241 ℃, [α]D23 +121 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 8.90 (d, J = 8.0 Hz, 1H), 5.68 (dd, J = 8.0, 4.9 Hz, 1H), 5.18 (d, J = 4.9 Hz, 1H), 3.99~3.95 (m, 1H), 3.69~ 3.64 (m, 1H), 3.09~3.05 (m, 2H), 2.63 (t, J = 7.2 Hz, 7H), 1.67~1.61 (m, 2H)。HR-MS calcd. for C11H12Cl2N2O4S, [M+Na]+: 360.978 7, found: 360.979 2。
TM1s: 淡黄色固体, mp 144~148 ℃, [α]D23 +266 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 9.15 (d, J = 8.2 Hz, 1H), 6.35 (dd, J = 17.1, 8.2 Hz, 1H), 5.79 (dd, J = 8.2, 4.9 Hz, 1H), 5.23 (d, J = 4.8 Hz, 1H), 5.20 (d, J = 4.8 Hz, 1H), 4.00 (d, J = 9.3 Hz, 1H), 3.72~3.70 (m, 1H), 2.84 (dt, J = 13.0, 6.6 Hz, 2H)。HR-MS calcd. for C10H10BrClN2O4S, [M+H]+: 368.930 6, found: 368.930 5。
TM1t: 淡黄色固体, mp 172~176 ℃, [α]D23 +227 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 13.45 (s, 1H), 8.82 (d, J = 8.2 Hz, 1H), 5.68 (dd, J = 8.2, 4.8 Hz, 1H), 5.09 (d, J = 4.8 Hz, 1H), 3.62 (d, J = 18.1 Hz, 1H), 3.46 (d, J = 18.1 Hz, 1H), 3.08 (dd, J = 13.2, 7.0 Hz, 2H), 2.63 (t, J = 7.0 Hz, 3H), 1.65 (dt, J = 13.7, 7.0 Hz, 2H)。HR-MS calcd. for C11H12BrClN2O4S, [M+Na]+: 404.928 2, found: 404.927 6。
TM1u: 白色固体, mp 170~173 ℃, [α]D23 +273 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 13.17 (s, 1H), 9.24 (d, J = 8.2 Hz, 1H), 6.50 (dd, J = 6.3, 2.3 Hz, 1H), 5.74 (dd, J = 8.2, 5.0 Hz, 1H), 5.08 (d, J = 5.0 Hz, 1H), 4.17 (s, 2H), 3.65 (dd, J = 19.0, 2.3 Hz, 1H), 3.56 (dd, J = 19.0, 6.4 Hz, 1H)。HR-MS calcd. for C9H9ClN2O4S, [M+Na]+: 298.986 4, found: 298.986 4。
TM1v: 白色固体, mp 170~173 ℃, [α]D23 +145 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 13.19 (s, 1H), 9.00 (d, J = 8.2 Hz, 1H), 6.49 (dd, J = 6.2, 2.1 Hz, 1H), 5.75 (dd, J = 8.2, 5.0 Hz, 1H), 5.05 (d, J = 5.0 Hz, 1H), 3.79 (t, J = 5.5 Hz, 2H), 3.63 (dd, J = 19.0, 2.1 Hz, 1H), 3.54 (dd, J = 19.0, 6.2 Hz, 1H), 2.71 (td, J = 6.0, 3.0 Hz, 2H)。HR-MS calcd. for C10H11ClN2O4S, [M+Na]+: 313.002 0, found: 313.002 0。
TM1w: 白色固体, mp 149~153 ℃, [α]D23 +215 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 8.89 (d, J = 8.2 Hz, 1H), 6.35 (dd, J = 6.1, 2.0 Hz, 1H), 5.66 (dd, J = 8.2, 4.9 Hz, 1H), 5.00 (d, J = 4.9 Hz, 1H), 3.65~3.62 (m, 2H), 3.59 (dd, J = 18.8, 2.2 Hz, 1H), 3.49 (dd, J = 18.8, 6.3 Hz, 1H), 2.36 (dd, J = 10.8, 3.9 Hz, 2H), 1.97~1.92 (m, 2H)。HR-MS calcd. for C11H13ClN2O4S, [M+Na]+: 327.017 7, found: 327.017 7。
TM1x: 白色固体, mp 151~152 ℃, [α]D23 +213 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 13.04 (s, 1H), 8.98 (d, J = 8.2 Hz, 1H), 6.49 (dd, J = 6.3, 2.3 Hz, 1H), 5.75 (dd, J = 8.2, 5.0 Hz, 1H), 5.05 (d, J = 5.0 Hz, 1H), 3.65 (dd, J = 6.0, 2.2 Hz, 2H), 3.62 (dd, J = 12.6, 2.5 Hz, 1H), 3.54 (dd, J = 19.0, 6.3 Hz, 1H), 2.89~2.78 (m, 2H)。HR-MS calcd. for C10H11BrN2O4S, [M+H]+: 334.969 6, found: 334.9695; [M+Na]+: 356.9515, found: 356.951 3。
TM1y: 白色固体, mp 152~154 ℃, [α]D23 +216 (c 1, CH2Cl2)。1H NMR (600 MHz, DMSO-d6) δH 12.84 (s, 1H), 8.81 (d, J = 8.2 Hz, 1H), 6.48 (dd, J = 6.2, 2.2 Hz, 1H), 5.71 (dd, J = 8.2, 4.9 Hz, 1H), 5.04 (d, J = 4.9 Hz, 1H), 3.62 (dd, J = 18.9, 2.1 Hz, 1H), 3.52 (dd, J = 19.0, 6.4 Hz, 1H), 3.09~3.05 (m, 2H), 2.64~2.62 (m, 2H), 1.68~1.61 (m, 2H)。HR-MS calcd. for C11H13BrN2O4S, [M+H]+: 348.985 2, found: 348.985 0; [M+Na]+: 370.967 1, found: 370.967 2。
2 化合物的生物活性测试 2.1 抗人致病菌活性按照美国国家临床实验室标准化委员会(NCCLS) 推荐的微量稀释法, 采用本实验室常用的测试方法[27-29], 测定了目标分子对金葡菌ATCC 25129及ATCC 14125、藤黄微球菌、枯草芽孢杆菌、大肠杆菌ATCC 25922、鲍曼不动杆菌ATCC 19606、沙门菌ATCC 13076、铜绿假单胞菌ATCC 27853的MIC, 相关结果见表 4。
2.2 抗毕赤酵母菌活性采用NCCLS推荐的微量肉汤稀释法, 参照本实验室常用的测试方法[27-29], 测定了目标分子TM1a~TM1y抑制毕赤酵母菌的MIC值, 相关结果见表 5。
2.3 抗柑橘溃疡病菌和病原真菌活性采用本实验室常用的测试方法[27-29], 测定了目标分子TM1a~TM1y对柑橘溃疡病菌RL菌株、柑橘胶孢炭疽菌Co.3菌株与柑橘褐斑病菌Al.6菌株的抑制活性, 相关结果见表 6及表 7。
活性测试的具体操作步骤, 参见辅助材料。
致谢: 西南大学药学院中医药学院徐兴然副教授、蚕桑纺织与生物质科学学院周围博士在人致病菌、毕赤酵母菌活性测试中提供的大力帮助, 重庆天地药业赠送头孢母核样品, 本学院老师在核磁共振测试中提供的支持。
作者贡献: 李洋负责大多数化合物的合成与部分生物活性测试, 论文的撰写、修改和校对; 范莉、唐雪梅、杨德蒙负责少数分子合成, 文本修改、校对; 胡军华、吴玉珠、占爽负责柑橘病菌生物活性测试, 文本修改; 杨大成负责课题规划, 指导实验的设计、化合物的合成, 对外联系, 文本的修改、校对。
利益冲突: 无利益冲突。
| [1] |
Zhou CH. Basic Medicinal Chemistry (基础药物化学)[M]. Beijing: Science Press, 2014: 306-312.
|
| [2] |
Zheng H. Medicinal Chemistry (药物化学)[M]. Beijing: People's Medical Publishing House, 2003: 254-262.
|
| [3] |
Liu X. Study on the Synthesis and Biological Activity of New Cephalosporins with 2-Position Substitution (2位取代的头孢菌素类新化合物的合成与生物活性的研究)[D]. Beijing: Peking Union Medical College, 2008.
|
| [4] |
Shukla SN, Gaur P, Gupta JP, et al. Identification of new pharmacophore in bioactive palladium schiff base metal complexes of cephalosporins: synthesis, characterization and biological activity[J]. Int J PharmTech Res, 2015, 5: 1-5. |
| [5] |
Zhang Z, Bi CF, Fan YH, et al. Cefepime, a fourth-generation cephalosporin, in complex with manganese, inhibits proteasome activity and induces the apoptosis of human breast cancer cells[J]. Int J Mol Med, 2015, 36: 1143-1150. DOI:10.3892/ijmm.2015.2297 |
| [6] |
Chen GH, Yang Y, Lin C, et al. Synthesis and antibacterial activity of 7β-[2-(2-substituted aminothiazole-4-yl)-(Z)-2-methoxyiminoacetylamido]-3-quaternaryammoniummethyl-cephalosporins[J]. Acta Pharm Sin (药学学报), 2009, 44: 366-370. |
| [7] |
Abdul-Mutakabbir JC, Alosaimy S, Morrisette T, et al. Cefiderocol: a novel siderophore cephalosporin against multidrug-resistant gram-negative pathogens[J]. Pharmacotherapy, 2020, 40: 1228-1247. DOI:10.1002/phar.2476 |
| [8] |
Cherian PT, Cheramie MN, Marreddy RKR, et al. New β-lactam-tetramic acid hybrids show promising antibacterial activities[J]. Bioorg Med Chem Lett, 2018, 28: 3105-3112. DOI:10.1016/j.bmcl.2018.07.018 |
| [9] |
Basoglu S, Demirbas A, Ulker S, et al. Design, synthesis and biological activities of some 7-aminocephalosporanic acid derivatives[J]. Eur J Med Chem, 2013, 69: 622-631. DOI:10.1016/j.ejmech.2013.07.040 |
| [10] |
Evans LE, Krishna A, Ma Y, et al. Exploitation of antibiotic resistance as a novel drug target: development of a β-lactamase-activated antibacterial prodrug[J]. J Med Chem, 2019, 62: 4411-4425. DOI:10.1021/acs.jmedchem.8b01923 |
| [11] |
Vigliotta G, Giordano D, Verdino A, et al. New compounds for a good old class: synthesis of two β-lactam bearing cephalosporins and their evaluation with a multidisciplinary approach[J]. Bioorg Med Chem, 2020, 28: 115302. DOI:10.1016/j.bmc.2019.115302 |
| [12] |
Haren MJV, Tehrani KHME, Kotsogianni I, et al. Cephalosporin prodrug inhibitors overcome metallo-β-lactamase driven antibiotic resistance[J]. Chemisty, 2021, 27: 3806-3811. DOI:10.1002/chem.202004694 |
| [13] |
Liu J, Ren ZH, Fan L, et al. Design, synthesis, biological evaluation, structure-activity relationship, and toxicity of clinafloxacin-azole conjugates as novel antitubercular agents[J]. Bioorg Med Chem, 2019, 27: 175-187. DOI:10.1016/j.bmc.2018.11.035 |
| [14] |
Yang DC, Ren YH, Fan L, et al. Fluoroquinolone derivatives of p-aminosalicylic acid and intermediates, preparation methods and applications thereof: CN, 2020110256397[P]. 2020-09-25.
|
| [15] |
Yang DC, Pan JF, Fan L, et al. Fluoroquinolone derivatives of p-aminosalicylic acid and intermediates, preparation methods and applications thereof: CN, 2020110256626[P]. 2020-09-25.
|
| [16] |
Pan JF, Sun XL, Fan L, et al. Study on the hybrid molecules of dihydroartemisinin and fluoroquinolones linked by L-homoserine derivative[J]. Acta Pharm Sin (药学学报), 2020, 52: 2157-2169. |
| [17] |
Zhou FW, Lei HS, Fan L, et al. Design, synthesis, and biological evaluation of dihydroartemisinin-fluoroquinolone conjugates as a novel type of potential antitubercular agents[J]. Bioorg Med Chem Lett, 2014, 24: 1912-1917. DOI:10.1016/j.bmcl.2014.03.010 |
| [18] |
Yang DC, Ren ZH, Lei HS et al. Application of clinfloxacin amino derivatives and pharmaceutically acceptable salts thereof in preparation of anti-tuberculosis drugs: CN, ZL201310389329.7 [P]. 2014-12-10.
|
| [19] |
Han HY, Chen L, Xu XR, et al. Simple synthesis of clinfloxacin amide derivatives and their biological activities in vitro and in vivo[J]. Sci China Chem (中国科学: 化学), 2011, 41: 461-473. |
| [20] |
Rei M. A mild and efficient method for the esterification of cephalosporanic acids[J]. Chem Lett, 1978, 7: 979-982. DOI:10.1246/cl.1978.979 |
| [21] |
Mobashery S, Johnston M. Preparation of ceph-3-em esters unaccompanied by Δ3→Δ2 isomerization of the cephalosporin[J]. J Org Chem, 2002, 51: 4723-4726. |
| [22] |
Chen ZK, Hu CQ. Degradation mechanism of cephalosporin antibiotics[J]. World Notes Antibiot (国外医药: 抗生素分册), 2004, 25: 249-252. |
| [23] |
Yao LR, Jin GY, Liu XH, et al. Research progress on double bond isomerization of cephalosporin nucleus[J]. Chin J Pharm (中国医药工业杂志), 2014, 45: 978-985. |
| [24] |
Zhou XB, Xue F, Ju SG. Research progress on removal methods of cephalosporin carboxyl protective group[J]. Technol Dev Chem Ind (化工技术与开发), 2009, 38: 26-30. |
| [25] |
Yang DC, Fan L, Zhong YG. Study on the synthetic method of fully protected RGD tripeptide[J]. Chin J Org Chem (有机化学), 2003, 23: 493-498. |
| [26] |
Chen FE. Organic Medicine Synthesis Method (有机药物合成法)[M]. Vol. 1. Beijing: China Medical Science Press,, 1999: 632-635.
|
| [27] |
Fan L, Yang DC, Pan JF, et al. p-Aminosalicylic acid dihydroartemisinin derivatives and preparation method and application thereof: CN, 2020110275326[P]. 2020-09-25.
|
| [28] |
Yang DC, Li WL, Luo P, et al. Synephrine fluoroquinolone derivatives and preparation method and application thereo: CN, 2020110275504[P]. 2020-09-25.
|
| [29] |
Yang DC, Luo P, Li WL, et al. Synephrinazole derivatives and preparation method and application thereof: CN, 2020110275650[P]. 2020-09-25.
|
| [30] |
Gasser B, Prielhofer R, Marx H, et al. Pichia pastoris: protein production host and model organism for biomedical research[J]. Fut Microbiol, 2013, 8: 191-208. DOI:10.2217/fmb.12.133 |
| [31] |
Inglin RC, Stevens MJA, Meile L, et al. High-throughput screening assays for antibacterial and antifungal activities of Lactobacillus species[J]. J Microbiol Methods, 2015, 114: 26-29. DOI:10.1016/j.mimet.2015.04.011 |
 2021, Vol. 56
2021, Vol. 56


