2. 中国科学院过程工程研究所, 北京 100190;
3. 山西大学化学生物学与分子工程教育部重点实验室, 山西 太原 030006;
4. 地产中药功效物质研究与利用山西省重点实验室, 山西 太原 030006;
5. 山西大学化学化工学院, 山西 太原 030006;
6. 山西省果业工作总站, 山西 太原 030001
2. Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China;
3. Key Laboratory of Chemical Biology and Molecular Engineering of Ministry of Education, Shanxi University, Taiyuan 030006, China;
4. Key Laboratory of Effective Substances Research and Utilization in TCM of Shanxi Province, Shanxi University, Taiyuan 030006, China;
5. College of Chemistry and Chemical Engineering, Shanxi University, Taiyuan 030006, China;
6. Shanxi Fruit Industry Work Station, Taiyuan 030001, China
黄芪多糖是黄芪中免疫调节活性最强, 含量最为丰富的物质[1], 是由黄芪药材经过水提醇沉, 除蛋白纯化后得到的复杂多糖混合物。目前关于黄芪多糖活性研究已有大量报道, 具有抗肿瘤、抗糖尿病、抗病毒、调节心血管活性和神经保护作用等多种生物活性, 研究表明这些药理活性均是以免疫调节为基础实现的[2-4]。本课题组前期研究表明黄芪多糖由两种不同分子量黄芪多糖[APS-Ⅰ (> 2 000 kDa) 和APS-Ⅱ (1.02×104 Da)] 组成, 其中APS-Ⅱ在免疫活性中发挥主要作用[5, 6]。然而由于多糖结构难于精确测定, 限制了黄芪多糖作用机制的深入研究。
近年来多糖受体理论研究成果表明[7-9], 具有免疫调节活性的多糖, 有类似糖蛋白结构上的糖链, 可与细胞表面模式识别受体(pattern recognition receptor, PRR) 结合, 活化胞内信号通路, 促进细胞因子等免疫物质基因表达, 进而激活免疫系统, 如细菌脂多糖(lipopolysaccharide, LPS) 的受体为Toll样受体2 (toll-like receptor 2, TLR-2) 和Toll样受体4 (Toll-like receptor 4, TLR-4); 甘露聚糖受体是C型凝集素、甘露糖结合凝集素(mannose-binding lectin, MBL) 和TLR-4等; β-葡聚糖受体则包括补体受体3 (complement receptor 3, CR3)、乳糖神经酰胺、清道夫受体和dectin-1受体。研究表明, 多糖在与这些蛋白受体结合时, 仅是多糖分子中的寡糖片段与受体相结合, 与酶作用过程相似, 多糖分子中也存在一种或多种寡糖片段“活性中心”。依据该理论已有将小分子寡糖开发的新型药, 如磺达肝癸钠是根据抗凝血药物肝素核心戊糖合成后研发的新型抗凝药, 该糖非还原端的2~3个糖残基与抗凝血酶Ⅲ (antithrombin-Ⅲ, AT-Ⅲ) 结合显示出较强的抗凝作用, 且不良反应较小[10, 11]。此外, 香菇多糖核心七糖的发现[12]和活性壳寡糖的应用[13]均为多糖活性中心的研究提供了依据。
因此将黄芪多糖降解为寡糖, 从寡糖水平研究多糖的活性中心, 为突破黄芪多糖结构研究瓶颈提供了新思路。目前降解多糖常用方法有化学降解法和酶降解法, 相较于化学降解, 酶解法可以切断特定糖苷键, 反应易于控制, 且降解过程中条件温和, 无副产物生成, 是一种理想的降解方法, 但也存在一定局限性, 对于未知结构的多糖则无法选用相应酶进行降解[14, 15]。本课题组前期研究表明, 分子量10 kDa左右的黄芪多糖APS-Ⅱ主链主要由α-D-1, 4-葡聚糖组成, 且在主链上存在少量α-D-(1→4, 6)-葡聚糖、阿拉伯聚糖和半乳聚糖[16-18]。因此本文通过水提醇沉法得到黄芪总多糖, 采用超滤技术分离得到APS-Ⅱ, 用内切α-1, 4-葡聚糖酶降解APS-Ⅱ, 并通过单因素试验和正交试验确定了APS-Ⅱ最佳酶降解条件, 获得黄芪多糖酶解寡糖混合物, 再采用聚丙烯酰胺凝胶色谱柱分离后得到不同聚合度的寡糖组分, 结合特异性免疫和非特异性免疫两方面细胞试验对不同寡糖组分进行免疫活性筛选, 初步确定其免疫活性中心寡糖组分。
材料与方法材料 山西浑源黄芪(仿野生蒙古黄芪) 由山西大学秦雪梅教授鉴定为蒙古黄芪的干燥根(2017年采收, 生长年限5年)。药材样品留存于山西大学中医药现代研究中心样品库。
动物 雌性BALB/c小鼠(SPF级), 购自北京维通利华实验动物技术有限公司, 年龄6~8周, 体重20 ± 2 g, 动物许可证号为SCXK (京) 2016-0006。饲养环境为温度(25 ± 2) ℃, 湿度(50± 10) %, 12 h明暗交替光照, 动物福利和实验过程均遵循山西大学动物伦理委员会的规定。
仪器 1.5 cm×70 cm中压玻璃层析柱; 2695型高效液相色谱仪(6000蒸发光散射检测器, 美国Waters公司); GS-NF500型膜片式切向流膜分离系统, PES材质GS-100 kDa (上海顾信生物科技有限公司); CPA225D型十万分之一分析天平(德国Sartorius公司); Neofuge 13R高速冷冻离心机(上海力申科学仪器有限公司); ZX-LGJ-18普通型冷冻干燥机(上海知信实验仪器技术有限公司); RE-52型旋转蒸发器(上海亚荣生化仪器厂)。
试剂 聚丙烯酰胺凝胶Bio-Gel-P-2 (美国Bio-Rad公司); 内切α-D-1, 4-葡聚糖水解酶(CAS: 9000-90-2, 北京索莱宝科技有限公司); 葡萄糖(≥99%)、葡聚2糖(≥98%)、葡聚3糖(≥99%)、葡聚4糖(≥97%)、葡聚5糖(≥97%)、葡聚6糖(≥95%)、葡聚7糖(≥95%)、葡聚8糖(≥90%)、葡聚9糖(≥90%) (日本Glycarbo公司); 三氟乙酸TFA (≥99%) (中国上海阿拉丁公司); 乙醇、甲醇(天津市大茂化学试剂厂); 甲酸(≥98%)、质谱级乙腈CAN、色谱级乙腈、色谱级甲醇(美国Thermo公司)。
APS-Ⅱ分离制备的操作方法 黄芪粉末过100目筛后取黄芪细粉15 g, 以1∶20比例加入去离子水, 90 ℃下磁力搅拌器搅拌提取4 h, 离心取上清液浓缩至150 mL, 酶解法结合三氯乙酸法除蛋白(加入200 U木瓜蛋白酶, 45 ℃下水浴6 h, 随后加10%三氯乙酸至总体积200 mL, 冰浴中搅拌15 min后静置30 min, 离心弃沉淀)。离心后上清液中缓缓加入无水乙醇至最终醇浓度为80%, 静置过夜, 沉淀冷冻干燥得黄芪总多糖(APS), 将APS配制成5 mg·mL-1溶液, 并通过分子截留量为10 kDa的超滤膜得到APS-Ⅱ。
内切α-1, 4-葡聚糖酶降解APS-Ⅱ单因素试验设计 称取黄芪多糖, 在100 mmol·L-1醋酸钠-醋酸缓冲液中溶解, 制得1 mg·mL-1多糖溶液, 量取2 mL糖液加入封管中, 在一定温度下加入2 mL上述缓冲液配制的内切α-1, 4-葡聚糖酶溶液降解多糖, 分别考察酶解温度、酶浓度和酶解时间对多糖降解的影响。酶解温度分别为40、50、55、60和70 ℃, 酶浓度分别为0.05、0.2、0.5、1和2 U·min-1, 酶解时间分别为0.5、1、1.5、2和3 h。酶解完成后立即置于沸水中灭活10 min, 离心取上清液, 旋干后溶于2 mL甲醇再次旋干, 重复3次, 最终溶于蒸馏水, 通过100 D透析膜除盐, 寡糖液浓缩后冷冻干燥, 得寡糖混合物, 加蒸馏水配制成2 mg·mL-1寡糖溶液, 进行亲水作用色谱-蒸发光检测(HILIC-ELSD) 分析。
酶解温度 在酶浓度0.5 U·min-1、酶解时间1.5 h条件下, 考察酶解温度40、50、55、60和70 ℃, 酶解后立即置于沸水中灭活10 min, 离心取上清, 除盐后进行HILIC-ELSD分析。
酶浓度 在酶解温度55 ℃、酶解时间1.5 h条件下, 考察酶浓度0.05、0.2、0.5、1和2 U·min-1, 酶解后立即置于沸水中灭活10 min, 离心取上清, 除盐后进行HILIC-ELSD分析。
酶解时间 在酶浓度0.5 U·min-1、酶解温度55 ℃条件下, 考察酶解时间0.5、1、1.5、2和3 h, 酶解后立即置于沸水中灭活10 min, 离心取上清, 除盐后进行HILIC-ELSD分析。
内切α-1, 4-葡聚糖酶降解APS-Ⅱ正交试验设计根据降解后寡糖片段数量和峰面积大小选取最佳水平左右三个水平, 通过三因素三水平进行正交试验(表 1), 通过SPSS 16.0软件对实验结果进行分析, 优化降解条件。
| 表 1 The table of orthogonal test design. A: The concentration of endo α-1, 4-glucanase enzymatic; B: The temperature of enzymatic hydrolysis reaction; C: The time of enzymatic hydrolysis reaction |
APS-Ⅱ酶降解寡糖混合物的分离纯化 称取40 g聚丙烯酰胺凝胶(Bio-Gel-P-2) 倒入去离子水中, 浸泡24 h后弃去悬浮的细小颗粒, 缓缓倒入玻璃柱(1.5 cm×70 cm) 至60 cm, 真空脱气后用去离子水冲洗层析柱至恒定流速。
称取一定量APS-Ⅱ在酶浓度0.5 U·min-1、酶解温度60 ℃、酶解时间1.5 h条件下降解, 酶解后立即置于沸水中灭活10 min, 离心取上清, 冷冻干燥后得黄芪寡糖混合物, 称取350 mg用水溶解, 湿法上样, 去离子水进行洗脱, 通过2 mL的eppendorf (EP) 管连续收集洗脱液, 洗脱速度为层析柱中洗脱液下降速度5 cm·h-1, 收集60管, 每隔5管进行高效液相色谱(high performance liquid chromatography, HPLC) 分析。
HPLC分析条件 色谱柱华谱X-Amide (250 mm×4.6 mm, 5 μm); 检测器: ELSD; 流动相为A-纯水, B-乙腈; 梯度洗脱0~55 min, 15%~50% A, 85%~50% B; 流速1 mL·min-1; 柱温35 ℃; 进样量20 μL; ELSD漂移管温度105 ℃; 载气流速2.5 L·min-1。
不同寡糖组分对RAW264.7细胞吞噬活性的影响 配制含有100 μg·L-1青链霉素混合液的DMEM完全培养基。RAW264.7置于DMEM完全培养基中培养, 将细胞保持在37 ℃、5% CO2潮湿空气中, 直至细胞生长至对数期。中性红是一种大分子的荧光试剂, 由于分子量较大, 只能被内吞才能被摄取到细胞内, 因此通过检测药物影响细胞内中性红摄取量可以反映巨噬细胞的吞噬能力[19]。因此, RAW264.7的吞噬能力以中性红摄取量确定。在DMEM完全培养基中调节细胞浓度为每毫升1×105个细胞, 将细胞加到96孔板中, 每孔100 μL, 将96孔板置于培养箱中培养, 条件设置为37 ℃、5% CO2饱和湿度, 24 h后弃去培养基。配制10、20、30、50、70、100 μg·mL-1的APS-Ⅱ、酶解后总寡糖和P1~P4寡糖溶液, 并进行微孔滤膜除菌, 其中不同剂量APS-Ⅱ为阳性对照, 同时设立给药剂量为0的空白对照组。将RAW264.7细胞分别与100 μL不同浓度的APS-Ⅱ、酶解后总寡糖和P1~P4寡糖溶液一起培养24 h后, 除去含有多糖或寡糖的培养基, 并用磷酸缓冲盐溶液洗细胞, 重复两次。向每个孔中加入100 μL配制好的0.075%中性红。培养4 h后, 吸出液体并用磷酸缓冲盐溶液洗涤两次。最后, 用200 μL细胞裂解液即C2H5OH和CH3COOH (1∶1, v/v)处理RAW264.7, 培养过夜。通过使用酶标仪在540 nm处测量吸光度值。
不同寡糖组分对自然杀伤细胞(natural killer cell, NK) 的细胞杀伤活性的影响 将用作效应细胞的脾细胞(1×106细胞/孔) 和用作靶细胞的YAC-1白血病细胞NK细胞(2×104细胞/孔) 加入96孔板中, 总体积100 μL, RPMI1640完全培养基溶解, 使效靶比为50∶1。对于靶细胞对照组, 仅将靶细胞添加到孔中, 对于效应细胞对照组, 仅将效应细胞加入孔中。然后在每组的每个孔中加入不同浓度100 μL的APS-Ⅱ、酶解后总寡糖和P1~P4寡糖溶液(10、25、50、100、200、400 μg·mL-1) 于培养箱中孵育12 h后, 然后根据CCK-8 (cell counting kit-8) 试剂盒说明进行测定, 其中APS-Ⅱ为阳性对照, 同时设立空白对照组。最后, NK细胞的细胞毒性百分比通过以下公式计算: NK细胞的细胞毒性= [1-(AS-AE)/AT]×100%, AS为样品组吸光度值, AE为效应细胞对照组的吸光度值, AT为靶细胞对照组的吸光度值[17]。
不同寡糖组分对淋巴细胞增殖的影响 通过颈椎脱位将雌性BALB/c小鼠处死, 解剖, 无菌获取脾, 轻轻研磨, 然后通过将组织穿过200目的筛网获得单细胞悬浮液, 然后用灭菌的磷酸缓冲盐溶液冲洗至干净, 滤过筛网得细胞, 用磷酸缓冲盐溶液洗涤两次, 将滤液800 r·min-1离心10 min, 弃去上清液, 并加入红细胞裂解液, 摇动溶液并离心。用磷酸缓冲盐溶液洗涤3次并以800 r·min-1离心5 min后, 收集细胞沉淀[20]。
用RPMI1640培养基将细胞浓度调至每毫升1×107个细胞, 将100 μL细胞悬液加入96孔板中, 再加入90 μL不同浓度的APS-Ⅱ、酶解后总寡糖和P1~P4寡糖溶液(10、25、50、100、200、400 μg·mL-1) 以及10 μL终浓度为50 μg·mL-1的刀豆蛋白(concanavalin A, ConA), 检测T淋巴细胞增殖, APS-Ⅱ为阳性对照, 同时设立空白对照组。
将100 μL细胞悬液加入96孔板中, 再加入90 μL不同浓度的APS-Ⅱ、酶解后总寡糖和P1~P4寡糖溶液(10、20、30、50、70、100 μg·mL-1) 以及10 μL终浓度为10 μg·mL-1的LPS, 进行B淋巴细胞增殖实验。
在培养箱中培养孵育(37 ℃、5% CO2) 24 h后, 通过CCK-8试剂盒测定细胞活力。
不同寡糖组分对脾淋巴细胞分泌IgG的影响 用RPMI1640培养基将细胞浓度调节为每毫升5×105个细胞, 并加入96孔板中, 每孔100 μL。然后分别向孔中加入不同浓度的APS-Ⅱ、酶解后总寡糖和P1~P4寡糖溶液(10、25、50、100、200、400 μg·mL-1), APS-Ⅱ为阳性对照, 同时设立空白对照组。在37 ℃、5% CO2饱和湿度培养箱中培养48 h后, 将96孔板以3 000 r·min-1离心10 min, 取上清转移到新管中[21], 并根据试剂盒说明测定IgG。
统计学分析 对免疫活性试验结果通过Prism 7.00软件进行处理, 并进行t检验分析组间差异, 实验数据以x±s表示, 检验水准α = 0.05, P < 0.05表示具有统计学意义。
结果 1 APS-Ⅱ的分离制备由黄芪药材通过80%醇沉得到的黄芪总多糖APS包含两个不同分子量多糖: APS-Ⅰ (> 2 000 kDa) 和APS-Ⅱ (1.02×104 Da), 应用超滤法将APS截取得到APS-Ⅱ。
2 APS-Ⅱ酶降解单因素试验酶解产物中寡糖聚合度由葡聚糖2~9糖标准品确定, 如图 1所示, 14 min为葡聚2糖, 20 min为葡聚3糖, 24 min为葡聚4糖, 28 min为葡聚5糖, 31 min为葡聚6糖, 34 min为葡聚7糖, 37 min为葡聚8糖, 38 min为葡聚9糖, 9糖之后聚合度依次增加。根据标准品保留时间可推测黄芪多糖酶降解后寡糖样品的聚合度大小。

|
图 1 Chromatogram of dextran with degree of polymerization 2-9. 1: Maltose, 2: Maltotriose, 3: Maltotetraose, 4: Maltopentaose, 5: Maltohexaose, 6: Maltoheptaose, 7: Maltooctaose, 8: Maltononaose |
时间对酶解多糖的影响研究显示, 随着酶解时间延长, 酶解产物中1~6聚合度寡糖含量增加, 聚合度7~14寡糖含量基本不变, 其中5糖和6糖含量变化最为明显。酶解时间为0.5和1 h时, 酶解时间较短, 可能有一部分多糖还未被降解, 各组分峰面积随酶解时间延长均有所增加; 酶解时间延长至1.5 h后, 1~14聚合度寡糖各组分峰面积均达到最大值, 此时黄芪多糖酶解完全; 继续延长酶解时间, 在2和3 h酶解后, 黄芪多糖被完全降解, 继续降解含量较多且聚合度较大的5糖和6糖, 产生更多的单糖、2糖、3糖和4糖, 使寡糖混合物中5糖和6糖峰面积减小, 1~4糖峰面积增加。聚合度7~14寡糖在酶解过程中随酶解时长增加, 含量变化不明显, 原因可能是聚合度7~14寡糖不含特定的糖苷键, 无法二次酶解。因此推断, 黄芪多糖最佳酶解时长为1.5 h。
考察不同温度下黄芪多糖酶解产物的差异, 通过研究酶在5个不同温度下降解黄芪多糖活性的差异, 发现内切α-1, 4-葡聚糖酶降解APS-Ⅱ的酶活性范围为50~70 ℃。在40 ℃下, 可明显看到寡糖各组分峰面积较小, 黄芪多糖降解不完全; 在50和60 ℃下, 黄芪多糖降解程度相近, 55 ℃下寡糖各组分峰面积最大, 且5糖、6糖含量最多; 温度增加至70 ℃时, 寡糖各组分峰面积减小, 酶的活性在高温下被抑制, 降解不完全。由此推断, 不同温度对黄芪多糖酶解产物影响主要表现在降解后寡糖混合物中各组分含量的多少, 其中55 ℃为α-1, 4-葡聚糖酶降解黄芪多糖的最适温度。
考察不同酶浓度对黄芪多糖降解的影响, 随着酶浓度的增加, 酶解产物中聚合度1~9糖含量的变化最为明显, 0.01 U·min-1浓度下, 主要产物为1~9糖, 10~14糖含量较低, 原因可能是酶浓度较低, 不能完全降解黄芪多糖, 产生较多聚合度大的寡糖; 0.05和0.1 U·min-1浓度下, 主要产物为1~7糖, 相比于0.01 U·min-1, 酶浓度增加, 不完全酶解产物中8和9糖进一步被酶降解, 含量减少; 酶浓度增加至0.5和1 U·min-1, 主要产物为1~6糖, 且9~14糖含量高于前3个低浓度酶解产物中的寡糖, 说明在酶浓度达到0.5 U·min-1后, 黄芪多糖降解完全, 且寡糖各组分含量趋于稳定, 继续增加酶浓度至1 U·min-1, 使6糖进一步降解为更小聚合度寡糖。因此, 为保证黄芪多糖被降解完全且酶解产物各组分含量最大, 选择0.5 U·min-1为最佳酶浓度。
根据降解后寡糖片段峰数量及峰面积大小为评价指标, 选取三因素三水平进行正交试验。
3 APS-Ⅱ酶降解正交试验将正交试验结果数据及寡糖混合物峰面积总和导入SPSS 16.0软件, 结果如表 2所示, 在三个主要因素中, 酶浓度影响最大, 酶解温度次之, 酶解时间影响最小。根据正交试验优化结果分析, 最佳酶降解工艺为A3B3C2, 即酶浓度0.5 U·mL-1, 酶解温度60 ℃, 酶解时间90 min。
| 表 2 The results and analyses of orthogonal test. K: The sum of the experimental results at the corresponding level under each factor; R: The maximum value of K minus the minimum value under each factor |
黄芪多糖酶降解后主要产生聚合度1~18的寡糖和小分子量多糖。分别对0、5、10、15、18、20、22、25、27、30、32、35、37、40、43、45、50、55、60管进行检测。洗脱液中从第20管开始出现聚合度13~18的小分子多糖, 含量较少, 第27管后开始出现聚合度为9的寡糖, 故将0~27管合并, 主要成分为聚合度10~18的小分子多糖; 27~34管中主要出现聚合度7~14的寡糖和小分子多糖; 35~42管主要成分为聚合度3~6糖; 43管之后主要成分为聚合度1~3糖。综上, 通过P-2凝胶柱将黄芪寡糖混合物分离得到4个寡糖组分, P1为聚合度1~3糖(图 2A), P2为聚合度3~6糖(图 2B), P3为聚合度7~14糖(图 2C), P4为聚合度10~18糖(图 2D)。
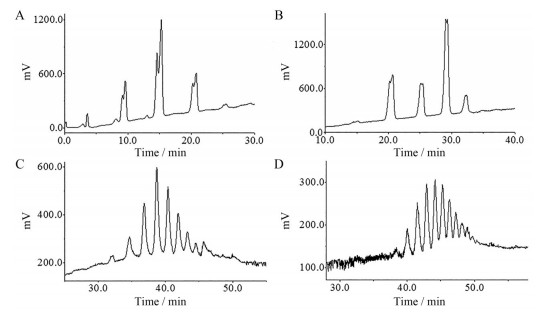
|
图 2 The high performance liquid chromatogram of P1 (A), P2 (B), P3 (C), and P4 (D). P1: 1-3 sugars; P2: 3-6 sugars; P3: 7-14 sugars; P4: 10-18 sugars |
应用中性红法检测不同寡糖组分对RAW264.7细胞吞噬活性的影响(图 3)。在0~100 μg·mL-1浓度范围内, 聚合度1~3糖剂量为50 μg·mL-1时, 细胞吞噬活性最强; 聚合度3~6糖为70 μg·mL-1时, 细胞吞噬活性最强; 聚合度7~14糖为100 μg·mL-1时, 细胞吞噬活性最强; 聚合度10~18糖为20 μg·mL-1时, 细胞吞噬活性最强; 酶解后总寡糖为70 μg·mL-1时, 细胞吞噬活性最强; APS-Ⅱ为50 μg·mL-1时, 细胞吞噬活性最强。以上不同寡糖组分最佳剂量与空白组比较差异具有统计学意义(P < 0.05), 均能显著促进RAW264.7细胞的吞噬活性, 影响顺序为聚合度10~18糖> APS-Ⅱ ≈酶解后总寡糖>聚合度7~14糖>聚合度1~3糖≈聚合度3~6糖, 其中APS-Ⅱ与酶解后总寡糖混合物对RAW264.7细胞吞噬活性增强作用相近, 表明黄芪多糖可降解成多种寡糖, 增强巨噬细胞的吞噬活性而发挥非特异性免疫作用。通过四部分寡糖的活性比较, 表明四部分寡糖都有不同程度的吞噬增强活性, 其中最强的为聚合度10~18糖, 聚合度7~14糖次之。

|
图 3 Effects of different oligosaccharide components on the phagocytic activity of RAW264.7 cells. Total: Total oligosaccharide mixture; APS-2: APS-Ⅱ. x ±s, n = 6. *P < 0.05, **P < 0.01, ***P < 0.001 vs APS-Ⅱ; ##P < 0.01, ###P < 0.001 vs blank control group |
不同寡糖组分对小鼠脾NK细胞杀伤活性均有一定促进作用(图 4)。聚合度1~3糖剂量为10 μg·mL-1时, 增强NK细胞杀伤活性的作用最强; 聚合度3~6糖为200 μg·mL-1时, 增强NK细胞杀伤活性的作用最强; 聚合度7~14糖为25 μg·mL-1时, 增强NK细胞杀伤活性的作用最强; 聚合度10~18糖为10 μg·mL-1时, 增强NK细胞杀伤活性的作用最强; 酶解后总寡糖为100 μg·mL-1时, 增强NK细胞杀伤活性的作用最强; APS-Ⅱ为25 μg·mL-1时, 增强NK细胞杀伤活性的作用最强。以上不同寡糖组分最佳剂量与空白组比较差异有统计学意义(P < 0.05), 均能显著促进小鼠脾NK细胞杀伤活性, 这几种寡糖促进NK细胞的杀伤活性顺序为聚合度10~18糖>聚合度7~14糖≈聚合度3~6糖> APS-Ⅱ ≈酶解后总寡糖>聚合度1~3糖。其中APS-Ⅱ与降解后的寡糖混合物增强NK细胞杀伤活性的作用相近, 表明黄芪多糖可降解成多种寡糖, 促进NK细胞的杀伤活性发挥非特异性免疫作用。四个寡糖组分中活性最强的为聚合度10~18糖, 聚合度3~6糖和聚合度7~14糖次之。

|
图 4 Effects of different oligosaccharide components on the killing activity of mouse spleen natural killer (NK) cells. x ±s, n = 6. *P < 0.05, **P < 0.01, ***P < 0.001 vs APS-Ⅱ; #P < 0.05, ##P < 0.01, ###P < 0.001 vs blank control group |
LPS联合不同寡糖组分对B淋巴细胞增殖的影响如图 5所示, 聚合度1~3糖、3~6糖和7~14糖对B淋巴细胞增殖活性作用不明显; 聚合度10~18糖为10 μg·mL-1时, 对B淋巴细胞增殖活性作用最强; 酶解后总寡糖为50 μg·mL-1时, 对B淋巴细胞增殖活性作用最强; APS-Ⅱ为30 μg·mL-1时, 对B淋巴细胞增殖活性作用最强。聚合度10~18糖、酶解后总寡糖和APS-Ⅱ这三个组分最佳剂量与空白组比较差异有统计学意义(P < 0.05), 均能显著促进B淋巴细胞增殖, 表明黄芪多糖降解成的聚合度10~18糖, 可通过增强LPS诱导B淋巴细胞增殖发挥特异性免疫作用。
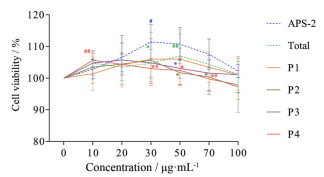
|
图 5 Effects of LPS combined with different oligosaccharide components on the proliferation of B lymphocytes. x ±s, n = 6. *P < 0.05, **P < 0.01 vs APS-Ⅱ; #P < 0.05, ##P < 0.01 vs blank control group |
ConA联合不同寡糖组分对T淋巴细胞增殖的影响如图 6所示, 聚合度1~3糖剂量为10 μg·mL-1时, 对T淋巴细胞增殖活性作用最强; 聚合度3~6糖为50 μg·mL-1时, 对T淋巴细胞增殖活性作用最强; 聚合度7~14糖为50 μg·mL-1时, 对T淋巴细胞增殖活性作用最强; 聚合度10~18糖为100 μg·mL-1时, 对T淋巴细胞增殖活性作用最强; 酶解后总寡糖为100 μg·mL-1时, 对T淋巴细胞增殖活性作用最强; APS-Ⅱ为100 μg·mL-1时, 对T淋巴细胞增殖活性作用最强。不同寡糖组分最佳剂量与空白组比较差异有统计学意义(P < 0.05), 均能显著促进T淋巴细胞增殖。这几种寡糖对T淋巴细胞增殖活性影响顺序为聚合度10~18糖>聚合度7~14糖≈聚合度3~6糖>聚合度1~3糖>酶解后总寡糖≈ APS-Ⅱ, 表明黄芪多糖可降解成多种寡糖, 通过增强ConA诱导T淋巴细胞增殖发挥特异性免疫作用, 其中活性最强为聚合度10~18糖, 其次为聚合度3~6糖和7~14糖。
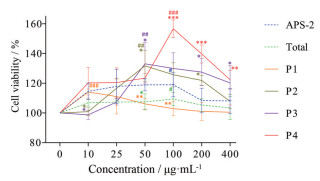
|
图 6 Effects of ConA combined with different oligosaccharide components on the proliferation of T lymphocytes. x ±s, n = 6. *P < 0.05, **P < 0.01, ***P < 0.001 vs APS-Ⅱ; #P < 0.05, ##P < 0.01, ###P < 0.001 vs blank control group |
不同寡糖组分对小鼠脾淋巴细胞分泌IgG的影响如图 7所示。聚合度1~3糖剂量为25 μg·mL-1时, 脾淋巴细胞分泌的IgG最多; 聚合度3~6糖为100 μg·mL-1时, 脾淋巴细胞分泌的IgG最多; 聚合度7~14糖为25 μg·mL-1时, 脾淋巴细胞分泌的IgG最多; 聚合度10~18糖为10 μg·mL-1时, 脾淋巴细胞分泌的IgG最多; 酶解后总寡糖为25 μg·mL-1时, 脾淋巴细胞分泌的IgG最多; APS-Ⅱ为25 μg·mL-1时, 脾淋巴细胞分泌的IgG最多。不同组分最佳剂量与空白组比较差异有统计学意义(P < 0.05), 均能显著促进小鼠脾淋巴细胞分泌IgG。这几种寡糖促进脾淋巴细胞分泌IgG活性顺序为聚合度10~18糖>酶解后总寡糖≈ APS-Ⅱ >聚合度1~3糖≈聚合度7~14糖>聚合度3~6糖, 表明黄芪多糖可降解成多种寡糖, 通过促进脾淋巴细胞分泌IgG发挥特异性免疫作用, 其中活性最强为聚合度10~18糖。

|
图 7 Effects of different oligosaccharide components on IgG secretion of splenic lymphocytes. x ±s, n = 6. *P < 0.05, **P < 0.01 vs APS-Ⅱ; #P < 0.05, ##P < 0.01, ###P < 0.001 vs blank control group |
黄芪多糖是由多个不同分子量多糖组成的混合物, 在本课题组前期研究基础上发现分子质量10 kDa左右的APS-Ⅱ在黄芪多糖的免疫活性中起主要作用。为进一步探究黄芪多糖体内作用机制, 本文依据“多糖受体学说”理论, 通过酶降解方式得到APS-Ⅱ降解后的不同寡糖片段, 并对不同寡糖片段的免疫活性进行研究, 从寡糖层面探究黄芪多糖的活性中心, 确定了在内切α-1, 4-葡聚糖酶浓度0.5 U·mL-1、酶解温度60 ℃、酶解时间90 min下, APS-Ⅱ降解得到的寡糖数量最多, 含量最高, 且降解一致性较好。本研究从机体特异性免疫和非特异性免疫两方面对不同寡糖片段活性进行了研究。在非特异性免疫中, 巨噬细胞遍布全身, 可通过吞噬作用杀死外部病原体, 而NK细胞是多糖介导免疫调节的重要靶点, 可直接识别并杀死病原体, 且具有杀伤肿瘤细胞的功能[22], 因此通过研究不同寡糖片段对巨噬细胞和NK细胞的影响, 探究了其对机体非特异性免疫功能的影响; 在特异性免疫中, 主要发挥作用的为T和B淋巴细胞, 而ConA和LPS分别是小鼠T和B淋巴细胞的促分裂原, 可促进细胞代谢[23], 因此通过研究不同寡糖片段对ConA和LPS诱导的T、B淋巴细胞的影响, 探究其对机体特异性免疫功能的影响。本研究结果表明APS-Ⅱ及其酶降解产物均可通过增强巨噬细胞的吞噬功能, 增强NK细胞的杀伤活性, 促进非特异性免疫功能, 还可协同ConA促进T淋巴细胞增殖, 协同LPS促进B淋巴细胞增殖并分泌细胞因子IgG, 增强特异性免疫功能, 不同寡糖组分中活性最强的为聚合度10~18寡糖组分且高于免疫活性多糖APS-Ⅱ。在增强巨噬细胞吞噬活性, 增强NK细胞的杀伤活性, 促进T和B淋巴细胞增殖, 促进淋巴细胞分泌细胞因子IgG方面, 聚合度10~18糖均表现出最强活性, 聚合度1~3糖、聚合度3~6糖、聚合度7~14糖也表现出一定活性。
相比于多糖, 寡糖分子量较小, 结构明确, 可在体内与特定酶结合发挥活性, 产生不良反应几率更小[24], 如肝素中的核心五糖结构可与抗凝血酶Ⅲ结合进而激活该酶, 直接与凝血酶Ⅹa因子作用产生抗凝血作用且无出血不良反应, 而肝素中的非核心五糖结构和抗凝血酶Ⅲ形成的复合物结合, 虽表现出抗凝活性, 但存在自发性出血不良反应, 目前基于肝素核心五糖开发的低分子肝素药物磺达肝癸钠已成功上市, 该药抗凝效果更好, 同时产生出血不良反应更少。因此, 将多糖降解成寡糖可避免多糖结构中的非活性片段对多糖活性的影响, 且小分子寡糖溶解性高于大分子多糖, 进入体内起效更快, 半衰期更长[25, 26]。
本文初步建立了活性黄芪多糖APS-Ⅱ的酶降解获得寡糖的方法, 并对降解后的寡糖进行分离, 初步探究了不同聚合度寡糖混合物的免疫活性, 筛选出聚合度10~18寡糖在免疫活性中高于APS-Ⅱ。本文也存在一定的局限性, 仅筛选出了免疫活性较强的一部分寡糖混合物, 未对不同聚合度寡糖的精细结构进行解析, 下一步需结合多种结构分析设备对获得聚合度10~18糖中的单个寡糖逐一进行深入探究。
作者贡献: 李科和崔连杰负责实验方案设计; 崔连杰负责实验实施、数据收集、结果分析和文章撰写等; 李科负责提供文章思路, 在文章写作方面进行指导和修改; 李晓霞、石丽霞和杜昱光负责文中数据分析的指导; 李震宇和秦雪梅对整个实验内容给予监督; 石丽霞、秦雪梅和李震宇负责对文章内容的修改完善。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Wu X, Yang W, Zhang L, et al. Effect of Astragalus polysaccharide segments with different molecular weight on systematic/mucosal immunization in immunodepressive mice[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2011, 17: 169-172. |
| [2] |
Li Q, Hu JH, Gao B, et al. Advances on immunoregulation effect of Astragalus polysaccharides[J]. Chin J Exp Tradit Med Formulae (中国实验方剂学杂志), 2017, 23: 199-206. |
| [3] |
Morten L, Anette W, Rune L, et al. Enhancement of human adaptive immune responses by administration of a high-molecular-weight polysaccharide extract from the cyanobacterium Arthrospira platensis[J]. J Med Food, 2008, 11: 313-322. DOI:10.1089/jmf.2007.564 |
| [4] |
Jiang CL, Tang C, Qian Y, et al. Immunoregulation effect of Astragalus polysaccharides[J]. Food Sci (食品科学), 2013, 34: 327-332. |
| [5] |
Li K, Cui LJ, Cao YX, et al. UHPLC Q-Exactive MS-based serum metabolomics to explore the effect mechanisms of immunological activity of Astragalus polysaccharides with different molecular weights[J]. Front Pharmacol, 2020, 11: 595692. DOI:10.3389/fphar.2020.595692 |
| [6] |
Li K, Cao YX, Jiao SM, et al. Structural characterization and immune activity screening of polysaccharides with different molecular weights from Astragali Radix[J]. Front Pharmacol, 2020, 11: 582091. DOI:10.3389/fphar.2020.582091 |
| [7] |
Jiang MH, Zhu L, Jiang JG, et al. Immunoregulatory actions of polysaccharides from Chinese herbal medicine[J]. Expert Opin Ther Targets, 2010, 14: 1367-1402. DOI:10.1517/14728222.2010.531010 |
| [8] |
Miao Y, Ren GH, Jin ZY, et al. Progress on macrophages receptors of fungus polysaccharide[J]. Chin J Cell Biol (中国细胞生物学学报), 2017, 39: 675-680. |
| [9] |
Pu XY, Ma XL, Liu L, et al. Structural characterization and antioxidant activity in vitro of polysaccharides from angelica and astragalus[J]. Carbohydr Polym, 2016, 137: 154-164. DOI:10.1016/j.carbpol.2015.10.053 |
| [10] |
Wang SM, Zhao XL, Li J, et al. Research on the relationship between different molecular weight D-polymannuronicate and activity ratio of anti-FⅩa/anti-FⅡa[J]. Chin J Clin Pharmacol Ther (中国临床药理学杂志), 2013, 29: 695-697. |
| [11] |
Liu D. Study on the Preparation of A New Type and Ultra-Pure Low Molecular Weight Heparin (新型超纯低分子肝素的制备方法研究)[D]. Suzhou: Soochow University, 2010.
|
| [12] |
Zhang HT, Zhu L, Zhang S, et al. Mechanism of lentinan hydrolysis based on ESI-CID-MS/MS and preparation of full series of oligosaccharides[J]. Chem Res Chin Univ (高等学校化学学报), 2014, 35: 2329-2334. |
| [13] |
Li XX, Wu XL, Jia SL, et al. Effect of chitosan oligosaccharide on learning and memory functions and serum antioxidant status in a rat model of amyloid-β1-42-induced Alzheimer's disease[J]. Food Sci (食品科学), 2017, 38: 220-225. |
| [14] |
Miu YQ, Gu LP, Wu GR, et al. Advance in research on the hydrolysis of plant polysaccharide and product[J]. Chin Wild Plant Resour (中国野生植物资源), 2005, 24: 4-7. |
| [15] |
Li P, Li WY, Cao W, et al. Application progress of enzymolysis technology in the study of the structure and activity of polysaccharides[J]. Northwest Pharm J (西北药学杂志), 2015, 30: 433-436. |
| [16] |
Cao YX. Quality Comparison of Astragali Radix from Different Sources Based on Polysaccharide Structure and Immune Activity (基于多糖分子量分布和免疫活性比较的黄芪质量研究)[D]. Taiyuan: Shanxi University, 2020.
|
| [17] |
Li SY. Screening and Structure Study of the Active Polysaccharides of Astragalus Polysaccharides for Injection (注射用黄芪多糖中活性多糖的筛选及结构研究)[D]. Taiyuan: Shanxi University, 2020.
|
| [18] |
Cao YX, Li K, Qin XM, et al. Quality evaluation of different areas of Astragali Radix based on carbohydrate specific chromatograms and immune cell activities[J]. Acta Pharm Sin (药学学报), 2019, 54: 1277-1287. |
| [19] |
Liu QM, Xu SS, Li L, et al. In vitro and in vivo immunomodulatory activity of sulfated polysaccharide from Porphyra haitanensis[J]. Carbohydr Polym, 2017, 165: 189-196. DOI:10.1016/j.carbpol.2017.02.032 |
| [20] |
Yao YL, Yao J, Du ZY, et al. Structural elucidation and immune-enhancing activity of an arabinogalactan from flowers of Carthamus tinctorius L.[J]. Carbohydr Polym, 2018, 202: 134-142. DOI:10.1016/j.carbpol.2018.08.098 |
| [21] |
Xu W, Fang SJ, Cui XM, et al. Signaling pathway underlying splenocytes activation by polysaccharides from Atractylodis macrocephalae Koidz[J]. Mol Immunol, 2019, 111: 19-26. DOI:10.1016/j.molimm.2019.03.004 |
| [22] |
Wang YS, Zhang QF, Chen YC, et al. Antitumor effects of immunity enhancing traditional Chinese medicine[J]. Biomed Pharmacother, 2020, 121: 109570. DOI:10.1016/j.biopha.2019.109570 |
| [23] |
Yu Y, Song QQ, Huang LX, et al. Immunomodulatory activities of sulfated Cyclocarya paliurus polysaccharides with different degrees of substitution on mouse spleen lymphocytes[J]. J Funct Foods, 2020, 64: 103706. DOI:10.1016/j.jff.2019.103706 |
| [24] |
Wu J. Quality Control Method and Oligosaccharide Active Research of Propylene Glycol Alginate Sodium Sulfate (藻酸双酯钠的质量控制方法及寡糖活性研究)[D]. Qingdao: Ocean University of China, 2014.
|
| [25] |
Yang FF. Study on Identification of Traditional Chinese Medicines by the Application of Oligosaccharides from Polysaccharide Degradation Products (中药多糖控制降解寡糖在中药鉴定中的应用研究)[D]. Baoding: Hebei University, 2016.
|
| [26] |
Shi LX, Xiao YC, Xiao X, et al. Recent advances in the study on oligosaccharides from TCM[J]. Asia Pac Tradit Med (亚太传统医药), 2012, 8: 191-192. |
 2021, Vol. 56
2021, Vol. 56


