2. 中国医药工业研究总院, 上海益诺思生物技术股份有限公司, 上海 201203;
3. 上海健康医学院药学院, 上海 201318;
4. 复旦大学药学院, 上海 201203
2. Shanghai InnoStar Bio-Tech Co., Ltd., China State Institute of Pharmaceutical Industry, Shanghai 201203, China;
3. School of Pharmacy, Shanghai University of Medicine and Health Sciences, Shanghai 201318, China;
4. School of Pharmacy, Fudan University, Shanghai 201203, China
《2020年世界毒品报告》指出, 具有潜在危害的新型阿片类物质(如非洲曲马多和北美洲芬太尼类似物) 日益增多[1]。因该类物质制造简单、生产成本低或缺乏国际监管等原因, 使得这些物质在药品市场和非法市场上都有供应, 并难以发现和防止其滥用, 从而加剧了公共卫生危机[1]。因此, 非临床依赖性评价对于此类药物的滥用控制具有重要作用。各国指导原则指出, 对于此类物质以及所有作用于中枢神经系统的新药或原认为不具依赖性而在临床上发现有依赖性倾向的药物, 均要求进行非临床依赖性评价[2]。然而, 对于非临床依赖性评价, 国外早已建立了成熟的技术平台并已得到广泛应用, 而国内对此评价体系的研究仍处于初步探索阶段。其中, 非临床依赖性实验中的药物辨别实验是一种行为药理学实验, 可评价测试药物所产生的主观效应是否与已知的滥用药物(训练药物) 相似[3], 能够比较准确地评估待测药物依赖性倾向潜力。美国食品药品监督管理局(Food and Drug Administration, FDA) 依赖性相关指导原则建议, 在进行药物辨别实验评价药物依赖性时, 采用固定比率(fixed ratio, FR) 为10 (FR10) 的模式[3]。但是, 由于该实验相比于其他依赖性评价方法实验周期最长, 不利于新药研发转化的进程, 且相关报道在国内较少见并尚未得到普及, 因此选择合适的实验方法以缩短建模时长至关重要。另外, 在进行药物辨别实验时, 有研究者采用逐渐递增FR值或每4天递增2~5个FR值方式进行双杆辨别训练[4], 也有研究者在进行双杆训练前选择先进行10或12天的单杆训练[5]。基于上述原因, 本研究拟采用以上2种实验方法进行辨别训练, 以探究何种方法可缩短建模时长, 进而缩短整个实验周期。本实验选择了临床上广泛应用的经典阿片类药物吗啡作为阳性药物, 建立FR10模式下的吗啡药物辨别模型[6], 并进行剂量反应关系的测试以系统评估滥用潜力, 以期为阿片类药物的非临床依赖性评价和药物辨别实验方法的建立提供一定的经验基础及思路。
材料与方法药品与仪器 盐酸吗啡购自东北制药集团沈阳第一制药有限公司(批号为190501-2, 浓度10 mg·mL-1)。量取所需体积的吗啡, 加入生理盐水稀释至所需浓度, 混匀即可。由于吗啡遇光易变质, 故整个配制过程均需无菌避光进行。
MED药物辨别实验系统购自美国Med Associates公司(型号: MED-008-CT-01), 包括12个实验箱和1套控制软件(主程序软件为MED-PC-V), 每个实验箱均配有2个可伸缩的左右踏板、2个刺激灯、1个房灯、1个食物分配器和1个所对应的食槽。食物颗粒为F0021颗粒(购自于Bioserv公司), 包含常规营养成分, 每粒45 mg。
实验动物 40只雄性SD (Sprague-Dawley) 大鼠购自浙江维通利华实验动物技术有限公司, 使用许可证号: SYXK (沪) 2019-0009。购入时体重为200~220 g, 约6~8周龄。动物单笼饲养于通风良好的SPF (specified pathogen free) 级动物房, 每12 h明暗交替(暗周期为07:00~19:00), 饲养环境温度为20~26 ℃, 湿度为40%~60%。实验开始前使大鼠体重降至自由饮食时体重的85%[5, 7], 实验过程均在暗周期进行, 自由饮水, 每天限量喂食并于每次实验结束后加食约8~12 g, 以维持体重几乎不变, 并每周称重1次用于调整加食量和药量。动物福利和实验过程均遵循上海益诺思生物技术股份有限公司动物伦理委员会的规定。
食物训练 为快速建立辨别模型, 需进行食物训练, 让动物学会踩踏板, 建立踏板这一操作式反射行为。在食物训练开始之前, 需将40只大鼠禁食约18 h, 以提高动物的活动探索能力, 有助于提高食物训练的成功率。食物训练每日1次, 以每次30 min或30 min内获得50次食物奖励为1个实验期[8]。食物训练期间大鼠踩左踏板或者右踏板均可以获得食物奖励。食物训练从FR1开始, 当获得的奖励≥ 20时, 第2天选择每获得5次奖励FR值增加1的方式, 直到FR10为止。
每次实验结束, 记录FR值、总奖赏次数、总有效踏板次数。若在FR10条件下, 动物能连续2天在30 min内获得50次食物奖励, 则认为食物训练成功。未成功的动物可选择继续训练(最长可接受10天) 或者直接淘汰, 而成功的动物也可选择强化训练直到第10天, 若动物连续5天的奖赏次数均≤ 10次, 可提前结束训练予以淘汰。
不同方法下FR10药物辨别模型的建立 根据相关文献[5, 7], 直接进行双杆辨别训练, 即直接训练动物主动地建立药物与伴药杆、生理盐水与非伴药杆这一操作式联系; 或先进行单杆辨别训练, 即训练动物被动地建立此操作式联系, 再进行双杆辨别训练。2种方式均可建立辨别模型, 因此本研究采用了上述2种方式进行模型建立。将食物训练成功的大鼠随机分为2组, 分别为10天单杆辨别训练(仅左踏板或右踏板伸出) + 双杆辨别训练(2个踏板均伸出) 的组1和双杆辨别训练的组2, 进行如下训练。
单杆辨别训练 组1先进行10天单杆训练, FR值从10开始。放入实验箱前15 min大鼠腹腔注射5.6 mg·kg-1吗啡或生理盐水[9]; 每次训练30 min或30 min内获得50次食物奖励结束当日实验[8, 10]。以S代表生理盐水, D代表 5.6 mg·kg-1吗啡。当给予D时, 踩左踏板(伴吗啡杆) 10次获得1次食物奖励; 当给予S时, 踩右踏板(非伴吗啡杆) 10次获得1次食物奖励[5, 11]。辨别训练以6天为1个训练周期, 并以DSSDDS的顺序给药[7, 12]。完成10天单杆训练后进入下述的双杆辨别训练。
双杆辨别训练 组1 (完成10天单杆训练) 和组2均进行双杆辨别训练, 其中组1从FR10开始训练, 组2从FR1开始训练。两个组别均是放入实验箱前15 min大鼠腹腔注射5.6 mg·kg-1吗啡或生理盐水[9]; 每次训练30 min或30 min内获得50次食物奖励结束当日实验[8, 10]。当给予D时, 大鼠踩左踏板(伴吗啡杆) 获得奖励, 踩右踏板(非伴吗啡杆) 无奖励; 当给予S时, 大鼠踩右踏板(非伴吗啡杆) 获得奖励, 踩左踏板(伴吗啡杆) 无奖励, 训练频率依然按照DSSDDS的方式进行。当组2动物连续2天在30 min内获得50次奖赏且总正确踏板反应百分数≥ 80% (总正确踏板反应百分数/% =正确踏板次数/总踏板次数× 100), 认为动物在该FR模式下辨别良好, 此时将FR值按1、3、6、10的方式逐渐上调直至FR10。
当大鼠在FR10模式下, 连续10天中有8天同时满足以下标准, 则认为辨别训练成功, 即动物成功辨别伴吗啡杆或者非伴吗啡杆: ①获得第1次食物前正确踏板反应百分数≥ 80%; ②满足总正确踏板反应百分数≥ 80%[6, 10]。当动物首次满足辨别成功标准后, 再次进行10天的辨别训练(或称强化训练), 且该10天内需有8天同时满足上述2个标准, 不满足上述标准的动物继续训练或者予以淘汰。
替代测试 所有药物辨别训练成功的动物合并为1组进行替代测试。以T代表替代不同剂量的吗啡[0 (生理盐水)、0.1、0.5、1、3、5.6、10 mg·kg-1], 替代方式可按DSTSDT的顺序进行[13], 即D、S辨别训练各1天, 满足上述2个辨别训练标准后进行一个剂量吗啡的替代, 替代结束后再进行S、D辨别训练各1天, 再次满足上述2个辨别训练标准后进行下一个剂量吗啡的替代, 按此周期顺序直到所有剂量替代完成[7, 11, 13]。若替代前2天(D和S各1天) 内未满足上述2个辨别训练标准, 则需继续训练, 直到满足标准后方可替代。在替代测试期间2个踏板均为有效踏板, 以大鼠获得1次食物奖励或实验时间达到30 min而结束当日实验。1周最多进行2个剂量的替代, 且以上所有给药方式均是在放入实验箱前15 min进行腹腔注射药物。伴吗啡杆反应百分数/% =伴吗啡杆踏板次数/总踏板次数× 100, 反应率=总踏板次数/所消耗时间。
统计学分析 采用GraphPad Prism 8软件作图, 数据以均数±标准误[x±SEM (standard error of mean)] 方式表示。采用SPSS 21.0软件进行统计分析, 两组间比较采用独立样本t检验, 多组间比较采用单因素方差分析(ANOVA) 和Dunnett's t检验。P < 0.05为统计学上有显著差异。在剂量-伴吗啡杆反应百分数关系图中, 若某剂量下产生了完全替代(即伴吗啡杆反应百分数≥ 80%), 则可通过线性拟合的方式求出ED50值。
结果 1 辨别训练经过10天的食物训练, 有34只大鼠达到食物训练成功标准进入辨别训练。随后, 将其随机分成2组, 每组17只, 进行辨别训练。辨别训练期间, 组1和组2分别有14只和13只大鼠连续10天中有8天首次满足获得第1次食物前正确踏板反应百分数和总正确踏板反应百分数均≥ 80%, 用时分别为(40.71 ± 2.93) 和(51.15 ± 2.55) 天, 且与组1所用时间相比有统计学差异(P < 0.05)。首次满足辨别标准后又进行了至少10天的辨别训练(也称强化训练), 在整个辨别阶段中, 组1和组2的大鼠学习记忆曲线如图 1、2, 组1和组2满足辨别训练成功标准的时间范围分别为25~63和34~63天。从图 1和图 2中可以看出, 大鼠已形成稳定的辨别行为, 即给予吗啡时大鼠踩伴吗啡杆的反应百分数≥ 80%, 给予生理盐水时大鼠踩伴吗啡杆的反应百分数 < 20%, 表明已成功建立大鼠吗啡药物辨别模型。反应百分数均用获得第1次食物前的伴吗啡杆反应百分数表示, 其伴吗啡杆反应百分数/% =伴吗啡杆踏板次数/总踏板次数× 100。
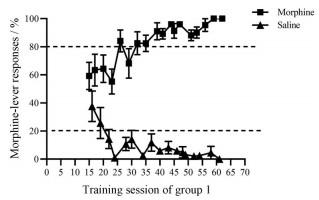
|
图 1 Learning curve of rats in group 1 trained to discriminate 5.6 mg·kg-1 morphine from saline. Each point is the mean percentage of morphine-lever responses with a standard error of mean (SEM) of 11 rats |
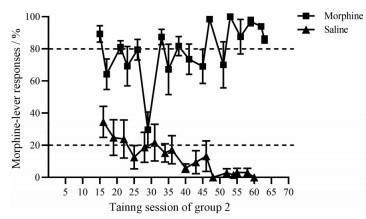
|
图 2 Learning curve of rats in group 2 trained to discriminate 5.6 mg·kg-1 morphine from saline. Each point is the mean percentage of morphine-lever responses with an SEM of 6 rats |
共有17只大鼠完成了0 (生理盐水)、0.1、0.5、1、3、5.6、10 mg·kg-1吗啡替代, 大鼠所产生的伴吗啡杆反应百分数与其剂量之间的关系如图 3所示(大鼠产生的伴吗啡杆反应百分数的个体数据见表 1), 可见吗啡产生的辨别刺激效应呈剂量依赖性增长趋势, 在替代剂量为5.6、10 mg·kg-1时, 大鼠产生的伴吗啡杆反应百分数与生理盐水相比有非常显著差异(P < 0.01), 且在剂量为5.6、10 mg·kg-1时产生了完全替代(伴吗啡杆反应百分数≥ 80%)。另外, 通过对剂量反应关系做线性拟合求得吗啡的ED50值为4.74 mg·kg-1。反应率与剂量之间的关系如图 4所示(大鼠产生的反应率个体数据见表 2), 当给予0.1 mg·kg-1吗啡时, 其反应率与生理盐水相比有显著差异(P < 0.05), 剂量为10 mg·kg-1时所产生的反应率低于生理盐水所产生的反应率, 表明无需进行更高剂量的替代, 因为更高剂量的吗啡将产生较显著的镇静作用, 并会抑制动物行为。

|
图 3 The relationship between the substitution dose and the percentage of morphine-lever responses. Symbols above "S" represent data collected after saline administration during a test session. Each point is the mean percentage of morphine-lever responses with an SEM of 17 rats. **P < 0.01 vs saline control |
| 表 1 The percentage of 17 Sprague-Dawley (SD) rats morphine-lever responses at substitution tests phase |
| 表 2 The response rates of 17 SD rats at substitution tests phase |
药物辨别实验是一种行为药理学实验, 包含3个阶段: 食物训练、辨别训练和替代测试。在辨别训练阶段常选已知具有依赖性或滥用倾向的药物(如吗啡、可卡因) 做训练药物进行建模, 后用不同剂量的待测药物进行替代, 以此评价待测药物是否产生与训练药物类似的行为反应[2]。FDA指导原则指出当大鼠踩伴药杆的反应百分数≥ 60%时, 表明待测药物与训练药物有相似的主观效应, 可能属于同类药物[3]。此外, 对于药物辨别实验国内外所采用的训练方法各有不同, 如在食物训练阶段, 有研究采用连续2天满足一定标准后FR值递增1或渐进递增FR值的方式[14]; 在辨别训练阶段, 有报道采用逐渐递增FR值或每4天递增2~5个FR值的方式进行双杆训练, 也有报道选择先进行10天单杆训练再进行双杆训练, 这些方式可能会对建模时长产生不同程度的影响[4, 5]。基于上述原因, 本研究采用双杆训练和10天单杆训练+ 双杆训练2种不同的方法进行实验, 并成功建立了不同方法下的FR10吗啡药物辨别模型。通过该项实验, 表明采用10天单杆训练+ 双杆训练的方式优于仅使用双杆训练的方式, 且与仅双杆训练所用时间相比有统计学差异(P ˂ 0.05)。产生上述结果的原因一方面可能是单杆训练会让大鼠被动地建立吗啡和伴吗啡杆、生理盐水和非伴吗啡杆的对应关系, 即初步意识到给予吗啡时应踩伴吗啡杆, 给予生理盐水时应踩非伴吗啡杆, 进而有利于在双杆训练时主动建立吗啡和伴吗啡杆、生理盐水和非伴吗啡杆的对应关系; 另一方面, 经历了单杆训练的大鼠, 在之后的双杆训练时, FR值是直接从FR10而不是从FR1开始的, 这种方式省去了FR值从1递增到10的过程, 进而缩短了部分辨别训练时间。另外, 首次满足辨别标准后再次进行至少10天强化训练, 可稳定辨别行为, 从而加快整个实验进程。
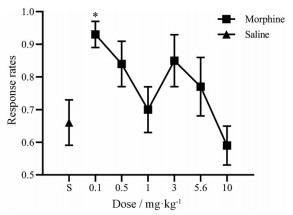
|
图 4 The relationship between the dose and the response rates. Symbols above "S" represent data collected after saline administration during a test session. Each point is the mean response rates with an SEM of 17 rats. *P < 0.05 vs saline control |
对于吗啡训练剂量, 起初采用30 min前皮下注射10 mg·kg-1吗啡进行辨别训练, 发现大鼠几乎不踩踏板, 后尝试腹腔15 min前给予10 mg·kg-1吗啡以及腹腔和皮下15 min前给予5.6 mg·kg-1吗啡, 发现仅腹腔15 min前给予5.6 mg·kg-1吗啡的大鼠踩踏板。产生上述现象的原因一方面可能是10 mg·kg-1吗啡产生了较大的镇静作用, 并且10 mg·kg-1吗啡和皮下注射5.6 mg·kg-1吗啡均抑制了动物行为。另一方面, 不同给药途径和剂量所产生吸收代谢速率不同, 进而产生不同的血药浓度, 造成大鼠内感受刺激有所不同, 故踩踏板状况不同[4]。此外, 有研究者选用3[4]、3.2[9, 15, 16]、5.6[9]和10 mg·kg-1[17]吗啡作为训练剂量, 且使用3.2和5.6 mg·kg-1吗啡作为训练剂量建立吗啡药物辨别模型所花费的时长基本相同[9]; 而且, 考虑到吗啡成瘾性相对可卡因和甲基苯丙胺较低, 较低和较高剂量均不利于模型的建立。综上所述, 最终采用腹腔15 min前给予5.6 mg·kg-1吗啡进行辨别训练。
辨别训练成功后用不同剂量的吗啡进行了替代测试, 从各替代剂量与伴吗啡杆反应百分数关系图(图 3) 中可见伴吗啡杆反应呈剂量依赖性增长, 在5.6和10 mg·kg-1时产生了与训练药物类似的主观效应并且产生了完全替代。另外, 有文献表明, 吗啡在人体和大鼠体内产生的主要代谢产物是吗啡-3-葡萄糖苷(morphine-3-glucuronide, M3G) 和吗啡-6-葡萄糖苷(morphine-6-glucuronide, M6G), 但仅代谢产物M6G与吗啡的辨别刺激效应相关, 而不同剂量的吗啡所产生的吸收代谢速率不同, 进而产生不同浓度的M6G, 造成大鼠内感受刺激有所不同, 故在不同剂量替代测试下产生的辨别刺激有所不同[4]。从剂量反应率关系图(图 4) 中可见, 10 mg·kg-1吗啡替代时所产生的反应率低于生理盐水, 表明无需进行更高剂量的替代, 因为更高剂量吗啡将会产生更大的镇静作用, 并且剂量越大, 对动物行为的抑制作用越大[18], 因此不应选此剂量作为训练剂量。
此外, 本研究建立的吗啡辨别模型可作为阿片类药物的精神依赖性评价研究的动物模型, 而且该模型也可为临床药物辨别试验设计提供一定的数据支持(如训练方式、给药时间、剂量设计等) 以及通过该模型可判定测试药物是否和训练药物类似, 进而为药政管理的分类/目录和说明书的撰写提供一定帮助。
综上所述, 本研究使用2种不同的方法成功建立了FR10吗啡辨别模型, 且实验结果表明, 在辨别训练时长和模型稳定性方面, 使用10天单杆训练+ 双杆训练的方式优于仅使用双杆训练, 且0~10 mg·kg-1吗啡诱导的辨别刺激效应呈剂量依赖性增长。是否有比使用10天单杆训练+ 双杆训练更优的训练方法以进一步缩短建模周期并保持模型稳定, 有待更深入的研究。
作者贡献: 邱云良负责实验指导及数据分析, 主导论文构思及修改; 张欢负责实验设计, 实验操作, 论文撰写、修改及投稿; 王舒哲、李贝贝、王翊名、刘小珍负责部分实验及论文修改; 陈华英负责论文修改及投稿。全体作者都阅读并同意最终的文本。
利益冲突: 本文作者声明没有利益冲突。
| [1] |
The United Nations Office on Drugs and Crime (UNODC) World Drug Report 2020[EB/OL]. (2020-06-25)[2020-11-21]. https://wdr.unodc.org/wdr2020/field/WDR20_BOOKLET_1.pdf.
|
| [2] |
Markgraf CG, Hudzik TJ, Compton DR. Nonclinical assessment of abuse potential for new pharmaceuticals[M]//Calderon S, Giarola A, Heal D. Regulatory Framework and Guidance to the Evaluation of the Abuse Liability of Drugs in the United States and Europe. London: Elsevier Inc., 2015: 245-268.
|
| [3] |
U.S. FDA. Guidance for industry: assessment of abuse potential of drugs[EB/OL]. (2017-01-18)[2020-11-21]. https://www.fda.gov/regulatory-information/search-fda-guidance-documents/assessment-abuse-potential-drugs.
|
| [4] |
Fujiwara A, Shimosawa M, Iino M, et al. Generalization tests using different dosing routes from those of drug discrimination training in rats[J]. J Toxicol Sci, 2018, 43: 451-458. DOI:10.2131/jts.43.451 |
| [5] |
Harvey EL, Baker LE. Differential effects of 3, 4-methylenedioxypyrovalerone (MDPV) and 4-methylmethcathinone (mephedrone) in rats trained to discriminate MDMA or a d-amphetamine + MDMA mixture[J]. Psychopharmacology (Berl), 2016, 233: 673-680. DOI:10.1007/s00213-015-4142-4 |
| [6] |
O'Connor EC, Chapman K, Butler P, et al. The predictive validity of the rat self-administration model for abuse liability[J]. Neurosci Biobehav Rev, 2011, 35: 912-938. DOI:10.1016/j.neubiorev.2010.10.012 |
| [7] |
Kueh D, Baker LE. Reinforcement schedule effects in rats trained to discriminate 3, 4-methylenedioxymethamphetamine (MDMA) or cocaine[J]. Psychopharmacology (Berl), 2007, 189: 447-457. |
| [8] |
Gauvin DV, McComb M, Code R, et al. Abuse liability assessment of hydrocodone under current draft regulatory guidelines[J]. J Pharmacol Toxicol Methods, 2015, 75: 118-129. DOI:10.1016/j.vascn.2015.05.003 |
| [9] |
Young AM, Masaki MA, Geula C. Discriminative stimulus effects of morphine: effects of training dose on agonist and antagonist effects of mu opioids[J]. J Pharmacol Exp Ther, 1992, 261: 246-257. |
| [10] |
Zimmermann ZJ, Gauvin DV, Poling A. Discriminative stimulus effects of cocaine-levamisole combinations in Sprague-Dawley rats[J]. J Psychopharmacol, 2018, 32: 900-910. DOI:10.1177/0269881118773545 |
| [11] |
Berquist MD, Thompson NA, Baker LE. Evaluation of training dose in male Sprague-Dawley rats trained to discriminate 4-methylmethcathinone[J]. Psychopharmacology (Berl), 2017, 234: 3271-3278. DOI:10.1007/s00213-017-4716-4 |
| [12] |
Suzuki T, Mori T, Tsuji M, et al. Interaction between discriminative stimulus effects of cocaine and morphine[J]. Jpn J Pharmacol, 1995, 67: 341-347. DOI:10.1254/jjp.67.341 |
| [13] |
Naylor JE, Freeman KB, Blough BE, et al. Discriminative-stimulus effects of second generation synthetic cathinones in methamphetamine-trained rats[J]. Drug Alcohol Depend, 2015, 149: 280-284. DOI:10.1016/j.drugalcdep.2015.02.002 |
| [14] |
Fu D, Chen Q, Liu HF, et al. The substitution effect of nicotine in heroin discriminative rats[J]. Chin J Behav Med Brain Sci (中华行为医学与脑科学杂志), 2012, 21: 385-388. |
| [15] |
Neelakantan H, Ward SJ, Walker EA. Discriminative stimulus effects of morphine and oxycodone in the absence and presence of acetic acid in male and female C57Bl/6 mice[J]. Exp Clin Psychopharmacol, 2015, 23: 217-227. DOI:10.1037/pha0000028 |
| [16] |
Li JX, Shah AP, Patel SK, et al. Modification of the behavioral effects of morphine in rats by serotonin (5-HT)1A and 5-HT2A receptor agonists: antinociception, drug discrimination, and locomotor activity[J]. Psychopharmacology (Berl), 2012, 225: 791-801. |
| [17] |
Gianutsos G, Lal H. Effect of loperamide, haloperidol and methadone in rats trained to discriminate morphine from saline[J]. Psychopharmacologia (Berl), 1975, 41: 267-270. DOI:10.1007/BF00428935 |
| [18] |
Craft RM, Clark JL, Hart SP, et al. Sex differences in locomotor effects of morphine in the rat[J]. Pharmacol Biochem Behav, 2006, 85: 850-858. DOI:10.1016/j.pbb.2006.11.022 |
 2021, Vol. 56
2021, Vol. 56


