2. 军事科学院军事医学研究院毒物药物研究所, 北京 100850
2. Institute of Pharmacology and Toxicology, Academy of Military Medical Sciences, Academy of Military Sciences, Beijing 100850, China
固有免疫反应是人体内的第一道防线, 对宿主有效抵抗外来病原微生物的入侵至关重要。模式识别受体(pattern recognition receptors, PRRs) 通过检测病原体相关分子模式(pathogen-associated molecular patterns, PAMPs) 和损伤相关分子模式(damage-associated molecular patterns, DAMPs), 启动下游对Ⅰ型干扰素(type Ⅰ interferons, IFNs) 和促炎细胞因子的反应[1]。微生物DNA和来自细胞核或线粒体的自身DNA是主要的PAMPs/DAMPs, 可被胞质DNA感受器, 如环磷酸鸟苷-腺苷合成酶(cyclic guanosine monophosphate-adenosine monophosphate synthase, cGAS) 识别[2-4]。由cGAS内源性产生或由细菌病原体合成的胞质环状二核苷酸(cyclic dinucleotides, CDNs) 激活干扰素基因刺激因子(stimulator of interferon genes, STING), 引发免疫反应[5, 6]。许多研究表明STING参与多种疾病的发生, STING的激活能够诱导有效的免疫反应, 对抗病原体感染和癌症; 而STING的异常激活会引发自身免疫性疾病和炎症性疾病[7, 8]。作为一个潜在的药物新靶点, STING的结构和功能也已经被广泛研究, 为发现和确定STING激动剂提供了理论基础。
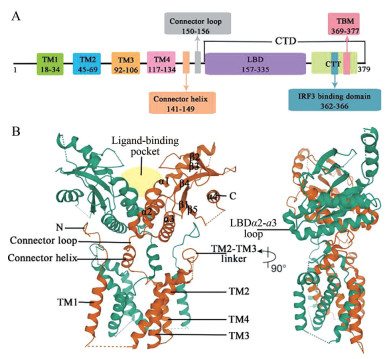
1 STING的结构STING的胞质部分以二聚体形式存在[9-11]。全长STING的结构直到2019年, 才由Shang等[12]利用冷冻电镜技术解析完全。人源STING (human STING, hSTING) 的结构如图 1, 包含一个跨膜的N末端结构域和一个球状的C末端结构域(C-terminal domain, CTD)[13]。N末端结构域分为4个跨膜的区域(transmembrane region 1~4, TM1~4), 主要负责将STING锚定于内质网膜或其他细胞器膜上。在STING二聚体中, TM1~4采用结构域交换结构, 其中一个亚基的TM1与另一个亚基的TM2、TM3和TM4组合在一起, 8个跨膜区组成两层: 两个亚基的TM2和TM4形成了中央层, 被外围的TM1和TM3包围[12]。CTD暴露在细胞质中, 包含配体与蛋白结合的区域(ligand-binding domain, LBD) 和C尾端结构域(C-terminal tail, CTT)。LBD包括4个α螺旋(LBDα1~α4) 和5个β折叠片层(LBDβ1~β5)[13]。连接TM4和LBDα1的连接子包括一个连接螺旋和一个连接环, 在二聚体中两个连接子形成右旋交叉, 使同一STING分子的TM和LBD分布在二聚体的对侧。TM2和TM3之间的连接桥、连接螺旋和LBD共同形成胞质和跨膜结构域之间的表面沟槽, TM1之前的N末端段位于这个沟槽中, 这种域间相互作用是一种保守的结构特征, 对蛋白质的稳定性和功能非常重要[12]。CTT与STING的胞质部分结合, 包含结合TANK结合激酶1 (TANK binding kinase 1, TBK1) 的基序(TBK1-binding motif, TBM) 和结合干扰素调节因子3 (interferon regulatory factor 3, IRF3) 的基序[14]。
|
图 1 The structure of hSTING. (A) A bridged view for structural and functional domains of hSTING. (B) Crystal structure of full-length hSTING by Cryo-Electron Microscopy (PDB: 6NT5) |
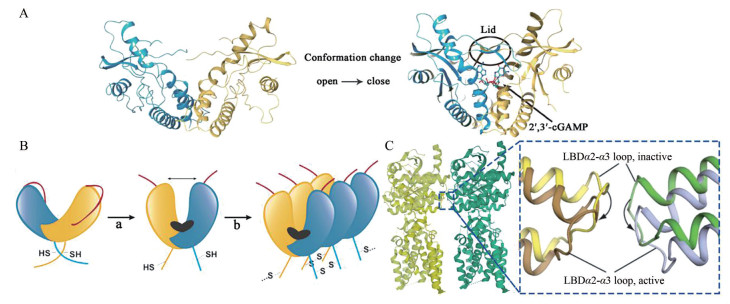
cGAS合成的2', 3'-环磷酸鸟苷-腺苷(2', 3'-cyclic GMP-AMP, 2', 3'-cGAMP) 结合STING后, 诱导LBD向配体结合口袋内旋, 由“V形”变为“U形”, 并且在结合口袋上方四个β折叠片层反向平行形成“盖子”结构, STING由“开放”构象转变为“闭合”构象(图 2A)[10]。然而, 这种构象变化如何导致STING的激活一直困扰着科学研究者。直到2019年, Shang等[12]和Ergun等[15]阐明了STING的激活机制。
|
图 2 Conformational changes in STING activation. (A) Conformational changes of hSTING when 2', 3'-cGAMP bound to it (PDB: 4EMU (left) and 4KSY (right)). (B) Cartoon model of STING activation. (C) LBDα2-α3 loop at the inactive and active STING tetramer (PDB: 6NT6) interface |
Shang等[12]发现2', 3'-cGAMP与LBD的结合诱导包括连接子、LBD和CTT在内的STING胞质部分相对于TM旋转180°, 使连接子的右旋交叉被解开, 同一STING亚基的LBD回到TM同侧, 形成肩并肩的STING二聚体(图 2B: a)。2', 3'-cGAMP与LBD的结合还导致LBDα2和LBDα3向下倾斜, 从而使STING二聚体间连接LBDα2和LBDα3的环(LBDα2-α3 loop)相互远离, 不再冲突(图 2C); 同时Ergun等[15]的研究补充证明2', 3'-cGAMP的结合会触发CTT的释放, 暴露STING聚合界面, 这两种构象变化使STING以二聚体为单位平行排布式的组装成聚合体(图 2B: b)。Ergun等[15]还发现STING聚合使Cys148形成二硫键来连接、稳定STING聚合体(图 2B: b)。STING聚合体的形成对后续反应至关重要。
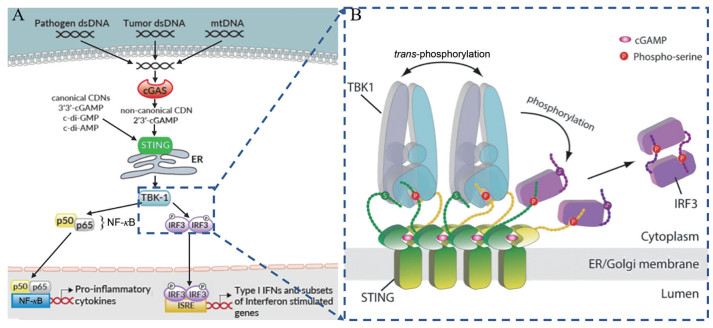
3 cGAS-STING通路STING是固有免疫中重要的信号分子, 介导胞质DNA诱导的固有免疫反应[16]。当DNA感受器cGAS检测到死细胞、肿瘤细胞或病原体释放的胞质双链DNA (double-stranded DNA, dsDNA), 以及泄漏于胞质的线粒体DNA (mitochondrial DNA, mtDNA) 时, cGAS催化ATP和GTP合成第二信使2', 3'-cGAMP, 直接激活内质网上的STING蛋白[3-6]。此外, STING还可以直接作为DNA感受器, 识别细菌携带的CDNs, 引发对病原体的固有免疫反应[17]。STING激活形成的聚合体招募下游的TBK1和IRF3, TBK1磷酸化IRF3, 激活IRF3二聚体进入细胞核, 诱导Ⅰ型IFN的表达(如IFN-β), 启动干扰素免疫应答[16]。另外, 转录因子核因子κB (nuclear factor kappa-B, NF-κB) 也可以被STING激活, 进入细胞核, 诱导促炎性细胞因子(如肿瘤坏死因子α(tumor necrosis factor-α, TNF-α) 和白细胞介素6 (interleukin 6, IL-6) 的表达(图 3A)[18]。STING通路分泌最多的细胞因子IFN-β不仅可以直接杀伤癌细胞, 还可以通过促进树突细胞的成熟来实现抗原的呈递, 从而将先天免疫应答与适应性免疫应答联系起来[19]。除了诱导细胞因子外, 一些研究发现诱导自噬过程也是cGAS-STING通路的基本功能, 在抗病毒防御中发挥着重要的作用[20, 21]。
|
图 3 The mechanism of cGAS-STING pathway. (A) Cartoon model of cGAS-STING pathway. (B) Cartoon model of STING-mediated activation of TBK1 and the downstream signalling pathway[14] |
2019年, Zhang等[14]用冷冻电镜方法阐明了活化的STING聚合体如何特异地招募TBK1和IRF3, 实现依赖TBK1的IRF3磷酸化。研究发现一个STING二聚体结合一个TBK1二聚体, 活化STING释放的CTT末端的TBM结合在TBK1二聚体界面的沟槽内, 从而实现STING对TBK1高亲和力的招募。在STING聚合体中, 多个TBK1二聚体聚集在一起, TBK1二聚体间进行反式自磷酸化。同时STING聚合体中只有一些STING二聚体的CTT招募TBK1, 邻近未结合TBK1的CTT的Ser366被TBK1磷酸化。STING磷酸化后的363LXIS366基序构成IRF3结合基序, 招募IRF3被TBK1磷酸化, 激活IRF3二聚体进入细胞核(图 3B)。
STING在抗病原体感染、抗肿瘤免疫反应和自身免疫性疾病中发挥重要作用[19]。因此2008年STING一经发现, 便成为免疫和肿瘤学的一个极具吸引力的靶标。研究者们大力开展了STING相关药物的研发, 通过激活或抑制STING信号通路达到不同的治疗目的。本文主要介绍STING激动剂的研究进展。
4 STING激动剂随着STING及其通路机制的深入研究, STING激动剂得到快速发展。研究者们不仅证明了具有抗病原微生物、抗肿瘤活性的天然CDNs、5, 6-二甲基呫吨酮-4-乙酸(5, 6-dimethylxanthenone-4-acetic acid, DMXAA) 和10-羧甲基-9-吖啶酮(10-carboxymethyl-9-acridanone, CMA) 为STING激动剂, 还通过高通量筛选得到了多种结构类型的STING激动剂。在进行激动剂作用机制研究时发现, 一些激动剂可以与STING结合, 称为直接STING激动剂; 而另一些激动剂不与STING结合, 称为间接STING激动剂, 其激活STING通路的机制不明, 可能与STING通路中任何阶段的蛋白发生作用, 甚至可能是激活其他通路发挥效应后, 再间接激活STING通路。
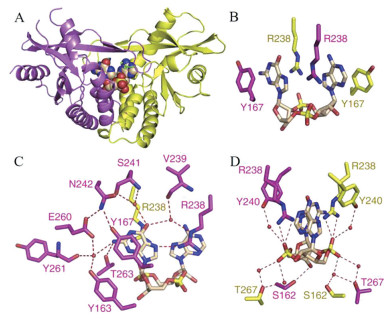
4.1 直接STING激动剂 4.1.1 环状二核苷酸类细菌产生的环二鸟嘌呤(cyclic dimeric GMP, c-di-GMP) (1)、环二腺嘌呤(cyclic dimeric AMP, c-di-AMP) (2)、3', 3'-环磷酸鸟苷-腺苷(3', 3'-cyclic GMP-AMP, 3', 3'-cGAMP) (3) 和哺乳动物由cGAS催化产生的2', 3'-cGAMP (4) (图 4) 是天然的CDNs类STING激动剂[22-24]。其中2', 3'-cGAMP与STING具有更广泛的相互作用, 形成更稳定的“闭合”二聚体构象(图 5A), 因此诱导更强的Ⅰ型IFNs反应[25]。2', 3'-cGAMP-hSTINGH232晶体结构中, 2', 3'-cGAMP位于STING二聚体的“U形”裂缝中, 核糖-磷酸位于底部, 嘌呤环平行向上, 嘌呤碱基位于Y167和R238之间(图 5B)[10]。R238在平面上对齐, 与一个嘌呤的N7形成氢键, 其胍基则堆叠在另一个嘌呤上(图 5C)。鸟苷NH2与T263、核糖3'-OH与S162、磷酸链与R238胍基形成直接氢键网络。N242、S241、V239、Y163、E260、Y261、T267和Y240与鸟苷O6、鸟苷NH2和磷酸链形成水介导的氢键网络(图 5C, D)。核糖2'-OH不参与氢键网络的形成, 因此含有3'-OH的2', 3'-cGAMP比其他天然CDNs与STING的结合亲和力更强。

|
图 4 Chemical structures of natural CDNs. a ITC (isothermal titration calorimetry) assay. b IFN reporter THP-1 cell-based assay. c THP1-Dual cell-based assay. d type Ⅰ IFN induction activities of compounds in human blood samples |
|
图 5 Crystal structure of 2', 3'-cGAMP-hSTINGH232 (PDB: 4LOH). (A) Crystal structure of 2', 3'-cGAMP-hSTINGH232. STING dimer is in yellow and purple. (B-D) The intermolecular interaction in 2', 3'-cGAMP-hSTINGH232. 2', 3'-cGAMP is in wheat. The direct and water-mediated hydrogen bonds are in #FF0000 |
然而, 天然CDNs相对较大的分子质量和强极性使其难以透过细胞膜, 细胞摄取不足, 且其磷酸二酯键易被酶水解, 代谢不稳定[26, 27], 这些因素一定程度上限制了其临床应用。因此研究者们对天然CDNs的磷酸二酯键、核糖和碱基三个部分进行了大量的结构改造(图 6), 以期改善其较差的膜渗透性、细胞摄取和代谢不稳定性, 从而提高生物活性。优化后, CDNs展现出更为有利的药代动力学特征, 其中的一些化合物已进入临床试验中。
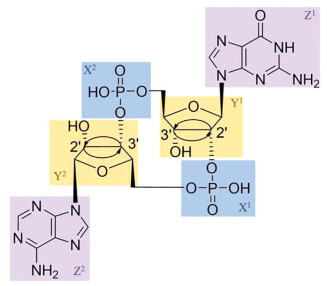
|
图 6 Three structural modification sites of natural CDNs: phosphate (X), ribose (Y) and base (Z). The skeleton is 2', 3'-cGAMP |
CDNs易受体内酶的水解, 对磷酸二酯键进行硫代(5, 6)、脲或硫脲(7, 8) (图 7) 取代可以增强化合物对水解酶的抗性[28-30]。Aduro与诺华公司合作开发的化合物6, Rp, Rp-2', 3'-c-diAMPSS (也称为ML-RR-S2-CDA、MIW815或ADUS100), 诱导IFN的效力明显高于2', 3'-cGAMP, 经瘤内注射, 可使小鼠肿瘤显著消退, 并提供长期免疫记忆[31]。6为第一个进入临床试验的非典型CDNs, 应用于晚期或转移性实体瘤或淋巴瘤(NCT02675439和NCT03172936) 和头颈部鳞状细胞癌(NCT03937141)。

|
图 7 Chemical structures of the substituted-phosphate CDNs. aSPA (scintillating proximity assay). bIFN reporter THP-1 cell-based assay. cTHP1-Dual cell-based assay |
在化合物6的核糖环上引入氟原子(9, 图 8), 其细胞通透性得到改善, 活性提高8倍[29]。默沙东(MERCK SHARP & DOHME, MSD) 和Immune Senor对2', 3'-cGAMP的核糖进行了结构改造, 分别得到活性增强的化合物10~14和抗水解的化合物15、16[32, 33]。其中化合物10、14、15与STING的结合亲和力比2', 3'-cGAMP稍强或相当, 而化合物11、16丧失了部分结合亲和力。MSD研制的MK-1454正在进行Ⅰ期临床试验, 初步数据显示, 单药治疗时无应答, 但与Keytruda联合治疗时产生部分应答(NCT03010176)。Aduro公司在CDNs核糖环上引入了锁核酸结构, 活性较好的化合物17、18的细胞渗透性比ADU-S100和2', 3'-cGAMP更好, 细胞吸收增强[34]。

|
图 8 Chemical structures of the substituted-ribose CDNs. aIFN reporter THP-1 cell-based assay. b 3H-cGAMP filtration binding assay. cThe relative bioactivities to 2', 3'-cGAMP were determined through detection of IFN-β from THP-1 cells |
Lioux等[35]设计并合成了由腺苷核苷和肌苷核苷组成的环磷酸腺苷-肌苷(cyclic adenosine-inosine monophosphate, cAIMP), 并且进行了核糖取代、核苷酸间连接位置和磷酸修饰。其中化合物19和20 (图 9) 活性最优, 均能较好地促进Ⅰ型IFN和促炎细胞因子的分泌和抵抗水解酶的水解。四种连接异构体中3', 3'连接对Ⅰ型IFNs的诱导作用最强, 这与cGAMP不同(3', 3'-cGAMP活性最弱[23])。硫代磷酸类似物比其对应的磷酸二酯类似物更能抵抗酶解, 这与Li等[28]的研究结果一致。施贵宝制药和武田公司则将2', 3'-cGAMP的嘌呤碱基替换为非碱基部分, 同时也进行了核糖和磷酸修饰, 其中化合物21、22激活THP1-Dual细胞的IRF通路活性较强[36, 37]。
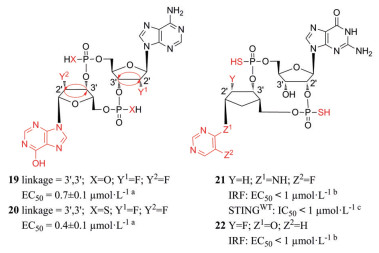
|
图 9 Chemical structures of the substituted-base CDNs. aType Ⅰ IFN induction activities of compounds in human blood samples. bTHP1-Dual cell-based assay. cHTRF (homogeneous time resolved fluorescence) binding assay |
黄酮-8-乙酸(flavone-8-acetic acid, FAA) (23, 图 10) 最初为一种非甾体抗炎药被发现, 20世纪80年代发现其抗肿瘤特性, 但在Ⅱ期临床试验中失败[38, 39]。呫吨酮-4-乙酸(xanthenone-4-acetic acid, XAA) (24) 是一种具有类似FAA结构的活性药物。2005年发现具有呫吨酮(又称氧杂蒽酮)结构的XAA的5, 6位二甲基取代产物DMXAA (也称为ASA404或vadimezan) (25) 可以激活NF-κB信号通路, 破坏肿瘤血管的发生, 2007年发现它还可以激活TBK1-IRF3信号通路[40, 41]。DMXAA和化疗药物紫杉醇、卡铂组成的联合疗法, 通过了治疗非小细胞肺癌的Ⅱ期临床试验, 但人体Ⅲ期临床试验宣告失败。20世纪80年代发现吖啶酮(又称氮蒽酮) 类化合物CMA (26) 是一种非常有效的Ⅰ型IFN诱导剂, 在防范啮齿动物病毒感染方面表现良好, 但同样在临床试验中失败[42, 43]。2013年研究发现DMXAA和CMA只能结合并激活鼠源STING (mouse STING, mSTING), 不与hSTING结合, 解释了临床失败的原因[44-46]。
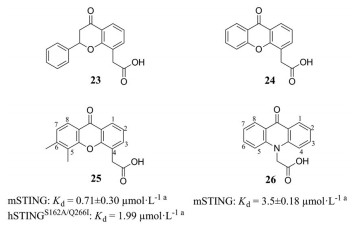
|
图 10 Chemical structures of FAA (flavone-8-acetic acid), XAA (xanthenone-4-acetic acid), DMXAA (5, 6-dimethylxanthenone-4-acetic acid) and CMA (10-carboxymethyl-9-acridanone). aITC assay |
DMXAA、CMA均诱导mSTING形成“闭合”构象, 且与mSTING的分子间作用十分相似(图 11)[47, 48]。两个化合物分子位于mSTING二聚体结合口袋, 芳香环平行排列, 酮基与T266直接形成氢键, C10位O/N与T262结合, 羧基与T262、R237形成直接氢键、与Y239通过水分子形成氢键, DMXAA的5、6位甲基与L169和I234侧链形成疏水性区域(图 11A, B)。Gao等[47]还发现hSTING结合口袋的Q266I和S162A突变, “盖子”上G230I的突变, 均可增强DMXAA对hSTING的敏感性, 三者之间是互助促进的关系。DMXAA-hSTINGS162A/Q266I晶体结构中, I266侧链与侧链I165、L170和I235一起形成疏水性区域, 将DMXAA的5、6位甲基和未取代的7位牢牢包裹起来, A162侧链与DMXAA另一侧芳香环边缘也发生了疏水性相互作用(图 11C)。因此DMXAA的双甲基和羧酸可能为活性必须, 且对C1/C2 (对应Q266I突变) 和C7位(对应S162A突变) 进行结构改造, 可能会恢复DMXAA对hSTING的敏感性。由于CMA与DMXAA的相似性, 推测CMA也可进行类似结构改造。
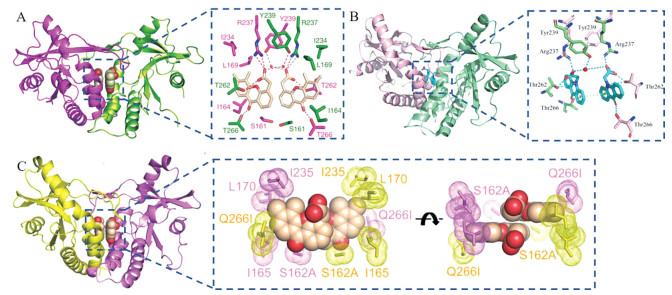
|
图 11 Crystal structure of DMXAA, CMA bound to STING. (A) Crystal structure and intermolecular interaction of DMXAA-mSTING (PDB: 4LOL). STING dimer is in magenta and green, DMXAA is in wheat. (B) Crystal structure and intermolecular interaction of CMA-mSTING (PDB: 4JC5). STING dimer is in pink and light green, CMA is in turquoise. (C) Crystal structure and hydrophobic interactions of DMXAA-hSTINGS162A/Q266I (PDB: 4QXQ). STING dimer is in yellow and purple, DMXAA is in wheat |
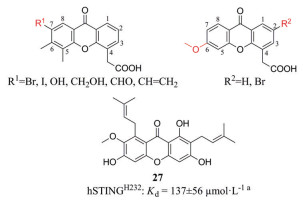
根据晶体复合物结构, 人们对DMXAA进行了结构改造(图 12)。Hwang等[49]设计了C7位具有极性基团的DMXAA衍生物, 遗憾的是没有得到与不同的hSTING突变体特异性结合的化合物。本课题组在DMXAA的C2位修饰疏水性的基团, 保留5, 6位双甲基的结构或者仅在C6位修饰甲氧基, 但也没有获得能与hSTING结合的DMXAA衍生物[50]。从山竹子果壳中分离出的呫吨酮类α-倒捻子素(27)能结合、激活hSTINGH232和hSTINGR232, 但只能小程度的激活mSTING, 其诱导IFN-β水平高于2', 3'-cGAMP, 且能够将人单核细胞来源的M2巨噬细胞重新极化为M1表型, 可能具有抗肿瘤、抗病毒作用[51, 52]。
|
图 12 Chemical structures of DMXAA derivatives. aDSF (differential scanning fluorimetry) assay |
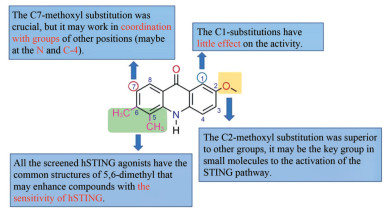
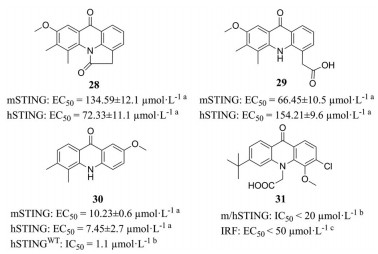
本课题组参照DMXAA的结构在CMA的5, 6位引入了双甲基、将N原子上的羧基转移至C4位, 在C1、C2和C7的一处或多处取代卤素原子或甲氧基, 并分析了构效关系(图 13)[50]。其中化合物28、29和30 (图 14) 对hSTING和mSTING均能有效激活。最优化合物30可以有效激活STING-IRF3和STING-NF-κB两个通路, 且对NF-κB途径的激活效应比2', 3'-cGAMP更强。Silicon Swa公司也合成了数百种带有CMA衍生物[53]。通过亲和力结合试验和细胞实验, 得到最优化合物31。对CMA的成功改造说明吖啶酮类在治疗肿瘤或病毒感染方面有巨大潜力。未来对于吖啶酮类激动剂的改造, 可以在化合物30的N、C4和C7的位置修饰适宜的基团, 增强活性; 也可以将两个活性小分子通过共价连接, 形成CDNs模拟物, 以增强与STING的结合亲和力, 提高活性。
|
图 13 The structure-activity relationship of 30[50] |
|
图 14 Chemical structures of CMA derivatives. a293-Dual cell assay. bHTRF binding assay. cTHP1-Dual cell-based assay |
2018年, 葛兰素史克(GlaxoSmithKline, GSK) 通过筛选与3H-cGAMP竞争结合STING CTD的小分子, 发现氨基苯并咪唑类化合物32(图 15), 是第一种有效的、非核苷酸类、同时激活mSTING和hSTING的STING激动剂[54]。不同于2', 3'-cGAMP, 化合物32激活STING的同时保持“开放”的STING构象(图 16A), 对“闭合”构象使STING蛋白激活的观点提出了质疑。晶体复合物结构表明两分子化合物32与一个STING蛋白二聚体结合, 甲基与L159和T267残基形成疏水性区域(图 16B), 吡唑N与S162的羟基形成氢键, 中间酰胺与T263形成氢键, 末端酰胺与S241形成氢键网络(位于STING开放的“盖子”区) (图 16C)。
|
图 15 Chemical structures of amidobenzimidazole compounds. a 3H-cGAMP filtration binding assay. bChemoproteomic analysis of THP-1 cell lysates with LC-MS/MS. cType Ⅰ IFN induction activities of compounds in PBMC. d THP1-Dual cell-based assay |

|
图 16 Crystal structure of 32-STING (PDB: 6DXG). (A) Crystal structure of 32-STING. STING dimer is in green and purple[54]. (B-C) The intermolecular interaction in 32-STING. 32 is in green and purple. STING in (B) is shown in monomer and in white |
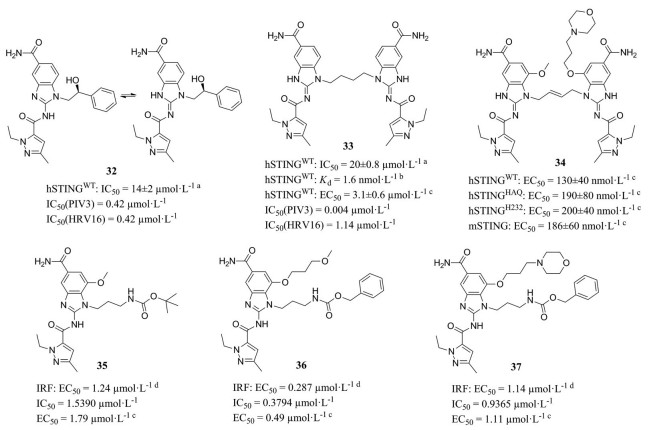
化合物32的N1位羟苯乙基与STING蛋白没有相互作用, 且两分子的N1在空间上很接近, 因此, 在N1位通过连接桥合成二聚化合物33, 其结合能力提升了近1 000倍。通过进一步的优化, 化合物34的结合亲和力和诱导IFN-β分泌的活性进一步提高, 小鼠静脉给药后产生持久的抗肿瘤作用。另外, Xi等[55]选择了四个修饰位点(R1、R2、R3、R4) 对化合物32进行优化, 其构效关系如图 17。其中化合物35、36和37在THP1-Dual细胞荧光实验显示出微摩尔激动剂活性。结肠肿瘤小鼠静脉注射化合物37, 有显著的抗肿瘤作用。

|
图 17 The structure-activity relationship of 32 |
Zhu等[56]研究了化合物32和33的抗病毒活性, 发现其对呼吸道RNA病毒: 副流感病毒3型(parainfluenza virus 3, PIV3) 和人鼻病毒16 (human rhinovirus, HRV16) 表现强大的抗病毒活性, 而且有两种不同的抗病毒机制。抗PIV3依赖于Ⅰ型IFN应答, 而抗HRV16则需要依赖自噬相关基因5 (autophagy-related gene 5, ATG5) 的自噬, 抗PIV3病毒的效应强于抗HRV16病毒效应, 延迟治疗起始时间点, 会显著降低抗HRV16病毒的活性。
4.1.4 3-咪唑-哒嗪类Chin等[57]以含有IRF荧光素酶报告基因的THP-1细胞为研究对象, 筛选了大约100万个小分子, 并在敲除STING或cGAS的ISG-THP1细胞系进行二次试验, 以确定通路特异性和潜在的靶标。其中3-咪唑-哒嗪类化合物38 (图 18) 依赖STING作用于cGAS的下游。进一步研究表明38为一种前药, 在体外不与STING直接结合, 在进入细胞后迅速转化为化合物39, 从而发挥作用。39在体外可以结合STING, 但在细胞检测中无活性, 可能的原因是酯取代赋予化合物细胞通透性, 而羧酸使化合物可以结合STING。结构优化得到含二氟取代的化合物40(SR-717), 与38具有同等的细胞活性, 而且在体外与常见hSTING突变型和mSTING结合。小鼠皮下注射SR-717后具有抗肿瘤活性(疗效优于抗PD-1或抗PD-L1治疗)、促进相关组织中CD8+T、自然杀伤细胞和树突状细胞的活化、促进抗原的交叉免疫。

|
图 18 Chemical structures of 3-imidazole-pyridazine compounds. aTHP1-Dual cell-based assay. bTSA (Thermal Shift Assay). cHTRF assay |
晶体复合物结构表明两分子SR-717结合在STING二聚体裂缝中, 形成“闭合”构象。对比SR-717-hSTINGWT和2', 3'-cGAMP-hSTING的晶体结构, 发现SR-717的结合模式与2', 3'-cGAMP相似(图 19A)。两个SR-717的哒嗪环位于结合2', 3'-cGAMP的两个嘌呤位置, 位于Y167和R238之间, 羧酸位于结合2', 3'-cGAMP的磷酸链位置。T263侧链羟基与一个SR-717分子的羧酸和另一个分子的酰胺羰基形成氢键作用, R238的胍基侧链与羧酸形成直接氢键。另外SR-717与V239、S241、N242和Y240形成水介导的氢键网络(图 19B)。因此SR-717是一种稳定的2', 3'-cGAMP模拟物, 可能具有相似的抗肿瘤免疫活性。
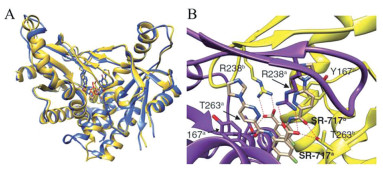
|
图 19 Crystal structure of SR-717-hSTINGWT (PDB: 6XNP)[57]. (A) Superposition of the structure of SR-717-hSTINGWT and 2', 3'-cGAMP-hSTING (PDB: 4KSY), shown as yellow or blue ribbon representations, respectively. (B) The intermolecular interaction in SR-717-hSTINGWT. STING dimer is in yellow and purple, the key residues are in sticks. SR-717 is in wheat |
IFN-β的分泌是STING激活的一个重要作用, 因此MSD选择表达hSTINGHAQ的THP-1细胞, 筛选能诱导IFN-β分泌的化合物, 最终从大约240万个化合物中筛出了少量分子[58]。化合物41(MSA-2, 图 20) 在溶液中以单体和非共价二聚体两种形式存在, 处于平衡状态, 其非共价二聚体结合、激活STING。MSA-2共价二聚体(如化合物42) 也能与2', 3'-cGAMP竞争结合STING、诱导IFN-β分泌。MSA-2诱导80%至100%的结肠癌小鼠肿瘤完全消退, 并且诱导长期的抗肿瘤免疫, 和抗PD-1抗体联合治疗在抑制肿瘤生长和延长生存方面优于单药治疗, 并且是第一种能够口服给药的STING激动剂。

|
图 20 Chemical structures of benzothiophene compounds. aThe relative bioactivities to 2', 3'-cGAMP were determined through detection of IFN-β from THP-1 cells. bTHP1-Dual cell-based assay. c 3H-cGAMP filtration binding assay |
MSA-2是一种弱酸, 在酸性肿瘤微环境中MSA-2的细胞进入和保留增加。皮下或口服给药后, 肿瘤中MSA-2浓度高于血浆或其他非肿瘤组织, 细胞因子水平的增加在肿瘤中有更高的趋势。这种优先靶向肿瘤的特性对于系统性给药的STING激动剂的抗肿瘤活性和耐受性非常关键。
MSA-2-hSTINGHAQ晶体结构显示, 两分子MSA-2与hSTINGHAQ结合, 形成“闭合”构象(图 21A)。MSA-2除与周围的几条侧链形成水分子介导的相互作用外, 酮基与邻近STING亚基的R238胍基形成氢键, 羧酸基团与邻近STING亚基的T263和另一STING亚基的R238侧链形成氢键(图 21B)。羧酸基团与STING的这种相互作用是MSA-2特有的, 能使复合物二聚体产生非共价交联并稳定构象。
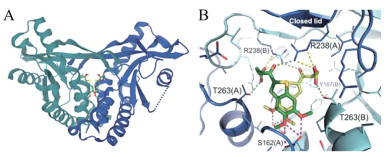
|
图 21 Crystal structure of MSA-2-hSTINGHAQ (PDB: 6UKM). (A) Crystal structure of MSA-2-hSTINGHAQ. STING dimer is in grayish green and blue-purple. (B) The intermolecular interaction in MSA-2-hSTINGHAQ. MAS-2 is in green[58] |
Hou等[59]通过基于结构的虚拟筛选和荧光偏振(fluorescence polarization, FP) 实验筛选得到STING激动剂: 化合物43、44和45 (图 22)。结构改造得到的化合物46依赖STING诱导THP-1细胞和小鼠BMDMs细胞中IFN-β、CXCL-10和IL-6的mRNA表达, 以及STING、TBK1和IRF3的磷酸化。化合物46溶解度和膜通透性有待进一步优化。

|
图 22 Chemical structures of triazoloquinoxaline compounds. aFP assay. bTHP-1 blue ISG cell assay |
DeFilippis课题组通过体外THF-ISRE细胞(荧光信号反应依赖IRF3的Ⅰ型IFN的转录) 高通量筛选从51 632个化合物中得到化合物47 (G10)、48 (C11)、49 (M04) (图 23)[60-62]。三种化合物具有相似的活性和作用机制, 激活THFs细胞和原代细胞PBMCs中IRF3的磷酸化、依赖IRF3的IFN应答, 同时在小鼠RAW264.7细胞中无法检测到相关活性, 且都不与STING CTD结合, 因此可能为间接hSTING激动剂。另外, C11、M04、G10都对表达hSTINGHAQ的THP-1细胞没有活性, 因此人们还研究了不同hSTING突变型对化合物活性的影响。结果表明G10对R232和H232突变型更有效, 对HAQ突变型的活性较低, 对AQ和Q突变型几乎没有活性[63]; M04能激活R232、H232突变型, 对HAQ仅能微弱地激活[61]。G10和C11对多种病毒有抑制作用[60, 62, 64]。
|
图 23 Chemical structures of 47-49 |
Chang课题组建立了一种高通量筛选方法, 化合物刺激HepAD38/cGAS-STING/ISG54Luc和HepAD38/cGAS-STINGΔC/ISG54Luc (不表达STING的C末端区域) 细胞系后, 只诱导前者荧光素酶表达, 可以反映化合物对cGAS和/或STING的激活。该团队分别在2017年和2019年筛选得到的化合物50(DSDP) 和51(BNBC) (图 24) 在缺乏cGAS和表达mSTING的细胞中没有活性, 为hSTING激动剂[65, 66]。DSDP和BNBC可以有效抑制黄热病病毒(yellow fever virus, YFV)、登革病毒(Dengue virus, DENV) 和寨卡病毒(Zika virus, ZIKV) 的复制。此外, BNBC可有效诱导树突状细胞的成熟, 因此可能调节CD4+和CD8+ T淋巴细胞的激活, 有利于慢性病毒感染和肿瘤治疗。
|
图 24 Chemical structures of 50 and 51 |
近年来, 对STING激动剂的研究取得了突破性进展, 但是开发结构更多样、更具有成药性的STING激动剂仍面临着严峻的挑战。首先, STING激动剂主要作为抗菌、抗病毒和抗肿瘤药物, 然而研究发现一些病毒可以通过抑制STING通路的反应, 保护其免受宿主免疫防御, 因此该类病毒可能对STING激动剂有严重的耐药性[67, 68]。另外, Lemos等[69]研究发现STING激活可诱导吲哚胺-2, 3-双加氧酶(indoleamine-2, 3-dioxygenase, IDO) 的产生, 促进低抗原性肿瘤的生长, 因此对STING激动剂耐受。Tu等[70, 71]总结了cGAS-STING通路对肿瘤的促进和抑制作用, 并发现淫羊藿素能够抑制黑色素瘤的转移。其次, STING具有单核苷酸多态性(single nucleotide polymorphism, SNP), 目前已发现5种hSTING突变型: R232 (58%)、HAQ (20%)、H232 (13%)、AQ (7%)和Q (2%)[72]。不同突变型对同一STING激动剂的敏感性不同, 例如, hSTINGR232对c-di-GMP产生强烈响应, 而hSTINGH232对c-di-GMP不响应[73]。因此人们期待发现能激活hSTING大部分突变型的小分子。第三, STING的过度激活会引起细胞因子的持续产生, 导致无法控制的炎症和细胞因子风暴、组织毒性、自身免疫和促进肿瘤生长的炎症性肿瘤微环境[74]。因此需要准确控制STING激动剂的剂量, 在发挥药效的同时, 最大限度地降低免疫毒性。第四, 由于STING在免疫细胞和非免疫细胞中广泛表达, 所以STING激动剂系统性给药时也会诱导正常组织产生炎性细胞因子, 因此目前进行临床试验的STING激动剂采用瘤内注射给药, 这限制了它们的应用[54]。需要开发可系统性给药且具有靶向性的稳定型STING激动剂(如化合物41)。第五, STING从“开放”到“闭合”的构象变化是否为STING激活仍需进一步的研究, 以期为STING激动剂研发提供新思路。总的来说, STING已经成为一个突出的药物靶点, 其激动剂的研发、以及在治疗感染和癌症方面的应用有广阔的前景。
作者贡献: 常佳佳负责文献查阅, 论文撰写和图片处理; 侯石和闫心林负责论文格式和内容合理性的初步检查; 肖军海提供撰写思路和论文最终审核。
利益冲突: 所有作者均无相关利益冲突。
| [1] |
Takeuchi O, Akira S. Pattern recognition receptors and inflammation[J]. Cell, 2010, 140: 805-820. DOI:10.1016/j.cell.2010.01.022 |
| [2] |
Roers A, Hiller B, Hornung V. Recognition of endogenous nucleic acids by the innate immune system[J]. Immunity, 2016, 44: 739-754. DOI:10.1016/j.immuni.2016.04.002 |
| [3] |
Sun L, Wu J, Du F, et al. Cyclic GMP-AMP synthase is a cytosolic DNA sensor that activates the type Ⅰ interferon pathway[J]. Science, 2013, 339: 786-791. DOI:10.1126/science.1232458 |
| [4] |
Wu J, Sun L, Chen X, et al. Cyclic GMP-AMP is an endogenous second messenger in innate immune signaling by cytosolic DNA[J]. Science, 2013, 339: 826-830. DOI:10.1126/science.1229963 |
| [5] |
Ablasser A, Goldeck M, Cavlar T, et al. cGAS produces a 2'-5'-linked cyclic dinucleotide second messenger that activates STING[J]. Nature, 2013, 498: 380-384. DOI:10.1038/nature12306 |
| [6] |
Cai X, Chiu YH, Chen ZJ. The cGAS-cGAMP-STING pathway of cytosolic DNA sensing and signaling[J]. Mol Cell, 2014, 54: 289-296. DOI:10.1016/j.molcel.2014.03.040 |
| [7] |
Li T, Cheng H, Yuan H, et al. Antitumor activity of cGAMP via stimulation of cGAS-cGAMP-STING-IRF3 mediated innate immune response[J]. Sci Rep, 2016, 6: 19049. DOI:10.1038/srep19049 |
| [8] |
Gao D, Li T, Li XD, et al. Activation of cyclic GMP-AMP synthase by self-DNA causes autoimmune diseases[J]. Proc Natl Acad Sci U S A, 2015, 112: E5699-E5705. DOI:10.1073/pnas.1516465112 |
| [9] |
Ouyang S, Song X, Wang Y, et al. Structural analysis of the STING adaptor protein reveals a hydrophobic dimer interface and mode of cyclic di-GMP binding[J]. Immunity, 2012, 36: 1073-1086. DOI:10.1016/j.immuni.2012.03.019 |
| [10] |
Gao P, Ascano M, Zillinger T, et al. Structure-function analysis of STING activation by c[G(2', 5') pA(3', 5')p] and targeting by antiviral DMXAA[J]. Cell, 2013, 154: 748-762. DOI:10.1016/j.cell.2013.07.023 |
| [11] |
Chin KH, Tu ZL, Su YC, et al. Novel c-di-GMP recognition modes of the mouse innate immune adaptor protein STING[J]. Acta Crystallogr, Sect D: Struct Biol, 2013, 69: 352-366. DOI:10.1107/S0907444912047269 |
| [12] |
Shang G, Zhang C, Chen ZJ, et al. Cryo-EM structures of STING reveal its mechanism of activation by cyclic GMP-AMP[J]. Nature, 2019, 567: 389-393. DOI:10.1038/s41586-019-0998-5 |
| [13] |
Shang G, Zhu D, Li N, et al. Crystal structures of STING protein reveal basis for recognition of cyclic di-GMP[J]. Nat Struct Mol Biol, 2012, 19: 725-727. DOI:10.1038/nsmb.2332 |
| [14] |
Zhang C, Shang G, Gui X, et al. Structural basis of STING binding with and phosphorylation by TBK1[J]. Nature, 2019, 567: 394-398. DOI:10.1038/s41586-019-1000-2 |
| [15] |
Ergun SL, Fernandez D, Weiss TM, et al. STING polymer structure reveals mechanisms for activation, hyperactivation, and inhibition[J]. Cell, 2019, 178: 290-301. DOI:10.1016/j.cell.2019.05.036 |
| [16] |
Abe T, Harashima A, Xia T, et al. STING recognition of cytoplasmic DNA instigates cellular defense[J]. Mol Cell, 2013, 50: 5-15. DOI:10.1016/j.molcel.2013.01.039 |
| [17] |
Yin Q, Tian Y, Kabaleeswaran V, et al. Cyclic di-GMP sensing via the innate immune signaling protein STING[J]. Mol Cell, 2012, 46: 735-745. DOI:10.1016/j.molcel.2012.05.029 |
| [18] |
Ishikawa H, Barber GN. STING is an endoplasmic reticulum adaptor that facilitates innate immune signalling[J]. Nature, 2008, 455: 674-678. DOI:10.1038/nature07317 |
| [19] |
Motwani M, Pesiridis S, Fitzgerald KA. DNA sensing by the cGAS-STING pathway in health and disease[J]. Nat Rev Genet, 2019, 20: 657-674. DOI:10.1038/s41576-019-0151-1 |
| [20] |
Gui X, Yang H, Li T, et al. Autophagy induction via STING trafficking is a primordial function of the cGAS pathway[J]. Nature, 2019, 567: 262-266. DOI:10.1038/s41586-019-1006-9 |
| [21] |
Rasmussen SB, Horan KA, Holm CK, et al. Activation of autophagy by alpha-herpesviruses in myeloid cells is mediated by cytoplasmic viral DNA through a mechanism dependent on stimulator of IFN genes[J]. J Immunol, 2011, 187: 5268-5276. DOI:10.4049/jimmunol.1100949 |
| [22] |
Burdette DL, Monroe KM, Sotelo-Troha K, et al. STING is a direct innate immune sensor of cyclic di-GMP[J]. Nature, 2011, 478: 515-518. DOI:10.1038/nature10429 |
| [23] |
Zhang X, Shi H, Wu J, et al. Cyclic GMP-AMP containing mixed phosphodiester linkages is an endogenous high-affinity ligand for STING[J]. Mol Cell, 2013, 51: 226-235. DOI:10.1016/j.molcel.2013.05.022 |
| [24] |
Li XD, Wu J, Gao D, et al. Pivotal roles of cGAS-cGAMP signaling in antiviral defense and immune adjuvant effects[J]. Science, 2013, 341: 1390-1394. DOI:10.1126/science.1244040 |
| [25] |
Diner EJ, Burdette DL, Wilson SC, et al. The innate immune DNA sensor cGAS produces a noncanonical cyclic dinucleotide that activates human STING[J]. Cell Rep, 2013, 3: 1355-1361. DOI:10.1016/j.celrep.2013.05.009 |
| [26] |
Gao J, Tao J, Liang W, et al. Identification and characterization of phosphodiesterases that specifically degrade 3'3'-cyclic GMP-AMP[J]. Cell Res, 2015, 25: 539-550. DOI:10.1038/cr.2015.40 |
| [27] |
Corrales L, McWhirter SM, Dubensky TW, et al. The host STING pathway at the interface of cancer and immunity[J]. J Clin Invest, 2016, 126: 2404-2411. DOI:10.1172/JCI86892 |
| [28] |
Li L, Yin Q, Kuss P, et al. Hydrolysis of 2'3'-cGAMP by ENPP1 and design of nonhydrolyzable analogs[J]. Nat Chem Biol, 2014, 10: 1043-1048. DOI:10.1038/nchembio.1661 |
| [29] |
Katibah GE, Kanne D, Sung L, et al. Compositions and methods for activating stimulator of interferon gene-dependent signalling: WO 2017075477[P]. 2017-05-04.
|
| [30] |
Glick G, Ghosh S, Roush WR, et al. Cyclic dinucleotide analogs for treating conditions associated with STING (stimulator of interferon genes) activity: WO 2018045204[P]. 2018-03-08.
|
| [31] |
Corrales L, Glickman LH, McWhirter SM, et al. Direct activation of STING in the tumor microenvironment leads to potent and systemic tumor regression and immunity[J]. Cell Rep, 2015, 11: 1018-1030. DOI:10.1016/j.celrep.2015.04.031 |
| [32] |
Altman MD, Andresen BM, Chang W, et al. Cyclic di-nucleotide compounds as STING agonists: WO 2017027645[P]. 2017-02-16.
|
| [33] |
Chen C, Chen Z, Dai Y, et al. Cyclic di-nucleotide compounds and methods of use: WO 2017161349[P]. 2017-09-21.
|
| [34] |
Kanne DB, Ndubaku CO, Bruml JR, et al. Locked nucleic acid cyclic dinucleotide compounds and uses thereof: WO 2018009466[P]. 2018-01-11.
|
| [35] |
Lioux T, Mauny MA, Lamoureux A, et al. Design, synthesis, and biological evaluation of novel cyclic adenosine-inosine monophosphate (cAIMP) analogs that activate stimulator of interferon genes (STING)[J]. J Med Chem, 2016, 59: 10253-10267. DOI:10.1021/acs.jmedchem.6b01300 |
| [36] |
Fink BE, Zhao Y, Chen L, et al. Cyclic dinucleotides as anticancer agents: WO 2019079261[P]. 2019-04-25.
|
| [37] |
Vyskocil S, Ciavarri J, Cullis C, et al. STING modulator compounds, and methods of making and using: WO 2019092660[P]. 2019-05-16.
|
| [38] |
Corbett TH, Bissery MC, Wozniak A, et al. Activity of flavone acetic acid (NSC-347512) against solid tumors of mice[J]. Invest New Drugs, 1986, 4: 207-220. |
| [39] |
Kerr DJ, Kaye SB. Flavone acetic acid-preclinical and clinical activity[J]. Eur J Cancer Clin Oncol, 1989, 25: 1271-1272. DOI:10.1016/0277-5379(89)90072-2 |
| [40] |
Woon ST, Reddy CB, Drummond CJ, et al. A comparison of the ability of DMXAA and xanthenone analogues to activate NF-κB in murine and human cell lines[J]. Oncol Res, 2005, 15: 351-364. DOI:10.3727/096504005776449743 |
| [41] |
Roberts ZJ, Goutagny N, Perera PY, et al. The chemotherapeutic agent DMXAA potently and specifically activates the TBK1-IRF-3 signaling axis[J]. J Exp Med, 2007, 204: 1559-1569. DOI:10.1084/jem.20061845 |
| [42] |
Taylor JL, Schoenherr CK, Grossberg SE. High-yield interferon induction by 10-carboxymethyl-9-acridanone in mice and hamsters[J]. Antimicrob Agents Chemother, 1980, 18: 20-26. DOI:10.1128/AAC.18.1.20 |
| [43] |
Taylor JL, Schoenherr C, Grossberg SE. Protection against Japanese encephalitis virus in mice and hamsters by treatment with carboxymethylacridanone, a potent interferon inducer[J]. J Infect Dis, 1980, 142: 394-399. DOI:10.1093/infdis/142.3.394 |
| [44] |
Kim S, Li L, Maliga Z, et al. Anticancer flavonoids are mouse-selective STING agonists[J]. ACS Chem Biol, 2013, 8: 1396-1401. DOI:10.1021/cb400264n |
| [45] |
Conlon J, Burdette DL, Sharma S, et al. Mouse, but not human STING, binds and signals in response to the vascular disrupting agent 5, 6-dimethylxanthenone-4-acetic acid[J]. J Immunol, 2013, 190: 5216-5225. DOI:10.4049/jimmunol.1300097 |
| [46] |
Cavlar T, Deimling T, Ablasser A, et al. Species-specific detection of the antiviral small-molecule compound CMA by STING[J]. EMBO J, 2013, 32: 1440-1450. DOI:10.1038/emboj.2013.86 |
| [47] |
Gao P, Zillinger T, Wang W, et al. Binding-pocket and lid-region substitutions render human STING sensitive to the species-specific drug DMXAA[J]. Cell Rep, 2014, 8: 1668-1676. DOI:10.1016/j.celrep.2014.08.010 |
| [48] |
Zhang H, Han MJ, Tao J, et al. Rat and human STINGs profile similarly towards anticancer/antiviral compounds[J]. Sci Rep, 2015, 5: 786-791. |
| [49] |
Hwang J, Kang T, Lee J, et al. Design, synthesis, and biological evaluation of C7-functionalized DMXAA derivatives as potential human-STING agonists[J]. Org Biomol Chem, 2019, 17: 1869-1874. DOI:10.1039/C8OB01798K |
| [50] |
Hou S, Lan XJ, Li W, et al. Design, synthesis and biological evaluation of acridone analogues as novel STING receptor agonists[J]. Bioorg Chem, 2020, 95: 103556. DOI:10.1016/j.bioorg.2019.103556 |
| [51] |
Zhang Y, Sun Z, Pei J, et al. Identification of α-mangostin as an agonist of human STING[J]. ChemMedChem, 2018, 13: 2057-2064. DOI:10.1002/cmdc.201800481 |
| [52] |
Downey CM, Aghaei M, Schwendener RA, et al. DMXAA causes tumor site-specific vascular disruption in murine non-small cell lung cancer, and like the endogenous non-canonical cyclic dinucleotide STING agonist, 2'3'-cGAMP, induces M2 macrophage repolarization[J]. PLoS One, 2014, 9: e99988. DOI:10.1371/journal.pone.0099988 |
| [53] |
Chamberlain BT, Rice JM, Jernigan FE, et al. Oxoacridinyl acetic acid derivatives and methods of use: WO 2019100061[P]. 2019-05-23.
|
| [54] |
Ramanjulu JM, Pesiridis GS, Yang J, et al. Design of amidobenzimidazole STING receptor agonists with systemic activity[J]. Nature, 2018, 564: 439-443. DOI:10.1038/s41586-018-0705-y |
| [55] |
Xi Q, Wang M, Jia W, et al. Design, Synthesis, and biological evaluation of amidobenzimidazole derivatives as stimulator of interferon genes (STING) receptor agonists[J]. J Med Chem, 2020, 63: 260-282. DOI:10.1021/acs.jmedchem.9b01567 |
| [56] |
Zhu Q, Hu H, Liu H, et al. A synthetic STING agonist inhibits the replication of human parainfluenza virus 3 and rhinovirus 16 through distinct mechanisms[J]. Antiviral Res, 2020, 183: 104933. DOI:10.1016/j.antiviral.2020.104933 |
| [57] |
Chin EN, Yu C, Vartabedian VF, et al. Antitumor activity of a systemic STING-activating non-nucleotide cGAMP mimetic[J]. Science, 2020, 369: 993-999. DOI:10.1126/science.abb4255 |
| [58] |
Pan BS, Perera SA, Piesvaux JA, et al. An orally available non-nucleotide STING agonist with antitumor activity[J]. Science, 2020, 369: 935. |
| [59] |
Hou H, Yang R, Liu X, et al. Discovery of triazoloquinoxaline as novel STING agonists via structure-based virtual screening[J]. Bioorg Chem, 2020, 100: 103958. DOI:10.1016/j.bioorg.2020.103958 |
| [60] |
Sali TM, Pryke KM, Abraham J, et al. Characterization of a novel human-specific STING agonist that elicits antiviral activity against emerging alphaviruses[J]. PLoS Pathog, 2015, 11: e1005324. DOI:10.1371/journal.ppat.1005324 |
| [61] |
Abraham J, Botto S, Mizuno N, et al. Characterization of a novel compound that stimulates STING-mediated innate immune activity in an allele-specific manner[J]. Front Immunol, 2020, 11: 1430. DOI:10.3389/fimmu.2020.01430 |
| [62] |
Gall B, Pryke K, Abraham J, et al. Emerging alphaviruses are sensitive to cellular states induced by a novel small-molecule agonist of the STING pathway[J]. J Virol, 2018, 92: e01913-e01917. |
| [63] |
Banerjee M, Middya S, Shrivastava R, et al. G10 is a direct activator of human STING[J]. PLoS One, 2020, 15: e0237743. DOI:10.1371/journal.pone.0237743 |
| [64] |
Ming SL, Zeng L, Guo YK, et al. The human-specific STING agonist G10 activates type Ⅰ interferon and the NLRP3 inflammasome in porcine cells[J]. Front Immunol, 2020, 11: 575818. DOI:10.3389/fimmu.2020.575818 |
| [65] |
Liu B, Tang L, Zhang X, et al. A cell-based high throughput screening assay for the discovery of cGAS-STING pathway agonists[J]. Antiviral Res, 2017, 147: 37-46. DOI:10.1016/j.antiviral.2017.10.001 |
| [66] |
Zhang X, Liu B, Tang L, et al. Discovery and mechanistic study of a novel human-stimulator-of-interferon-genes agonist[J]. ACS Infect Dis, 2019, 5: 1139-1149. DOI:10.1021/acsinfecdis.9b00010 |
| [67] |
Wu J, Chen ZJ. Innate immune sensing and signaling of cytosolic nucleic acids[J]. Annu Rev Immunol, 2014, 32: 461-488. DOI:10.1146/annurev-immunol-032713-120156 |
| [68] |
Huang J, You H, Su C, et al. Herpes simplex virus 1 tegument protein VP22 abrogates cGAS/STING-mediated antiviral innate immunity[J]. J Virol, 2018, 92: e00841-18. |
| [69] |
Lemos H, Mohamed E, Huang L, et al. STING promotes the growth of tumors characterized by low antigenicity via IDO activation[J]. Cancer Res, 2016, 76: 2076-2081. DOI:10.1158/0008-5472.CAN-15-1456 |
| [70] |
Tu SM, Liu YP, Chen Y. Research progress of cGAS-STING in tumor metastasis[J]. Acta Pharm Sin (药学学报), 2020, 55: 398-406. |
| [71] |
Tu SM, Liu YP, Chen Y. Inhibition of exosomes-mediated melanoma metastasis by icaritin[J]. Acta Pharm Sin (药学学报), 2021, 56: 778-785. |
| [72] |
Yi G, Brendel VP, Shu C, et al. Single nucleotide polymorphisms of human STING can affect innate immune response to cyclic dinucleotides[J]. PLoS One, 2013, 8: e77846. DOI:10.1371/journal.pone.0077846 |
| [73] |
Wu X, Wu FH, Wang X, et al. Molecular evolutionary and structural analysis of the cytosolic DNA sensor cGAS and STING[J]. Nucleic Acids Res, 2014, 42: 8243-8257. DOI:10.1093/nar/gku569 |
| [74] |
Barber GN. STING: infection, inflammation and cancer[J]. Nat Rev Immunol, 2015, 15: 760-770. DOI:10.1038/nri3921 |
 2021, Vol. 56
2021, Vol. 56


