美国《A Cancer Journal For Clinicians》于2018年发布的一份全球癌症统计数据报告显示, 每年原发性肝癌约有841 000例新发病例和782 000例死亡病例, 已成为全球第六大常见癌症, 死亡率高居第四的癌症[1]。国家癌症中心于2019年发表的报告显示我国肝癌的发病率居全国各类恶性肿瘤第四位, 死亡率更是高达第二位[2]。肝癌可分为: ①原发性肿瘤, 如肝细胞癌(hepatocellular carcinoma, HCC)、肝内胆管癌(intrahepatic cholangiocarcinoma, ICC)、纤维层状癌和肝母细胞瘤(儿童早期肝肿瘤); ②从其他肿瘤(如结直肠癌、胰腺癌、胃癌、乳腺癌和卵巢癌等) 的转移细胞中获得的继发性肿瘤。在这些肿瘤中, HCC是最常见的, 并且在过去几十年中发病率不断上升[3]。
常规的化疗对原发性肝癌的治疗效果较差, 肝癌的系统治疗可以说是从2007年多激酶抑制剂索拉非尼(sorafenib) 被FDA批准用于晚期肝癌开始, 索拉非尼将患者的总生存期提高了3个月[4]。2017年瑞戈非尼(regorafenib) 被FDA批准上市用于治疗接受过索拉非尼无效的肝癌患者, 用于肝癌二线治疗。2018年乐伐替尼(lenvatinib) 被FDA批准用于一线不可切除的肝癌患者。同时, 免疫治疗药物如纳武单抗(nivolumab) 和派姆单抗(pembrolizumab) 通过阻断程序死亡受体1/细胞程序性死亡-配体1 (PD-1/PD-L1) 细胞信号通路治疗肝癌, 也分别于2017和2018年被FDA批准为晚期肝癌二线治疗药物。但目前肝癌患者的五年生存率仍然非常低, 迫切需要开发新的治疗药物, 给患者长期生存带来希望。
成纤维细胞生长因子受体4 (fibroblast growth factor receptor 4, FGFR4) 是一种酪氨酸激酶受体, 选择性结合成纤维细胞因子19 (fibroblast growth factor 19, FGF19), 进行二聚化和自磷酸化, 通过激活磷脂酰肌醇3激酶/蛋白激酶B (PI3K/AKT)、有丝分裂原细胞外激酶/胞外信号调控激酶(MEK-ERK) 以及糖原合成酶激酶-3/β-链蛋白(GSK3β/β-catenin)等通路促进肿瘤细胞的增生、促进上皮细胞-间充质转化(EMT)、抑制肿瘤细胞凋亡[5]。研究发现, FGF19与其受体FGFR4的过表达会上调早期生长反应基因-1 (Egr-1)、即刻早期基因(c-Fos)、白细胞介素-6 (IL-6) 和结缔组织生长因子(CTGF), 诱导肝癌细胞增殖[6-8]。同时, 通过激活GSK3β/β-catenin信号通路, 促进肝癌发生EMT; 活化转化生长因子β (TGF-β), 促进肝癌的侵袭和转移[9]。另外, 过度表达的FGF19可以抑制索拉非尼诱导肝癌细胞生成活性氧(ROS), 因此, 过度表达的FGF19能下调ROS信号, 促进细胞生存, 抑制细胞凋亡, 是索拉非尼耐药的机制之一[10]。FGF19-FGFR4复合物的异常信号通路已被证实是HCC的致癌驱动因素[11]。因此, FGFR4被认为是一个肝癌的新的潜在治疗靶点。几种具有不同选择性和结合模式的小分子FGFR抑制剂已经被开发并进入临床试验, 用于治疗HCC和其他具有异常FGFR4信号转导的实体肿瘤[12]。本文对正在进行临床试验研究的FGFR抑制剂的药效团、结合模式、临床研究进展以及药物优化策略进行了详细的说明。
1 FGFR4的结构和配体 1.1 FGFR4的结构FGFR4是FGFR家族的一员, 是RTKs超家族的重要成员, 在胚胎发育、组织修复、肿瘤血管生成和肿瘤进展中发挥关键作用。人类FGFR4基因位于5号染色体上, 长度约为11.3 kb。FGFR4蛋白由两个完整的FGFR4转录本编码而来, 包括802个氨基酸(amino acid, aa), 分子量在95~110 kDa[13]。FGFR4蛋白中的802个氨基酸核心区域包含4个部分: 信号肽(1~21 aa)、细胞外区域(22~369 aa)、跨膜区域(70~390 aa) 和细胞内区域(391~802 aa)(图 1)[14]。FGFR4的细胞外结构域由3个免疫球蛋白样结构域(IgI~IgIII) 组成。IgI和IgII之间存在一个富含丝氨酸的序列, 称为酸盒(acid box), 与IgI结构域一起抑制FGFR与配体的结合[15]。IgII和IgIII支持与配体结合并确定配体的特异性。基于IgIII区域的C-末端部分的可变剪接, FGFR1~3可被剪接为IIIb和IIIc两种亚型, 而在FGFR4中目前只发现IIIc一种亚型[16]。因此, FGFR4的单配体结合域使其与特定配体的高亲和结合成为可能, 这意味着有可能开发高度特异性的FGFR4抑制剂。
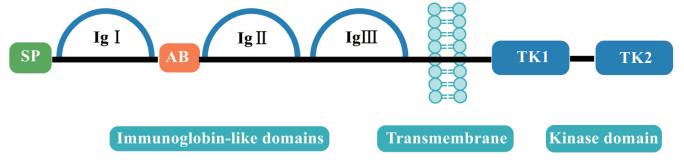
|
Figure 1 Schematic structure overview of fibroblast growth factor receptor 4 (FGFR4). SP: Signal peptide; AB: Acid box; TK: Tyrosine kinase domain |
FGFR4的细胞内激酶结构域是由一个N-端小叶和一个C-端大叶组成, N-端由5股反平行式的β-折叠(β1~β5) 和一个α-螺旋结构组成, C-端由7个α-螺旋结构组成(αD, αE, αEF, αF~αI) (图 2)[17]。ATP和底物蛋白结合的活性位点位于两个叶瓣之间的铰链区上(hinge), 其中在守门人氨基酸后两个位点(GK+2) 是一个保守性较差的氨基酸, 在FGFR1~3为体积较大的酪氨酸, 在FGFR4为体积较小的半胱氨酸(C552), 因此该位点可被用作开发FGFR4选择性抑制剂。
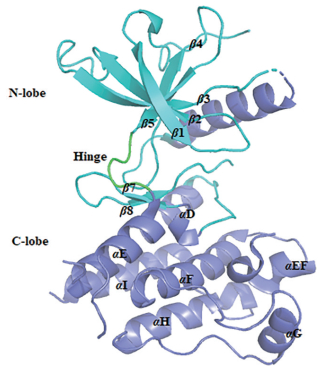
|
Figure 2 Structure of the FGFR4 kinase domain |
人类FGF家族由22个成员组成, 这些因子与多种生物学功能密切相关, 包括细胞生长和分化、血管生成、胚胎发育、伤口愈合和修复等, 按照其序列和生化功能分为7个亚家族, 包括FGF1、FGF4、FGF7、FGF8、FGF9、FGF19亚家族和FGF11亚家族[18]。FGF11亚家族(FGF11~14) 又被称为胞内分泌FGFs, 这些因子在细胞内分泌, 它们不与FGFRs相互作用, 其主要作用是调节神经元和其他可兴奋细胞(如心肌细胞) 的电兴奋性。FGF1亚家族(FGF1和2)、FGF4亚家族(FGF4~6)、FGF7亚家族(FGF3、7、10和12)、FGF8亚家族(FGF8、17和18)、FGF9亚家族(FGF9、16和20) 被称为旁分泌FGFs, 旁分泌FGFs可以借助肝素/硫酸肝素与FGFR结合。FGF19亚家族(FGF15/19、21和23) 被称为内分泌FGFs, 与旁分泌FGFs不同的是需要与一个跨膜蛋白β-klotho形成共受体才能结合于FGFR4。FGF19基因位于染色体11q13, 小鼠中的FGF15是人类FGF19基因的同源基因[19]。FGF19最初在回肠中被发现, 是由从胆囊分泌到小肠的胆汁酸, 激活法尼酯衍生物X受体(FXR), 从而刺激回肠分泌的内分泌激素[20]。FGF19主要在胆汁酸合成、胆囊充盈、糖原合成、糖异生和蛋白质合成中发挥作用。Nicholes等[21]在转基因小鼠中证明过表达的FGF19与肝脏发育不良有关。
2 FGFR4的下游信号通路β-Klotho与FGFR4相互作用, 形成1∶1的复合体, 促进FGF19和FGFR4之间的结合。随后FGF19与β-klotho和FGFR4的复合体结合形成同源二聚体受体复合物, 激活下游信号通路[22]。在受体二聚体化后, 激酶结构域从之前的非活性状态转变为活性状态, 并催化ATP上γ-磷酸转移到蛋白酪氨酸残基上, 实现受体的自磷酸化, 激活其酪氨酸激酶活性。活化的FGFR又与胞内的激酶互相靠近, 相互磷酸化, 从而激活下游一系列的相关信号通路。成纤维细胞生长因子受体底物2 (FRS2) 是一类接头蛋白, 在FGF/FGFR的信号传导中起着非常重要的作用。FRS2首先被活化的FGFR磷酸化, 进而招募生长因子受体结合蛋白(GRB2), GRB2蛋白一方面可以直接激活PI3K/AKT通路; 另外可以通过结合鸟苷释放蛋白(SOS), 促使GRB2/SOS的结合, 激活下游的丝裂原活化蛋白激酶(RAS-RAF-MEK-ERK) 通路。此外, 活化的FGFR还可以磷酸化胞内的Janus激酶(JAK), 激活Janus激酶/信号传导和转录激活因子(JAK/STAT) 通路; 以及磷酸化磷脂酶Cγ (PLCγ), 产生二酰基甘油(DAG) 并活化蛋白激酶C (PKC), 进而参与细胞的一些生化反应调控, 以及细胞核内的转录、基因表达等(图 3)[23]。
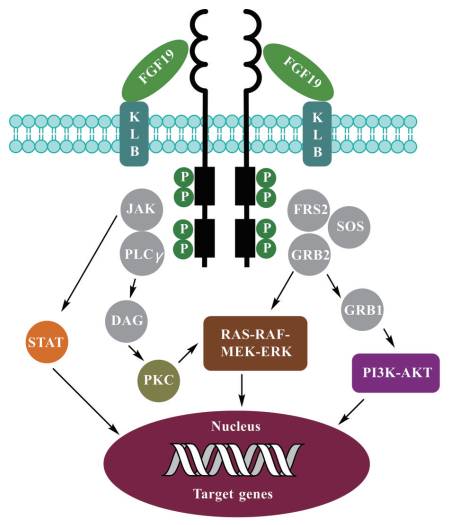
|
Figure 3 FGF19-FGFR4 mediated signaling pathway. FGF19: Fibroblast growth factor 19; KLB: β-Klotho; JAK: Janus kinase; FRS2: Fibroblast growth factor receptor substrate 2; SOS: Son of sevenless; PLCγ: Phosphoinositide-specific phospholipase γ; GRB2: Growth factor receptor-bound protein 2; DAG: Diacylglycerol; GRB1: Growth factor receptor-bound protein 1; STAT: Signal transducers and activators of transcription; PKC: Protein kinase C; RAS: Ras protein; RAF: Raf protein; RMEK: Mitogen extracellular kinase; ERK: Extracellular signal-regulated kinase; PI3K: Phosphatidyl inositol-kinase; AKT: Protein kinase B |
FGFR4在肝脏癌变中的重要性在体外和体内均已得到证实。Nicholes等[21]首先证明了在骨骼肌中过表达FGF19的转基因小鼠在其生命早期会发生多发性HCC, 而其他组织则不会受到影响。后来, Wu等[24]发现FGF19通过激活FGFR4增加肝细胞增殖而诱导肝癌。Gauglhofer等[25]研究表明, FGFR4在体外的上调促进了肝细胞癌的侵袭性和致瘤性, 同时通过小干扰RNA (siRNA) 下调FGFR4, 抑制了肝细胞癌的癌变和侵袭。French等[26]培育了敲除FGFR4的FGF19转基因小鼠, 发现只有FGFR4野生型小鼠可以发展成肝细胞癌, 证实了FGFR4对于FGF19介导的癌变是必要的。同时, 还用免疫组织化学法发现33%的肝细胞癌患者的FGFR4呈增高趋势, 并通过定性实时聚合酶链反应(qRT-PCR) 在23个样本中证实, 在30%的肿瘤中FGFR4过表达这一现象。此外, FGF19及其受体FGFR4已被证明通过调节GSK3β/β-catenin信号级联参与肝癌细胞的EMT过程[27]。这些数据表明, 靶向FGF19/FGFR4介导的信号转导为肝癌治疗提供了一种新的有希望的策略。
4 FGFR抑制剂类型及其治疗肝癌现状从目前小分子FGFR抑制剂的临床试验情况来看, 已有一些小分子抑制剂进入临床研究, 其中有8个药物已上市, 这些上市的药物有6个为多靶点的RTKs抑制剂, 包括安洛替尼(anlotinib, 2018年)、仑伐替尼(lenvatinib, 2015年)、尼达尼布(intedanib, 2014年)、瑞戈非尼(regorafenib, 2012年)、普纳替尼(ponatinib, 2012年) 和培唑帕尼(pazopanib, 2009年), 2个为FGFR抑制剂厄达替尼(erdafitinib, 2019年) 和培米替尼(pemigatinib, 2020年), 而其他化合物则处于临床试验、临床前研究和生物活性测试阶段。由于激酶结构域具有相似性, 以上多靶点的RTKs抑制剂对FGFR也有一定抑制活性, 但同时也出现了较为严重的毒副作用, 为了克服脱靶效应, 针对FGFR高选择性和高亲和性的小分子抑制剂的研发显得尤为重要。目前, 随着FGFR靶点研究的深入和FGFR 4种亚型三维蛋白结构的报道, 使得选择性靶向于FGFR的抑制剂的设计成为可能。下面将FGFR抑制剂分为pan-FGFR抑制剂、FGFR4抑制剂和靶向FGFR单克隆抗体3种类型, 并对此展开详细说明(表 1)。
| Table 1 FGFR inhibitors in different phases of clinical trials |
pan-FGFR抑制剂包括已上市的厄达替尼(erdafitinib) 和培米替尼(pemigatinib); 进行临床Ⅲ期研究的TAS-120、BAY-1163877、AZD4547、BGJ398; 进行临床Ⅱ期研究的AM-001、ARQ-087、LY2874455、ICP-192、CH5183284、E-7090和HMPL-453; 进行临床Ⅰ期研究的EDP-317、CPL304110、PRN-1371、HH-185和BPI-17509。pan-FGFR抑制剂是根据FGFR激酶域ATP结合口袋进行设计的, 通过与ATP竞争结合ATP活性口袋与RTK结构域结合来抑制激酶活性, 与RTKs抑制剂相比, 高血压和心血管相关的不良反应减少, 然而在报道的早期临床试验中显示, pan-FGFR抑制剂的常见毒性为高磷酸盐血症和口腔炎。下面将对几种pan-FGFR抑制剂展开概述。
4.1.1 厄达替尼(erdafitinib)厄达替尼是强生通过虚拟片段筛选研发的一种喹喏啉母核的pan-FGFR抑制剂, 对于FGFR1~4的半抑制浓度(half maximal inhibitory concentration, IC50) 分别为1、2、3和6 nmol·L-1, 同时也抑制血管内皮生长因子受体-2 (vascular endothelial growth factor receptor 2, VEGFR2), 其IC50值为36.8 nmol·L-1[28]。2019年4月, 获FDA批准上市用于膀胱癌, 膀胱癌迎来了第一个靶向药, 也成为第一个获批上市的FGFR药物。对FGFR3突变或FGFR2/3融合的尿路上皮癌患者, 厄达替尼治疗的有效率为40%, 其中3%达到完全缓解, 37%达到部分缓解[29]。然而, 一项I期临床试验(NCT017034810) 显示, 剂量限制毒性为肝毒性(AST/ALT > 3), 最常见的不良反应是高磷血症, 60%的患者会出现高磷血症[30]。厄达替尼-FGFR1共晶结构[31] (PDB ID: 5EW8, 图 4) 显示, 厄达替尼的喹喏啉母核与铰链区的A564形成一个氢键, 3, 5-二甲氧基苯基侧链占据铰链区向里的疏水口袋, 甲基吡唑从铰链区伸向溶剂端, 主要跟靶蛋白形成疏水作用, 而异丙胺侧链伸入铰链区向下的口袋, 异丙胺的N-H与D641也有一个氢键作用。目前, 厄达替尼正在进行食管癌、非小细胞肺癌、胆管癌和尿路上皮癌的临床Ⅱ期研究(NCT02699606), 以及肝细胞癌的临床Ⅰ/Ⅱ期研究(NCT02421185)。
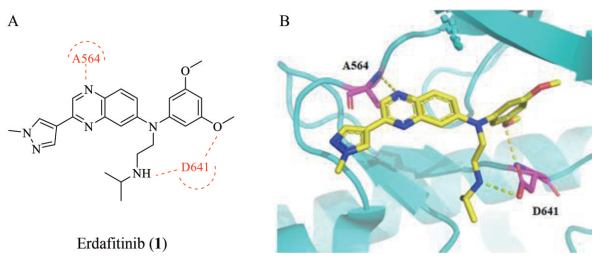
|
Figure 4 Structure and crystal structure of erdafitinib. A: Chemical structure of erdafitinib; B: Binding mode of erdafitinib with FGFR1 (PDB code 5EW8). Hydrogen bonds are indicated by yellow dashed lines to key amino acids |
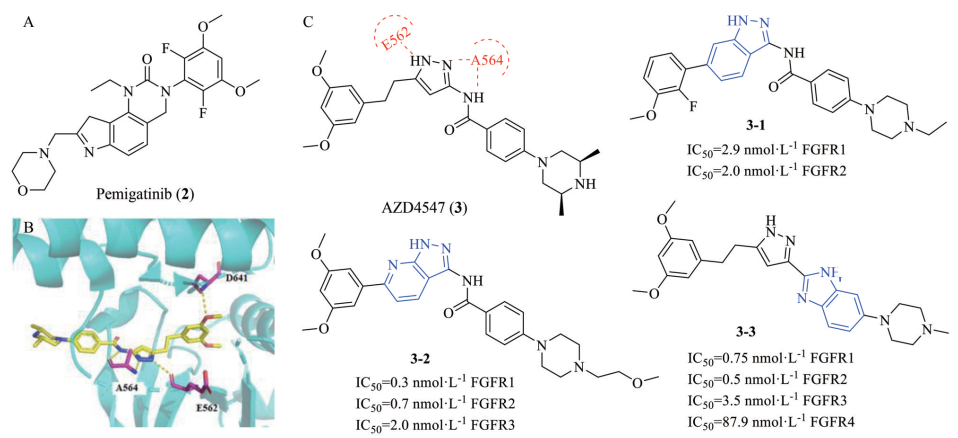
培米替尼是由信达和Incyte研发的一种具有口服活性的选择性FGFR抑制剂, 对于FGFR1~4的IC50分别为0.4、0.5、1.2、30 nmol·L-1 [32] (图 5)。目前正在进行泌尿系统肿瘤和血液癌症的临床Ⅱ期研究, 以及实体肿瘤的临床I/Ⅱ期研究。Pemigatinib对FGFR2融合突变胆管癌效果的Ⅱ期临床研究(NCT02924376) 结果显示, 客观缓解率(ORR) 为35.5%, 疾病控制率(DCR) 为82%, 无进展生存期(PFS) 为6.9个月, 总体生存时间(OS) 可达21.1个月, 优于FGFR1/3突变和无FGFR突变患者[33]。Pemigatinib于2020年4月被FDA加速批准上市, 适应症为晚期或转移性胆管癌。
|
Figure 5 Structure of pemigatinib and AZD4547 with its analogues and crystal structure of pemigatinib. A: Chemical structure of pemigatinib; B: Binding mode of pemigatinib with FGFR1 (PDB code 4RWJ). Hydrogen bonds are indicated by yellow dashed lines to key amino acids; C: Optimization of AZD4547 and its analogues 3-1, 3-2 and 3-3 |
AZD4547是由阿斯利康公司研发的一类吡唑骨架的新型FGFR抑制剂。体外药理实验表明, AZD4547对FGFR1~3激酶均表现出良好的抑制活性, IC50值分别为0.2、2.5和1.8 nmol·L-1。对FGFR4激酶的活性则较弱, IC50值为165 nmol·L-1 [34]。从AZD4547-FGFR1共晶结构[35] (PDB ID: 4RWJ, 图 5) 可看出3-氨基吡唑母核与铰链上的E562羰基和A564形成3个氢键, 3, 5-二甲氧基苯基侧链伸入铰链区向内的疏水口袋, 此外, 甲氧基上的氧原子与D641的N-H基团形成氢键, 对位手性哌嗪取代的苯甲酰基, 与伸向铰链区外的近溶剂端结构域发生亲水和疏水的相互作用。当前进行的Ⅱ/Ⅲ期临床试验主要为了评估AZD4547在肺癌和乳腺癌治疗中的安全性和疗效。Liu[36]和Zhao[37]等以AZD4547作为先导化合物, 运用骨架跃迁、生物电子等排以及引入卤素原子(F和Cl原子) 等策略, 设计并合成了一系列吲唑骨架化合物如3-1和吡唑并[3, 4-b]吡啶骨架化合物如3-2 (图 5), 最终得到化合物3-2具有优于AZD4547的体外酶活性, 对FGFR1~2激酶的IC50值均达到小于1 nmol·L-1。Yamani等[38]采用骨架跃迁的方法合成了一系列新型吡唑-苯并咪唑的化合物, 发现了化合物3-3对FGFR1~3抑制活性与AZD4547相当, 对FGFR4抑制活性更是优于AZD4547。由于化合物3-3具有良好的药代动力学特性、低毒性和体内强抗肿瘤活性, 目前正处于治疗膀胱癌、胃癌和鳞状细胞肺癌的I期临床试验评估阶段(NCT04149691)。
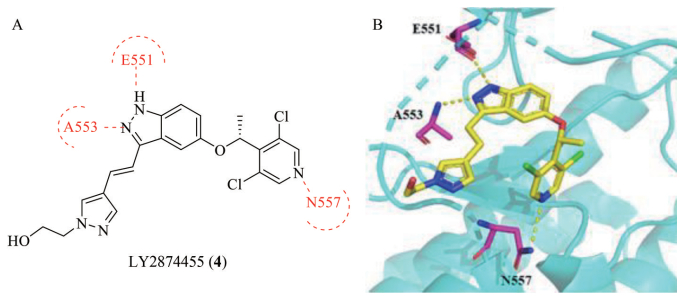
4.1.4 LY2874455LY2874455是由Eli Lilly公司开发的一类pan-FGFR抑制剂, 对FGFR1~4具有较好的抑制能力, IC50分别为2.8、2.6、6.4和6 nmol·L-1 [39]。LY2874455的发现是基于一种新型的吲唑支架, 但详细的结构-活性关系(structure-activity relationship, SAR) 研究尚未见报道。从LY2874455-FGFR4共晶结构[40] (PDB ID: 5JKG, 图 6) 可看出吲唑母核上的N原子和N-H分别和铰链区的A553和E551形成氢键作用, 2, 6-二氯吡啶占据疏水空腔, 并且和N557形成氢键作用, 且R型的甲基能更好地固定吡啶基的空间构型, 使结合更加紧密。另外, 乙氧基取代的2-乙烯基吡唑基处于近溶剂端。Wu等[41]研究发现LY2874455与FGFR的折线形结合模式与突变的gatekeeper残基不会产生空间上的冲突, 能有效克服FGFRGK突变产生的耐药性。目前正在评估LY2874455用于晚期癌症患者的Ⅱ期临床研究(NCT01212107)。
|
Figure 6 Structure and crystal structure of LY2874455. A: Chemical structure of LY2874455; B: Binding mode of LY2874455 with FGFR4 (PDB code 5JKG). Hydrogen bonds are indicated by yellow dashed lines to key amino acids |
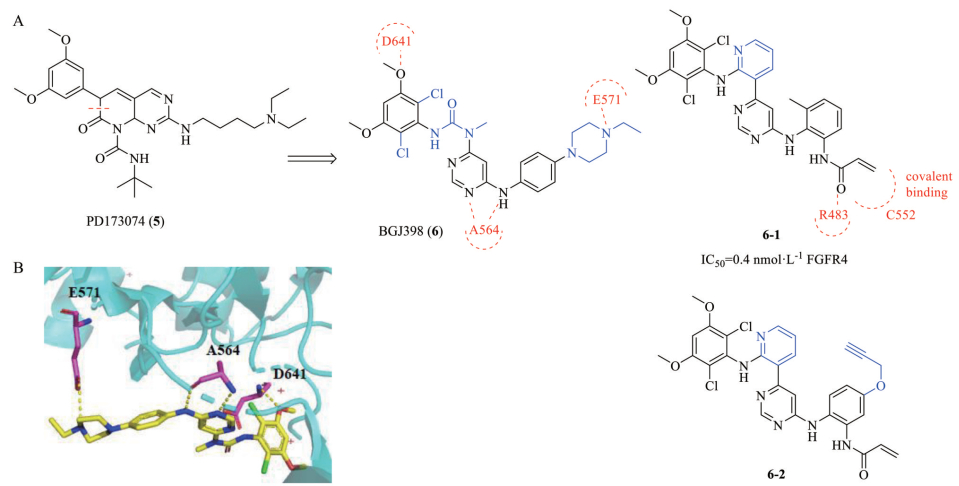
BGJ398是诺华公司在PD173074的基础上优化得到的一种pan-FGFR抑制剂, 对FGFR1~3均具有很好的抑制活性, IC50值分别为0.9、1.4和1 nmol·L-1, 作用于FGFR1~3比作用于FGFR4和VEGFR2选择性高40倍以上[42]。PD173074是诺华公司早期报道的吡啶并[2, 3-d]嘧啶母核的FGFR小分子抑制剂, 对FGFR1的IC50值是25 nmol·L-1, 对VEGFR有微弱的抑制活性, IC50值达到200 nmol·L-1左右, 鉴于PD173074的活性仍然不够理想, 研究人员用脲基替换了之前的吡啶环, 提高了整体分子的柔性, 使小分子更容易伸入结合口袋, 再对溶剂区和疏水空腔的苯环的取代基稍加修饰得到了新型的FGFR抑制剂BGJ398 (图 7)。从报道的BGJ398-FGFR1共晶(PDB ID: 3TT0, 图 7) 显示嘧啶母核的N原子与A564形成一个氢键作用, N-H作为氢键供体与A564的羰基形成氢键相互作用, 此外甲氧基中的氧与D641的N-H基团形成氢键, 哌嗪上的4位氮和E571上的羧基侧链形成氢键。3, 5-二甲氧基苯基提高了化合物对FGFR的选择性, 而氯原子的引入可以提高和疏水空腔的范德华力作用以及改善其电性。脲基可以和嘧啶环形成分子内氢键作用, 稳定化合物的构象。此外, 哌嗪基团的引入主要为了改善化合物的理化性质, 提高其生物活性和成药性。Rezende Miranda等[43]采用电子等排体置换策略, 将BGJ398的脲基替换为氨基吡啶基团, 吡啶的氮原子模仿脲基氧原子, 作为氢键受体, 在苯环取代基上连接丙烯酰胺基团, 和FGFR4 C552残基共价结合, 得到的化合物6-1 (图 7) 对FGFR4具有高度选择性, IC50值为0.4 nmol·L-1。化合物6-1与BGJ398相比, 丙烯酰胺上的羰基与R483残基形成一个额外的氢键, 吡啶环与L473和V481形成的疏水相互作用增强了与FGFR4结合能力。为了监测靶向作用并确定FGFR4特异性抑制剂的蛋白质组选择性, 研究人员将苯环用末端炔烃基团衍生物化取代, 以制造能够进行铜催化叠氮化物炔烃环加成(CuAAC) 反应的分子探针6-2。
|
Figure 7 Structure of PD173074, BGJ398, 6-1, 6-2 and crystal structure of BGJ398. A: Chemical structure of PD173074 and BGJ398 and its analogues 6-1 and 6-2; B: Binding mode of BGJ398 with FGFR1 (PDB code 3TT0) |
目前BGJ398正处于Ⅲ期临床研究, 用于治疗尿路上皮癌、胆管癌; II期临床研究阶段的, 有胶质母细胞瘤、实体瘤和血液恶性肿瘤。针对胆管癌的II期临床试验(NCT02150967), 招募了61名患者入组, 结果显示BGJ398治疗化疗失败胆管癌的ORR为14.8%, DCR为75.4%, PFS为5.8个月; 而对FGFR2融合突变的胆管癌患者效果较好, ORR为18.8%, DCR可达83.3%, 但62.3%的患者在治疗期间因不良反应需调整药物剂量[44]。
4.1.6 TAS-120TAS-120是Taiho公司最早发现的一类嘧啶并吡唑骨架的不可逆的pan-FGFR抑制剂, 对FGFR1~4的IC50分别是3.9、1.3、1.6和8.3 nmol·L-1。从报道的TAS-120-FGFR1共晶(PDB ID: 6MZW, 图 8) 结果显示作用方式是通过嘧啶的4-氨基与E562的羰基形成氢键, N3与A564的N-H基团形成氢键。其中一个甲氧基的氧原子与DFG-D641的主链N-H基团形成氢键, 该化合物与C488形成共价Michael加合物[45]。TAS-120目前处于软组织肉瘤的临床Ⅲ期研究; 胆管癌、实体癌、FGFR2基因融合的其他肿瘤类型的临床Ⅱ期研究。在胆管癌的I期临床试验(NCT02052778) 中, 该药治疗28例FGFR2融合胆管癌患者的ORR为25%, DCR达到79%[46]。基于此, FDA授予TAS-120孤儿药称号。目前, 该药正进行胆管癌及子宫内膜癌的剂量递增试验。Wang等[47]以TAS-120为先导化合物, 用苯并噻吩基团替代了之前的3, 5-二甲氧基苯基, 得到化合物7-1, 体外药理实验研究表明, 化合物7-1 (图 8) 有更好的体外酶活性以及对肿瘤细胞的抗增殖能力, 对FGFR1~4的IC50分别为0.3、0.8、9.4和5.3 nmol·L-1。

|
Figure 8 Structure and crystal structure of TAS-120. A: Chemical structure of TAS-120 and its analogue 7-1; B: Binding mode of TAS-120 with FGFR1 (PDB code 6MZW) |
由于FGFR4的氨基酸序列较FGFR1~3差异较大, 导致早期发现的FGFR抑制剂对FGFR4的效果较差。目前, 靶向FGFR4的策略有两种: ① C552共价结合策略, FGFR4的GK+2位置存在非常独特的半胱氨酸, 而其他FGFR1~3则为酪氨酸, 并且其他类型激酶中仅发现4个激酶的GK+2位置存在半胱氨酸(MAPKAPK2、MAPKAPK3、P70S6Kb和TTK), 因此通过小分子抑制剂末端的不饱和键(一般为碳-碳双键或氰基) 与FGFR4蛋白中半胱氨酸的巯基Michael加成, 形成相对较牢固的共价键, 提高配体小分子与靶蛋白的结合力。② C552亚口袋空间占据策略, 绝大多数激酶(包括FGFR1~3) 在GK+2位置含有较大的芳香族氨基酸残基, 只有12种其他激酶具有较小的残基。因此, 可利用由相对较小的半胱氨酸残基产生的亚口袋来实现选择性, 从而设计出选择性的FGFR4抑制剂。目前, FGFR4抑制剂包括进行临床Ⅱ期研究的ISIS-FGFR4; 进行临床Ⅰ/Ⅱ期研究的BLU554和FGF401; 进行临床Ⅰ期研究的INCB062079、ICP105和H3B-6527。
4.2.1 BLU554BLU554是Blueprint Medicines公司研究的一种高选择性的不可逆共价FGFR4抑制剂, 其IC50值为5 nmol·L-1 [48]。它是一种不可逆的FGFR4抑制剂, 共价结合到该受体的ATP结合位点。从2015年开始进行肝细胞癌的I期临床研究(NCT02508467), 根据在ESMO年会上公布的I期初步临床数据, 截止至2017年8月18日, 共有77例患者接受了BLU554的治疗, 在38名经FGF19免疫组化阳性(IHC+) 的HCC患者中, 6例患者(16%) 获得客观缓解, 26例患者(68%) 获得疾病控制, 18例患者(49%) 肿瘤负荷减少。38例FGF19 IHC+患者的最大肿瘤减小。其中一位病毒性肝细胞癌患者在经过索拉非尼治疗后病情进展, 在接受BLU554后, 部分缓解率达到49%。另一位非病毒性肝细胞癌患者在接受索拉非尼后出现纵膈转移, 接受BLU554治疗后, 部分缓解率达到44%。基于77例患者的药物安全性分析显示: 大多数不良事件为1或2级, 不良反应可控[49]。
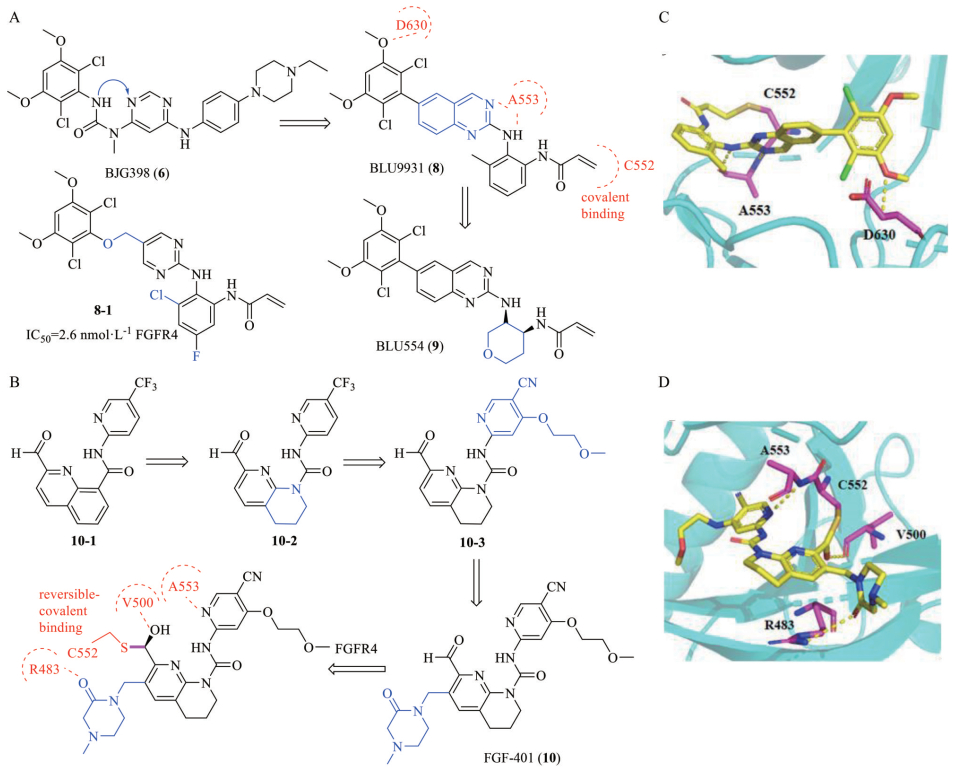
研究人员以BGJ398作为先导化合物, 通过骨架跃迁的策略将脲基部位环合, 以此来固定化合物构象, 得到喹唑啉母核, 接着对近溶剂端的苯胺取代基的优化主要是在邻位引入Michael加成受体丙烯酰胺, 能够和铰链区的C552形成共价键。但是, 由于苯胺和喹唑啉之间存在固定旋转角度, 使得丙烯酰胺不能很好地与C552结合, 导致化合物并没有表现出理想的选择性。因此, 研究人员在苯胺的邻位引入了甲基, 提供一个位阻作用, 使得苯胺和喹唑啉之间形成大约60°的二面角, 进而使丙烯酰胺能够恰好与C552形成共价结合, 最终得到选择性的FGFR4抑制剂BLU9931 (图 9)[50]。
|
Figure 9 Structures of BLU9931, BLU554, 8-1, FGF401 and crystal structures of BLU9931 and FGF401. A: Optimization process of BLU554 and its analogue 8-1; B: Optimization process of FGF401; C: Binding mode of BLU9931 with FGFR4 (PDB code 4XCU); D: Binding mode of FGF401 with FGFR4 (PDB code 6JPJ) |
BLU554是通过将BLU9931近溶剂端的苯环替换成六氢呋喃得到的小分子, 改善了BLU9931的ADME性质, 提高了成药性。据报道的BLU9931-FGFR4共晶(PDB ID: 4XCU, 图 9) 结果显示, 氨基喹唑啉母核与铰链区A553形成了两个氢键, 甲氧基上的氧与D630形成一个氢键, 而丙烯酰胺与C552成功形成共价键[12]。此外, Mo等[51]对喹唑啉的苯环进行了开环, 设计了化合物8-1 (图 9)。化合物8-1保持了对FGFR4选择性抑制活性, 同时提高了其理化性质, 对FGFR4的IC50值为2.6 nmol·L-1, 而对FGFR1~3的IC50值均大于1 000 nmol·L-1。
4.2.2 FGF401FGF401是诺华研发的针对HCC患者的可逆共价FGFR4抑制剂, 对FGFR4的IC50值是1.9 nmol·L-1 [52]。诺华公司通过高通量筛选发现化合物10-1具有高FGFR4抑制活性, 研究人员以此为先导化合物进行进一步研究, 通过降低10-1的芳香平面性质, 在不破坏酰胺和喹啉氮之间的分子内氢键的情况下, 将喹啉骨架替换成四氢萘吡啶, 提高化合物的溶解度。引入N-甲基哌嗪-2-酮改善醛基代谢稳定性和提高化合物的水溶性, 最终得到化合物FGF401 (图 9)[53]。FGF401-FGFR4的共晶结构(PDB ID: 6JPJ, 图 9) 显示, 该化合物的醛基与C552形成半硫缩醛, 由此生成的羟基与β3-内的V500形成氢键。此外, 吡啶氮与A553的N-H基团形成氢键, 哌嗪基上的氧原子与β2链内的R483的胍基形成氢键[54]。其中有趣的是, FGF401与FGFR4形成的共价键是可逆的, 减少了脱靶效应, 延长了停留时间。目前正在II期临床研究中, 用于治疗FGFR4和β-klotho表达的HCC (NCT02325739)[55]。
4.2.3 H3B-6527H3B-6527是H3 Biomedicine公司基于BGJ398的结构基础上, 在其苯胺的邻位引入丙烯酰胺, 和FGFR4激酶的C552共价结合, 研发的一种选择性的共价不可逆FGFR4抑制剂。丙烯酰胺一方面增加配体小分子和FGFR4蛋白结合的能力, 另一方面会与FGFR1~3相应位置的酪氨酸残基形成空间位阻, 改善对FGFR4的选择性。H3B-6527对FGFR4的IC50 < 1.2 nmol·L-1, 根据H3B-6527-FGFR1 (Y563C-MUT) (PDB ID: 5VND, 图 10) 共晶结构表明, 嘧啶氮与A564的N-H基团结合氢键, N-H与A564的羰基结合形成氢键[56]。此外, 甲氧基的氧与D641的N-H基团形成氢键, 丙烯酰胺与C563形成共价键。因此, 通过在pan-FGFR抑制剂支架上加入Michael受体来设计选择性FGFR4抑制剂具有重要的意义。目前, H3B-6527在进行HCC的临床Ⅰ期研究(NCT02834780)。
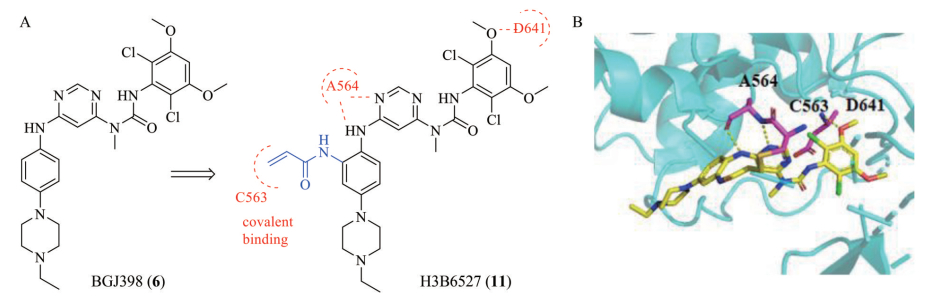
|
Figure 10 Structure and crystal structure of H3B-6527. A: Optimization strategy of H3B-6527; B: Binding mode of H3B-6527 with FGFR1 (Y563C-MUT) (PDB code 5VND) |
靶向FGFR4单克隆抗体通过作用于FGFR4细胞外免疫球蛋白结构域, 干扰配体与受体的结合或者抑制受体二聚来阻断FGFR信号通路。由于抗体-抗原相互作用的特异性, 可以有效减少因抑制多种FGFR造成的毒副作用。
LD-1和U3-1784是两种FGFR4单克隆抗体, 已被开发用于竞争性靶向FGFR4细胞外免疫球蛋白结构域。研究显示, LD-1能够抑制FGF19-FGFR4相互作用和FGFR4二聚化, 最终导致体外培养的肝癌细胞的增殖能力减弱, 并通过抑制FRS2/ERK1通路, 抑制肝癌移植瘤模型肿瘤的生长[57]。LD-1抗移植肝肿瘤模型生长突出了其在肝癌治疗中的潜在临床应用。U3-1784是一种新型的FGFR4靶向抗体, 是一种高亲和力的全人源化抗体。U3-1784可与多种FGFs竞争其FGFR4结合位点, 从而抑制受体激活和下游信号传导, 包括FRS2和ERK。动物实验表明, U3-1784对过表达FGF19的肝癌细胞具有较强的特异性抗肿瘤作用[58]。但是, U3-1784治疗HCC和其他晚期实体肿瘤(NCT02690350) 的评估目前已经停止[59]。
5 联合免疫治疗目前, 肝癌获批了很多靶向和免疫新药, 但是单药的疗效有限, 无法满足临床需求, 所以免疫联合靶向治疗应运而生。2020年7月, 公布了关于仑伐替尼联合派姆单抗(K药) 在无法切除的肝细胞患者中的Ib期临床研究结果, 数据截止时, 仍有37%的患者在接受治疗, 中位随访时间为10.6个月。mRECIST的客观缓解率ORR达到46%, 其中完全缓解11%; mRECIST与RECIST v1.1的中位PFS分别为9.3个月和8.6个月; 中位总生存期达到22个月[60]。基于小分子靶向抑制剂联合免疫抑制剂的良好疗效, 2019年6月5日基石药业宣布治疗局部晚期或转移性肝细胞癌PDL-1抑制剂CS1001联合FGFR4抑制剂BLU554疗法在中国获得临床试验批准。一项Ⅰ/Ⅱ期临床试验评估了FGF401单次使用或与单克隆抗PD-1抗体PDR001联合治疗HCC的效果[61]。这些新的FGFR4靶向疗法为肝癌提供了一种新的和有希望的方法, FGFR4抑制剂联合免疫治疗在未来有可能发展成为对抗肝癌的治疗策略。
6 总结与展望越来越多的研究表明, FGF19-FGFR4信号通路作为肝癌的驱动因素, 在肝癌的发生和发展中具有重要作用。FGFR4已被证明是一个潜在治疗肝癌的靶点, 可以针对FGF19-FGFR4通路开发相关的抑制剂。pan-FGFR抑制剂主要不良反应是由抑制FGF23-FGFR1信号传导引起的高磷酸盐血症, 而FGFR4选择性抑制剂可以很好地避免靶向FGFR1~3引起的不良反应。目前, 在设计和开发选择性FGFR4抑制剂方面取得了重大进展, 但仍面临着许多的挑战。与其他酪氨酸激酶抑制剂一样, FGFR4抑制剂面临获得性耐药性的问题, 如FGFR4守门位点的突变(FGFR4V550L、FGFR4V550M)[62]。因此, 下一阶段开发针对突变型FGFR4具有高选择性和亲和性的抑制剂至关重要。已报道的不可逆或可逆共价FGFR4抑制剂仍处于早期临床试验阶段, 这可能为FGF19-FGFR4信号通路的其他因素的研究提供了指示, 例如, klotho (FGFR4的共受体) 被认为是一种新的候选靶点, 因为它主要参与FGF19和FGFR4的结合, 而且在HCC中也处于升高状态[63]。因此, 未来klotho特异性抑制剂可以通过抑制FGF19与FGFR4的结合, 有希望作为单一药物或与其他抗癌药物联合使用治疗HCC。另外, 蛋白降解靶向嵌合体(proteolysis targeting chimeras, PROTAC) 是一种双功能小分子, 在体内可以分别识别靶蛋白和E3泛素连接酶, 将靶蛋白和E3泛素连接酶拉近, 靶蛋白被泛素化后, 在体内通过泛素—蛋白酶体途径降解。靶蛋白降解后, PROTAC分子又可以释放出来参与下一个蛋白的降解过程, 这种降解作用具有催化效果, 较少的药物剂量就可以实现高效的降解[64]。随着越来越多的PROTAC分子进入临床或者临床前研究阶段, 如今PROTAC技术已经成为药物研发的新策略, 未来可以考虑尝试利用PROTAC技术实现对FGFR4靶向降解, 治疗FGF19-FGFR4信号异常的肝癌。总之, 大多数FGFR4特异性抑制剂现处于临床前阶段, 这些抑制剂将推进FGF19-FGFR4异常导致的肝癌的进展, 有望改变HCC的治疗现状。
作者贡献: 王敏负责文献检索与分析、论文撰写; 张谨阳、王雨薇负责文献检索; 李雯负责文献数据整理; 孙丽萍负责论文修改与检查。
利益冲突: 本文研究内容无任何利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Sun KX, Zheng RS, Zhang SW, et al. Report of cancer incidence and mortality in different areas of China, 2015[J]. Bull Chin Cancer (中国肿瘤), 2019, 28: 1-11. |
| [3] |
Bosch FX, Ribes J, Diaz M, et al. Primary liver cancer: worldwide incidence and trends[J]. Gastroenterology, 2004, 127: S5-S16. DOI:10.1053/j.gastro.2004.09.011 |
| [4] |
Llovet JM, Villanueva A, Lachenmayer A, et al. Advances in targeted therapies for hepatocellular carcinoma in the genomic era[J]. Nat Rev Clin Oncol, 2015, 12: 408-424. DOI:10.1038/nrclinonc.2015.103 |
| [5] |
Vainikka S, Joukov V, Wennstrom S, et al. Signal transduction by fibroblast growth factor receptor-4(FGFR-4)-comparison with FGFR-1[J]. J Biol Chem, 1994, 269: 18320-18326. DOI:10.1016/S0021-9258(17)32309-8 |
| [6] |
Wu AL, Coulter S, Liddle C, et al. FGF19 regulates cell proliferation, glucose and bile acid metabolism via FGFR4-dependent and independent pathways[J]. PLoS One, 2011, 6: e17868. DOI:10.1371/journal.pone.0017868 |
| [7] |
Zhou M, Yang H, Learned RM, et al. Non-cell-autonomous activation of IL-6/STAT3 signaling mediates FGF19-driven hepatocarcinogenesis[J]. Nat Commun, 2017, 16: 15433. |
| [8] |
Urtasun R, Latasa MU, Demartid MI, et al. Connective tissue growth factor autocriny in human hepatocellular carcinoma: oncogenic role and regulation by epidermal growth factor receptor/Yes-associated protein-mediated activation[J]. Hepatology, 2011, 54: 2149-2158. DOI:10.1002/hep.24587 |
| [9] |
Huang J, Qiu M, Wan L, et al. TGF-β1 promotes hepatocellular carcinoma invasion and metastasis via ERK pathway-mediated FGFR4 expression[J]. Cell Physiol Biochem, 2018, 45: 1690-1699. DOI:10.1159/000487737 |
| [10] |
Gao L, Wang X, Tang Y, et al. FGF19/FGFR4 signaling contributes to the resistance of hepatocellular carcinoma to sorafenib[J]. J Exp Clin Cancer Res, 2017, 36: 8. DOI:10.1186/s13046-016-0478-9 |
| [11] |
Repana D, Ross P. Targeting FGF19/FGFR4 pathway: a novel therapeutic strategy for hepatocellular carcinoma[J]. Diseases, 2015, 3: 294-305. DOI:10.3390/diseases3040294 |
| [12] |
Lu X, Chen H, Patterson AV, et al. Fibroblast growth factor receptor 4(FGFR4) selective inhibitors as hepatocellular carcinoma therapy: advances and prospects[J]. J Med Chem, 2019, 62: 2905-2915. DOI:10.1021/acs.jmedchem.8b01531 |
| [13] |
Raja A, Park I, Haq F, et al. FGF19-FGFR4 signaling in hepatocellular carcinoma[J]. Cells, 2019, 8: 536. DOI:10.3390/cells8060536 |
| [14] |
Lang L, Teng Y. Fibroblast growth factor receptor 4 targeting in cancer: new insights into mechanisms and therapeutic strategies[J]. Cells, 2019, 8: 31. DOI:10.3390/cells8010031 |
| [15] |
Beenken A, Mohammadi M. The FGF family: biology, pathophysiology and therapy[J]. Nat Rev Drug Discov, 2009, 8: 235-253. DOI:10.1038/nrd2792 |
| [16] |
Touat M, Ileana E, Postel-Vinay S, et al. Targeting FGFR signaling in cancer[J]. Clin Cancer Res, 2015, 21: 2684-2694. DOI:10.1158/1078-0432.CCR-14-2329 |
| [17] |
Dai S, Zhou Z, Chen Z, et al. Fibroblast growth factor receptors (FGFRs): structures and small molecule inhibitors[J]. Cells, 2019, 8: 614. DOI:10.3390/cells8060614 |
| [18] |
Prieto-Dominguez N, Shull AY, Teng Y. Making way for suppressing the FGF19/FGFR4 axis in cancer[J]. Future Med Chem, 2018, 10: 2457-2469. DOI:10.4155/fmc-2018-0099 |
| [19] |
Ornitz DM, Itoh N. Fibroblast growth factors[J]. Genome Biol, 2001, 2: REVIEWS3005. |
| [20] |
Liu WY, Xie DM, Zhu GQ, et al. Targeting fibroblast growth factor 19 in liver disease: a potential biomarker and therapeutic target[J]. Expert Opin Ther Targets, 2015, 19: 675-685. DOI:10.1517/14728222.2014.997711 |
| [21] |
Nicholes K, Guillet S, Tomlinson E, et al. A mouse model of hepatocellular carcinoma-ectopic expression of fibroblast growth factor 19 in skeletal muscle of transgenic mice[J]. Am J Pathol, 2002, 160: 2295-2307. DOI:10.1016/S0002-9440(10)61177-7 |
| [22] |
Teng Y, Zhao H, Gao L, et al. FGF19 protects hepatocellular carcinoma cells against endoplasmic reticulum stress via activation of FGFR4-GSK3 beta-Nrf2 signaling[J]. Cancer Res, 2017, 77: 6215-6225. DOI:10.1158/0008-5472.CAN-17-2039 |
| [23] |
Levine KM, Ding K, Chen L, et al. FGFR4:a promising therapeutic target for breast cancer and other solid tumors[J]. Pharmacol Ther, 2020, 214: 107590. DOI:10.1016/j.pharmthera.2020.107590 |
| [24] |
Wu X, Ge H, Lemon B, et al. FGF19-induced hepatocyte proliferation is mediated through FGFR4 activation[J]. J Biol Chem, 2010, 285: 5165-5170. DOI:10.1074/jbc.M109.068783 |
| [25] |
Gauglhofer C, Paur J, Schrottmaier WC, et al. Fibroblast growth factor receptor 4:a putative key driver for the aggressive phenotype of hepatocellular carcinoma[J]. Carcinogenesis, 2014, 35: 2331-2338. DOI:10.1093/carcin/bgu151 |
| [26] |
French DM, Lin BC, Wang M, et al. Targeting FGFR4 inhibits hepatocellular carcinoma in preclinical mouse models[J]. PLoS One, 2012, 7: e36713. DOI:10.1371/journal.pone.0036713 |
| [27] |
Zhao H, Lv F, Liang G, et al. FGF19 promotes epithelial-mesenchymal transition in hepatocellular carcinoma cells by modulating the GSK3 beta/beta-catenin signaling cascade via FGFR4 activation[J]. Oncotarget, 2016, 7: 13575-13586. DOI:10.18632/oncotarget.6185 |
| [28] |
Perera TPS, Jovcheva E, Mevellec L, et al. Discovery and pharmacological characterization of JNJ-42756493(erdafitinib), a functionally selective small-molecule FGFR family inhibitor[J]. Mol Cancer Ther, 2017, 16: 1010-1020. DOI:10.1158/1535-7163.MCT-16-0589 |
| [29] |
Loriot Y, Necchi A, Park SH, et al. Erdafitinib in locally advanced or metastatic urothelial carcinoma[J]. N Engl J Med, 2019, 381: 338-348. DOI:10.1056/NEJMoa1817323 |
| [30] |
Bahleda R, Dienstmann R, Adamo B, et al. Phase 1 study of JNJ-42756493, a pan-fibroblast growth factor receptor (FGFR) inhibitor, in patients with advanced solid tumors[J]. J Clin Oncol, 2014, 32: 2501. DOI:10.1200/jco.2014.32.15_suppl.2501 |
| [31] |
Patani H, Bunney TD, Thiyagarajan N, et al. Landscape of activating cancer mutations in FGFR kinases and their differential responses to inhibitors in clinical use[J]. Oncotarget, 2016, 7: 24252-24268. DOI:10.18632/oncotarget.8132 |
| [32] |
Roskoski RJ. The role of fibroblast growth factor receptor (FGFR) protein-tyrosine kinase inhibitors in the treatment of cancers including those of the urinary bladder[J]. Pharmacol Res, 2020, 151: 104567. DOI:10.1016/j.phrs.2019.104567 |
| [33] |
Abou-Alfa GK, Sahai V, Hollebecque A, et al. Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study[J]. Lancet Oncol, 2020, 21: 671-684. DOI:10.1016/S1470-2045(20)30109-1 |
| [34] |
Gavine PR, Mooney L, Kilgour E, et al. AZD4547:an orally bioavailable, potent, and selective inhibitor of the fibroblast growth factor receptor tyrosine kinase family[J]. Cancer Res, 2012, 72: 2045-2056. DOI:10.1158/0008-5472.CAN-11-3034 |
| [35] |
Tucker JA, Klein T, Breed J, et al. Structural insights into FGFR kinase isoform selectivity: diverse binding modes of AZD4547 and ponatinib in complex with FGFR1 and FGFR4[J]. Structure, 2014, 22: 1764-1774. DOI:10.1016/j.str.2014.09.019 |
| [36] |
Liu J, Peng X, Dai Y, et al. Design, synthesis and biological evaluation of novel FGFR inhibitors bearing an indazole scaffold[J]. Org Biomol Chem, 2015, 13: 7643-7654. DOI:10.1039/C5OB00778J |
| [37] |
Zhao B, Li Y, Xu P, et al. Discovery of substituted 1H-pyrazolo 3, 4-b pyridine derivatives as potent and selective FGFR kinase inhibitors[J]. ACS Med Chem Lett, 2016, 7: 629-634. DOI:10.1021/acsmedchemlett.6b00066 |
| [38] |
Yamani A, Zdzalik-Bielecka D, Lipner J, et al. Discovery and optimization of novel pyrazole-benzimidazole CPL304110, as a potent and selective inhibitor of fibroblast growth factor receptors FGFR (1-3)[J]. Eur J Med Chem, 2021, 210: 112990. DOI:10.1016/j.ejmech.2020.112990 |
| [39] |
Zhao G, Li WY, Chen D, et al. A novel, selective inhibitor of fibroblast growth factor receptors that shows a potent broad spectrum of antitumor activity in several tumor xenograft models[J]. Mol Cancer Ther, 2011, 10: 2200-2210. DOI:10.1158/1535-7163.MCT-11-0306 |
| [40] |
Wu D, Guo M, Philips MA, et al. Crystal structure of the FGFR4/LY2874455 complex reveals insights into the pan-FGFR selectivity of LY2874455[J]. PLoS One, 2016, 11: e0162491. DOI:10.1371/journal.pone.0162491 |
| [41] |
Wu D, Guo M, Min X, et al. LY2874455 potently inhibits FGFR gatekeeper mutants and overcomes mutation-based resistance[J]. Chem Commun, 2018, 54: 12089-12092. DOI:10.1039/C8CC07546H |
| [42] |
Guagnano V, Furet P, Spanka C, et al. Discovery of 3-(2, 6-dichloro-3, 5-dimethoxy-phenyl)-1-{6-4-(4-ethyl-piperazin-1-yl)-phenylamino-pyrimidin-4-yl}-1-methyl-urea (NVP-BGJ398), a potent and selective inhibitor of the fibroblast growth factor receptor family of receptor tyrosine kinase[J]. J Med Chem, 2011, 54: 7066-7083. DOI:10.1021/jm2006222 |
| [43] |
Rezende Miranda R, Fu Y, Chen X, et al. Development of a potent and specific FGFR4 inhibitor for the treatment of hepatocellular carcinoma[J]. J Med Chem, 2020, 63: 11484-11497. DOI:10.1021/acs.jmedchem.0c00044 |
| [44] |
Javle M, Lowery M, Shroff RT, et al. Phase Ⅱ study of BGJ398 in patients with FGFR-altered advanced cholangiocarcinoma[J]. J Clin Oncol, 2018, 36: 276-282. |
| [45] |
Kalyukina M, Yosaatmadja Y, Middleditch MJ, et al. TAS-120 cancer target binding: defining reactivity and revealing the first fibroblast growth factor receptor 1(FGFR1) irreversible structure[J]. ChemMedChem, 2019, 14: 494-500. DOI:10.1002/cmdc.201800719 |
| [46] |
Goyal L, Shi L, Liu LY, et al. TAS-120 overcomes resistance to ATP-competitive FGFR inhibitors in patients with FGFR2 fusion-positive intrahepatic cholangiocarcinoma[J]. Cancer Discov, 2019, 9: 1064-1079. DOI:10.1158/2159-8290.CD-19-0182 |
| [47] |
Wang Y, Li L, Fan J, et al. Discovery of potent irreversible pan-fibroblast growth factor receptor (FGFR) inhibitors[J]. J Med Chem, 2018, 61: 9085-9104. |
| [48] |
Dogan-Topal B, Li W, Schinkel AH, et al. Quantification of FGFR4 inhibitor BLU-554 in mouse plasma and tissue homogenates using liquid chromatography-tandem mass spectrometry[J]. J Chromatogr B Anal Technol Biome Life Sci, 2019, 1110-1111: 116-123. DOI:10.1016/j.jchromb.2019.02.017 |
| [49] |
Kim R, Sarker D, Macarulla T, et al. Phase 1 safety and clinical activity of BLU-554 in advanced hepatocellular carcinoma (HCC)[J]. Ann Oncol, 2017, 28: v122-v141. |
| [50] |
Hagel M, Miduturu C, Sheets M, et al. First selective small molecule inhibitor of FGFR4 for the treatment of hepatocellular carcinomas with an activated FGFR4 signaling pathway[J]. Cancer Discov, 2015, 5: 424-437. |
| [51] |
Mo C, Zhang Z, Guise CP, et al. 2-Aminopyrimidine derivatives as new selective fibroblast growth factor receptor 4(FGFR4) inhibitors[J]. ACS Med Chem Lett, 2017, 8: 543-548. DOI:10.1021/acsmedchemlett.7b00091 |
| [52] |
Porta DG, Weiss A, Fairhurst RA, et al. NVP-FGF401, a first-in-class highly selective and potent FGFR4 inhibitor for the treatment of HCC[J]. Cancer Res, 2017, 77: 2098. |
| [53] |
Fairhurst RA, Knoepfel T, Buschmann N, et al. Discovery of roblitinib (FGF401) as a reversible-covalent inhibitor of the kinase activity of fibroblast growth factor receptor 4[J]. J Med Chem, 2020, 63: 12542-12573. |
| [54] |
Zhou Z, Chen X, Fu Y, et al. Characterization of FGF401 as a reversible covalent inhibitor of fibroblast growth factor receptor 4[J]. Chem Commun, 2019, 55: 5890-5893. |
| [55] |
Weiss A, Adler F, Buhles A, et al. FGF401, a first-in-class highly selective and potent FGFR4 inhibitor for the treatment of FGF19-driven hepatocellular cancer[J]. Mol Cancer Ther, 2019, 18: 2194-2206. |
| [56] |
Joshi JJ, Coffey H, Corcoran E, et al. H3B-6527 is a potent and selective inhibitor of FGFR4 in FGF19-driven hepatocellular carcinoma[J]. Cancer Res, 2017, 77: 6999-7013. |
| [57] |
Dennis M, Desnoyer L, French D. Anti-FGFR4 antibodies and methods of use: US, 4241331[P]. 2014-02-06.
|
| [58] |
Bartz R, Fukuchi K, Ohtsuka T, et al. Preclinical development of U3-1784, a novel FGFR4 antibody against cancer, and avoidance of its on-target toxicity[J]. Mol Cancer Ther, 2019, 18: 1832-1843. |
| [59] |
Bartz R, Fukuchi K, Lange T, et al. U3-1784, a human anti-FGFR4 antibody for the treatment of cancer[J]. Cancer Res, 2016, 76: 3852. |
| [60] |
Finn RS, Ikeda M, Zhu AX, et al. Phase Ib Study of lenvatinib plus pembrolizumab in patients with unresectable hepatocellular carcinoma[J]. J Clin Oncol, 2020, 38: 2960-2970. |
| [61] |
Chan SL, Yen CJ, Schuler M, et al. Ph I/Ⅱ study of FGF401 in adult pts with HCC or solid tumors characterized by FGFR4/KLB expression[J]. Cancer Res, 2017, 77: CT106. |
| [62] |
Tan L, Wang J, Tanizaki J, et al. Development of covalent inhibitors that can overcome resistance to first-generation FGFR kinase inhibitors[J]. Proc Natl Acad Sci U S A, 2014, 111: E4869-E4877. |
| [63] |
Poh W, Wong W, Ong H, et al. Klotho-beta overexpression as a novel target for suppressing proliferation and fibroblast growth factor receptor-4 signaling in hepatocellular carcinoma[J]. Mol Cancer, 2012, 11: 14. |
| [64] |
Sun XY, Gao HY, Yang YQ, et al. PROTACs: great opportunities for academia and industry[J]. Signal Transduct Target Ther, 2019, 4: 64. |
 2021, Vol. 56
2021, Vol. 56


