2. 中国中医科学院医学实验中心, 北京 100700;
3. 石药集团远大 (大连) 制药有限公司, 辽宁 大连 116600;
4. 清华大学医院, 北京 100084
2. Experimental Research Center, China Academy of Chinese Medical Sciences, Beijing 100700, China;
3. CSPC Yuanda(Dalian) Pharmaceutical Co., Ltd., Dalian 116600, China;
4. Tsinghua University Hospital, Beijing 100084, China
香茅为禾本科香茅属植物柠檬草Cymbopogon citrates [DC.] Stapf.的全草, 以“茅香”之名始载于《本草拾遗》, 又名香茅草。香茅草有疏风通络, 温中止痛、止泻的功效, 临床多用于治疗感冒头身疼痛、风寒湿痹、脘腹冷痛、泄泻、跌打损伤等病症[1]。现代药理研究显示, 香茅草具有抗菌、抗炎、镇痛、抗氧化、抗肿瘤、抗焦虑、降压、降血糖等作用[2]。近来, 作者等从香茅草中制备获得一种香茅草提取物, 其中含β-榄香烯约60%~75%[3]。含β-榄香烯制剂已用于临床多种癌症的治疗, 和现有化疗药合用, 具有逆转肿瘤耐药和协同增敏的特点[4]; 另报道β-榄香烯有抗氧化、抗凝血和抗血栓等作用, 开发前景广阔[5, 6]。有研究显示β-榄香烯的口服生物利用度较低[7], 但香茅草提取物中β-榄香烯的药代动力学特征尚不清楚。本文采用液液微萃取结合气相色谱-质谱联用(gas chromatography-mass spectrometry, GC-MS) 方法检测血浆中β-榄香烯的药物浓度, 并用于香茅草提取物在大鼠体内药代动力学特征的研究, 以期为香茅草的新药研发及临床应用提供方法及数据参考。
材料与方法仪器设备 GC-MS仪(美国Aglient公司), 配有7980A气相系统、7963自动进样器、5975C单四极杆检测器和OpenLab CDS2数据处理工作站; Easyflow独立通气笼具(意大利Tecniplast公司); 桌面式麻醉机(美国Harvard Apparatus公司); 小动物自动采血系统(美国Instech公司), 包括ABS2TM小动物采血仪、ABS2采血软件、C19PU股动脉采血管、C19PU股静脉给药管和VAH95AB大鼠血管通道马甲等; Targin VX-Ⅲ多管涡旋振荡器(北京踏锦科技有限公司); Rotanta 460R高速冷冻离心机(德国Hettich公司)。
药品与试剂 香茅草提取物(批号: 200320, 含β-榄香烯约69.1%) 和β-榄香烯对照品(批号: 171102, 纯度大于99.9%), 由石药集团远大(大连) 制药有限公司制备[3]和提供。萘(100 μg·mL-1, 批号: 19003), 中国计量科学研究院。异氟烷(批号: 217180801), 深圳市瑞沃德生命科技有限公司。甘油(批号: 151201), 河北省保定市金钟制药有限公司。肝素钠(批号: 20120612), 国药集团化学试剂有限公司。硫酸庆大霉素注射液(批号: 91Y01071), 宜昌人福药业有限责任公司。
实验动物 雄性SD大鼠, SPF级, 6~7周龄, 实验动物质量合格证号1112512011001913, 购自中国食品药品检定研究院(许可证号: SCXK (京) 2017-0005)。饲养于独立通气笼具(461 mm×274 mm×229 mm), 保持实验室环境温度为22 ℃, 湿度为50%左右。所有动物喂养3周适应饲养环境, 自由饮水和食用商业饲料。实验给药前, 禁食12~16 h, 自由饮水。所有动物实验过程和动物关怀均得到中国中医科学院中药研究所伦理委员会的批准。实验后, 所有动物施行安乐死。
大鼠股动脉和股静脉置管 大鼠称重后, 麻醉(异氟烷, 5%诱导和2.5%维持), 将PU管植入大鼠左侧股动脉和股静脉中, 然后将管路从大鼠背部引出, 连上大鼠血管通道马甲, 肌内注射硫酸庆大霉素注射液0.1 mL, 恢复性饲养备用。股动脉置管用于自动采血, 股静脉置管用于静脉给药。
小动物自动采血仪参数设置 采血体积为200 μL, 采血及补液速度为375 μL·min-1, 保持血管畅通模式及速度为200 μL·h-1, 低损失模式, 预抽体积为5 μL, 空气推进量为150%样品量, 样品收集室温度为4~6 ℃。含100 U·mL-1肝素钠的生理盐水用于大鼠采血管的封管, 含10 U·mL-1肝素钠的生理盐水用于大鼠采血过程中的补液。
GC-MS检测方法 色谱柱为Aglient DB-5ms色谱柱(30 m×0.25 mm, 0.25 μm); 载气为高纯度氦气(> 99.5%), 进样口温度为260 ℃; 程序升温梯度洗脱程序(初始60 ℃; 以50 ℃·min-1的速度升温至160 ℃, 保持3 min; 之后260 ℃, 保持3 min; 最后降至60 ℃, 总运行时间为13 min), 流速为0.15 mL·min-1; 脉冲不分流模式, 脉冲压力25 psi (1 psi ≈ 6.9 kPa), 加压时间0.75 min, 吹扫流量60 mL·min-1, 时间1 min, 进样量为2 μL。采用电子轰击离子源(EI) 电离, 单离子监测(SIM) 模式扫描, 正离子方式检测。电子轰击能量70 eV, 离子源温度230 ℃, 四极杆温度150 ℃。选择监测的离子为m/z 128 (内标萘, 监测时间段2.5~3.5 min) 和m/z 93 (β-榄香烯, 监测时间段3.5~5.0 min)。
内标溶液、对照品溶液和质量控制(QC)样品的配制 取萘标准溶液适量, 加适量正己烷逐级稀释, 得到200 ng·mL-1的内标溶液。精密称取β-榄香烯约20 mg, 精密称定, 加适量正己烷溶解后定容, 进行逐级稀释, 得到对照品系列溶液, 然后取部分对照品溶液加入一定量的空白血浆混匀制备最低定量限(limit of quantification, LOQ, 1.0 ng·mL-1)、低浓度质控(LQC, 2.0 ng·mL-1)、中浓度质控(MQC, 40 ng·mL-1) 和高浓度质控(HQC, 240 ng·mL-1) 样品, 以上-80 ℃冰箱中保存备用。
生物样品前处理 血浆样品在室温下融化后, 涡旋混匀, 精密吸取90 μL, 置于250 μL圆底玻璃小管中, 加入内标溶液10 μL, 加入正己烷50 μL, 3 000 r·min-1涡旋振荡3 min, 4 ℃、2 000 ×g离心5 min, 然后取有机层于尖底玻璃小管中, 4 ℃、20 000 ×g离心10 min, 取上清待测。
不同体积萃取溶剂对MS响应及萃取回收率的影响 取含β-榄香烯和萘均为100 ng·mL-1的血浆样品100 μL, 分别加入25、50、100、200和300 μL的正己烷(溶剂-样品体积比分别为0.25、0.5、1、2和3), 按“生物样品前处理”项下方法操作, 另用正己烷配置同等浓度的对照品溶液, 按上述方法测定, 每份样品平行制备3份, 考察不同体积萃取溶剂对内标和β-榄香烯MS响应和萃取回收率的影响。
方法学考察
选择性 取大鼠空白血浆90 μL, 按“生物样品前处理”项下方法操作, 获得大鼠空白血浆的色谱图; 将内标及LOQ浓度的对照品溶液加入大鼠空白血浆中, 依同法操作, 得色谱图; 取受试大鼠给药的血浆样品, 同法操作, 得色谱图, 考察分析方法的选择性。
线性范围及定量限 取大鼠空白血浆90 μL, 加入对照品溶液适量, 配制成相当β-榄香烯质量浓度约为1、2.5、5、10、25、50、100和250 ng·mL-1的模拟生物样品, 按“生物样品前处理”项下方法操作, 按上述方法测定, 以生物样品中待测药物的浓度X, 待测物与内标的峰面积比值为纵坐标Y, 用加权最小二乘法(权重系数为1/X)作直线回归, 求得的回归方程即为标准曲线, 根据信噪比为10及连续进样6次的RSD判定各成分的LOQ。
基质效应、准确度与精密度、稳定性 取空白血浆制备的LOQ、LQC、MQC及HQC样品, 按“生物样品前处理”项下方法操作, 得到内标和β-榄香烯的色谱峰面积A; 取空白血浆, 按“生物样品前处理”项下方法操作, 正己烷萃取后的上清液加入与上述相应等浓度的对照品和内标溶液, 得到内标和β-榄香烯的色谱峰面积B; 取用纯水制备的LOQ、LQC、MQC及HQC样品, 按“生物样品前处理”项下方法操作, 得到内标和β-榄香烯的色谱峰面积C; A与B的比值即为提取率, B与C的比值即为基质效应。LOQ样品和QC样品1日之内测定6次, 以及连续3天测定, 计算日内、日间精密度和准确度。LOQ样品和QC样品处理后在样品室放置12 h再次测定, 计算回收率, 分析处理后样品的稳定性。以上所有样品平行制备6份。
药代动力学及生物利用度研究 大鼠随机分为香茅草提取物灌胃给药组和静脉注射给药组, 每组6只。香茅草提取物组用甘油-生理盐水溶剂(含甘油10%和生理盐水90%) 制备, 按提取物80 μL·kg-1大鼠(合β-榄香烯55 mg·kg-1) 灌胃(每只大鼠2.5 mL) 和股静脉注射(每只大鼠1.0 mL) 给药。大鼠给药后5、10、15、30 min及1、2、3、4、6、8、10、12、16、20和24 h, 用小动物自动采血仪收集全血(约200 μL) 于0.5 mL的ETDA·K2抗凝管中, 4 ℃、2 000 ×g离心15 min, 取上清血浆, 于-80 ℃冻存。另取6只空白大鼠, 按上述方法制备大鼠空白血浆样品。
数据分析 药代参数采用DAS软件(版本3.0, 上海博佳医药科技有限公司) 的非房室模型计算。最大血药浓度(Cmax) 和达峰时间(tmax) 均为实测值, 时间浓度曲线下面积(AUC) 采用梯形法计算。数据以均值±标准差形式表示。统计学分析用方差分析及非参数检验, P < 0.05有统计学意义, P < 0.01有显著统计学意义。数据处理和绘图软件为Origin Pro 2019 (版本9.6.5.169, 美国OriginLab公司)。
结果 1 液液微萃取方法提高样品检测的灵敏度不同体积萃取溶剂对血浆中内标萘和β-榄香烯MS响应及萃取回收率的影响, 结果见图 1。可知, 随着正己烷体积的减少, 内标萘和β-榄香烯的MS响应快速升高, 而萃取回收率内标稳定在75%左右, β-榄香烯在60%~69%之间, 这说明微小体积的萃取溶剂也能实现对血浆中内标和β-榄香烯的充分和稳定萃取。因此, 在减少检测系统污染的前提下, 为尽可能增加β-榄香烯MS响应, 提高样品检测的灵敏度, 本文选择萃取溶剂和血浆比为0.5, 即液液微萃取的前处理方法, 以萘为内标进行血浆中β-榄香烯的提取。
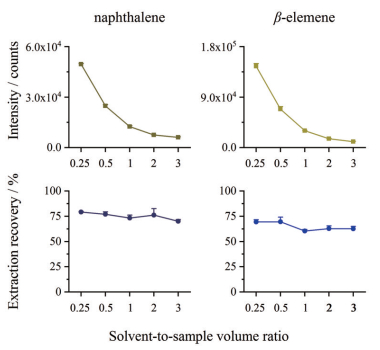
|
Figure 1 Effect of organic solvent-to-plasma volume ratio on the MS intensity and extraction recovery for β-elemene and internal standard (naphthalene) in rat plasma samples |
MS扫描结果显示β-榄香烯的分子离子峰为204, 基峰为93, 内标萘的分子离子峰和基峰均为128, 因此选择93和128离子监测β-榄香烯和内标萘。经过GC的分离, β-榄香烯在大鼠血浆中的色谱图如图 2所示, 可知本方法β-榄香烯和内标的峰形及分离效果良好, β-榄香烯的出峰时间约为4.50 min, 内标的出峰时间约为3 min, 大鼠血浆中的内源性物质、代谢产物等不干扰以上物质的检出。
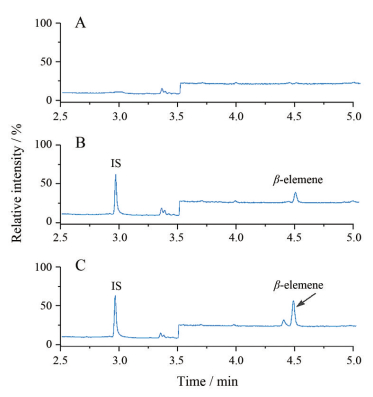
|
Figure 2 GC-MS chromatograms of β-elemene in blank plasma samples (A), blank plasma samples spiked with internal standard (IS, naphthalene) and standard (LOQ, 1 ng·mL-1) (B), and plasma samples obtained 4 h after intragastric administration of citronella grass extract in rats (C) |
血浆中β-榄香烯的线性范围为1.0~250 ng·mL-1。典型的标准曲线回归方程为Y= 2.765 8 X + 0.235 4 (r = 0.997 0), 按信噪比10和连续进样6次RSD小于15%的LOQ为1.0 ng·mL-1。
2.3 提取率与基质效应血浆中β-榄香烯的提取率和基质效应结果见表 1, 提取率在56.02%~66.89%之间, 基质效应为94.28%~108.63%。
| Table 1 Extraction efficacy, matrix effect, accuracy, precision and stability results of β-elemene in rat plasma (n = 6). LOQ: Limit of quantification; LQC: Low concentration quality control; MQC: Medium concentration quality control; HQC: High concentration quality control |
血浆中β-榄香烯检测的准确度, 仪器的日内、日间精密度及稳定性结果见表 1, 可知准确度在-4.47% ~ -0.85%以内, 日内和日间精密度均在12%以内, 表明样品前处理方法准确、稳定可行。处理后的样品放置12 h的回收率在91.86%~105.46%以内, 表明样品处理后稳定性良好。
3 药代动力学及生物利用度大鼠灌胃静脉注射香茅草提取物(β-榄香烯55 mg·kg-1), β-榄香烯的平均药时曲线见图 3, 主要药代动力学参数见表 2。灌胃香茅草提取物大鼠血浆中β-榄香烯达峰速度较快, 约在1.67 h达峰, 浓度为7.36 ng·mL-1, 而静脉注射的峰浓度是其30多倍(P < 0.01); 半衰期约为2.73 h, 清除速度较快约1.95 L·h-1·kg-1, 表观分布容积较大约7.4 L·kg-1, 体内滞留时间短约2.76 h, 绝对生物利用度约为8%。大鼠口服香茅草提取物后β-榄香烯的药代动力学性质不佳, 生物利用度较低。
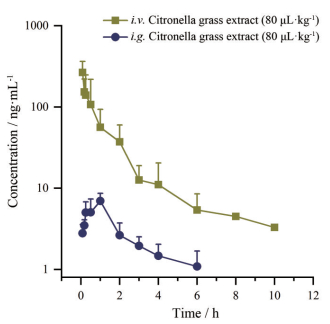
|
Figure 3 Mean plasma concentration-time curves of β-elemene after intragastric and intravenous administration of citronella grass extract at dosage of 80 μL·kg-1 in rats. n= 6, x± s |
| Table 2 Pharmacokinetics parameters of β-elemene after intragastric and intravenous administration of citronella grass extract at dosage of 80 μL·kg-1 in rats. n = 6, x± s. **P < 0.01 vs iv |
关于生物样品中β-榄香烯的分析方法有气相色谱法[8]、高效液相色谱法[9]等。最近, 也有用GC-MS方法检测血浆中β-榄香烯的报道[10, 11]。这些分析方法的样品前处理操作大都是液液萃取技术, 特点是需大量的萃取溶剂、加入饱和盐、多次提取以及溶剂吹干等复杂的前处理操作, 分析方法的定量限最低的仅为31.25 ng·mL-1 [10]。因此, 为深入了解香茅草提取物的药代动力学特征, 亟需建立简单、灵敏和准确的β-榄香烯血药浓度分析方法。
液液微萃取技术是基于两相溶剂不相容的原理, 使待测物质转移到较少的萃取溶剂中, 和传统使用3~10倍体积萃取溶剂的方法相比, 液液微萃取不仅能节省大量有机溶剂, 减少繁琐的前处理操作, 还能使样品得到富集, 提高样品检测的灵敏度[12]。应用液液微萃取技术进行生物样品的前处理已有相关报道, 如用于中药冰片中龙脑、异龙脑、樟脑等挥发性化合物的提取, 槲皮素、银杏内酯A等非挥发性化合物的提取等等[13, 14]。而液液微萃取用于生物样品中β-榄香烯提取的研究尚未见报道。本文基于液液微萃取技术, 使用0.5倍血浆体积的正己烷对血浆中β-榄香烯进行提取和富集; 并且优化了GC的进样体积(脉冲进样2 μL峰型较好, 而3 μL时峰型较差), 提高了样品检测的灵敏度, 最终使β-榄香烯检测的LOQ低至1 ng·mL-1, 和文献相比提高了30倍[10]。但使用液液微萃取技术制备的样品, 需注意MS基质效应以及系统耐用性分析等, 本研究未见明显的基质效应影响, 进样分析约300个样品, 未见明显的柱效降低现象。
本文建立的β-榄香烯的GC-MS分析方法, 经验证符合生物样品分析方法指导原则的要求[15], 可满足大鼠灌胃香茅草提取物后血浆中较低浓度β-榄香烯的样品检测(Cmax低于10 ng·mL-1), 完整绘制了血浆中β-榄香烯的药时曲线, 成功用于香茅草提取物中β-榄香烯的药代动力学特征研究。口服香茅草提取物大鼠血浆中β-榄香烯的主要药代学参数, 如表观分布容积为(3.8~9.8) L·kg-1, 远大于大鼠的体液体积(0.67 L·kg-1)[16], 说明β-榄香烯在大鼠体内分布广泛, 这已有组织分布的实验结果证实[17]。血浆中消除快(半衰期为2.73 h), 生物利用度低(小于10%)。文献表明β-榄香烯的溶解度不好, 测定的油水分配系数(LogP) 较大(LogP = 2.29~2.69)[18], 不易透过Caco-2单层细胞膜[19], 在体内可发生生物转化[17], 以上可能是其生物利用度低的主要原因。同样, 结果也提示香茅草提取物的进一步开发需注意β-榄香烯的生物利用度。目前, 为提高β-榄香烯口服生物利用度的香茅草提取物的滴丸、肠溶滴丸及纳米脂质体等制剂正在研究开发阶段[20]。
总之, 基于液液微萃取结合GC-MS的方法简便、准确, 灵敏度高, 适用于香茅草提取物中β-榄香烯在大鼠体内的药代动力学特征和生物利用度研究, 也可为后期香茅草提取物制剂和其他含β-榄香烯制剂的研究提供方法参考。
作者贡献: 杨伟鹏和李涛提供了研究思路, 所有作者参与了本项研究的设计, 李涛收集和分析了大部分数据并撰写了论文, 李涛和杨伟鹏讨论了研究结果并修订了论文。
利益冲突: 无任何利益冲突。
| [1] |
Chinese Materia Medica Editorial Board of National Administration of Traditional Chinese Medicine. Chinese Materia Medica (中华本草)[M]. Shanghai: Shanghai Scientific & Technical Publishers, 1999: 335-337.
|
| [2] |
Xiang JM, Zheng XL, Wei JH, et al. Research progress in Cymbopogon citratus (DC.) Stapf and lemongrass tea[J]. Mod Tradit Chin Med Mater Med World Sci Technol (世界科学技术-中医药现代化), 2017, 19: 874-879. |
| [3] |
Xu H, Feng Z. Anticancer drug elemene and its preparation method: CN, 1413580A[P]. 2003-04-30.
|
| [4] |
Zhang WZ, Huang XX, Chen B, et al. Combination of Chinese and western medicine to prevent and reverse resistance of cancer cells to anticancer drugs[J]. Chin Sci Bull (科学通报), 2020, 65: 1845-1856. DOI:10.1360/TB-2020-0455 |
| [5] |
Huo WM, Duan WL, Liu J, et al. Studies on the anticoagulant and antithrombotic effects of β-elemene[J]. Asia-Pacific Tradit Med (亚太传统医药), 2013, 9: 30-33. |
| [6] |
Mao LF, Huo WM, Liu J, et al. Study on the antioxidant effects of β-elemene[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2012, 17: 727-731. |
| [7] |
Wang K, Su CY. Pharmacokinetics and disposition of β-elemene in rats[J]. Acta Pharm Sin (药学学报), 2000, 35: 725-728. |
| [8] |
Wang K, Su CY. Determination of β-elemene in biological specimens by gas chromatography[J]. Chin J Pharm Anal (药物分析杂志), 1998, 18: 394-395. |
| [9] |
Wang YZ, Zheng JX, Deng YH, et al. Determination of β-elemene in mouse tumor by HPLC[J]. Chin Hosp Pharm J (中国医院药学杂志), 2007, 27: 1246-1248. |
| [10] |
Chen ZH, Song YX, Che JJ, et al. Validation of a sensitive gas chromatographic-mass spectrometric method for the simultaneous determination of β-elemene and β-elemenal in human plasma[J]. J Chromatogr B, 2009, 877: 408-414. DOI:10.1016/j.jchromb.2008.12.038 |
| [11] |
Li J, Liu WJ. Determination of plasma concentration of β-elemene in Curcuma zedoaria by GC-MS and its pharmacokinetic study in rats[J]. Chin J Pharm Anal (药物分析杂志), 2019, 39: 846-851. |
| [12] |
Soares da Silva Burato J, Vargas Medina DA, de Toffoli AL, et al. Recent advances and trends in miniaturized sample preparation techniques[J]. J Sep Sci, 2020, 43: 202-225. DOI:10.1002/jssc.201900776 |
| [13] |
Seidi S, Rezazadeh M, Yamini Y. Pharmaceutical applications of liquid-phase microextraction[J]. Trends Anal Chem, 2018, 108: 296-305. DOI:10.1016/j.trac.2018.09.014 |
| [14] |
Cheng C, Liu XW, Du FF, et al. Sensitive assay for measurement of volatile borneol, isoborneol, and the metabolite camphor in rat pharmacokinetic study of Borneolum (Bingpian) and Borneolum syntheticum (synthetic Bingpian)[J]. Acta Pharmacol Sin, 2013, 34: 1337-1348. DOI:10.1038/aps.2013.86 |
| [15] |
Chinese Pharmacopoeia Commission. Guiding Principles for Quantitative Analysis of Biological Samples[S]//Pharmacopoeia of the People's Republic of China (中华人民共和国药典). Vol IV. 2020 Ed. Beijing: China Medicine Science and Technology Press, 2020: 466-472.
|
| [16] |
Davies B, Morris T. Physiological parameters in laboratory animals and humans[J]. Pharm Res, 1993, 10: 1093-1095. DOI:10.1023/A:1018943613122 |
| [17] |
Wang K, Li Z, Chen YR, et al. The disposition, metabolism, and pharmacokinetics of a novel anti-tumor agent, β-elemene, in Sprague-Dawley rats[J]. Biopharm Drug Dispos, 2005, 26: 301-307. DOI:10.1002/bdd.463 |
| [18] |
Wang XM, Deng YJ, Zhao CJ, et al. Determination of the oil-water partition coefficients of β-elemene[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2005, 22: 289-290, 320. |
| [19] |
Leng W, Zheng Y, Li SP, et al. Study on absorption mechanisms of zedoary turmeric oil by Caco-2 cell model[J]. Chin Pharm J (中国药学杂志), 2007, 42: 1228-1232. |
| [20] |
Feng X, Xu JY, Yao H, et al. A new elemene nano-liposome and its preparation method: CN, 111358757A[P]. 2020-07-03.
|
 2021, Vol. 56
2021, Vol. 56


