2. 西安交通大学医学部药学院, 陕西 西安 710061
2. School of Pharmacy, Health Science Center, Xi'an Jiaotong University, Xi'an 710061, China
炎症性肠病(IBD), 包括溃疡性结肠炎和克罗恩病, 是一种慢性非特异性炎症性疾病, 可导致肠道黏膜溃疡和肠道功能的进行性破坏[1]。在过去十年, IBD在全球的发病率呈逐年上升趋势, 且患病人群越来越趋于年轻化, 已经成为消化系统常见疾病, 给医疗保健系统带来了巨大的财政和资源负担[2]。IBD病因复杂, 与遗传易感性、免疫应答失衡、肠道菌群失调、环境因素等多种因素相关[3], 目前缺乏对该病的最佳治疗, 被世界卫生组织列为现代难治病之一。然而越来越多的证据表明, 肠道菌群失调引发肠道胆汁酸代谢紊乱在IBD的发病机制中起重要作用[4]。
芍药苷(peoniflorin) 是白芍Paeoniae Radix Alba和赤芍Paeoniae Radix Rubra的主要有效成分, 是一种水溶性单萜类糖苷[5]。芍药苷具有解痉镇痛、抗炎、抗氧化、降血糖、神经保护、保肝等药理作用[6], 以毒性低疗效好的优点受到了广泛关注。近期大量研究表明, 芍药苷对溃疡性结肠炎动物具有显著疗效, 目前报道的作用机制主要集中在抗炎和调节免疫功能两方面[7, 8]。然而, 关于芍药苷的药代动力学研究发现由于低通透性和P-糖蛋白的外排作用, 芍药苷不易吸收, 口服生物利用度低至3%~4%, 粪便中的药物含量远远高于大鼠血浆中药物的含量[9]。因此芍药苷发挥药效的首要部位可能在肠道。本研究采用16S rDNA焦磷酸测序技术结合靶向胆汁酸代谢组学分析结肠炎小鼠肠内容物样本中肠道菌群多样性和胆汁酸分子的含量, 研究芍药苷对结肠炎小鼠肠道菌群多样性和胆汁酸代谢的干预作用, 以期从肠道微环境的角度揭示芍药苷改善结肠炎的作用机制。
材料与方法主要实验试剂 芍药苷(纯度 > 95.0%) 购自上海源叶生物科技有限公司(批号S315885); 5-氨基水杨酸购自上海阿拉丁生化科技股份有限公司(批号A129982);右旋葡聚糖硫酸钠(dextran sodium sulfate, DSS) 购自美国MP Biomedicals公司(批号0216011080);荧光素异硫氰酸酯(FITC)-葡聚糖购自美国Sigma-Aldrich公司(批号68059); 髓过氧化物酶(myeloperoxidase, MPO, 批号JL10367)、肿瘤坏死因子-α (tumor necrosis factor alpha, TNF-α, 批号JL10484)、白细胞介素-1β (interleukin 1 beta, IL-1β, 批号JL13044)、白细胞介素-6 (interleukin 6, IL-6, 批号JL18212) 和白细胞介素-10 (interleukin 10, IL-10, 批号JL20242) 的ELISA试剂盒均购自上海江莱生物科技有限公司; 胆汁酸对照品均购自上海甄准生物科技有限公司, 包括猪磺去氧胆酸(THDCA, 批号ZS-20027)、牛磺猪胆酸钠盐(THCA, 批号ZS-20025)、7-酮基石胆酸(7-ketoLCA, 批号ZS-20043)、胆酸(NorCA, 批号IR-14909)、牛磺脱氧胆酸钠盐(TDCA, 批号IR-15583)、猪去氧胆酸(HDCA, 批号ZS-20019)、甘氨结合型猪胆酸(GHCA, 批号ZS-20022)、去甲脱氧氯酸(23norDCA, 批号IR-30205)、异羟胆酸(isoLCA, 批号ZS-20053)、12-酮基石胆酸(12-ketoLCA, 批号ZS-20044)、别石胆酸(alloLCA, 批号ZS-20054)、硫酸化石胆酸(LCA_S, 批号IR-15705)、脱氧胆酸(DCA, 批号IR-14896)、甘氨石胆酸(GLCA, 批号IR-14913)、牛磺鹅脱氧胆酸(TCDCA, 批号IR-14900)、甘氨熊脱氧胆酸(GUDCA, 批号IR-14906)、鹅脱氧胆酸(CDCA, 批号IR-14897)、胆酸(CA, 批号IR-14894)、牛磺熊脱氧胆酸(TUDCA, 批号IR-15611)、鹅去氧胆酸-3-β-D-葡萄糖醛酸化合物(CDCA-3Gln, 批号IR-15687)、石胆酸(LCA, 批号IR-14895)、3β-熊去氧胆酸(βUDCA, 批号IR-15342)、甘氨鹅脱氧胆酸(GCDCA, 批号ZS-20040)、甘氨胆酸(GCA, 批号IR-14924)、牛磺石胆酸(TLCA, 批号IR-14912)、熊去氧胆酸(UDCA, 批号IR-15342)、去氧胆酸(3-DHCA, 批号IR-14896)、猪胆酸(HCA, 批号ZS-20020)、α-鼠胆酸(α-MCA, 批号ZS-20001)、β-鼠胆酸(β-MCA, 批号ZS-20003)、牛磺胆酸(TCA, 批号IR-14312)、牛磺-α-鼠胆酸钠盐(T-α-MCA, 批号ZS-20002)、甘氨脱氧胆酸钠盐(GDCA, 批号IR-14908)。
实验动物 雄性C57BL/6小鼠, SPF级, 6~8周龄, 体重18~22 g, 由西安交通大学实验动物中心提供。许可证号: SCXK (陕) 2018-001。动物饲养室内保持相对湿度55% ± 5%, 建立正常的昼夜节律以维持小鼠正常活动。所有对动物的处理和操作均通过西安交通大学伦理委员会的批准(批准号: XJTU2019-679)。
造模方法与样品采集 小鼠按体重随机分为5组(n= 8): 正常组(Ctrl)、模型组(Colitis)、芍药苷低剂量组(PF-L, 25 mg·kg-1·d-1)、高剂量组(PF-H, 50 mg·kg-1·d-1) 和阳性药组(5-ASA, 50 mg·kg-1·d-1)。正常组小鼠给予去离子水7天, 其余组小鼠给予自由饮用3% DSS溶液7天, 建立急性结肠炎小鼠模型。在造模的同时, 给药组以灌胃的方式连续给药7天, 而正常组与模型组连续灌胃去离子水7天。按照Cooper等[10]方法, 给药期间每天监测体重和疾病活动指数(disease activity index, DAI, 表 1), 包括体重下降、粪便软硬度及便血程度。实验结束后, 动物颈椎脱臼处死, 获得新鲜脾脏用于重量测量、结肠组织用于重量和长度测量。随后迅速将结肠组织及收集结肠内容物样品于-80 ℃保存, 用于后续生化分析、肠道菌群分析以及靶向胆汁酸代谢组学分析。
| Table 1 Scoring method of disease activity index |
病理学检测指标 收集结肠组织, 将其置于以PBS为缓冲液的10%福尔马林溶液中固定48 h, 然后以浓度梯度酒精脱水, 将组织块置于二甲苯中替换出组织中酒精, 包埋于石蜡当中。将切下的3~4 μm厚的切片进行HE染色, 采用切片扫描仪(Pannoramic DESK, P-MIDI, P250) 对切片扫描成像, 根据溃疡大小、炎性浸润和组织损伤程度等对结肠病变损伤程度进行比较。
结肠中炎性因子的测定 采用ELISA方法按照试剂盒上的说明分别检测不同组小鼠结肠组织中的MPO活性以及TNF-α、IL-1β、IL-6、IL-10的浓度。
肠通透性检测 小鼠禁食禁水4 h, 然后口服4 kDa的FITC-葡聚糖(60 mg·100g-1)。5 h后眼眶取血, 收集血清, 测定荧光强度(激发波长492 nm, 发射波长525 nm)。并通过连续稀释FITC-葡聚糖制备的标准曲线, 测定血清中的FITC-葡聚糖浓度。
肠道菌群检测 按照课题组前期报道的方法[11]进行16S rDNA测序分析。使用试剂盒(TIANamp Stool DNA Kit) 从小鼠粪便中提取细菌DNA。使用V4或V3-V4可变区引物扩增分离的DNA。使用通用引物338F (5'-ACTCCTACGGGAGGCAGCA-3') 和806R (5'-GGACTACHVGGGTWTCTAAT-3') 扩增16S rDNA基因的V3-V4区。扩增程序如下进行: 在95 ℃初次变性3 min, 在95 ℃变性30 s循环30次, 在55 ℃退火30 s, 在72 ℃引物延伸45 s循环30次。使用Ampure XP珠子纯化扩增子, 并使用Qubit dsDNA HS分析试剂盒用Qubit 3.0荧光计进行定量, 然后由中国北京诺禾致源生物信息有限公司在Illumina Hiseq PE300平台上完成测序。
测序数据的生物信息分析: 基于微生物组分析平台QIIME2 2018.4 (Quantitative Insights Into Microbial Ecology, USA) 分析了原始序列。使用q2-dada2插件对已测序的序列进行去噪并用DADA2进行质量过滤, 该插件可删除低质量序列(每50 bp滑动窗口中的平均质量得分 < 25), 如引物序列、嵌合序列和保留独特的从头序列变异。此外, 其余的独特序列通过分类sklearn对Greengenes 13_8 99% OTU (Operational Taxonomic Units, 操作分类单元) 参考序列进行了分类, 最后生成了一个特征表, 用于相对丰度图和进一步分析。使用QIIME2相关通道计算α-多样性指数。采用Bray-Curtis PCoA主坐标分析等生物信息学方法对不同组别小鼠的肠道菌群进行分析。
靶向胆汁酸代谢组学检测 代谢物提取采用液氮研磨样本, 准确称取样本100 mg, 加入到0.9 mL质谱水中, 涡旋混匀, 为10倍稀释样本, 再取其中10 μL, 加入质谱水190 μL, 涡旋混匀, 为200倍稀释样本; 分别取10倍稀释样本和200倍稀释样本100 μL, 各加入含混合内标溶液的沉淀剂(乙腈-甲醇= 8∶2) 500 μL, 涡旋混匀, 12 000 r·min-1离心10 min, 取全部上清氮气吹干; 加入复溶剂(水-乙腈= 8∶2, 含0.1%甲酸) 100 μL, 涡旋混匀, 离心取上清, LC-MS分析(其中THDCA、NorCA、TDCA、23norDCA、NorCA、TUDCA、GCA、UDCA、3_DHCA、GDCA使用稀释10倍的样本进行检测, 其余物质用稀释200倍的样本进行检测)。
采用AB SciexExionLCTMAD液相色谱串联AB SciexQTRAP 6500+质谱仪, AgelaVenusilMPC18 (2.1 mm×100 mm, 2.5 μm) 色谱柱, 柱温箱设定为50 ℃, 流动相由0.1%甲酸水溶液(A)-乙腈(B) 组成, 梯度洗脱(v/v): 0 min, 80% A; 0.5 min, 80% A; 1.0 min, 65% A; 2.5 min, 63% A; 4.1 min, 62% A; 5.0 min, 62% A; 6.0 min, 61% A; 6.5 min, 60% A; 8.5 min, 56% A; 9.0 min, 55% A; 9.5 min, 48% A; 11.5 min, 45% A; 12.5 min, 0% A; 15.0 min, 0% A; 15.1 min, 80% A; 17.0 min, 80% A, 进样体积为2 μL, 流速为0.5 mL·min-1。质谱采用电喷雾电离源(ESI), 负离子电离模式。离子源温度550 ℃, 离子源电压-4 500 V, 气帘气207 kPa, 雾化气和辅助气均为448 kPa。采用多反应监测(MRM) 扫描模式对小鼠粪便中的胆汁酸谱进行测定。最后采用SCIEX OS软件和Microsoft Excel对后续数据进行分析。
数据处理及分析 采用R语言(v.3.5.2) 对16S测序结果以及胆汁酸靶向代谢组学结果进行分析并实现可视化。对于其他数据, 采用单向或双向方差分析(ANOVA) 评估不同组间的差异, 然后采用Dunnett多重比较检验。使用Graphpad prism 8.4 (Graphpad, San Diego, CA) 进行统计分析。P < 0.05为差异有统计学意义, 所有数据均以平均值± SEM表示(n = 8)。
结果 1 芍药苷对结肠炎小鼠疾病症状的缓解作用采用3% DSS诱导结肠炎模型期间, 正常组小鼠体重持续增长(图 1A); 模型组小鼠体重增长较正常组缓慢, 并伴随严重的腹泻和血便等症状, DAI随DSS诱导时间逐渐升高(图 1B), 说明采用DSS成功诱导了结肠炎小鼠模型。分别采用芍药苷与阳性药干预后结肠炎小鼠体重增长趋势明显高于模型组, 芍药苷高剂量组在第4~6天体重几乎与正常组保持一致。药物治疗组的DAI与模型组有显著差异, 表明芍药苷具有良好的治疗效果(图 1B)。结肠组织肉眼观察结果: 正常组结肠外观正常, 未见粘连及充血; 模型组结肠充血较严重, 肠黏膜和肌层明显变薄, 颜色加深; 而给药组小鼠结肠颜色及形态均趋于正常。结肠重量与长度的比值可反映结肠的肿胀程度, 在模型组中的小鼠结肠的重量-长度比明显增加, 芍药苷和阳性药对照组可以明显降低结肠的重量-长度比, 说明芍药苷和阳性药可以有效缓解结肠炎小鼠的结肠肿胀(图 1C)。脾脏重量是衡量全身炎症的重要指标之一, 脾肿大在结肠炎患者中很常见[12], 通过对各组小鼠脾脏的测量发现, 模型组小鼠的脾脏变大, 而治疗组及阳性给药组可以显著缓解结肠炎小鼠脾肿大的现象(图 1D)。对各组小鼠结肠组织HE染色结果如图 1E, 正常组小鼠结肠黏膜完整, 基层结构正常, 未见炎症症状; 模型组小鼠的结肠隐窝消失, 黏膜变薄并出现炎性细胞浸润; 而芍药苷治疗组和阳性给药组小鼠结肠黏膜结构、黏膜损伤及炎性细胞浸润均获得显著改善。

|
Figure 1 PF improves the symptoms of DSS-induced colitis in mice. (A) Daily changes of body weight in different groups; (B) Daily changes of disease activity index (DAI) in different groups; (C) Macroscopic observations of colon and ratios of colon weight to length; (D) Ratio of spleen to body weight; (E) Representative pictures of H & E-stained colon tissue. Scale bar = 100 μm. Data represent the mean ± SEM (n = 8). *P < 0.05, **P < 0.01, ***P < 0.001 vs Ctrl group, #P < 0.05, ##P < 0.01, ###P < 0.001 vs Colitis group. Ctrl: Normal group; PF-L: Low dose of paeoniflorin group; PF-H: High dose of paeoniflorin group; 5-ASA: 5-Aminosalicylic acid group |
髓过氧化物酶(myeloperoxidase, MPO) 是炎性细胞浸润的标志, 其活性可以反映中性粒细胞的积聚, 用于测量结肠组织的炎症程度[13], 检测结果发现模型小鼠结肠黏膜的MPO活性显著增强, 采用芍药苷或阳性药干预后可以有效减弱结肠炎小鼠的MPO活性(图 2A)。ELISA炎性因子检测结果表明, 与正常组小鼠相比, 模型组小鼠的促炎因子水平, 包括TNF-α、IL-1β和IL-6, 均明显升高, 抑炎因子IL-10水平显著降低。而芍药苷与阳性药均显著逆转这一趋势(图 2B), 表明芍药苷对小鼠的结肠炎症有显著抑制作用。

|
Figure 2 PF alleviates colonic inflammation in DSS-induced colitis mice. (A) MPO activity in colonic tissues; (B) Inflammatory cytokine concentrations in colonic tissues. Data represent the mean ± SEM (n = 8). ***P < 0.001 vs Ctrl group, #P < 0.05, ##P < 0.01, ###P < 0.001 vs Colitis group. MPO: Myeloperoxidase; TNF-α: Tumor necrosis factor alpha; IL-1β: Interleukin 1 beta; IL-6: Interleukin 6; IL-10: Interleukin 10 |
肠屏障功能损伤在结肠炎中具有重要作用, 通过FITC标记的葡聚糖对小鼠体内肠渗透性进行检测, 用于评估肠屏障功能。结果表明, 与前期报道一致[14], DSS诱导的模型组小鼠血清中FITC-葡聚糖的含量显著升高, 表明该组小鼠的肠屏障功能减弱, 肠通透性增加(图 3)。与模型组相比, 芍药苷治疗的小鼠血清中的FITC-葡聚糖水平显著下降(图 3), 表现出较低的肠渗透性, 这一结果表明芍药苷可以有效修复DSS诱导的结肠炎小鼠肠屏障功能破坏。

|
Figure 3 PF inhibits the intestinal barrier dysfunction in DSS-induced colitis mice. Epithelial permeability of fluorescein isothiocyanate (FITC)-dextran in mice from different groups. Data represent the mean ± SEM (n = 8). ***P < 0.001 vs Ctrl group, #P < 0.05, ###P < 0.001 vs Colitis group |
大量研究表明, 肠道微生物群在IBD的发生中起着至关重要的作用[15]。对各组菌的OTU物种进行分析, 结果显示3组共有387个OTU, 正常组、模型组及芍药苷给药组特有的OTU物种分别有1075、49和126个(图 4A)。采用主坐标分析(principal co-ordinates analysis, PCoA) 的方法分析各组小鼠肠道菌群β多样性, 用于评估各组样本间肠道菌群构成的差异。结果如图 4B所示, 模型组与正常组各样本的距离较远, 表明两组小鼠肠道菌群组成存在较大差异; 而与模型组相比, 给药组中大部分样本与正常组的样本距离更为接近, 表明芍药苷治疗后在一定程度上改变了小鼠的肠道菌群结构, 使其逐渐趋于正常菌群状态。

|
Figure 4 PF modulates the intestinal microbiota dysbiosis in DSS-induced colitis mice. (A) Venn diagram showing the unique and shared OTUs in the diverse groups; (B) Multiple sample PCoA analysis based on Bray-Curtis similarity; (C) Relative abundance of gut microbiota at the phylum level; (D) Relative abundance of gut microbiota at the genus level; (E) Ratio of Firmicutes to Bacteroides; (F) Relative abundance of the significantly-altered bacteria at the genus levels from the three groups. Data represent the mean ± SEM (n = 8). *P < 0.05, **P < 0.01 vs Ctrl group; #P < 0.05, ##P < 0.01 vs Colitis group |
为了进一步评估芍药苷对结肠炎小鼠肠道菌群的影响, 分别从门和属水平对各组菌群进行分析。门水平的结果如图 4C所示, 各组小鼠的肠道中厚壁菌门(Firmicutes) 和拟杆菌门(Bacteroidetes) 约占总门水平的80%以上, 是最丰富的两种门。与正常组相比, 模型组中的厚壁菌门丰度未有显著变化, 但拟杆菌门丰度显著上调, 且厚壁菌门与拟杆菌门的比例有所降低, 这一趋势与临床IBD患者以及动物模型一致[16, 17]。经芍药苷治疗后, 厚壁菌门与拟杆菌门的比例发生显著上调(图 4E), 提示芍药苷干预有助于调节结肠炎小鼠的肠道菌群比例失衡。属水平共检测到乳酸杆菌(Lactobacillus)、链球菌(Streptococcus)、拟杆菌(Bacteroides)、布劳特菌(Blautia)、罗姆布茨菌(Romboutsia) 等10种菌属(图 4D), 其中乳酸杆菌相对丰度较大, 为优势菌。与正常组相比, 模型组小鼠乳酸杆菌丰度显著减低至12%左右, 芍药苷干预后PF组的乳酸杆菌比例显著升高至28%左右(图 4F), 表明芍药苷干预可以提高益生菌的比例, 促进肠道菌群的恢复。此外, 与正常组相比, 拟杆菌、链球菌和布劳特菌三种菌属的丰度在DSS诱导小鼠结肠炎的模型中显著增加, 而通过芍药苷治疗后可明显逆转拟杆菌与链球菌丰度的下降, 使其恢复到正常水平。
综上所述, 芍药苷干预可以调节结肠炎小鼠的肠道菌群结构和生物多样性, 通过选择性促进益生菌乳酸杆菌的生长, 抑制拟杆菌与链球菌生长, 一定程度上逆转了结肠炎小鼠肠道菌群失调, 恢复小鼠肠道稳态。
5 芍药苷对结肠炎小鼠粪便中胆汁酸代谢紊乱的调节作用在IBD状态下, 肠道微生物结构改变, 会导致胆汁酸池构成比发生变化, 从而破坏肠道免疫平衡以及肠屏障稳态, 因此芍药苷可能通过调节肠道菌群组成, 进一步影响胆汁酸分子的代谢。本研究总共精准定量了小鼠肠内容物中21种胆汁酸分子(图 5C), 对其采用偏最小二乘法判别分析方法(partial least-squares discrimination analysis, PLS-DA) 进行分析, 结果如图 5A所示, 各组粪便样本簇居紧密, 其中疾病组与正常组胆汁酸代谢谱距离最远, 分别聚集分布于两个象限; 给予芍药苷治疗后, 结肠炎小鼠的粪便胆汁酸代谢谱有明显改变, 与疾病组相比, 给药组的整体代谢轮廓更接近正常组。因此给药组和正常组具有相似的胆汁酸代谢表型, 表明芍药苷治疗改变了结肠炎小鼠的粪便胆汁酸代谢紊乱。此外, 疾病组小鼠的初级胆汁酸与次级胆汁酸的比例有所升高(图 5B), 这一结果与前期报道一致, 表明结肠炎状态下肠道菌群失调导致代谢功能减弱, 无法将初级胆汁酸有效转化为次级胆汁酸[18]。而相对于疾病组, 芍药苷治疗后的初级胆汁酸与次级胆汁酸比例有下降的趋势, 接近正常组, 提示芍药苷干预可以促进初级胆汁酸转化为次级胆汁酸, 从而调控胆汁酸代谢紊乱。
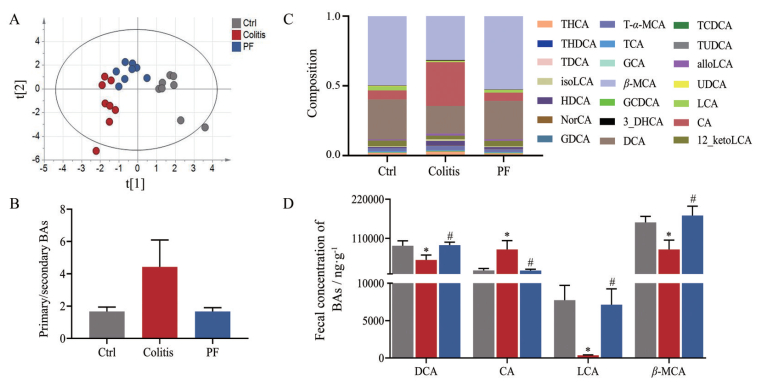
|
Figure 5 PF improves the microbial BAs dysmetabolism in DSS-induced colitis mice. (A) PLS-DA score plots for discriminating the fecal BA profiles from three groups; (B) Ratio of second/primary BAs in feces; (C) Composition of bile acid pool in feces; (D) Relative abundance of the significantly-changed BAs from different groups. Data represent the mean ± SEM (n = 8). *P < 0.05 vs Ctrl group, #P < 0.05 vs Colitis group. GCA: Glycocholic acid; CA: Cholic acid; HDCA: Hyodeoxycholic acid; isoLCA: Isolithocholic acid; NorCA: Norcholic acid; alloLCA: Allolithocholic acid; THCA: Taurohyocholic acid; T-α_MCA: Tauro-α-muricholic acid; THDCA: Taurohyodeoxycholic acid; 3_DHCA: 3-Dehydrocholic acid; GCDCA: Glycochenodeoxycholic acid; GDCA: Glycodeoxycholicacid; TUDCA: Tauroursodeoxycholic acid; TDCA: Tauroursodeoxycholic acid; TCDCA: Taurochenodeoxycholic acid; TCA: Taurocholic acid; UDCA: Ursodeoxycholic acid; β-MCA: β-Muricholic acid; DCA: Deoxycholic acid; 12_ketoLCA: 12-Ketolithocholic acid; LCA: Lithocholic acid |
进一步对各组胆汁酸分子定量分析发现, 疾病组中胆酸(CA) 含量显著上升, 而脱氧胆酸(DCA)、石胆酸(LCA) 以及β-鼠胆酸(β-MCA) 的浓度显著降低; 当芍药苷干预后, 显著逆转了结肠炎小鼠中各胆汁酸分子的变化趋势, 使其浓度趋于正常组水平(图 5D)。值得注意的是芍药苷显著上调的DCA与LCA, 这两种胆汁酸分子是G蛋白偶联胆汁酸受体(TGR5) 或法尼醇X受体(FXR) 的激动剂, 而已有研究证明TGR5与FXR对保护肠屏障及抗炎方面有非常重要的作用[19, 20]。
最后, 对胆汁酸分子与肠道菌群属水平进行相关性分析结果表明, 胆汁酸谱与肠道菌群紧密关联, 尤其是具有胆酸盐水解酶活性以及胆固醇7α-羟化酶(CYP7A1) 酶活性的乳酸杆菌[21, 22]与非结合型次级胆汁酸DCA及LCA呈显著正相关(图 6), 表明当采用芍药苷干预结肠炎小鼠后, 肠道菌群中乳酸杆菌相对丰度的上调, 促进了结合型初级胆汁酸向非结合型次级胆汁酸的转化, 从而增加肠道中DCA及LCA的生成。

|
图 6 The heatmap analysis of the Spearman correlation of fecal BAs and gut microbiota. The spot with asterisk in red refers to the significant positive correlation (R > 0.3 and P < 0.05), and green indicates negative correlation (R < -0.3 and P < 0.05) |
IBD已成为全球范围的疾病, 迫切需要开发治疗该病的有效药物。芍药苷具有显著治疗IBD的潜力[23, 24], 但由于口服生物利用度非常低, 芍药苷治疗IBD的作用机制尚不清晰, 这极大阻碍了临床采用芍药苷治疗IBD的新药开发。鉴于芍药苷在体内的吸收非常差[9], 粪便中的药物含量远远高于小鼠血浆中药物的含量, 因此肠道可能是芍药苷发挥药效的首要部位。
据估计, 人类肠道中有数万亿微生物与宿主存在共生关系, 履行健康个体的基本功能, 如营养、宿主防御和免疫发育[25, 26]。在大多数健康个体中, 99%的肠道菌群由厚壁菌门、拟杆菌门、变形菌门(Proteobacteria) 和放线菌门(Actinobacteria) 组成, 其中厚壁菌门和拟杆菌门共占约90%[27]。当肠道微生物组的多样性、组成或功能被破坏, 对个体产生负面影响时, 肠道就会失调, 例如, 肠道稳态丧失和不适当的免疫激活[28]。IBD患者表现为生物多样性下降(主要是厚壁菌门), 稳定性下降, 且变形菌门增加, 如肠杆菌科、嗜胆菌属等[17]。菌群多样性的降低导致维护肠道屏障完整性和调节宿主免疫系统的重要功能的丧失或减少。同时粘液溶解细菌和致病菌也会增加, 导致黏膜屏障受损, 使更多的病原体侵入肠道组织[17]。在本研究中, 采用16S rDNA高通量测序法对肠道菌群分析, 结果表明: 与临床IBD患者类似, DSS诱导的结肠炎小鼠模型中拟杆菌门的相对丰度上升, 而厚壁菌门与拟杆菌门的比例下降。当采用芍药苷连续干预结肠炎小鼠7天后发现, 药物可明显改善结肠炎相关肠道菌群失调, 尤其显著上调了益生菌乳酸杆菌的相对丰度, 提示芍药苷具有一定的益生元功能。目前尚未见有文献报道芍药苷对IBD动物模型中乳酸杆菌的生长有促进作用, 但近期有一项关于白芍总苷(芍药苷为主要成分) 治疗结肠炎小鼠研究发现白芍总苷对结肠炎的保护作用伴随着显著的肠道菌群结构恢复, 尤其是对乳酸杆菌相对丰度的显著上调[29], 这一报道与本研究结果完全吻合。
胆汁酸是脂肪吸收和消化所需的乳化剂, 有多种形式。它们对肠道微生物群的形成也有重要的影响[30]。肠道菌群可将初级胆汁酸转换为次级胆汁酸, 这一过程很重要, 可以将其转化为下游胆汁酸受体的配体(如抗炎信号受体FXR和TGR5)[31, 32]。结合型和非结合型胆汁酸的比例也对健康和疾病有影响; 过多的结合型胆汁酸可能会引发炎症, 并导致潜在有害细菌的大量繁殖。临床IBD患者表现为胆汁酸吸收不良, 次级非结合型胆汁酸缺乏, 肠道免疫平衡被打破, 肠屏障功能受损, 引发IBD进一步恶化[21]。本研究试图将芍药苷干预后的结肠炎小鼠体内肠道菌组成与胆汁酸代谢改变相关联, 以分析芍药苷如何改善DSS诱导的小鼠结肠炎症状、肠道炎症以及肠屏障功能破坏。在本研究中, 基于靶向胆汁酸代谢组学分析方法, 首次发现芍药苷可以显著逆转由DSS诱导的肠道内胆汁酸分子代谢异常, 并下调了结肠炎小鼠粪便中初级胆汁酸与次级胆汁酸的比例, 表明芍药苷提高了肠道菌群将初级胆汁酸转化为次级胆汁酸的能力。进一步对具有显著差异的胆汁酸分子分析发现, 芍药苷治疗后的结肠炎小鼠粪便中次级胆汁酸DCA及LCA的浓度显著升高, 而初级胆汁酸CA的浓度显著降低, 这一变化趋势符合胆汁酸分子在体内的代谢路径, 如DCA是由CA在肠道内CYP7A1酶的作用下发生7α-脱羟基化产生的, 而LCA也是通过同样的转化过程由鹅去氧胆酸(CDCA) 代谢生成的[22]。但是在本实验中并未检测到CDCA, 这可能是由于小鼠粪便中CDCA几乎全部转化为LCA, 导致CDCA含量非常低, 无法达到定量限。最后, 对各胆汁酸分子及菌属水平的肠道菌群进行相关性分析, 结果发现LCA及DCA与益生菌乳酸杆菌丰度呈显著正相关。这一发现刚好与已有报道完全吻合, 即益生菌乳酸杆菌是参与CA及CDCA发生7α-脱羟基化反应转化为DCA及LCA的主要菌群之一[21, 22]。同时, 已有大量研究表明DCA及LCA内源性胆汁酸小分子可与胆汁酸受体TGR5或FXR结合, 发挥维持肠道屏障稳态、免疫调节等功能[4], 提示芍药苷可能通过间接激活胆汁酸受体, 如TGR5或FXR, 发挥保护结肠炎小鼠肠道屏障损伤及肠道炎症的作用。
因此, 总结芍药苷治疗结肠炎的潜在作用机制为: 芍药苷口服进入结肠炎小鼠胃肠道后, 首先作用于肠道菌群, 重构肠道菌群组成, 尤其促进了体内益生菌乳酸杆菌的生长, 进一步恢复肠道菌群介导的胆汁酸代谢稳态, 尤其提高了初级胆汁酸CA和CDCA向次级胆汁酸DCA和LCA转化的能力, 从而增加了结肠炎小鼠肠道中DCA与LCA的浓度, 最后激活结肠部位潜在的胆汁酸受体(如TGR5或FXR), 发挥修复结肠炎小鼠肠屏障功能损伤, 抑制肠道炎症的作用。
作者贡献: 王欣、朱敏、董思晶和许银月负责完成相关实验研究, 董思晶负责数据采集与处理分析工作, 王欣和朱敏负责完成撰写论文工作, 景王慧和王嗣岑负责对本课题实验设计思路进行指导与修改论文工作。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Stange EF, Schroeder BO. Microbiota and mucosal defense in IBD: an update[J]. Expert Rev Gastroenterol Hepatol, 2019, 13: 963-976. DOI:10.1080/17474124.2019.1671822 |
| [2] |
Kaplan GG. The global burden of IBD: from 2015 to 2025[J]. Nat Rev Gastroenterol Hepatol, 2015, 12: 720-727. DOI:10.1038/nrgastro.2015.150 |
| [3] |
Guan Q. A comprehensive review and update on the pathogenesis of inflammatory bowel disease[J]. J Immunol Res, 2019, 2019: 7247238. |
| [4] |
Baars A, Oosting A, Knol J, et al. The gut microbiota as a therapeutic target in IBD and metabolic disease: a role for the bile acid receptors FXR and TGR5[J]. Microorganisms, 2015, 3: 641-666. DOI:10.3390/microorganisms3040641 |
| [5] |
Wu SH, Wu DG, Chen YW. Chemical constituents and bioactivities of plants from the genus Paeonia[J]. Chem Biodivers, 2010, 7: 90-104. DOI:10.1002/cbdv.200800148 |
| [6] |
Zhang YG, Zhang SJ, Bian TT, et al. New progress in pharmacological action of paeoniflorin[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 3735-3740. |
| [7] |
Xu JH, Ao H, Hong JQ, et al. Paeoniflorin inhibits lipopolysaccharide-induced microglia inflammation and phagocytosis through IL-10-STAT3 signaling pathway[J]. Chin J Biochem Mol Biol (中国生物化学与分子生物学报), 2017, 33: 169-175. |
| [8] |
Liu JQ, Zhao ZX, Wei Y, et al. Inhibitory effect of paeoniflorin on inflammatory chemokines and their receptor in a mouse model of asthma[J]. Acta Lab Anim Sci Sin (中国实验动物学报), 2016, 24: 460-464. |
| [9] |
Zhou YX, Gong XH, Zhang H, et al. A review on the pharmacokinetics of paeoniflorin and its anti-inflammatory and immunomodulatory effects[J]. Biomed Pharmacother, 2020, 130: 110505. DOI:10.1016/j.biopha.2020.110505 |
| [10] |
Cooper HS, Murthy SN, Shah RS, et al. Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J]. Lab Invest, 1993, 69: 238-249. |
| [11] |
Jing W, Dong S, Luo X, et al. Berberine improves colitis by triggering AhR activation by microbial tryptophan catabolites[J]. Pharmacol Res, 2021, 164: 105358. DOI:10.1016/j.phrs.2020.105358 |
| [12] |
Ashrafi F, Kowsari F, Darakhshandeh A, et al. Composite lymphoma in a patient with ulcerative colitis: a case report[J]. Int J Hematol Oncol Stem Cell Res, 2014, 8: 45-48. |
| [13] |
Metzler KD, Fuchs TA, Nauseef WM, et al. Myeloperoxidase is required for neutrophil extracellular trap formation: implications for innate immunity[J]. Blood, 2011, 117: 953-959. DOI:10.1182/blood-2010-06-290171 |
| [14] |
Yang M, Zhang F, Yang C, et al. Oral targeted delivery by nanoparticles enhances efficacy of an hsp90 inhibitor by reducing systemic exposure in murine models of colitis and colitis-associated cancer[J]. J Crohns Colitis, 2020, 14: 130-141. DOI:10.1093/ecco-jcc/jjz113 |
| [15] |
Lee M, Chang EB. Inflammatory bowel diseases (IBD) and the microbiome-searching the crime scene for clues[J]. Gastroenterology, 2021, 160: 524-537. DOI:10.1053/j.gastro.2020.09.056 |
| [16] |
Sun MC, Zhang FC, Yin X, et al. Lactobacillus reuteri F-9-35 prevents DSS-induced colitis by inhibiting proinflammatory gene expression and restoring the gut microbiota in mice[J]. J Food Sci, 2018, 83: 2645-2652. DOI:10.1111/1750-3841.14326 |
| [17] |
Sheehan D, Moran C, Shanahan F. The microbiota in inflammatory bowel disease[J]. J Gastroenterol, 2015, 50: 495-507. DOI:10.1007/s00535-015-1064-1 |
| [18] |
Hu JY, Shen H, Zhu L, et al. Research progress on the role of bile acids in inflammatory bowel disease[J]. J Southeast Univ (Med Sci Ed) (东南大学学报医学版), 2021, 40: 108-113. |
| [19] |
Sorrentino G, Perino A, Yildiz E, et al. Bile acids signal via TGR5 to activate intestinal stem cells and epithelial regeneration[J]. Gastroenterology, 2020, 159: 956-968. DOI:10.1053/j.gastro.2020.05.067 |
| [20] |
Vavassori P, Mencarelli A, Renga B, et al. The bile acid receptor FXR is a modulator of intestinal innate immunity[J]. J Immunol, 2009, 183: 6251-6261. DOI:10.4049/jimmunol.0803978 |
| [21] |
Jia W, Xie G, Jia W. Bile acid-microbiota crosstalk in gastrointestinal inflammation and carcinogenesis[J]. Nat Rev Gastroenterol Hepatol, 2018, 15: 111-128. |
| [22] |
Chiang JY. Bile acids: regulation of synthesis[J]. J Lipid Res, 2009, 50: 1955-1966. DOI:10.1194/jlr.R900010-JLR200 |
| [23] |
Wu XX, Huang XL, Chen RR, et al. Paeoniflorin prevents intestinal barrier disruption and inhibits lipopolysaccharide (LPS)-induced inflammation in Caco-2 cell monolayers[J]. Inflammation, 2019, 42: 2215-2225. DOI:10.1007/s10753-019-01085-z |
| [24] |
Li J, Ren S, Li M, et al. Paeoniflorin protects against dextran sulfate sodium (DSS)-induced colitis in mice through inhibition of inflammation and eosinophil infiltration[J]. Int Immunopharmacol, 2021, 97: 107667. DOI:10.1016/j.intimp.2021.107667 |
| [25] |
Human Microbiome Project C. Structure, function and diversity of the healthy human microbiome[J]. Nature, 2012, 486: 207-214. DOI:10.1038/nature11234 |
| [26] |
Sender R, Fuchs S, Milo R. Revised estimates for the number of human and bacteria cells in the body[J]. PLoS Biol, 2016, 14: e1002533. DOI:10.1371/journal.pbio.1002533 |
| [27] |
Andoh A. Physiological role of gut microbiota for maintaining human health[J]. Digestion, 2016, 93: 176-181. DOI:10.1159/000444066 |
| [28] |
Marchesi JR, Adams DH, Fava F, et al. The gut microbiota and host health: a new clinical frontier[J]. Gut, 2016, 65: 330-339. DOI:10.1136/gutjnl-2015-309990 |
| [29] |
Fan Q, Guan X, Hou Y, et al. Paeoniflorin modulates gut microbial production of indole-3-lactate and epithelial autophagy to alleviate colitis in mice[J]. Phytomedicine, 2020, 79: 153345. DOI:10.1016/j.phymed.2020.153345 |
| [30] |
van Best N, Rolle-Kampczyk U, Schaap FG, et al. Bile acids drive the newborn's gut microbiota maturation[J]. Nat Commun, 2020, 11: 3692. DOI:10.1038/s41467-020-17183-8 |
| [31] |
Gadaleta RM, van Erpecum KJ, Oldenburg B, et al. Farnesoid X receptor activation inhibits inflammation and preserves the intestinal barrier in inflammatory bowel disease[J]. Gut, 2011, 60: 463-472. DOI:10.1136/gut.2010.212159 |
| [32] |
Sinha SR, Haileselassie Y, Nguyen LP, et al. Dysbiosis-induced secondary bile acid deficiency promotes intestinal inflammation[J]. Cell Host Microbe, 2020, 27: 659-670. |
 2021, Vol. 56
2021, Vol. 56


