2. 北京中医药大学, 中药分析与转化研究中心, 北京 100029;
3. 北京中医药大学, 北京中医药研究院, 北京 100029
2. Research Center for Chinese Medicine Analysis and Transformation, Beijing University of Chinese Medicine, Beijing 100029, China;
3. Beijing Research Institute of Chinese Medicine, Beijing University of Chinese Medicine, Beijing 100029, China
药对是中医临床遣药组方常用的配伍形式, 具有内在的组合变化规律, 是单一药物和中草药配方之间的桥梁。药对通常比单味药具有更好的药理功效[1], 且在提高药物疗效和降低药物毒性方面具有特殊的临床意义[2, 3]。川芎为治疗偏头痛圣药, 与白芷配伍是治疗偏头痛经典方剂中经常出现的一组药对。2020年版《中国药典》收载的“都梁丸”由白芷、川芎(白芷-川芎= 4∶1) 组成, 该药对具有祛风散寒、活血通络的功效, 用于风寒瘀血阻滞脉络所致的头痛, 症见头胀痛或刺痛、痛有定处、反复发作、遇风寒诱发或加重[4]。白芷中主含香豆素类、挥发油类、脂肪酸类等化合物, 其中香豆素类化合物是白芷的主要活性成分, 包括欧前胡素、异欧前胡素、氧化前胡素、白当归素、佛手柑内酯、花椒毒酚等[5]。现代药理学研究表明, 白芷中香豆素类化合物具有解热镇痛抗炎、抗高血压、抗凝血、抗微生物、抗病毒、抗癌、抗氧化等多种药理活性[6]。川芎其性温燥, 善于行走, 有活血行气、祛风止痛之功效, 为治疗头痛的“要药”, 与同为祛风之品的白芷配伍使用, 可加强祛除风邪的功效, 是治疗头痛、中风的佳选。
中药药代动力学可以从动力学的角度阐明多成分之间的相互作用, 在中药体内多组分物质基础、多靶点作用的药效和安全性等关键科学问题的研究中均起着重要作用。目前只有少数报道对白芷单味药中香豆素类成分的药代动力学进行了研究[7, 8], 所采用的检测方法主要有反向液相色谱法、液质联用法等[9-11], 然而对于采用UPLC-FLD法测定白芷中香豆素类化合物的血浆药物浓度, 并且研究白芷配伍川芎前后香豆素类成分在大鼠体内的药代动力学行为国内外未见报道。因此, 本文研究白芷配伍川芎前后大鼠体内白芷中4种香豆素类化合物(图 1) 的整体药代动力学行为, 以探讨川芎是否可以促进白芷中香豆素类成分的吸收进而产生协同作用, 从而在一定程度上阐明白芷-川芎配伍的合理性。
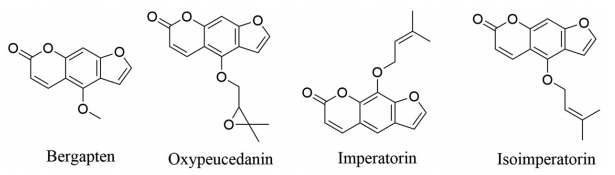
|
Figure 1 Chemical structures of four coumarins (bergapten, oxypeucedanin, imperatorin, and isoimperatorin) |
药品和试剂 佛手柑内酯(F-008-170426, 98%)、氧化前胡素(Y-151-180713, 98%)、异欧前胡素(Y-007-170426, 98%)、欧前胡素(O-001-170526, 98%) 均购自成都瑞芬思科技生物有限公司。白芷(批号2010008)、川芎(批号2009002) 均购自北京太洋树康药业有限责任公司, 并由北京中医药大学王学勇教授鉴定为正品。乙腈、甲醇(色谱纯, 纯度99.9%, 美国Fisher公司)、甲酸(色谱纯, 纯度99.9%, 美国Sigma公司)。
仪器 Agilent 1290超高效液相色谱仪(美国Agilent公司); 配有Agilent 1260 G1321B荧光检测器(美国Agilent公司), Agilent 1290 G4220A二元梯度泵(美国Agilent公司), Agilent 1290 G1316C柱温箱(美国Agilent公司), Agilent 1290 G4226A自动进样器(美国Agilent公司)等; 3-18KS离心机(德国Sigma公司); Concentrator plus真空浓缩机(美国OMNI公司); HD-2500涡旋器(杭州佑宁仪器有限公司)。
动物 雄性Sprague-Dawley (SD) 大鼠(SPF级, 10周龄, 体重200~230 g) 12只, 购自北京维通利华生物技术有限公司, 动物许可证号: SYXK (京) 2020-0033, 实验动物质量合格证号: 110011211100291687。标准环境下饲养1周。本研究中动物实验方案已获得北京中医药大学实验动物伦理委员会的批准(批准号: BUCM-4-2020083105-3072)。
色谱条件 色谱柱为Agilent ZORBAX ECLIPSE C18柱(2.1 mm×100 mm, 1.8 μm); 流动相为含0.1%甲酸的水溶液(A)-乙腈溶液(B), 梯度洗脱: 0~2 min, 10%~38% B; 2~7 min, 38%~39% B; 7~9 min, 39%~40% B; 9~10 min, 40%~55% B; 10~14 min, 55%~70% B; 14~15 min, 70%~100% B; 流速0.4 mL·min-1; 柱温35 ℃; 进样量5 μL。
荧光检测条件 激发波长(Exitation, Ex): 259 nm; 发射波长(Emission, Em): 490 nm。
对照品储备溶液的配制 分别精密称取佛手柑内酯、氧化前胡素、异欧前胡素对照品20.00 mg及欧前胡素对照品80.00 mg, 加甲醇溶解并定容至10 mL, 得佛手柑内酯、氧化前胡素、异欧前胡素的质量浓度分别为2 000 ng·mL-1、欧前胡素的质量浓度为8 000 ng·mL-1的混合对照品溶液, 采用逐级稀释的方法, 得到佛手柑内酯、氧化前胡素、异欧前胡素的质量浓度分别为1 000、800、400、200、100、50和25 ng·mL-1; 欧前胡素的质量浓度分别为4 000、3 200、1 600、800、400、200和100 ng·mL-1的混合对照品溶液。-4 ℃冰箱保存。
血浆样品处理方法 精密吸取血浆样品100 μL, 准确加入乙腈300 μL沉淀蛋白, 涡旋10 min, 12 000 r·min-1离心10 min, 取上清, 真空浓缩机吹干; 然后用75%甲醇100 μL复溶样品, 涡旋10 min, 12 000 r·min-1离心10 min, 取上清液按上述色谱条件进样测定。
灌胃药液的制备
白芷提取液的制备 白芷300 g, 10倍量70%乙醇浸泡12 h, 180 ℃加热回流提取2次, 每次2 h。合并滤液, 蒸干, 残渣用水溶解并定容至300 mL, 供试品溶液为1 g·mL-1。置于-20 ℃冰箱保存。
白芷-川芎合煎液的制备 白芷-川芎(300 g + 75 g), 10倍量70%乙醇浸泡12 h, 180 ℃加热回流提取2次, 每次2 h。合并滤液, 蒸干, 残渣用水溶解并定容至300 mL, 供试品溶液中白芷浓度为1 g·mL-1。置于-20 ℃冰箱保存。
灌胃药液中4种香豆素类化合物含量测定 取“灌胃药液的制备”部分合并后的滤液, 分别过滤膜取续滤液, 按上述色谱及荧光检测条件进样测定, 以外标法计算白芷提取液、白芷-川芎合煎液中佛手柑内酯、氧化前胡素、欧前胡素及异欧前胡素的含量。
药动学研究 SD大鼠12只, 分为2组, 禁食12 h后分别灌胃给予白芷提取液、白芷-川芎合煎液8 g·kg-1体重(灌胃体积为8 mL·kg-1), 并于给药后0、5、10、15、30、45 min、1、2、4、6、8、12、24 h眼眶静脉丛取血0.3 mL至润有肝素钠的离心管中, 以3 500 r·min-1离心15 min, 取上层血浆, -80 ℃储存, 并于3日内完成测定。
方法学考察
专属性 取6个不同来源的大鼠空白血浆, 按“血浆样品处理方法”项下方法操作, 进行UPLC-FLD分析, 分别获得空白样品色谱图、空白血浆添加对照品色谱图、给药后血浆样品色谱图。分析血浆中内源性物质是否对待测化合物佛手柑内酯、氧化前胡素、欧前胡素和异欧前胡素产生干扰, 考察该方法的专属性。
线性与定量限考察 取空白血浆100 μL, 分别加入系列浓度的对照品储备溶液100 μL, 使血浆中佛手柑内酯、氧化前胡素、异欧前胡素的质量浓度分别为25、50、100、200、400、800、1 000和2 000 ng·mL-1; 欧前胡素的质量浓度分别为100、200、400、800、1 600、3 200、4 000和8 000 ng·mL-1, 按“血浆样品处理方法”项下方法操作。以待测物质量浓度为横坐标x, 待测物峰面积为纵坐标y, 得到各成分的标准曲线和线性范围, 以血浆标准曲线的最低浓度点作为定量下限(LLOQ)。
准确度和精密度考察 取空白血浆100 μL, 分别加入高、中、低浓度的对照品储备溶液100 μL, 配制成佛手柑内酯、氧化前胡素、异欧前胡素1 000、400和50 ng·mL-1, 欧前胡素4 000、1 600和200 ng·mL-1的高、中、低浓度质控样品, 各浓度水平均为6样本, 按照“血浆样品处理方法”项下方法处理后测定。代入随行基质标准曲线计算相应的药物浓度, 与理论值相比, 计算方法的准确度; 同一质量浓度每隔1 h测1次, 测定3次, 进行日内精密度计算; 每隔1天测定1次, 连续测定3天, 进行日间精密度计算。
回收率考察 配制高、中、低3个浓度的质控样品, 各浓度水平均为6个样本, 按“血浆样品处理方法”项下方法处理后, 测定的样品所得峰面积A1; 取空白血浆100 μL, 按照“血浆样品处理方法”项下方法处理至真空浓缩机吹干后用含高、中、低浓度混合对照品的甲醇溶液复溶, 检测并记录峰面积A2。A1和A2的比值即绝对回收率。
稳定性及冻融稳定性 配制高、中、低3个浓度的质控样品, 各浓度水平均为6样本, 按照“血浆样品处理方法”项下方法处理后, 进行以下3种稳定性方法处置: ① 20 ℃室温放置12 h; ②贮存于-80 ℃冰箱3天; ③贮存于-80 ℃冰箱, 反复冻融3次。
数据处理 将给药后的血浆样品按照“血浆样品处理方法”处理后进行UPLC-FLD分析, 以随行基质标准曲线计算血药浓度后, 将血药浓度-时间数据代入DAS 3.2.8统计学软件求算4种香豆素类化合物在大鼠体内的各项药代动力学参数, 并以SPSS 20.0统计白芷单独给药与白芷-川芎配伍给药后的主要药代动力学参数差异。
结果 1 方法学验证 1.1 专属性空白血浆样品的色谱图见图 2A, 加入混合对照品溶液的血浆样品色谱图见图 2B, 大鼠给药后样品的代表性色谱图见图 2C、图 2D。佛手柑内酯、氧化前胡素、欧前胡素及异欧前胡素的色谱保留时间分别为5.75、7.97、11.61和12.65 min。结果表明, 白芷中4种香豆素类成分峰形良好, 大鼠空白血浆中的内源性物质不干扰待测物的定量分析, 本方法具有良好的专属性。
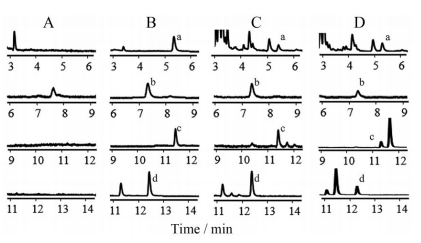
|
图 2 The typical chromatogram of four coumarins in rat plasma. A: Blank rat plasma sample; B: Plasma solution after adding standard; C: A rat plasma sample collected at 30 min after the oral administration of Baizhi aqueous extracts; D: A rat plasma sample collected at 30 min after the oral administration of Baizhi-Chuanxiong aqueous extracts. a: Bergapten, b: Oxypeucedanin, c: Imperatorin, d: Isoimperatorin |
白芷中4种香豆素类化合物在大鼠血浆中的线性范围内线性良好, 结果见表 1。
| Table 1 Regression data and lower limit of quantification (LLOQ) for four coumarins |
白芷中4种香豆素类化合物各浓度质控样品准确度平均在89.95%~101.43%之间, 日内精密度(RSD) 在0.569%~6.84%之间, 日间精密度在1.81%~9.85%之间, 均符合有关生物样品分析方法验证的要求。
1.4 回收率考察结果4种香豆素类化合物在3个浓度水平上的回收率均在85.20%~96.00%之间, 符合生物样品分析要求。
1.5 稳定性及冻融稳定性结果显示, 实际值均在理论值的86.42%~103.4%之间波动, 表明样品在以上条件下稳定。
2 灌胃药液中4种香豆素类化合物的含量测定白芷提取液中佛手柑内酯、氧化前胡素、欧前胡素、异欧前胡素的含量分别为0.122、1.39、2.26和0.672 mg·mL-1; 白芷-川芎合煎液中佛手柑内酯、氧化前胡素、欧前胡素、异欧前胡素的含量分别为0.125、1.39、2.26和0.689 mg·mL-1。结果表明: 在提取液中, 白芷配伍川芎前后其中4种香豆素类成分含量无明显变化。
3 药代动力学以标准曲线法计算血药浓度, 将平均血药浓度对时间作图, 得平均血药浓度-时间曲线(图 3), 药代动力学参数结果见表 2。
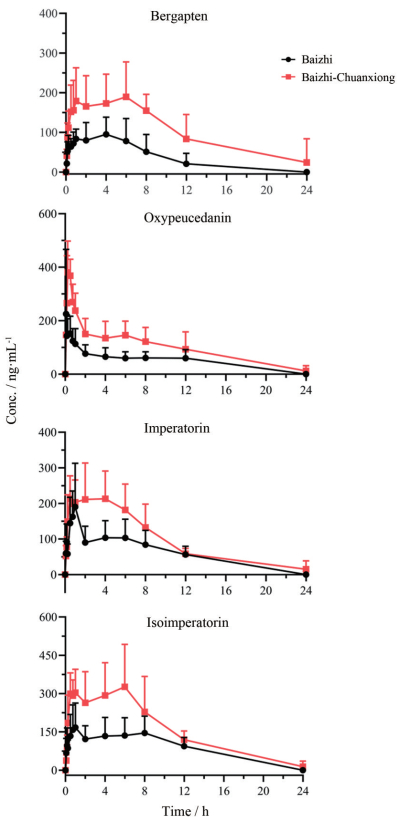
|
Figure 3 Mean plasma concentration-time curves of the four coumarins after oral administration of Baizhi and Baizhi-Chuanxiong aqueous extracts. n= 6, x±s |
| Table 2 The pharmacokinetic parameters of four coumarins in rat plasma after oral administration of Baizhi and Baizhi-Chuanxiong aqueous extracts. n= 6, x±s. *P < 0.05, **P < 0.01 vs Baizhi |
平均血药浓度-时间曲线图表明, 白芷-川芎配伍组较白芷单独给药组的血药浓度显著升高。药动学参数计算结果显示, 配伍川芎后, 佛手柑内酯、欧前胡素的AUC0-∞和AUC0-24 h均显著增加(P < 0.05)且CLZ/F显著降低(P < 0.01, P < 0.05), Cmax显著升高(P < 0.05), 此外, 佛手柑内酯的VZ/F显著降低(P < 0.05); 氧化前胡素的AUC0-∞和AUC0-24h均显著增加(P < 0.01)且CLZ/F显著降低(P < 0.05), Cmax显著升高(P < 0.01); 异欧前胡素的Cmax显著升高(P < 0.05)。
讨论白芷中的佛手柑内酯、氧化前胡素、欧前胡素和异欧前胡素具有苯环结构特征, 有较强的荧光吸收。通过文献调研发现, 相比于紫外检测器, 荧光检测器有更好的选择性和特异性[12]; 相比于三重串联四极杆质谱, 荧光检测器花费更少[13]。因此, 本研究建立了保留时间更短、特异性和选择性更好的UPLC-FLD检测方法, 并成功应用于白芷体内香豆素类化合物的含量测定中, 方法学考察结果表明, 该方法灵敏度高、重复性好、操作简便、结果准确, 具有较高的专属性, 符合生物样品分析要求。同时, UPLC-FLD检测方法的应用也为香豆素类化合物的血药浓度分析提供了参考价值。
AUC0-∞、AUC0-t和Cmax分别可作为吸收程度与吸收速度的指标[14, 15]。吸收程度增加会导致AUC0-∞、AUC0-t和Cmax升高, 吸收速度增快会导致Cmax升高。配伍川芎后, 白芷中4种香豆素类化合物的AUC和Cmax均有不同程度的升高, 说明川芎可能是通过促进白芷中香豆素类化合物的吸收速度和吸收程度而升高其血药浓度、提高其生物利用度。Vz/F和CLz/F分别是药物分布程度和体内药物消除速度的评价指标[16, 17]。Vz/F和CLz/F减小会导致血药浓度以及Cmax增加, 配伍川芎后, 白芷中4种香豆素类化合物的Vz/F和CLz/F均有不同程度的减小, 这表明配伍川芎后白芷中香豆素类化合物血药浓度的升高不仅与吸收增加有关, 还与川芎抑制香豆素类成分向全身分布以及清除有关。因此推测, 川芎可能促进白芷中香豆素类成分更多地向靶器官分布, 但该推论仍缺乏实验数据的支撑, 后续将在此基础上设计实验进行进一步的验证。
中药配伍的体内药动学相互作用主要由转运蛋白和药物代谢酶介导[18], 特别是P-糖蛋白(P-gp) 和细胞色素P450 (CYP450) 酶[19-21]。有研究表明, 白芷中香豆素类化合物(佛手柑内酯、氧化前胡素、欧前胡素、异欧前胡素) 是外排转运体P-gp的底物[22], 可因P-gp的抑制而增加其吸收, 川芎嗪(tetramethylpyrazine, TMP, 又名四甲基吡嗪) 是一种生物碱, 为中药川芎的有效成分之一, 有研究表明, TMP可能通过抑制P-gp的功能增强P-gp底物的口服吸收, 长期应用TMP可能通过下调肠道以及其他器官P-gp的表达而降低P-gp的活性, 抑制底物的外排作用, 改变其他P-gp底物的生物利用度[23]。因此推测, 川芎促进白芷香豆素的吸收可能与川芎抑制外排转运蛋白表达有关, 但仍需要进一步的实验进行验证。
有研究认为白芷中香豆素类成分有镇痛抗炎的作用[24], 能明显降低血中和脑中一氧化氮水平, 说明香豆素类成分对偏头痛有一定的治疗作用[25]; 也有研究表明, 川芎提取物能显著提高豆腐果苷吸收, 并显著增加豆腐果苷的药效(P < 0.05), 说明川芎提取物有促吸收作用[26]; 此外, 有文献进行了川芎提取物及吸收促进剂对欧前胡素和异欧前胡素在大鼠结肠吸收过程的影响的研究, 发现川芎提取物对欧前胡素与异欧前胡素均有一定的促吸收效果, 从肠道吸收的角度证明了传统中医将川芎配伍白芷作为药对使用是合理的[27]。然而, 目前缺乏直接证据表明川芎确实促进了白芷中香豆素类化合物的吸收, 即缺乏关于白芷配伍川芎前后大鼠体内香豆素类成分的比较药代动力学研究, 故本文从此角度研究都梁丸中白芷以4∶1配伍川芎后对白芷中香豆素类化合物的影响, 研究结果表明: 配伍川芎能不同程度地增加白芷中4种香豆素类化合物的血药浓度和Cmax, 促进有效成分在体内的吸收, 同时减缓其在体内的清除速率。该结果从药代动力学的角度, 为白芷和川芎药对联合使用的科学性提供了数据支撑, 也为进一步阐明中医药配伍理论的合理性提供了方法参考。
作者贡献: 肖红斌教授进行了课题的设计; 刘力榕负责文献查阅、实验实施、数据计算与分析及文章撰写; 贾志鑫负责方法验证实验、论文撰写与修改; 闫晓宁、朱美霞及方聪负责动物实验; 冯梦晗、黄蓓蓓负责实验所需试剂及材料的准备。所有作者均已批准该稿件的最终版本。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Jin Y, Qu C, Tang YP, et al. Herb pairs containing Angelicae Sinensis Radix (Danggui): a review of bio-active constituents and compatibility effects[J]. J Ethnopharmacol, 2016, 181: 158-171. DOI:10.1016/j.jep.2016.01.033 |
| [2] |
Zhou MM, Hong YL, Lin X, et al. Recent pharmaceutical evidence on the compatibility rationality of traditional Chinese medicine[J]. J Ethnopharmacol, 2017, 206: 363-375. DOI:10.1016/j.jep.2017.06.007 |
| [3] |
Tang YP, Shang EX, Chen YY, et al. Modern research approaches and strategies for compatibility effects and efficacy components of herbal pairs[J]. Acta Pharm Sin (药学学报), 2019, 54: 1564-1573. |
| [4] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典一部)[S]. Part 1. Beijing: China Medical Science Press, 2020: 1428.
|
| [5] |
Wang R, Liu J, Yang DY, et al. Research progress in chemical constituents and pharmacological action of Angelica dahurica[J]. Inf Tradit Chin Med (中医药信息), 2020, 37: 123-128. |
| [6] |
Wang MY, Jia MR, Ma YY, et al. Pharmacological effect of four linear furocoumarins in Radix Angelicae Dahuricae[J]. Nat Prod Res Dev (天然产物研究与开发), 2010, 22: 485-489. |
| [7] |
Shi XY, Zhang FL, Liang S, et al. Study on pharmacokinetics of multi-component integration of total coumarin extracts from Angelica dahurica[C]//Proceedings of the Tenth National Conference on Drug and Chemical Foreign Body Metabolism and the Third International ISSX/CSSX Joint Conference (第十届全国药物和化学异物代谢学术会议暨第三届国际ISSX/CSSX联合学术会议论文集). Nanjing: Chinese Pharmacological Society, 2012: 9.
|
| [8] |
Zhang JP. Analysis and Pharmacokinetics of Coumarin Compounds in Radix Angelicae Dahuricae (白芷香豆素类成分含量测定及药代动力学研究)[D]. Suzhou: Soochow University, 2011.
|
| [9] |
Huang YW, Chen XH, Huo YS, et al. Pharmacokinetic study of imperatorin in rat after oral administration of extractum Angelicae Dahuricae Siccum[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2008, 25: 215-218. |
| [10] |
Xie Y. Study on Extraction, Preparation and Pharmacokinetic of Active Componentsfrom from Radix Angelicae Dahuricae (白芷活性成分的提取分离及其体内药代动力学研究)[D]. Shanghai: The Second Military Medical University, 2007.
|
| [11] |
Deng JY. Study on the Method of Qulity Assessment of Radix Angelica Dahurica and the Pharmacokinetics of Imperatorin in Rats (白芷质量评价方法及欧前胡素在大鼠体内的药物动力学研究)[D]. Shenyang: Shenyang Pharmaceutical University, 2004.
|
| [12] |
Chepyala D, Tsai IL, Sun HY, et al. Development and validation of a high-performance liquid chromatography-fluorescence detection method for the accurate quantification of colistin in human plasma[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2015, 980: 48-54. DOI:10.1016/j.jchromb.2014.12.015 |
| [13] |
Zhao AH, Zhang YB, Yang XW. Simultaneous determination and pharmacokinetics of sixteen Angelicae dahurica coumarins in vivo by LC-ESI-MS/MS following oral delivery in rats[J]. Phytomedicine, 2016, 23: 1029-1036. DOI:10.1016/j.phymed.2016.06.015 |
| [14] |
Chen ZY, Zheng QS, Sun RY, et al. Functions of the DAS software for pharmacological calculation[J]. Chin J Clin Pharmacol Ther (中国临床药理学与治疗学), 2002, 7: 562-564. |
| [15] |
Huang SK, Han KQ. Statistical approaches for assessment of bioequivalence[J]. Chin Pharm J (中国药学杂志), 1994, 29: 312-314. |
| [16] |
Liu YT, Jiang QY, Huang GY, et al. Determining the effect of Huangqi on the pharmacokinetics of six different alkaloids from Fuzi in rats by LC-MS[J]. Acta Pharm Sin (药学学报), 2019, 54: 2289-2295. |
| [17] |
Liang WQ, Li G, Liu JP. Biopharmaceutics and Pharmacokinetics (生物药剂学与药物动力学)[M]. 2nd Ed. Beijing: People's Medical Publishing House, 2007: 176.
|
| [18] |
Zhou Y, Wu XA, Deng Y. Effect of cooperation between transporters and metabolic enzymes on drug disposition by intestine and liver[J]. Acta Pharm Sin(药学学报), 2020, 55: 1762-1767. |
| [19] |
Levêque D, Lemachatti J, Nivoix Y, et al. Mechanisms of pharmacokinetic drug-drug interactions[J]. Rev Med Interne, 2010, 31: 170-179. DOI:10.1016/j.revmed.2009.07.009 |
| [20] |
Sparreboom A, Cox MC, Acharya MR, et al. Herbal remedies in the United States: potential adverse interactions with anticancer agents[J]. J Clin Oncol, 2004, 22: 2489-2503. DOI:10.1200/JCO.2004.08.182 |
| [21] |
Qiu W, Liu CX, Ju Y, et al. Pharmacokinetic interaction of plant preparations with chemical drugs[J]. Chin J Nat Med (中国天然药物), 2010, 8: 137-144. DOI:10.3724/SP.J.1009.2010.00137 |
| [22] |
Dong W, Guan XJ, Liao ZG, et al. In vitro study on affinity of coumarins in Angelicae Dahuricae Radix and P-gp[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2893-2896. |
| [23] |
Song J, Tang J, He J, et al. Effects of tetramethylpyrazine on the function and expression of P-glycoprotein in Caco-2 cells[J]. Cent South Pharm (中南药学), 2007, 5: 440-443. |
| [24] |
Liu XY, Lai Y. Preparation of drug-in adhesive patch of Angelica dahurica coumarins and study its in vitro permeability through excised anthony pig skin[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2018, 35: 330-334. |
| [25] |
Ni HX, Wang CM. Preventive effects of total coumarin and essential oil of Angelicae Dahuricae Radix on migraine rats and their mechanisms[J]. J Jilin Univ (Med Ed) (吉林大学学报医学版), 2018, 44: 487-492. |
| [26] |
Su ZT, Xu JL, Liu Y, et al. The study on promotion of absorption and synergistic effect of Chuanxiong Rhizoma with helicid[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2012, 18: 176-178. |
| [27] |
Zhang FL, Huang YF, Yi J. Effects of Chuanxiong Rhizoma excract and different absorption enhancers on rat colonic absorption of Angelica Dahuricae Radix[J]. J Guangdong Pharm Univ (广东药学院学报), 2015, 31: 300-304. |
 2021, Vol. 56
2021, Vol. 56


