2. 中国药科大学中药学院, 江苏 南京 210009;
3. 中国食品药品检定研究院, 北京 100050
2. China Pharmaceutical University of Traditional Chinese Pharmacy, Nanjing 210009, China;
3. National Institutes for Food and Drug Control, Beijing 100050, China
由于中药成分复杂, 如何科学准确地评价中药质量一直是行业关注的热点与难点问题, 随着分析技术的发展, 多成分含量测定已成为中药质量评价与质量控制的重要手段[1-8], 但这需要大量标准物质的支持, 对于药品生产企业和检验机构, 大量标准物质的使用提高了检验成本, 并时常会因为缺乏标准物质而无法完整地执行既定的药品标准, 限制了中药质量标准的推广与应用。替代对照品法、一测多评法是目前减少对照品的常用方法, 《中华人民共和国药典》2020年版中收录了“一测多评法”对丹参、黄连等品种进行多成分含量测定的方法, 但采用一个对照品利用相对保留时间(relative retention time, RRT) 给色谱峰定位常常会因为色谱柱的差异出现定位不准确, “双标线性法(liner calibration with two reference substances, LCTRS)”采用一个定量对照品以相对校正因子法定量, 两个对照品采用双标线性校正法进行色谱峰定位, 显著提高了定位的准确度和色谱柱的适用性。
天麻为兰科植物天麻(Gastrodia elata Bl.)的干燥块茎, 具有息风止痉、平抑肝阳、祛风通络的功效, 主要用于小儿惊风、癍痫抽搐、破伤风、头痛眩晕、手足不遂、肢体麻木、风湿痹痛[9]。本文采用高效液相色谱法, 以双标线性校正法辅助色谱峰定性, 同时定位天麻中天麻素、对羟基苯甲醇、巴利森苷A、巴利森苷B、巴利森苷C和巴利森苷E等6种成分, 与相对保留时间法相比, 双标线性校正法具有更高的准确性。
材料与方法材料与试剂 Waters e2695型高效液相色谱仪(美国Waters公司, 包括Alliance 2695型四元梯度泵、Alliance 2695自动进样器、可降温柱温箱、2498型紫外检测器); Mettler Toledo XS105DU电子分析天平(Mettler Toledo, 瑞士); 数控超声清洗机(KQ-700DE型, 昆山超声仪器有限公司); Milli-Q纯水机(Millipore, 美国); 28根色谱柱(编号Col 1~28), 色谱柱规格均为250 mm×4.6 mm (5 μm), 不同色谱柱型号信息见表 1。
| Table 1 The detailed information of different column types |
对照品天麻素(批号: 110807-201809, 纯度96.7%), 对羟基苯甲醇(批号: 111970-201702, 纯度99.4%), 购自中国食品药品检定研究院。巴利森苷A (批号: 62499-28-9, 纯度98.0%), 巴利森苷B (批号: 174972-79-3, 纯度95.0%), 巴利森苷C (批号: 174972-80-6, 纯度98.0%), 巴利森苷E (批号: 952068-57-4, 纯度98.0%), 均购自上海诗丹德标准技术服务有限公司。天麻样品批号分别为TIANMA-02, TIANMA-04, TIANMA-07, 购自药材市场。甲醇、乙腈(色谱纯, Merck公司, 美国), 其余试剂为分析纯。
色谱条件 采用上述编号Col 1~24色谱柱, 以乙腈为流动相A, 0.1%磷酸溶液为流动相B, 梯度洗脱(0~25 min, 3%→18% A; 25~35 min, 18% A; 35~37 min, 18%→95% A), 检测波长220 nm, 流速0.8 mL·min-1, 柱温35 ℃, 进样量为5 μL。
对照品溶液的制备 精密称取天麻素、对羟基苯甲醇、巴利森苷A、巴利森苷B、巴利森苷C、巴利森苷E对照品适量, 加50%甲醇制成每1 mL各含上述对照品约100 μg的混合溶液, 即得。
供试品溶液的制备 取本品粉末(过四号筛) 约0.5 g, 精密称定, 置具塞锥形瓶中, 精密加入50%甲醇25 mL, 称定重量, 超声处理(功率500 W, 频率40 kHz) 30 min, 放冷, 再称定重量, 用50%甲醇溶液补足减失的重量, 摇匀, 滤过, 取续滤液, 即得。
精密度 精密吸取混合对照品溶液, 在上述色谱条件下, 以色谱柱Col 1连续进样6次, 对6个对照品成分色谱峰的保留时间和峰面积进行统计, 计算RSD值。
重复性 取样品(批号: TIANMA-07) 6份, 按照供试品溶液的制备方法处理, 在上述色谱条件下, 以色谱柱Col 1进样, 对6种成分色谱峰的峰面积进行统计, 以峰面积计算6种成分的含量, 并计算RSD值。
稳定性 取样品(批号: TIANMA-07), 按照供试品溶液的制备方法处理, 在上述色谱条件下, 采用Col 1色谱柱分别于0、1、3、6、12、16和24 h进样, 对6个对照品成分色谱峰的保留时间和峰面积进行统计, 计算RSD值。
色谱柱耐用性 取样品(批号: TIANMA-07), 按照供试品溶液的制备方法处理, 在上述色谱条件下, 采用上述24根色谱柱分别进样, 考察6种成分的分离情况。
双标线性校正法定性研究 将采集的色谱数据导入DRS Origin软件, 通过关联对照品, 设定双标成分, 进行分析, 得到保留时间预测准确率和色谱柱符合率, 并在4根其他品牌和型号色谱柱(Col 25~28) 上进行验证。同时与相对保留时间法比较, 判断两种方法的优劣。
结果 1 方法学考察 1.1 精密度对天麻素、对羟基苯甲醇、巴利森苷A、巴利森苷B、巴利森苷C和巴利森苷E对照品成分色谱峰的保留时间和峰面积进行统计, 结果其保留时间基本一致, 峰面积RSD均 < 1.5%, 表明仪器精密度良好。
1.2 重复性天麻素、对羟基苯甲醇、巴利森苷A、巴利森苷B、巴利森苷C和巴利森苷E的含量分别为0.34%、0.061%、1.90%、0.73%、0.19%和0.49%, RSD均 < 2.0%, 表明重复性良好。
1.3 稳定性对天麻素、对羟基苯甲醇、巴利森苷A、巴利森苷B、巴利森苷C和巴利森苷E的色谱峰保留时间和峰面积进行统计, 结果保留时间基本一致, 峰面积RSD均 < 2.0%, 表明样品稳定性较好。
1.4 色谱柱耐用性按照供试品溶液的制备方法处理, 在上述色谱条件下, 以上述24根色谱柱进样, 全部色谱柱均可将6个成分色谱峰分离, 表明方法适用性较好。样品的代表性图谱见图 1、2。
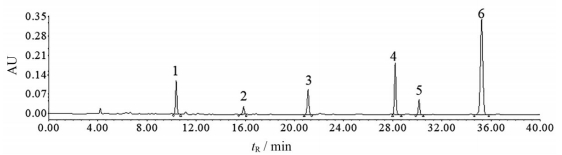
|
Figure 1 High performance liquid chromatography of Gastrodiae Rhizoma (Col 1). 1: Gastrodin; 2: p-Hydroxybenzyl alcohol; 3: Parishin E; 4: Parishin B; 5: Parishin C; 6: Parishin A |
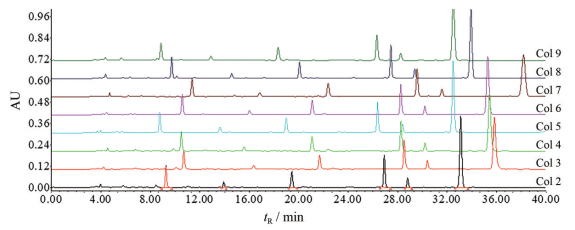
|
Figure 2 HPLC chromatograms of Gastrodiae Rhizoma by different chromatography columns (Col 2-9) |
液相色谱中, 化学成分在不同色谱仪和不同色谱柱上的保留时间具有线性关系[10, 11]。通过对照品保留时间进行色谱峰定位, 得到样品实际保留时间, 以24根色谱柱得到的样品保留时间平均值作为预测保留时间(standard retention time, SRT)。以6种成分的SRT为横坐标, 分别为天麻素为9.721 min, 对羟基苯甲醇为14.580 min, 巴利森苷E为19.992 min, 巴利森苷B为27.510 min, 巴利森苷C为29.451 min, 巴利森苷A为34.268 min。以实际保留时间为纵坐标, 得到各色谱柱的拟合结果, 见图 3。各色谱柱的线性方程和相关系数见表 2。由图 3和表 2可见, 天麻各成分在Col 7和Col 16两根色谱柱上与拟合直线有偏离, 说明成分在这些色谱柱上的保留时间与其余色谱柱差异较大。其余22根色谱柱的保留时间的线性关系良好。
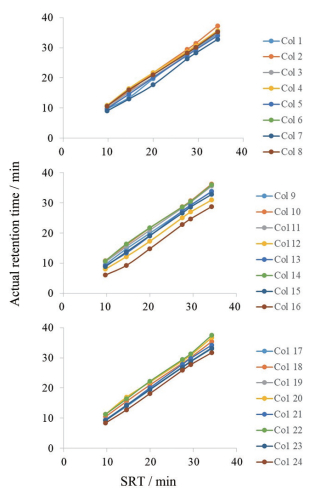
|
Figure 3 Retention time relationship of chromatographic peaks on different chromatographic columns (A, B and C). SRT: Standard retention time |
| Table 2 Linear equation and correlation coefficient of retention time on different chromatographic columns. ※Chromatographic column with a large deviation of fitting |
在6个成分中选择2个作为双标成分, 有很多种方案。将上述24根色谱柱上采集的HPLC数据导入DRS Origin软件, 进行相对保留时间法、双标校正法及大数据算法进行色谱峰替代定性研究。通过软件自有功能进行“双标线性校正法”分析, 筛选出了10种双标选择方案, 能确保色谱柱符合率达到100%, 其中峰3~峰6组合的预测正确率为100%。按双标选择尽量分布在保留时间两端的原则[12]且预测值与实测值绝对偏差最小的原则综合考虑, 以巴利森苷E和巴利森苷A作为双标化合物。以这2个成分的SRT为纵坐标, 实际保留时间(以未知色谱柱Col 25为例), 巴利森苷E (20.367 min), 巴利森苷A (34.25 min) 为横坐标, 得到两点巴利森苷E (20.366 7, 19.992 1) 和巴利森苷A (34.25, 34.267 5), 做一直线, 得到方程y= 1.028 2x- 0.949 8, 然后将其余4个成分的SRT值代入方程(Y值), 得到预测保留时间分别为天麻素10.378 min, 对羟基苯甲醇15.104 min, 巴利森苷B 27.680 min, 巴利森苷C 29.567 min, 实际保留时间依次为10.05、15.53、27.77和29.7 min。偏差的绝对值依次为0.328、0.429、0.087和0.133 min, 满足单纯定性条件下, 预测保留时间与实测保留时间的误差应不超过0.5 min的要求, 说明该双标选择在Col 25上预测效果良好。
4 双标线性校正法与相对保留时间法的对比对双标线性校正法与相对保留时间法两者在天麻液相色谱中定性的优劣进行比较。双标线性校正法以巴利森苷E和巴利森苷A作为双标化合物, 相对保留时间法以中间位置的巴利森苷E为参照物, 两种方法在24根色谱柱上的比较结果, 双标线性校正法的保留时间预测值的绝对偏差波动范围较小, 且绝对偏差较低, 见表 3。
| Table 3 Absolute deviation of predicted retention time of different components in different chromatographic columns. *Absolute deviation between predicted and measured retention time is more than 0.5 min. -: The retention time is calculated with the component as a reference |
用4根新的色谱柱(Col 25~28), 按照供试品溶液的制备方法处理样品, 测试3种不同批次天麻药材, 不同色谱柱色谱图见图 4, 结果见表 4。双标线性校正法能够很好的预测各成分在Col 25~28上的保留时间, 但相对保留时间法在Col 26~28的预测误差偏大, 表明双标线性校正法比相对保留时间法预测更为精确。
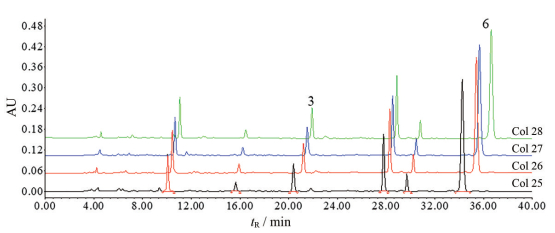
|
Figure 4 HPLC chromatograms of Gastrodiae Rhizoma by different chromatography columns (Col 25-28). 3: Parishin E; 6: Parishin A |
| Table 4 Comparison of two different methods for predicting retention time of four chromatographic columns. *Absolute deviation between predicted and measured retention time is more than 0.5 min. -: The retention time is calculated with the component as a reference |
在多成分含量测定、特征图谱等研究中, 色谱峰定位具有重要的意义。本实验研究结果表明, 双标线性校正法适用于天麻药材的多组分定性分析, 能较好定位天麻中的6种成分。与相对保留时间法相比, 双标线性校正法能准确地预测各成分的保留时间, 扩大色谱柱的适用范围, 提高检验的效率, 降低检验成本。
本实验选择所有双标的组合, 综合考虑了预测准确率和色谱柱符合率, 避免选择在色谱柱拟合过程中偏离较大的成分, 以减小保留时间的预测误差, 最终选择了峰3与峰6组合的巴利森苷E和巴利森苷A两个成分为双标参照物。
建立方法时, 本实验考察了24根不同品牌、型号的色谱柱对待测成分分离情况的影响, 基本符合建模要求。本实验仅考察了双标线性校正法用于天麻药材中6种成分的色谱峰定性, 是否适用于其他多组分中药的分析, 还需进一步的拓展研究。
作者贡献: 周亚楠主要完成方法建立, 不同色谱柱的测定及撰写文章并对编辑部修改意见进行核修等工作。张元元主要完成数据分析等工作。李会军主要完成色谱方法的建立、方法学考察。刘永利负责对实验思路、数据处理、撰写文章等进行专业指导。孙磊负责双标线性校正法技术指导。马双成对本文的选题的设计、实验思路等进行指导。
利益冲突: 无任何利益冲突。
| [1] |
Lu D, Luo F, Chi YM, et al. Determination of nucleosides in Rhizoma Pinelliae by high performance liquid chromatography[J]. Chin J Chromatogr (色谱), 2011, 29: 83-86. DOI:10.3724/SP.J.1123.2011.00083 |
| [2] |
Luo Y, Yang L, She XQ, et al. HPLC simultaneous determination of 7 organic acids in Lonicera macranthoides Hand. Mazz[J]. Cent South Pharm (中南药学), 2018, 16: 1283-1286. |
| [3] |
Yao J, Sun XG, Dong R, et al. Simultaneous quantitative analyses of six components in Astragalus membranaceus based on HPLC-CAD and quantitative analysis of multi- components with a single-marker[J]. Acta Pharm Sin (药学学报), 2021, 56: 557-563. |
| [4] |
Li J, Li YL, Yu JD, et al. Quality control of Arnebiae Radix based on characteristic chromatogram and QAMS[J]. Chin J Pharm Anal (药物分析杂志), 2020, 40: 1209-1216. |
| [5] |
Kong JJ, Zhu JJ, Wang ZM, et al. Quantitative analysis of polytype components in Forsythia suspense by QAMS Method[J]. Chin Pharm J (中国药学杂志), 2010, 45: 1301-1304. |
| [6] |
Liu ZH, Gu W, Chang XJ, et al. Quantitative analysis of polytype components in Maizhenhua Granules by QAMS[J]. Chin Tradit Pat Med (中成药), 2012, 34: 2342-2347. |
| [7] |
Cao HT, Lu J, Lin RC, et al. Analysis of four saponins in Rhizoma Paridis with substitution method of reference substance[J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 1641-1645. |
| [8] |
Xu J, Jin HY, Sun L, et al. Determination of loureirin A and loureirin B in Dracaena cochinchinensis by substitute reference substance[J]. Chin J Pharm Anal (药物分析杂志), 2011, 31: 2058-2062. |
| [9] |
State Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2020 Ed. Part I. Beijing: China Medical Science Press, 2020: 735-740.
|
| [10] |
Wang LX, Xiao HB, Liang XM, et al. A new method for improving the eproducibility of chromatographic fingerprint retention time[J]. Chin J Anal Chem (分析化学), 2003, 31: 1232-1236. |
| [11] |
Chen R, Zhang C, Zhang H, et al. Determination of multiple components in Shuanghuanglian preparations by liner calibration with two reference substances assisted with chromatographic peaks identification[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 40-48. |
| [12] |
Sun L, Jin H, Pang Y, et al. Two reference substances for determination of multiple components (Ⅰ): linear calibration using two reference substances for identification of chromatographic peaks[J]. Chin J Pharm Anal (药物分析杂志), 2013, 33: 1424-1430. |
 2021, Vol. 56
2021, Vol. 56


