ATP结合盒转运蛋白(ATP binding cassette transporter, ABC) 是人体中最重要的外排型转运蛋白家族, 也称ABC转运蛋白家族, 这类外排型转运蛋白在药物的吸收、分布、排泄过程中起着重要的作用。肠道屏障和血脑屏障依靠特殊的内皮细胞结构与分布其上的ABC转运蛋白限制药物的体内分布, 为新药开发带来许多困难, 肿瘤细胞中ABC转运蛋白表达的上调也会导致多药耐药性从而限制化疗药物的治疗效果。在对天然药物, 特别是传统中药的研究中发现许多活性成分都对ABC转运蛋白的活性或表达有影响, 进而影响体内屏障或肿瘤细胞上ABC转运蛋白介导的药物分布。本文基于中药活性成分对外排型转运蛋白的影响研究进展, 对体内屏障和肿瘤细胞上的ABC转运蛋白介导的中药-化药相互作用进行综述, 以期为临床上中药和化药联合应用的安全有效性提供参考。
1 ABC转运蛋白及其分布ABC转运蛋白广泛分布于体内, 分为ABCA、ABCB、ABCC、ABCD、ABCE、ABCF、ABCG七个主要子家族, 这些子家族转运蛋白的功能和研究现状各不相同。ABCA子家族介导光感细胞中维生素A衍生物与高密度脂蛋白合成过程胆固醇的外排; ABCB子家族介导了肿瘤细胞的多药耐药性、铁代谢和铁/S蛋白前体运输的作用; ABCC子家族介导了核苷转运、有机阴离子外排和耐药性; ABCD子家族在超长链脂肪酸运输的调控中发挥作用; ABCE和ABCF子家族都被认为是先天免疫的一部分; ABCG子家族介导了胆固醇和甾醇的转运、毒性物质外排与多药耐药性[1]。
研究较为广泛的ABC转运蛋白如表 1所示。其中ABCB子家族的P-糖蛋白(P-glycoprotein, P-gp)、ABCG子家族的乳腺癌耐药蛋白(breast cancer resistance protein, BCRP) 和ABCC子家族的多药耐药相关蛋白(multidrug resistance-associated proteins, MRPs) 是最具代表性的ABC转运蛋白, 其介导的中药-化药相互作用对于药物发挥药效以及多药耐药性有重要影响。
| Table 1 List of human ABC genes, chromosomal location, and function[1] |
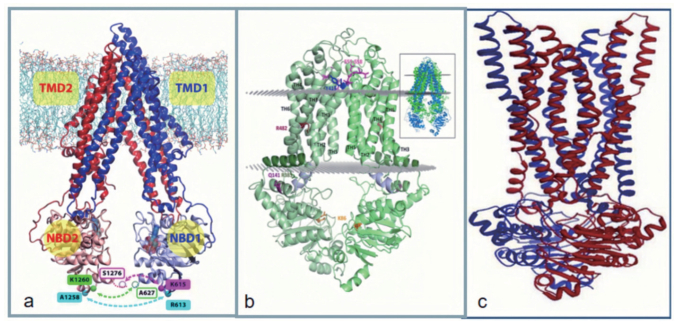
P-gp是第一个被人类发现的ABC转运蛋白, 结构如图 1a[2]所示, 氨基酸序列分析表明, P-gp包含多个跨膜结构域(transmembrane domain, TMDs) 和细胞内限制性ATP结合盒或核苷酸结合结构域(nucleotide-binding domain, NBDs), 利用细胞内的ABC水解ATP提供能量, 将这些跨膜结构域作为通道, 通过TMD排出外源性物质, 从而将细胞内该物质的浓度降低到亚致死水平[3]。P-gp在肝脏、肾脏、胰腺、结肠、空肠以及大脑均有表达, 是体内具有重要生理功能的转运体之一, 在内源性或外源性物质的吸收、分布和排泄过程中发挥着关键作用[4]。
BCRP最早在乳腺癌MCF-7细胞中被发现, 在肿瘤细胞中其表达上调并引起多药耐药[7], 结构如图 1b[5]所示。研究表明BCRP不仅在肝小管膜、乳腺、各种祖细胞和干细胞中有生理表达; 在生理组织屏障中, 包括形成血脑屏障的脑微血管内皮细胞、肠和肾小管上皮细胞以及胎盘绒毛膜中也均有表达[8]。BCRP转运的底物范围广泛, 包括尿酸、许多共轭内源代谢物、疏水和两性药物及药物共轭物[9], 米托蒽醌、多西他赛、吉非替尼、阿霉素、伊立替康、拓扑替康和甲氨蝶呤等[10]的活性代谢物也是其底物, 因此BCRP的表达及功能变化会显著影响药物代谢、尿酸代谢以及肿瘤治疗效果[11]。
MRP是ABC转运蛋白家族的第二个被发现的成员, 结构如图 1c[6]所示。MRP已被证明可以运输各种中性和阴离子疏水化合物和II期药物代谢产物, 如谷胱甘肽和葡萄糖醛酸酯缀合物, 介导对多柔比星、依托泊苷和长春新碱等的耐药性。但是普遍观点认为它并不是抗癌治疗的合适靶点, 因此针对MRP蛋白开展的研究较少, 通常与P-gp/BCRP同时研究。
ABC转运蛋白在体内生物屏障上有较广泛的分布, 尤其是肠道屏障和血脑屏障, 具有调控药物吸收和跨血脑屏障入脑起效的功能, 已有研究发现许多中药活性成分对体内屏障的ABC转运蛋白的活性或表达有影响。此外, ABC转运蛋白表达上调导致肿瘤细胞产生多药耐药性是限制化疗药物治疗的关键因素, 围绕肿瘤治疗过程的中药-化药合理联用的研究也是目前的热点。
2 肠道屏障上ABC转运蛋白介导的中药-化药相互作用肠道屏障(intestinal barrier) 是一个半透性屏障, 由高度糖基化的黏蛋白构成的外部黏液层、特殊上皮细胞构成的中央单细胞层和包含T细胞、B细胞、巨噬细胞和树突状细胞等免疫细胞的内部固有层组成。大部分药物的吸收发生在小肠, 特别是十二指肠和空肠的肠上皮细胞上[12]。ABC转运蛋白家族主要位于中央单细胞层上, 它们控制着肠黏膜屏障的通透性[13], 不仅能够在营养物质的吸收和免疫感知中起重要作用, 同时也能限制潜在的有害抗原和微生物进入体内环境[14]。表 2[15-23]列举了2015年以来基于肠道屏障ABC转运蛋白介导的中药-化药相互作用的研究实例。
| 表 2 Studies on TCM-drug interactions mediated by ABC transporters in the intestinal barrier (2015-2020) |
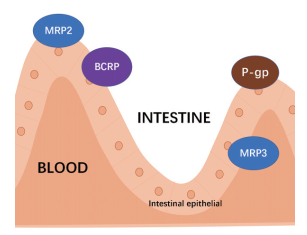
P-gp、MRP2、MRP3和BCRP是肠道屏障上分布的主要ABC转运蛋白, 如图 2所示。其中, P-gp在回肠和结肠中表达量较高, 而在空肠和十二指肠中表达量最低。BCRP则在小肠和大肠中广泛表达。MRP同样在小肠和大肠中高度表达, 主要分布在肠上皮细胞基底外侧膜, 发挥控制吸收载体的作用[24]。这些ABC转运体介导的药物外排限制了底物药物的吸收, 导致其药代动力学参数的改变, 进而对口服药物的分布与疗效产生重大影响[25]。
|
Figure 2 ABC transporters located on intestinal epithelial in intestinal barrier |
中药通过影响肠道屏障上的P-gp外排活性, 从而影响P-gp底物药物的吸收, 在中药-化药联用过程中发挥重要作用。药用植物中广泛存在的植酸(IP-6) 能够通过抑制Caco-2和MDCK II-MDR1单层细胞中P-gp的功能, 浓度依赖性地降低罗丹明123的流出率, 增加Caco-2细胞内罗丹明123的积累[26]。
许多中药活性成分在临床研究中被证明在P-gp介导的中药-化学合成药物相互作用具有正面效应, 如白藜芦醇[15]、丁香酚[17]、小檗碱[18]和黄芩[21]等。胡椒碱是黑胡椒和长胡椒中主要的生物碱, Bhardwaj等[27]发现了胡椒碱会对人肝微粒体CYP3A4产生影响, Athukuri等[20]进一步发现胡椒碱对肠道屏障上的P-gp也有抑制作用: 将大鼠随机分为两组, 分别给药胡椒碱和等量P-gp抑制剂维拉帕米预处理8天后给药多潘立酮, 胡椒碱组和维拉帕米组多潘立酮的平均累积浓度增加了1.1倍和1.7倍。胡椒碱组和维拉帕米组多潘立酮在回肠中的有效通透性分别增加了4.1倍和5.9倍。提示胡椒碱与多潘立酮联用时具有类似P-gp抑制剂的作用, 具有增强多潘立酮药效的潜力。
中药安息香和麝香等在方剂中常被用来增强其他成分的功效。Wang等[28]发现, 安息香中的活性成分苯甲醛和香兰素、麝香的活性成分麝香酮和冰片均能显著增加罗丹明123在P-gp抑制剂维拉帕米处理后的Caco-2细胞(VB-Caco-2细胞) 中的转运量。动物实验也表明上述成分可以增加罗丹明123在大鼠空肠和回肠中的吸收速率, 减少外排率。进一步研究发现这些成分降低了VB-Caco-2细胞中P-gp的蛋白和ABCB1 mRNA水平, 从而抑制P-gp的功能和表达。
2.2 BCRPBCRP作为一种保护性外排型转运蛋白广泛分布于体内生物屏障。即便在没有过表达P-gp或MRP的情况下, 肠道屏障上的BCRP依然会通过限制药物进入体内的含量来影响药物对于多药耐药性肿瘤的疗效[29], 如米托蒽醌、阿霉素、伊立替康、拓扑替康和甲氨蝶呤等抗肿瘤药物均是BCRP的底物。而肠道屏障中肠上皮细胞的BCRP表达, 限制了这类抗肿瘤药物的口服生物利用度。相关研究表明, 中药往往比合成抑制剂具有更好的抑制BCRP功能, Karibe等[30]研究发现在非啮齿类动物模型中, 用姜黄素作为BCRP的体内选择性抑制剂预处理, 比用拉帕替尼和泮托拉唑预处理更适合评估BCRP对胃肠道吸收的影响。
中药对肠道屏障上BCRP的调节作用主要是抑制其活性, 以改善联用药物的口服生物利用度, 增强其药效。抗叶酸类抗肿瘤药甲氨蝶呤是BCRP的底物, 但是其治疗窗口狭窄, 低浓度下药效较差, 而高浓度下又会产生严重的肾毒性, 限制了其临床应用。Yu等[21]发现, 大鼠口服给药1.0或2.0 g·kg-1的黄芩会显著增加甲氨蝶呤的全身暴露和平均滞留时间(mean residence time, MRT), 进一步采用Caco-2细胞及高表达BCRP的MDCKII-BCRP细胞模型, 发现黄芩中的有效成分黄芩苷的体内代谢产物葡萄糖醛酸黄芩苷是MRP2和BCRP的底物, 葡萄糖醛酸黄芩苷可以通过抑制BCRP介导的外排转运, 使甲氨蝶呤的全身暴露和MRT增加293%~347%。而与黄芩相反, 有研究[31]发现, 大鼠联合给药白藜芦醇和甲氨蝶呤可以通过上调BCRP的表达, 显著改善肾功能, 降低亚硝化和凋亡标记物, 从而对甲氨蝶呤诱导的肾毒性产生保护作用。由此可见甲氨蝶呤联用黄芩苷或白藜芦醇具有不同的增加甲氨蝶呤抗肿瘤能力或抑制肾毒性的功能, 有扩宽甲氨蝶呤治疗窗的应用前景。关注肠道屏障上BCRP介导的中药-化学合成药物相互作用有望改善现有药物, 尤其是部分抗肿瘤药物的生物利用度。
2.3 MRP一些中药活性成分是肠道屏障的MRP转运蛋白的底物。在肠上皮细胞基底外侧膜表达的MRP3 (ABCC3)介导了黄芩苷的转运[32]; 葡糖醛酸化或硫酸盐化的中药活性成分是MRP高度亲和的底物[33]; 葛根芩连水煎液可以浓度依赖性地下调Caco-2细胞ABCC1-6 mRNA表达, 从而降低药物外排, 增大化疗药物的生物利用度[34]。因此, 中药活性成分具有肠道屏障上MRP抑制剂的潜力, 改善口服药物的生物利用度与药效。
白藜芦醇是中药虎杖中的主要活性成分, 也广泛存在于葡萄、浆果和花生中。口服主要代谢产物是葡醛酸酯化白藜芦醇, 为MRP2和MRP3的底物。体外实验证明白藜芦醇有抑制ABC转运蛋白的作用, 其与阿霉素和多西紫杉醇联用时, 可通过下调ABCB1和ABCC2的蛋白和mRNA水平对抗肿瘤细胞的多药耐药性[35]。胡椒碱、大蒜提取物及其活性成分二烯丙基二硫醚对MRP2具有诱导作用。姜黄素则可能对MRP2有抑制作用[36]。有关中药成分对肠道屏障MRP的作用研究较少, 其潜在的改善口服药物生物利用度的能力有待进一步研究。
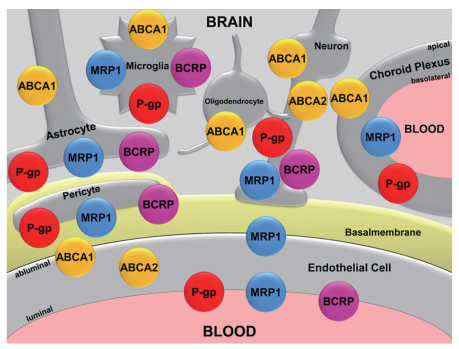
3 血脑屏障上ABC转运蛋白介导的中药-化药相互作用血脑屏障(blood-brain barrier, BBB) 是位于血液和脑组织中间的一道复合生理屏障, 有调节分子进出中枢神经系统(central nervous system, CNS), 维持稳定的神经元环境的作用[37]。其基膜包裹着紧密连接的内皮细胞、基膜之外包被的大量神经胶质细胞和星形细胞, 与其上高表达的P-gp形成了多重屏障[38]。这样的多重屏障结构使得绝大多数药物都无法穿过血脑屏障, 除了极少数高脂溶性的小分子药物。血脑屏障上分布的ABC转运蛋白如图 3[39]所示, 包括P-gp、BCRP和MRP1等。面对一些CNS疾病, 包括阿尔兹海默病、帕金森病、脑膜炎等, 药物难以穿过血脑屏障到达疾病部位, 或仅有少部分药物到达病灶后有效浓度不足导致疗效不佳, 例如针对阿尔兹海默病开展的近乎99%的临床试验都无法达到预期治疗效果[40]。一些中药活性成分可以通过影响血脑屏障上的ABC转运蛋白, 调控外源性物质和药物穿越血脑屏障。与其他药物联合应用时, 可提高CNS疾病的治疗效果。表 3[41-44]是近年来基于血脑屏障上ABC转运蛋白的中药-化药相互作用的研究。
|
Figure 3 Map of the ABC transporters ABCA1, ABCA2, P-gp, MRP1, and BCRP in the CNS[39] |
| 表 3 Studies on TCM-drug interactions mediated by ABC transporters in the blood-brain barrier (2015-2020) |
治疗CNS疾病药物的关键是使药物能够跨越BBB到达病灶发挥疗效, 但是几乎所有的高分子药物, 例如多肽、重组蛋白、单抗等和大部分小分子药物都无法穿越血脑屏障。P-gp是BBB上的主要外排型转运蛋白, 并且当发生原发脑肿瘤时, P-gp会在肿瘤细胞中高表达, 增加了原发性脑肿瘤的耐药性[45]。中药活性成分通过影响P-gp的功能而在治疗CNS疾病方面显示出独特的优势, 如京尼平苷、哈巴苷、马钱子苷等环烯醚萜类化合物[46]即可通过调节小鼠脑内皮细胞(bEnd3) 的P-gp表达来改善溶酶体自噬过程, 从而改善阿尔茨海默症。吴茱萸碱、吴茱萸次碱和去氢吴茱萸碱联用可以抑制P-gp而减少去氢吴茱萸碱的外排[47]。五味子中的五味子乙素、菖蒲中的姜黄素、没药树中的没药甾酮等也对血脑屏障上的P-gp有显著的抑制作用[48]。
替莫唑胺(TMZ) 是临床上治疗脑胶质瘤效果较好的化疗药物, 有研究表明, 血脑屏障上的P-gp与BCRP的联合缺失能使替莫唑胺的脑部浓度增加1.5倍[49]。因此抑制血脑屏障的ABC转运蛋白不仅能够有效提高替莫唑胺的药效, 同时也能减轻患者的经济压力。β-细辛醚是中药细辛的有效成分, Wang等[43]将人胶质瘤U251细胞和大鼠胶质瘤C6细胞各分为三组, 分别为对照模型组、单独给药TMZ组、以及联合给药TMZ和β-细辛醚组, 通过细胞免疫组织化学/免疫荧光、流式细胞术和Western blot检测P-gp的表达。结果显示, 与对照模型组相比, 其余两组的两种细胞P-gp的表达均降低, 其中联合给药TMZ和β-细辛醚组的P-gp表达低于单独给药TMZ组, 且细胞内浓度明显上升。提示β-细辛醚可以通过降低肿瘤细胞P-gp的表达, 逆转肿瘤细胞的耐药性, 增强与β-细辛醚联用的替莫唑胺的药效。粉防己碱联用长春新碱也可通过抑制过表达的P-gp, 对小鼠耐药性具有明显的逆转作用, 从而增强长春新碱的抗脑胶质瘤作用[42]。鉴于中药活性成分对于血脑屏障上ABC转运蛋白的影响, 研究ABC转运蛋白介导的中药对于治疗CNS疾病的化学合成药的相互作用有重要意义。
3.2 BCRPBCRP不仅在小肠和大肠上皮细胞中高表达, 也在血脑屏障和血脊髓屏障(blood cerebrospinal barrier, BCB) 的内皮细胞腔面表达, 限制了许多药物进入中枢神经系统, 进而导致CNS疾病的治疗失败[50]。通过BCRP敲除模型发现BCRP能降低许多药物穿透血脑屏障的能力, 如BCRP会严重限制甲氨蝶呤脑分布, 血浆中游离药物仅5%跨越BBB到达脑组织; 米托蒽醌与BCRP抑制剂GF120918灌注时米托蒽醌的脑摄取增加了3.0倍; 新型酪氨酸激酶抑制剂甲磺酸伊马替尼也被证明其脑分布受BCRP的制约[51]。尽管研究者在BCRP抑制剂的开发上做了大量的努力, 但由于缺乏合适的候选分子, 临床上针对BCRP的化学敲除/下调仍未实现[52]。化学合成的BCRP抑制剂目前还未有重大突破。
已有多种中药活性成分被证明可抑制BCRP的表达或功能, Fan等[44]研究了99种黄酮类化合物在体外和体内对BCRP的抑制作用, 并阐明黄酮类与BCRP的构效关系。其中有11种黄酮类化合物, 包括金丝桃素、穗花杉双黄酮、芫花素、甘草查尔酮A、山柰素、芹菜素、山柰酚、白杨素、柚皮素、鹰嘴豆芽素A, 对MDCKII-BCRP细胞中的BCRP表现出显著的抑制作用(> 50%), 减少了阿霉素和替莫唑胺的外排, 最终增加了它们的药效。进一步采用高表达BCRP的胶质瘤细胞U251、诱导替莫唑胺耐药的U251T细胞和天然TMZ耐药的T98G细胞研究TMZ联用上述黄酮类化合物对药效的影响, 结果显示甘草查尔酮A和芫花素可以显著抑制BCRP对替莫唑胺的外排, 从而达到增强药效的目的。
3.3 MRP由于对底物/抑制剂药物外排过程的分子识别过程认识不足, 对血脑屏障上MRP外排转运蛋白的研究很少, 而中药对血脑屏障上MRP的作用研究也几乎为零。有研究者建立了一个关于MRP1转运蛋白功能对血脑屏障渗透率影响的预测模型, 该模型为人工神经网络模型, 共选取9个描述符, 包括分子量、拓扑极性表面积、ClogP、氢键供体数、氢键受体数、可旋转键数、P-gp、BCRP和MRP-1底物概率[53]。中药活性成分对血脑屏障上的MRP功能或表达的影响有待进一步研究。
4 ABC转运蛋白介导逆转肿瘤多药耐药的中药-化药相互作用多药耐药性(multidrug resistance, MDR) 不仅是癌症化疗的主要临床障碍, 同时也干预着感染性疾病治疗, 近80%的患者在医院出现耐药性, 导致医疗成本飙升。因此, 针对多药耐药性开发了诸如microRNA和RNA干扰使耐多药相关基因失活、靶向P-gp的单克隆抗体、新型非P-gp底物抗癌药物的开发、基于纳米技术的方法来克服MDR等策略[54]。ABC转运蛋白是经典的MDR抑制剂靶点, 至今已开发了三代抑制剂, 包括维拉帕米、伐司朴达、Tariquidar、Elacridar等[55], 以维拉帕米为代表的第一代抑制剂在临床中需要高浓度才能达到抑制P-gp功能与表达的效果; 伐司朴达等第二代抑制剂虽然对P-gp抑制作用更强, 但是与CYP450的高亲和力限制了其临床使用; 目前第三代抑制剂的开发以识别高特异性和低毒性为目标[56]。但是这些抑制剂因毒性较强或疗效差几乎无法通过临床试验[57], 因此寻找合适的P-gp抑制剂成为了研究热点。近年来, 关于多药耐药性的研究重点已转移到从天然药物中寻找有效抑制剂, 以期逆转ABC转运蛋白介导的MDR[58]。茯苓、枸杞、人参、姜黄、甘草、当归、黄芪[59]等的活性成分均能影响P-gp的活性, 从而改善P-gp介导的多药耐药情况。表 4[60-74]归纳了2015年以来的中药逆转ABC转运体介导的MDR研究情况。
| 表 4 Studies on TCM-drug interactions on reversal of MDR mediated by ABC transporters (2015-2020) |
P-gp作为逆转肿瘤MDR的明星靶点, 针对其开展的中药活性成分逆转肿瘤MDR的研究较为丰富。从阿魏属植物中分离纯化的15种倍半萜香豆素处理MCF-7/Adr细胞后能抑制细胞中P-gp的功能, 明显增加罗丹明123的细胞内蓄积[75]。姜黄素与川芎嗪也都被认为是细胞毒性与逆转MDR的双功能化疗药物[76], 可指导今后P-gp抑制剂的开发。
Hu等[73]采用MTT法测定联用丹参酮I、丹参酮IIA、隐丹参酮、二氢丹参酮和米替龙等5种丹参活性成分对阿霉素和伊立替康对P-gp过表达的SW620细胞和P-gp过表达且阿霉素耐药的SW620AD300细胞的细胞毒性, 结果表明化疗药物联用隐丹参酮或二氢丹参酮可以增强化疗药物对癌症细胞的细胞毒性。Western blot结果表明, 在化疗药物联合给药隐丹参酮或二氢丹参酮24 h内, SW620细胞与SW620AD300细胞内P-gp的表达量显著减少。上述结果表明隐丹参酮和二氢丹参酮都能增强化疗药物对P-gp过表达且耐药的结肠癌细胞的细胞毒性。且与传统的P-gp抑制剂维拉帕米相比, 隐丹参酮和二氢丹参酮在抑制P-gp方面更有效。
Ma等[61]使用流式细胞仪、RT-qPCR和Western blot法测定了使用奥沙利铂(L-OHP) 时联用人参皂苷-Rh2的奥沙利铂耐药细胞LoVo/L-OHP和LoVo细胞的P-gp表达。研究发现人参皂苷-Rh2处理可显著抑制LoVo/L-OHP和LoVo细胞的增殖, 诱导其凋亡, 同时显著降低了LoVo/L-OHP和LoVo细胞中P-gp的水平。提示奥沙利铂与人参皂苷-Rh2联用可显著增强奥沙利铂的细胞毒性, 可能是由于人参皂苷-Rh2降低了P-gp水平。
4.2 BCRP癌症干细胞亚群具有ABCG2/BCRP和其他ABC转运蛋白高表达的特征。有研究表明, BCRP的变异可以影响包括癌症化疗在内多种疾病的药物治疗结果, 其被认为在化疗期间的多药耐药中发挥重要作用[77]。而ABCG2/BCRP的抑制实验证明, 通过抑制BCRP的表达或活性抑制癌细胞系侧群细胞的增殖[78]。但至今尚无可以投入临床应用的BCRP合成抑制剂, 从中药中开发低毒、高效的BCRP抑制剂, 将有可能为逆转BCRP介导的肿瘤多药耐药带来新希望。
α-倒捻子素是从山竹果皮中提取的天然氧杂蒽酮, Wu等[79]证明了在无毒浓度(0~3.0 μmol·L-1) 下, α-倒捻子素能有效和选择性地抑制BCRP介导的药物转运, 逆转AGCG2过表达的R482-HEK293细胞。α-倒捻子素与ABCG2药物结合位点之间的直接相互作用可以通过刺激TPase活性和抑制[125I] 碘酰拉唑嗪对BCRP底物结合位点(s) 的光标记来证实。因此α-倒捻子素有望进一步发展成为BCRP逆转MDR的调节剂。而Jia等[68]的研究结果也表明经过芫荽的活性成分鼠李酸处理后的HepG2/ADR细胞的BCRP表达显著降低, HepG2/ADR细胞对小分子激酶抑制剂索拉非尼、化疗药物依托泊苷和紫杉醇的敏感性显著升高。
4.3 MRP在P-gp介导的诸如白血病、肾癌、结肠癌、乳腺癌和肺癌等化疗过程中的不良反应常伴随着MRP的作用[45], 因此常与P-gp同时研究, 单独针对MRP蛋白开展的研究较少。
夏枯草水提物和迷迭香酸均可通过增加HepG2细胞内ATP水平增强MRP2和P-gp的外排活性, 当夏枯草与其他通过MRP2和P-gp转运的底物药物联合用药时, 可能产生潜在的药物-药物相互作用[80]。Zhao等[71]利用Western blot和RT-qPCR检测转运蛋白活性, 发现醋灸柴胡的活性成分赤桐甾醇与秋水仙碱联用后通过增加P-gp和MRP1活性而降低HEK 293细胞对秋水仙碱的吸收。Wang等[70]的研究结果表明, 白藜芦醇(RES) 能够增强抗癌药物对pumc-91/ADM细胞的细胞毒性。与对照组相比, RES组细胞的MRP1水平显著降低, Topo-II水平升高。RES有效逆转了pumc-91/ADM细胞中阿霉素耐药, 其潜在的分子机制可能与MRP1表达水平的改变有关。
5 小结与展望ABC转运蛋白家族是人体内重要的外排型转运蛋白, P-gp、BCRP和MRP是其中最具代表性的成员, 许多中药成分会影响ABC转运蛋白的功能或表达, 进而影响联用化药的体内动态过程与药效。肠道屏障上的ABC转运蛋白, 特别是P-gp影响着口服药物的生物利用度, 多数研究集中在P-gp介导的中药-化药相互作用, BCRP的作用也逐渐引起重视, 研究侧重于增强联用化药的生物利用度。血脑屏障上ABC转运蛋白限制CNS疾病药物入脑、导致原发性脑肿瘤耐药性等, 目前关于血脑屏障上P-gp介导的中药-化药相互作用研究较多, 对于BCRP和MRP的相关研究较少, 需引起关注。而肿瘤细胞ABC转运蛋白过表达则会造成化疗药物的多药耐药性, 许多中药成分对P-gp、BCRP与MRP具有抑制作用, 从中药中寻找开发高效低毒的转运蛋白抑制剂, 与化疗药物联合应用以逆转肿瘤细胞MDR成为研究热点。
ABC转运蛋白介导的中药-化药相互作用的研究虽已取得较多进展, 但是对疾病状态下体内屏障ABC转运蛋白功能和表达了解不够全面, 近年来通过诱导多能干细胞构建疾病相关细胞模型对其中的ABC转运蛋白进行精准研究; 而中药活性成分众多, 与ABC转运蛋白的相互作用研究需要更多新技术新方法的支撑, 如3D-QSAR技术逐渐应用于快速筛选可影响ABC转运蛋白的中药活性成分; 一些天然共聚物-脂质纳米盘可以模拟膜蛋白的结构和功能, 有望应用于中药成分与ABC转运蛋白相互作用研究。相信随着ABC转运蛋白介导的中药-化药相互作用研究的深入, 其研究成果将为改善药物疗效和临床合理用药提供更准确可靠的科学依据。
作者贡献: 何宇臻负责文献检索及论文撰写; 王辉负责修改文章; 方家豪负责修改文章; 曹雨虹负责修改文章; 洪战英负责文章选题、指导写作、修改及校对文章。柴逸峰负责审阅文章。
利益冲突: 本文无利益冲突。
| [1] |
Dean M, Hamon Y, Chimini G. The human ATP-binding cassette (ABC) transporter superfamily[J]. J Lipid Res, 2001, 42: 1007-1017. DOI:10.1016/S0022-2275(20)31588-1 |
| [2] |
Wen PC, Verhalen B, Wilkens S, et al. On the origin of large flexibility of P-glycoprotein in the inward-facing state[J]. J Biol Chem, 2013, 288: 19211-19220. DOI:10.1074/jbc.M113.450114 |
| [3] |
Linton KJ, Higgins CF. Structure and function of ABC transporters: the ATP switch provides flexible control[J]. Pflugers Arch, 2007, 453: 555-567. DOI:10.1007/s00424-006-0126-x |
| [4] |
Silva R, Vilas-Boas V, Carmo H, et al. Modulation of P-glycoprotein efflux pump: induction and activation as a therapeutic strategy[J]. Pharmacol Ther, 2015, 149: 1-123. DOI:10.1016/j.pharmthera.2014.11.013 |
| [5] |
László L, Sarkadi B, Hegedűs T. Jump into a new fold-a homology based model for the ABCG2/BCRP multidrug transporter[J]. PLoS One, 2016, 11: 1-22. |
| [6] |
Sreenivasan S, Ravichandran S, Vetrivel U, et al. In vitro and In silico studies on inhibitory effects of curcumin on multi drug resistance associated protein (MRP1) in retinoblastoma cells[J]. Bioinformation, 2012, 8: 13-19. DOI:10.6026/97320630008013 |
| [7] |
Doyle LA, Yang W, Abruzzo LV, et al. A multidrug resistance transporter from human MCF-7 breast cancer cells[J]. Proc Natl Acad Sci U S A, 1998, 95: 15665-15670. DOI:10.1073/pnas.95.26.15665 |
| [8] |
Borst P, Elferink RO. Mammalian ABC transporters in health and disease[J]. Annu Rev Biochem, 2002, 71: 537-592. DOI:10.1146/annurev.biochem.71.102301.093055 |
| [9] |
Sarkadi B, Homolya L, Hegedűs T. The ABCG2/BCRP transporter and its variants - from structure to pathology[J]. FEBS Lett, 2020, 594: 4012-4034. DOI:10.1002/1873-3468.13947 |
| [10] |
Zheng J, Yang X, Wang Q, et al. Research progress in toxic effects of antitumor drugs based on drug transporter[J]. Acta Pharm Sin (药学学报), 2017, 52: 1496-1504. |
| [11] |
Heyes N, Kapoor P, Kerr ID. Polymorphisms of the multidrug pump ABCG2:a systematic review of their effect on protein expression, function, and drug pharmacokinetics[J]. Drug Metab Dispos, 2018, 46: 1886-1899. DOI:10.1124/dmd.118.083030 |
| [12] |
Salvo Romero E, Alonso Cotoner C, Pardo Camacho C, et al. The intestinal barrier function and its involvement in digestive disease[J]. Rev Esp Enferm Dig, 2015, 107: 686-696. |
| [13] |
Chelakkot C, Ghim J, Ryu SH. Mechanisms regulating intestinal barrier integrity and its pathological implications[J]. Exp Mol Med, 2018, 50: 1-9. |
| [14] |
Vancamelbeke M, Vermeire S. The intestinal barrier: a fundamental role in health and disease[J]. Expert Rev Gastroenterol Hepatol, 2017, 11: 821-834. DOI:10.1080/17474124.2017.1343143 |
| [15] |
Li J, Liu Y, Zhang J, et al. Effects of resveratrol on P-glycoprotein and cytochrome P4503A in vitro and on pharmacokinetics of oral saquinavir in rats[J]. Drug Des Devel Ther, 2016, 10: 3699-3706. DOI:10.2147/DDDT.S118723 |
| [16] |
Zhang H, Wang X, Wang T, et al. Enhancement of berberine hypoglycemic activity by oligomeric proanthocyanidins[J]. Molecules, 2018, 23: 1-17. |
| [17] |
Shen Q, Wang Y, Zhang Y. Improvement of colchicine oral bioavailability by incorporating eugenol in the nanoemulsion as an oil excipient and enhancer[J]. Int J Nanomed, 2011, 6: 1237-1243. |
| [18] |
Yu CP, Lin HJ, Lin SP, et al. Rhubarb decreased the systemic exposure of cyclosporine, a probe substrate of P-glycoprotein and CYP 3A[J]. Xenobiotica, 2016, 46: 677-682. DOI:10.3109/00498254.2015.1117159 |
| [19] |
Knop J, Misaka S, Singer K, et al. Inhibitory effects of green tea and (-)-epigallocatechin gallate on transport by OATP1B1, OATP1B3, OCT1, OCT2, MATE1, MATE2-K and P-Glycoprotein[J]. PLoS One, 2015, 10: 1-13. |
| [20] |
Athukuri BL, Neerati P. Enhanced oral bioavailability of domperidone with piperine in male wistar rats: involvement of CYP3A1 and P-gp inhibition[J]. J Pharm Pharm Sci, 2017, 20: 28-37. DOI:10.18433/J3MK72 |
| [21] |
Yu CP, Hsieh YC, Shia CS, et al. Increased systemic exposure of methotrexate by a polyphenol-rich herb via modulation on efflux transporters multidrug resistance-associated protein 2 and breast cancer resistance protein[J]. J Pharm Sci, 2016, 105: 343-349. DOI:10.1016/j.xphs.2015.11.031 |
| [22] |
Yuan ZW, Li YZ, Liu ZQ, et al. Role of tangeretin as a potential bioavailability enhancer for silybin: pharmacokinetic and pharmacological studies[J]. Pharmacol Res, 2018, 128: 153-166. DOI:10.1016/j.phrs.2017.09.019 |
| [23] |
Guan HY, Li PF, Wang XM, et al. Shengjiang Xiexin decoction alters pharmacokinetics of irinotecan by regulating metabolic enzymes and transporters: a multi-target therapy for alleviating the gastrointestinal toxicity[J]. Front Pharmacol, 2017, 8: 1-13. |
| [24] |
Gameiro M, Silva R, Rocha-Pereira C, et al. Cellular models and in vitro assays for the screening of modulators of P-gp, MRP1 and BCRP[J]. Molecules, 2017, 22: 1-48. |
| [25] |
Oostendorp RL, Buckle T, Beijnen JH, et al. The effect of P-gp (Mdr1a/1b), BCRP (Bcrp1) and P-gp/BCRP inhibitors on the in vivo absorption, distribution, metabolism and excretion of imatinib[J]. Invest New Drugs, 2009, 27: 31-40. DOI:10.1007/s10637-008-9138-z |
| [26] |
Li L, Fu Q, Xia M, et al. Inhibition of P-glycoprotein mediated efflux in Caco-2 cells by phytic acid[J]. J Agric Food Chem, 2018, 66: 988-998. DOI:10.1021/acs.jafc.7b04307 |
| [27] |
Bhardwaj RK, Glaeser H, Becquemont L, et al. Piperine, a major constituent of black pepper, inhibits human P-glycoprotein and CYP3A4[J]. J Pharmacol Exp Ther, 2002, 302: 645-650. DOI:10.1124/jpet.102.034728 |
| [28] |
Wang S, Tan N, Ma C, et al. Inhibitory effects of benzaldehyde, vanillin, muscone and borneol on P-glycoprotein in Caco-2 cells and everted gut sac[J]. Pharmacology, 2018, 101: 269-277. DOI:10.1159/000487144 |
| [29] |
Doyle L, Ross DD. Multidrug resistance mediated by the breast cancer resistance protein BCRP (ABCG2)[J]. Oncogene, 2003, 22: 7340-7358. DOI:10.1038/sj.onc.1206938 |
| [30] |
Karibe T, Imaoka T, Abe K, et al. Curcumin as an in vivo selective intestinal breast cancer resistance protein inhibitor in cynomolgus monkeys[J]. Drug Metab Dispos, 2018, 46: 667-679. DOI:10.1124/dmd.117.078931 |
| [31] |
El-Sheikh AA, Morsy MA, Al-Taher AY. Protective mechanisms of resveratrol against methotrexate-induced renal damage may involve BCRP/ABCG2[J]. Fundam Clin Pharmacol, 2016, 30: 406-418. DOI:10.1111/fcp.12205 |
| [32] |
Kalapos-Kovács B, Magda B, Jani M, et al. Multiple ABC transporters efflux baicalin[J]. Phytother Res, 2015, 29: 1987-1990. DOI:10.1002/ptr.5477 |
| [33] |
He SM, Li CG, Liu JP, et al. Disposition pathways and pharmacokinetics of herbal medicines in humans[J]. Curr Med Chem, 2010, 17: 4072-4113. |
| [34] |
Li XL, Wang JX, Wang J, et al. Effect of different concentrations of Gegen Qinlian decoction on expression of P-glycoprotein and multi-drug resistance protein transporter in Caco-2 cells[J]. Chin J Chin Mater Med (中国中药杂志), 2018, 43: 3135-3139. |
| [35] |
Al-Abd AM, Mahmoud AM, El-Sherbiny GA, et al. Resveratrol enhances the cytotoxic profile of docetaxel and doxorubicin in solid tumour cell lines in vitro[J]. Cell Prolif, 2011, 44: 591-601. DOI:10.1111/j.1365-2184.2011.00783.x |
| [36] |
Stieger B, Mahdi ZM, Jäger W. Intestinal and hepatocellular transporters: therapeutic effects and drug interactions of herbal supplements[J]. Annu Rev Pharmacol Toxicol, 2017, 57: 399-416. DOI:10.1146/annurev-pharmtox-010716-105010 |
| [37] |
Sweeney MD, Zhao Z, Montagne A, et al. Blood-brain barrier: from physiology to disease and back[J]. Physiol Rev, 2019, 99: 21-78. DOI:10.1152/physrev.00050.2017 |
| [38] |
Wang H, Wu JJ, Xue Q, et al. Effect factors and mechanisms of borneol's bidirectional regulation on blood-brain barrier permeability[J]. Chin J Chin Mater Med (中国中药杂志), 2017, 42: 2200-2207. |
| [39] |
Wolf A, Bauer B, Hartz AM. ABC transporters and the Alzheimer's disease enigma[J]. Front Psychiatry, 2012, 3: 1-54. |
| [40] |
Li H. Clinical research progress in drug treatment of Alzheimer's disease[J]. Chin J New Drug (中国新药杂志), 2017, 26: 648-655. |
| [41] |
Dong W, Liao ZG, Zhao GW, et al. Reversal effect of oxypeucedanin on P-glycoprotein-mediated drug transport[J]. Molecules, 2018, 23: 1-11. |
| [42] |
Song XL, Liu S, Jiang Y, et al. Targeting vincristine plus tetrandrine liposomes modified with DSPE-PEG(2000)-transferrin in treatment of brain glioma[J]. Eur J Pharm Sci, 2017, 96: 129-140. DOI:10.1016/j.ejps.2016.09.024 |
| [43] |
Wang N, Zhang Q, Ning B, et al. β-Asarone promotes temozolomide's entry into glioma cells and decreases the expression of P-glycoprotein and MDR1[J]. Biomed Pharmacother, 2017, 90: 368-374. DOI:10.1016/j.biopha.2017.03.083 |
| [44] |
Fan X, Bai J, Zhao S, et al. Evaluation of inhibitory effects of flavonoids on breast cancer resistance protein (BCRP): from library screening to biological evaluation to structure-activity relationship[J]. Toxicol In Vitro, 2019, 61: 1-14. |
| [45] |
Robey RW, Pluchino KM, Hall MD, et al. Revisiting the role of ABC transporters in multidrug-resistant cancer[J]. Nat Rev Cancer, 2018, 18: 452-464. DOI:10.1038/s41568-018-0005-8 |
| [46] |
Dinda B, Dinda M, Kulsi G, et al. Therapeutic potentials of plant iridoids in Alzheimer's and Parkinson's diseases: a review[J]. Eur J Med Chem, 2019, 169: 185-199. DOI:10.1016/j.ejmech.2019.03.009 |
| [47] |
Zhang YN, Yang YF, Yang XW. Blood-brain barrier permeability and neuroprotective effects of three main alkaloids from the fruits of Euodia rutaecarpa with MDCK-pHaMDR cell monolayer and PC12 cell line[J]. Biomed Pharmacother, 2018, 98: 82-87. DOI:10.1016/j.biopha.2017.12.017 |
| [48] |
Jin L, Wei YF, Gao Y. Research progress in penetration mechanism of chemical constituents in Chinese materia medica into blood-brain barrier and penetration enhancing methods[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 2183-2188. |
| [49] |
de Gooijer MC, de Vries NA, Buckle T, et al. Improved brain penetration and antitumor efficacy of temozolomide by inhibition of ABCB1 and ABCG2[J]. Neoplasia, 2018, 20: 710-720. DOI:10.1016/j.neo.2018.05.001 |
| [50] |
Goncalves J, Bicker J, Alves G, et al. Relevance of breast cancer resistance protein to brain distribution and central acting drugs: a pharmacokinetic perspective[J]. Curr Drug Metab, 2018, 19: 1021-1041. DOI:10.2174/1389200219666180629121033 |
| [51] |
Iorio AL, Ros M, Fantappiè O, et al. Blood-brain barrier and breast cancer resistance protein: a limit to the therapy of CNS tumors and neurodegenerative diseases[J]. Anticancer Agents Med Chem, 2016, 16: 810-815. DOI:10.2174/1871520616666151120121928 |
| [52] |
Toyoda Y, Takada T, Suzuki H. Inhibitors of human ABCG2:from technical background to recent updates with clinical implications[J]. Front Pharmacol, 2019, 10: 208-217. DOI:10.3389/fphar.2019.00208 |
| [53] |
Lingineni K, Belekar V, Tangadpalliwar SR, et al. The role of multidrug resistance protein (MRP-1) as an active efflux transporter on blood-brain barrier (BBB) permeability[J]. Mol Divers, 2017, 21: 355-365. DOI:10.1007/s11030-016-9715-6 |
| [54] |
Li W, Zhang H, Assaraf YG, et al. Overcoming ABC transporter-mediated multidrug resistance: molecular mechanisms and novel therapeutic drug strategies[J]. Drug Resist Updat, 2016, 27: 14-29. DOI:10.1016/j.drup.2016.05.001 |
| [55] |
Beretta GL, Cassinelli G, Pennati M, et al. Overcoming ABC transporter-mediated multidrug resistance: the dual role of tyrosine kinase inhibitors as multitargeting agents[J]. Eur J Med Chem, 2017, 142: 271-289. DOI:10.1016/j.ejmech.2017.07.062 |
| [56] |
Dewanjee S, Dua TK, Bhattacharjee N, et al. Natural products as alternative choices for P-glycoprotein (P-gp) inhibition[J]. Molecules, 2017, 22: 1-22. |
| [57] |
Waghray D, Zhang Q. Inhibit or evade multidrug resistance P-glycoprotein in cancer treatment[J]. J Med Chem, 2018, 61: 5108-5121. DOI:10.1021/acs.jmedchem.7b01457 |
| [58] |
Lou JS, Yao P, Tsim KWK. Cancer treatment by using traditional Chinese medicine: probing active compounds in anti-multidrug resistance during drug therapy[J]. Curr Med Chem, 2018, p25: 5128-5141. |
| [59] |
Zhu H, Jiang M. The findings of tumor related research in compendium of materia medica[J]. Pharm Clin Chin Mater Med (中药与临床), 2013, 4: 41-44. |
| [60] |
Liu S, Li R, Qian J, et al. Combination therapy of doxorubicin and quercetin on multidrug-resistant breast cancer and their sequential delivery by reduction-sensitive hyaluronic acid-based conjugate/d-α-tocopheryl poly(ethylene glycol) 1000 succinate mixed micelles[J]. Mol Pharm, 2020, 17: 1415-1427. DOI:10.1021/acs.molpharmaceut.0c00138 |
| [61] |
Ma J, Gao G, Lu H, et al. Reversal effect of ginsenoside Rh2 on oxaliplatin-resistant colon cancer cells and its mechanism[J]. Exp Ther Med, 2019, 18: 630-636. |
| [62] |
Wang Z, Li X, Wang D, et al. Concurrently suppressing multidrug resistance and metastasis of breast cancer by co-delivery of paclitaxel and honokiol with pH-sensitive polymeric micelles[J]. Acta Biomater, 2017, 62: 144-156. DOI:10.1016/j.actbio.2017.08.027 |
| [63] |
Li Q, Wang X, Shen A, et al. Hedyotis diffusa Willd overcomes 5-fluorouracil resistance in human colorectal cancer HCT-8/5-FU cells by downregulating the expression of P-glycoprotein and ATP-binding casette subfamily G member 2[J]. Exp Ther Med, 2015, 10: 1845-1850. DOI:10.3892/etm.2015.2762 |
| [64] |
Saeed MEM, Boulos JC, Elhaboub G, et al. Cytotoxicity of cucurbitacin E from Citrullus colocynthis against multidrug-resistant cancer cells[J]. Phytomedicine, 2019, 62: 1-48. |
| [65] |
Zong L, Cheng G, Liu S, et al. Reversal of multidrug resistance in breast cancer cells by a combination of ursolic acid with doxorubicin[J]. J Pharm Biomed Anal, 2019, 165: 268-275. DOI:10.1016/j.jpba.2018.11.057 |
| [66] |
Wang H, Chen X, Li T, et al. A myrsinol diterpene isolated from a traditional herbal medicine, Langdu reverses multidrug resistance in breast cancer cells[J]. J Ethnopharmacol, 2016, 194: 1-5. DOI:10.1016/j.jep.2016.08.041 |
| [67] |
Wang S, Wang A, Shao M, et al. Schisandrin B reverses doxorubicin resistance through inhibiting P-glycoprotein and promoting proteasome-mediated degradation of survivin[J]. Sci Rep, 2017, 7: 8419-8429. DOI:10.1038/s41598-017-08817-x |
| [68] |
Jia H, Yang Q, Wang T, et al. Rhamnetin induces sensitization of hepatocellular carcinoma cells to a small molecular kinase inhibitor or chemotherapeutic agents[J]. Biochim Biophys Acta, 2016, 1860: 1417-1430. DOI:10.1016/j.bbagen.2016.04.007 |
| [69] |
Kwatra D, Venugopal A, Standing D, et al. Bitter melon extracts enhance the activity of chemotherapeutic agents through the modulation of multiple drug resistance[J]. J Pharm Sci, 2013, 102: 4444-4454. DOI:10.1002/jps.23753 |
| [70] |
Wang S, Meng Q, Xie Q, et al. Effect and mechanism of resveratrol on drug resistance in human bladder cancer cells[J]. Mol Med Rep, 2017, 15: 1179-1187. DOI:10.3892/mmr.2017.6111 |
| [71] |
Zhao Y, Feng LM, Liu LJ, et al. Clerosterol from vinegar-baked radix bupleuri modifies drug transport[J]. Oncotarget, 2017, 8: 21351-21361. DOI:10.18632/oncotarget.15212 |
| [72] |
Neyshaburinezhad N, Kalalinia F, Hashemi M. Encapsulation of crocetin into poly (lactic-co-glycolic acid) nanoparticles overcomes drug resistance in human ovarian cisplatin-resistant carcinoma cell line (A2780-RCIS)[J]. Mol Biol Rep, 2019, 46: 6525-6532. DOI:10.1007/s11033-019-05098-7 |
| [73] |
Hu T, To KK, Wang L, et al. Reversal of P-glycoprotein (P-gp) mediated multidrug resistance in colon cancer cells by cryptotanshinone and dihydrotanshinone of Salvia miltiorrhiza[J]. Phytomedicine, 2014, 21: 1264-1272. DOI:10.1016/j.phymed.2014.06.013 |
| [74] |
Mirzaei SA, Gholamian Dehkordi N, Ghamghami M, et al. ABC-transporter blockage mediated by xanthotoxin and bergapten is the major pathway for chemosensitization of multidrug-resistant cancer cells[J]. Toxicol Appl Pharmacol, 2017, 337: 22-29. DOI:10.1016/j.taap.2017.10.018 |
| [75] |
Kasaian J, Mosaffa F, Behravan J, et al. Reversal of P-glycoprotein-mediated multidrug resistance in MCF-7/Adr cancer cells by sesquiterpene coumarins[J]. Fitoterapia, 2015, 103: 149-154. DOI:10.1016/j.fitote.2015.03.025 |
| [76] |
Ma X, Hu M, Wang H, et al. Discovery of traditional Chinese medicine monomers and their synthetic intermediates, analogs or derivatives for battling P-gp-mediated multi-drug resistance[J]. Eur J Med Chem, 2018, 159: 381-392. DOI:10.1016/j.ejmech.2018.09.061 |
| [77] |
Chen L, Manautou JE, Rasmussen TP, et al. Development of precision medicine approaches based on inter-individual variability of BCRP/ABCG2[J]. Acta Pharm Sin B, 2019, 9: 659-674. DOI:10.1016/j.apsb.2019.01.007 |
| [78] |
Katayama R, Koike S, Sato S, et al. Dofequidar fumarate sensitizes cancer stem-like side population cells to chemotherapeutic drugs by inhibiting ABCG2/BCRP-mediated drug export[J]. Cancer Sci, 2009, 100: 2060-2068. DOI:10.1111/j.1349-7006.2009.01288.x |
| [79] |
Wu CP, Hsiao SH, Murakami M, et al. Alpha-mangostin reverses multidrug resistance by attenuating the function of the multidrug resistance-linked ABCG2 transporter[J]. Mol Pharm, 2017, 14: 2805-2814. DOI:10.1021/acs.molpharmaceut.7b00334 |
| [80] |
Wu J, Zhu Y, Li F, et al. Spica prunellae and its marker compound rosmarinic acid induced the expression of efflux transporters through activation of Nrf2-mediated signaling pathway in HepG2 cells[J]. J Ethnopharmacol, 2016, 193: 1-11. DOI:10.1016/j.jep.2016.07.021 |
 2021, Vol. 56
2021, Vol. 56