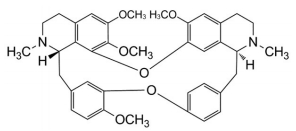
汉防己甲素(tetrandrine, TET, 图 1) 是粉防己(又名汉防己) 中提取的天然药物。粉防己(Stephania tetrandra S. Moore) 是传统中药材, 其根部入药可利水消肿, 祛风止痛, 用于水肿脚气、小便不利、风湿痹痛、湿疹疮毒、高血压症等。TET属于双苄基异喹啉生物碱。目前临床用制剂为TET片和TET注射液, 适应症为治疗各期煤硅肺以及抗风湿痛, 与小剂量放射合并用于治疗肺癌。TET治疗矽肺, 已在临床应用超过五十余年[1]。虽然有一些TET具有肺毒性、肝毒性以及遗传毒性等研究报道, 但临床报道的不良反应很少, 药品说明书中也提示仅有轻度嗜睡、乏力、恶心等消化道症状。近年来大量研究发现TET还具有抗过敏、抗心绞痛、抗高血压、抗抑郁、抗类风湿性关节炎、以及神经保护和促进记忆等药理作用[2]。随着新型冠状病毒肺炎(COVID-19) 的暴发, TET还被发现具有治疗新冠肺炎的前景[3]。
|
Figure 1 Chemical structure of tetrandrine |
药物原形或其代谢产物的体内有效暴露是决定其药效和毒性的重要物质基础。本文通过回顾TET针对肺部药理活性的用法用量及其疗效和作用机制, 结合相关的毒性研究以及药代动力学特征研究等文献, 探讨TET发挥治疗肺部疾病的药效和潜在毒性的体内暴露处置过程。基于此, 进一步论证其治疗新冠肺炎的应用前景。
1 TET肺部药理活性及其用法用量 1.1 治疗和预防矽肺TET最早用于临床的适应症就是矽肺。研究发现TET具有治疗和预防矽肺的作用。在一项临床试验中, 矽肺患者给予40 mg的TET, 每日3次口服, 连续6个月后, 与仅给予常规治疗加安慰剂的对照组相比, 能够明显改善临床症状, 抑制肺纤维化的进展[4]。在石英粉尘造成大鼠矽肺模型中, 灌胃给予TET (50 mg·kg-1) 后可以抑制矽肺纤维化形成。对粉尘矽肺大鼠肺组织Ⅰ型和Ⅲ型胶原表达研究发现, TET可以抑制矽肺大鼠肺内Ⅰ型和Ⅲ型胶原蛋白mRNA含量升高[5], 并且这种作用发生在胶原合成的起始阶段[6]。研究还发现TET不仅对染尘后的大鼠有保护作用, 还可以降低矽结节指数, 对其他脏器功能也没有影响[7]。对矽肺大鼠肺组织内的自由基指标测定发现, 矽肺模型组超氧化物歧化酶(SOD) 水平下降, 丙二醛(MDA) 和一氧化氮(NO) 水平上升, 而TET可以抑制这种变化[8]。
此外, TET还可以改善博来霉素诱导的大鼠肺纤维化的MDA、羟脯氨酸(HYP)、肿瘤坏死因子α (TNF-α) 和肺系数等指标, 并且与拮抗钙、钙调素系统有关, 预防性给药效果优于治疗性给药[9]。TET抑制转化生长因子-β1 (TGF-β1) 表达和成纤维化细胞的增殖及分化可能是其防治放射性肺纤维化的分子机制之一, 其治疗效果不亚于糖皮质激素类药物, 这为它的临床应用提供了良好的理论基础[10, 11]。
由于矽肺常常并发肺动脉高压, TET还可以通过抑制磷脂酶A2、前列腺素[12]、血小板衍生生长因子[13]、成纤维细胞生长因子等的表达[14], 调节NO信号通路及抗氧化、抗增殖作用[15]等抑制实验性肺动脉压的升高。
1.2 抗肺癌TET的抗肿瘤作用也是被广泛研究的药理活性。TET的抗肿瘤作用主要包括直接抑制细胞增殖, 诱导癌细胞凋亡、自噬, 抑制肿瘤细胞的迁移和侵袭, 逆转肿瘤细胞的多药耐药等机制[16, 17]。TET的抗肿瘤作用非常广泛, 包括抗肺癌、结肠癌、乳腺癌、胰腺癌、卵巢癌、前列腺癌和肝癌等[16], 相关研究很多, 但都处于研究阶段。本文重点关注对肺癌的药理作用。
TET的药品说明书中明确标注了其对肺癌放疗的辅助作用。早在上世纪80年代就有研究报道了对晚期肺癌患者实行小剂量放射合并TET的综合治疗效果。发现在放疗前2 h, 给予静脉滴注180~300 mg的TET后, 能够明显减轻患者的临床症状, 对鳞癌的效果更明显[18], 说明TET具有放疗增敏作用。近年来开展的TET注射液联合吉西他滨和顺铂治疗晚期非小细胞肺癌的研究发现, 缓慢静滴150 mg的TET, 连续10天, 可以明显提高晚期非小细胞肺癌患者化疗的近期疗效, 延长生存期, 无明显不良反应, 改善患者生活质量, 在一定程度上提高机体对化疗的耐受[19]。
在A549 (人非小细胞肺癌细胞系) 细胞模型上研究发现, TET能够通过上调多聚ADP-核糖聚合酶(PARP)、Bcl-2相关X蛋白(Bax)、细胞间黏附分子(ICAM-1) 和血管内皮细胞生长因子(VEGF) 的表达, 抑制Akt的磷酸化和通过参与VEGF/HIF-1α/ICAM-1信号通路抑制缺氧诱导因子-1α (HIF-1α)的表达从而有效地诱导癌细胞凋亡[20]。
在人肺腺癌耐药细胞(A549/DDP细胞) 的BALB/c裸鼠模型上, 研究含有TET的补肺益气汤对肺癌的治疗作用时, 发现给药组可明显抑制肿瘤生长, 增加抑瘤率。作用机制可能是TET通过下调多药耐药蛋白的mRNA和蛋白表达逆转多药耐药蛋白水平, 减少GST-π的蛋白含量, 通过降低MVD和PI3K/Akt/mTOR信号通路抑制bFGF/FGFR信号通路, 进而提高DDP的细胞毒性抗肿瘤作用[21]。
TET治疗肺癌的作用机制包括: ①直接诱导肿瘤细胞凋亡。②放疗增敏: 抑制放射线引起的致死性损伤发挥放射增敏作用, 并可通过抑制炎症反应而减轻放射损害。③化疗减毒: TET可减轻平阳霉素和博来霉素所致肺纤维化形成前的肺泡炎症反应, 加速氧自由基清除, 避免肺内功能细胞受损而导致各种致纤维化因子释放, 从而减轻毒性反应。④逆转耐药性: TET能够间接阻断肿瘤细胞膜表面过度表达的P-糖蛋白(P-gp) 的功能, 从而增加细胞内化疗药物浓度, 逆转耐药。
1.3 治疗方案及用法用量TET作为处方药物, 片剂规格为20 mg。在药品说明书中抗肺癌的用量为每次40~60 mg, 一日3次; 抗矽肺的用量为每次60~100 mg, 一日3次, 连服6天, 停药1天, 3个月为1疗程。为提高疗效, 临床也报道了很多探索性的用药方案。在针对TET治疗矽肺和肺癌的研究中, 研究者在体外和体内模型上尝试了多种给药浓度和剂量。考虑到药物剂量和浓度与药效和毒性密切相关, 本文特别总结了TET针对矽肺和肺癌研究的治疗方案和用法用量(表 1[4, 11, 18, 19, 22-39]), 以便理解TET的药代动力学特性。
| Table 1 Summary of the usage and efficacy of tetrandrine in clinical trials of pulmonary diseases |
从表 1可见, TET在临床的常用口服剂量在每次40 mg (一天3次) 到每天300 mg范围内, 疗程从连续6天至6个月; 静注剂量在每天150~270 mg内, 疗程从连续10天至两个月。上述开展的TET临床试验主要以观察药效为主, 未报道药代动力学结果。
2 TET的毒性TET的毒性研究报道比药理学研究少, 主要的报道来自动物整体研究。实验动物的毒性研究发现TET的急性毒性与给药途径相关。大鼠灌胃、肌注和静注给药的LD50分别为2 230、1 500和38 mg·kg-1, 小鼠分别为3 700、1 450和82.5 mg·kg-1 [40]。TET的中毒反应包括恶心、呕吐、震颤、共济失调、肌张力增加、四肢麻痹, 严重时因呼吸抑制而死亡。TET静注剂量过大或滴注太快时可发生严重不良反应, 表现为注射部位疼痛和静脉炎、血压急剧下降、血红蛋白血症、血红蛋白尿和轻度贫血、嗳气、恶心呕吐及呼吸急促、呼吸困难、肾小管坏死等。有实验报道, 以10~150 mg·kg-1剂量给猴子静脉滴注, TET可产生急性降压作用, 滴注速度太快, 可使动物立即死亡。在中毒剂量时, 会出现严重的局部组织刺激、肝脏毒性、淋巴组织坏死及肾脏毒性[40]。小鼠静注TET剂量达45 mg·kg-1时, 迅速出现兴奋、惊厥, 直至死亡。剂量减至35 mg·kg-1以下时, 小鼠出现先兴奋后抑制, 活动减少, 部分小鼠四肢抽搐, 呼吸困难, 惊厥, 死亡, 动物死亡均发生10 min内, 少数于10~15 min逐渐缓解而存活。家兔静注TET 10 mg·kg-1后, 血压显著降低, 心律减慢, 心电图P波低平, Q-T间期延长; 剂量达15 mg·kg-1时, 血压急剧下降, 心律明显降低, 并出现室性心律失常, 5~10 min内出现抽搐、惊厥、心脏停搏、呼吸衰竭而死亡[41]。犬口服TET 40 mg·kg-1, 一周3次, 连续给药2个月后出现肝功能异常, 6个月出现肝细胞坏死; 口服20 mg·kg-1, 连续给药5个月后肾小管上皮细胞出现肿胀坏死[42]。体外实验显示犬肾细胞(MDCK) 比大鼠肾细胞对TET更敏感[43], 提示不同种属对该药毒性的敏感性不同。在遗传毒性研究中, 给予TET的小鼠精子畸形率和小鼠骨髓细胞微核率显著增高, 且与微核率之间存在剂量-效应关系, 但小鼠的姊妹染色单体交换频率的改变不显著, 表明该药对实验动物可能具有遗传毒性[44]。
TET的临床毒性报道较少, 主要原因可能包括: ①在目前临床推荐的用法用量下, TET在体内的暴露量不能产生毒性; ② TET的代谢和毒性耐受存在种属差异; ③ TET常常与抗肿瘤药物和放射治疗同时应用, 肿瘤晚期患者经常伴随恶病质, 不容易发现明确的药物不良反应。
3 TET的药代动力学特征 3.1 吸收TET水溶性差, 在pH 7.4的磷酸缓冲液中的溶解度约为15 μg·mL-1 [45], 其透膜吸收特征未见报道。目前还没有其口服生物利用度的准确数据, 但根据静脉和口服途径的LD50差异较大提示TET的口服生物利用度较低。有研究者通过改变制剂剂型, 如制成吸入剂, 大大提高了体内药物浓度[45, 46]。
目前文献中关于TET的药代动力学数据差异较大。在大鼠体内TET的药代动力学研究中, 以10 mg·kg-1口服后血浆峰浓度(Cmax) 为519.3 ng·mL-1 [45], 而另一篇文献中以50 mg·kg-1口服的Cmax仅为237.1 ng·mL-1 [47]。在一项健康志愿者研究中, 单次口服100 mg的TET的Cmax为67.26 ng·mL-1 [48], 研究者同时以小檗胺作为代谢产物测定了小檗胺的浓度, 但小檗胺并不是TET的代谢产物, 两者是旋光异构体。也有文献[49]报道人体单次口服40 mg后Cmax可高达11.7 μg·mL-1, 其数据的准确性有待考察。因此可以看出, 目前调研到的TET药代动力学数据不够系统和严谨, 没有口服生物利用度以及剂量和暴露关系, 但根据经验可初步推测TET口服后血药浓度较低。
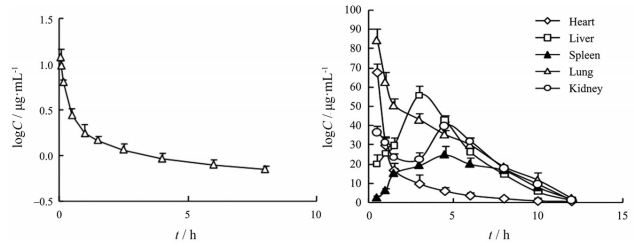
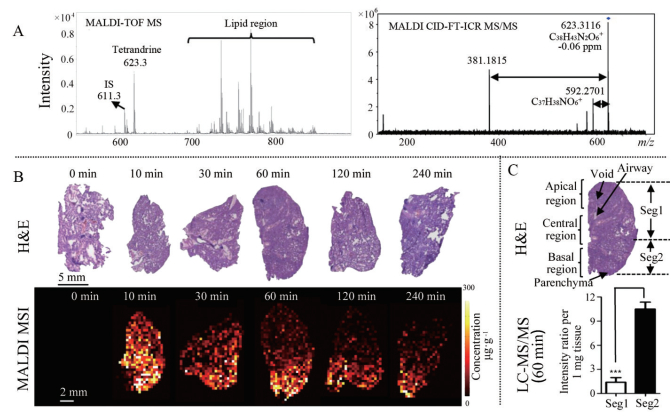
3.2 组织分布药物组织分布与药效和毒性密切相关, 对于TET的肺部药理活性来说, 肺部的暴露特征非常重要。TET的组织分布研究显示口服后血浆中药物浓度较低, 但很容易进入组织中, 并且主要组织中药物浓度明显高于血浆(图 2)。研究发现大鼠10 mg·kg-1静脉给药后, 肺部Cmax可达83.16 μg·mL-1, 肝中的浓度(50.57 μg·mL-1) 仅次于肺, 血浆Cmax仅为10.78 μg·mL-1。TET在肝中平均滞留时间(MRT) 最长为6.81 h, 在肺中MRT为3.72 h, 血浆中MRT为1.58 h[50]。应用MALDI质谱成像技术研究TET的组织分布也证实了其组织高亲和性。大鼠静注30 mg·kg-1 TET 10 min后, 药物就迅速在肺组织中达到峰值, 高于其他组织。在质谱成像技术支持下可观察到药物在肺组织中分布不均匀(图 3), 在肺底部的浓度高于肺尖部, 这可能是肺底部供血更充足造成的, 提示应警惕肺局部高浓度造成的毒性。TET在肾中也存在分布不均的现象, 可以长时间在肾皮质保持较高的浓度, 容易导致肾损伤。该药在心脏中以心尖分布浓度最高, 这可能与心尖部CaV1.2通道分布较多有关[51]。
|
Figure 2 Profiles of mean plasma (left) and tissue (right) C-t of TET in rats after iv administration[50] |
|
Figure 3 MALDI MS imaging analysis of the tetrandrine distribution in lung tissues after iv administration [51]. A: Single-pixel MALDI TOF MS spectrum of tetrandrine, IS and lipids from lung tissue (left) and MALDI CID-FT-ICR MS/MS spectrum of tetrandrine (right); B: H & E staining of tissue sections obtained at different time points (top) and MALDI images represent the spatio-temporal distribution of tetrandrine across lung tissue sections (bottom); C: Comparison of tetrandrine in lung tissues between the Seg 1 and 2 quantified using LC-MS/MS. The results were expressed as the mean ± SD from three independent animals. Student's t-test was used for comparing two groups. ***P < 0.001 |
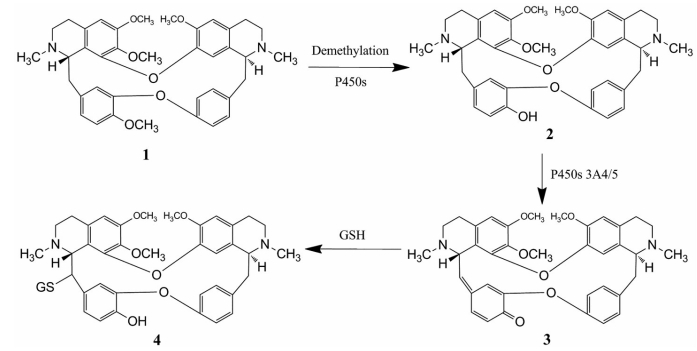
研究发现SD大鼠静注10 mg·kg-1 TET后广泛代谢, 血浆和尿样中发现26种代谢产物, 主要是脱甲基和氧化产物[52]。15 µmol·L-1的TET在表达Cyp3a5的细胞(WI-38/Cyp3a5) 中孵育8 h后, 表现出明显细胞毒性, 而不表达Cyp3a5的细胞正常[53]。小鼠腹腔注射150 mg·kg-1 TET后出现肺毒性, 合用CYP3A抑制剂酮康唑后毒性明显降低, 提示TET经Cyp3a5代谢后产生了毒性产物。经代谢产物鉴定研究发现, TET12位C (图 4) 的O-去甲基产物(M1) 经CYP3A5的催化产生亲电性醌甲基中间体, 是主要的毒性代谢物, 后者通过与谷胱甘肽(GSH) 结合而解毒[54]。CYP3A5主要分布在肺而CYP3A4主要在肝脏中, 并且肝中GSH含量较高, 因此肺脏对这种醌甲基中间体的毒性更敏感。
|
Figure 4 Proposed metabolic activation of TET[54]. 1: TET; 2: M1, O-demethylated tetrandrine; 3: Quinone methide; 4: M4, O-demethylated tetrandrine GSH conjugate |
大鼠以10 mg·kg-1静脉给药后, 24 h内尿中药物原形排泄量9.03%, 粪2.94%, 胆汁1.12%, 提示TET在体内主要以代谢消除为主[50]。应用放射性同位素标记的TET研究物质平衡时, 大鼠静脉给药后尿粪中原形和代谢物的排泄量占给药量的89.2%, 尿中主要有2种产物, 总排泄量占给药量的65.1%; 粪中主要有2种产物, 总排泄量占给药量的24.1%。兔连续3次静脉给药后, 尿粪中原形和代谢物的总排泄量占给药量的46.5%, 其中尿23.4%, 粪23.1%, 都主要有3种代谢产物[55]。
3.5 药物-药物相互作用TET在临床中经常与其他药物合用, 包括抗肿瘤药、抗病毒药、抗炎药等[2, 52], 因此TET的药物-药物相互作用研究非常重要, 但是相关的报道并不多。药物-药物相互作用主要是作用于代谢酶和转运体引起的。TET抑制肿瘤细胞多药耐药蛋白(MDR) 的功能进而增强细胞毒药物敏感性, 就是利用了TET与抗肿瘤药物的相互作用。研究发现TET是P-gp竞争性抑制剂但不是底物。在表达P-gp的肿瘤细胞上, 0.5 μmol·L-1的TET能够明显增强紫杉醇[52]或长春新碱[56]的敏感性。在Caco-2细胞上, 2 μmol·L-1 TET能够明显抑制小檗碱[57]和P-gp阳性底物罗丹明-123[58]的外排, 孵育48 h后还能降低P-gp的表达[57]。但至今未见TET对其他转运体作用的报道。
TET对药物代谢酶作用的报道不多。在代谢转化的研究中发现, CYP3A5是重要的代谢酶[53, 54]。应用高通量荧光检测试剂盒筛选TET对CYP1A2、2D6和3A4的抑制作用, 发现对CYP1A2无抑制, 对CYP2D6有较弱的抑制作用(IC50 = 58.3 μmol·L-1), 对3A4的IC50为3.9 μmol·L-1 [57]。因此, TET基于CYP3A发生的药物相互作用需要关注。TET是否对其他代谢酶具有抑制或诱导作用还需要深入系统研究。
4 TET治疗新冠肺炎的应用前景TET的抗病毒作用研究较少, 但最近有学者发现TET能够通过激活环氧化酶(COX-2)、核因子κB (NF-κB) 和激活蛋白-1 (AP-1) 而浓度(1~10 µmol·L-1) 依赖地抑制登革病毒的复制[59]。还有研究发现, 小鼠腹腔注射每天30 mg·kg-1的TET后, 可以抑制单纯疱疹病毒引起的角膜炎, 原因可能是调整了宿主的免疫炎症反应[60]。
新冠肺炎暴发以来, 在寻找对抗药物的过程中发现, 位于溶酶体膜上的双孔蛋白2 (two-pore channel 2, TPC2) 作为细胞内的Ca2+通道, 可能是抗新冠病毒药物的新靶点[61]。MERS病毒(MERS-CoV)、SARS病毒(SARS-CoV) 都可以通过网格蛋白介导的内吞作用被细胞膜吞噬, 随后包裹病毒的初级内涵体成熟为次级内涵体并与溶酶体融合, 同时递送组织蛋白酶和V型H+-ATP酶。病毒糖蛋白在酸性环境下被丰富的组织蛋白酶所水解, 使它们可以与内溶酶体的膜蛋白结合, 病毒mRNA最终释放进细胞质并开始复制[3, 61-63]。TET作为Ca2+通道阻滞剂, 已被证明可以阻断TPC2通道, 病毒糖蛋白的水解过程便无法顺利进行, 病毒mRNA不能释放进细胞质并进行进一步复制[61]。由于新型冠状肺炎病毒(SARS-CoV-2) 与MERS-CoV和SARS-CoV结构上的相似性, 因此推测由于TET的Ca2+通道阻滞剂的作用可阻断TPC2, 可能同样对新冠病毒的复制有抑制作用。在体外实验中, TET表现出比其他Ca2+通道阻滞剂更强的对MERS-CoV和HCoV-OC43的抑制作用[64]。由于HCoV-OC43与SARS-CoV-2结构相似, 应用HCoV-OC43模拟SARS-CoV-2感染MRC-5细胞进行了体外研究。TET对MRC-5细胞的半数毒性浓度(CC50) 约为13.41 μmol·L-1, 而用其预处理MRC-5细胞后再感染HCoV-OC43的半数抑制浓度(IC50) 为0.33 μmol·L-1 (比其他生物碱的活性都强), CC50/IC50大于40, 且抑制效果与处理时间和浓度呈依赖关系[62]。由此推测, TET可能有效抑制SARS-CoV-2复制作用而具有抗新冠肺炎的前景。在另一项利用SARS-CoV-2假病毒感染HEK293/hACE2细胞的实验中, 提前用TET处理也可明显减少假病毒进入细胞的数量, 且呈浓度依赖关系, IC90为4.8 μmol·L-1 (3 μg·mL-1)[63]。
到目前为止, TET的抗新冠病毒作用仅限于体外研究水平。TET能否安全有效治疗新冠肺炎, 很大程度上依赖其在肺组织中能够有效暴露但又不超过毒性暴露水平。根据调研到的文献, 大鼠以7.5、10和30 mg·kg-1单次静注给药后, 肺组织中TET的浓度分别为~20[46]、~83[50]和~120 μg·g-1 [51], 远远高于血浆浓度。药物组织中的有效浓度是经过蛋白结合率校正后的游离浓度, 按照文献报道TET的蛋白结合率大于90%计算[65], 大鼠单次静注7.5 mg·kg-1以后, 肺部有可能能够达到抗新冠病毒复制的有效浓度。按照人体等效剂量(HED) 法计算60 kg人体的有效静注剂量~72.6 mg, 远远低于文献[40, 65]报道人体静注的毒性剂量(10 mg·kg-1) 范围。按照目前TET片的说明书推荐的最大口服剂量每天300 mg, 如果TET的生物利用度大于25%就可以达到有效的肺部暴露。
目前对于传统中草药抗新冠病毒的作用也是研究的热点, 其作用机制和对应的中草药总结如下[66, 67]: ①通过与血管紧张素转化酶2 (ACE2) 受体和3C样蛋白酶(3CL pro) 结合, 直接抑制新冠病毒对宿主细胞的吸附和复制, 如丹参酮、连花清瘟胶囊和鱼腥草等; ②抑制促炎细胞因子, 阻断细胞因子风暴, 如连花清瘟胶囊、金银花乙醇提取物和桔梗D等; ③抑制肺部炎症, 减少肺上皮分泌; 如川贝母、瓜蒌等; ④预防多器官衰竭, 如黄芪、当归、党参等; ⑤预防肺纤维化, 如柚皮素、桑皮素等。虽然有很多研究报道传统中草药对治疗新冠肺炎的作用, 但大多数都是缓解症状作用, 直接针对新冠病毒、特别是抗病毒机制的研究比较少。在报道的连花清瘟胶囊对新冠病毒抑制的体外研究中, IC50高达411.2 μg·mL-1 [68], 其在体内特别是肺部能否达到足够高的药物浓度还需要深入研究。而TET在SARS-CoV-2假病毒感染的细胞中获得的IC90约为3 μg·mL-1。
虽然TET在中国临床应用超过五十年, 但仍缺乏口服生物利用度、剂量和暴露关系、药物-药物相互作用等系统的药代动力学数据, 文献报道的药代数据也不能互相验证。
5 结语与展望TET在矽肺的临床治疗中发挥了重要作用, 其肺部药理活性、药理机制等研究也比较广泛和明确。相比之下, TET药效物质基础的体内特征研究仍不够完善, 现有研究在给药剂量、制剂剂型、给药途径和实验动物选择等方面还不够规范合理, 导致研究结果不尽一致。目前比较共识的特征是TET的组织分布高于血浆、组织中的驻留时间也长于血浆、主要以代谢方式清除等。由于TET在临床应用都是按疗程给药, 未来治疗新冠肺炎也不会单次给药, 重复给药后药物在组织中的分布和蓄积情况直接影响其药效和毒性。其次, TET一般都与其他药物联合应用, 除了已证实的对P-gp抑制作用以外, 对其他转运体和代谢酶的作用仍没有系统研究结论。对于上述问题, 虽然体外研究发现TET具有抗SARS-CoV-2复制的作用, 按照老药重定位开发研究, 还有很多需要回答的科学问题。
本研究所目前正在开展TET在SARS-CoV-2病毒感染小鼠体内的药效研究, 初步获得了剂量-效应关系。在此基础上, 正在开展TET的系统临床前药代动力学和安全性评价, 推动TET成为治疗新冠肺炎的天然药物。
作者贡献: 王福润查阅文献、撰写文章; 丁日高、钟武和张文鹏指导撰写思路; 庄笑梅查阅文献、指导撰写思路和文章修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Shang L, Dong Y, Liu B, et al. Pharmacological research and application progress of tetrandrine in treating idiopathic pulmonary fibrosis[J]. J Tianjin Univ Tradit Chin Med (天津中医药大学学报), 2018, 37: 256-260. |
| [2] |
Jiang Y, Liu M, Liu H, et al. A critical review: traditional uses, phytochemistry, pharmacology and toxicology of Stephania tetrandra S. Moore (Fen Fang Ji)[J]. Phytochem Rev, 2020, 19: 449-489. DOI:10.1007/s11101-020-09673-w |
| [3] |
Heister PM, Poston RN. Pharmacological hypothesis: TPC2 antagonist tetrandrine as a potential therapeutic agent for COVID-19[J]. Pharmacol Res Perspect, 2020, 8: 1-8. |
| [4] |
Xu J, Zhou ZH. Effect of tetrandrine on anti-lung fibrosis of patients with silicosis[J]. J Clin Pulm Med (临床肺科杂志), 2015, 20: 1658-1661. |
| [5] |
He YX, Miao Q, Liu BC, et al. Effects of tetrandrine (TT) on gene expression of type Ⅰ and type Ⅲ lung collagens in experimental silicosis[J]. J Hyg Res (卫生研究), 1994, 23: 201-203. |
| [6] |
You BR, Liu BC, Wang HH, et al. Effect of tetrandrine on collagen metabolism in silicosis rats[J]. J Hyg Res (卫生研究), 1996, 25: 11-13. |
| [7] |
Zheng YY, Pan RH, Liang DY, et al. Efficacy of sinomenine on rats with early stage experimental silicosis[J]. Guangxi Med J (广西医学), 2014, 36: 1113-1116. |
| [8] |
Dang XM, Hu H, Yang L, et al. Protective effect of tetrandrine on free radical damage in silicosis rats[J]. Guangdong Med J (广东医学), 2013, 34: 838-840. |
| [9] |
Chen YF, Liu JY, Chen WX, et al. Experimental study on tetrandrine treating pulmonary interstitial fibrosis induced by bleomycin in rats[J]. J Xinxiang Med Coll (新乡医学院学报), 2001, 18: 97-99. |
| [10] |
Chen Y. Experimental Study of Tet on the Prevention of Radiation Pulmonary Fibrosis (汉防己甲素防治放射性肺纤维化的实验研究)[D]. Nanjing: Nanjing University of Chinese Medicine, 2017.
|
| [11] |
Liao C, Yang J, Zhu N, et al. Efficacy of tetrandrine on the prevention of radiation induced lung injury[J]. J Clin Pulm Med (临床肺科杂志), 2016, 21: 2252-2254. |
| [12] |
Chen DB, Chen H. The effects of tetrandrine on phospholipase A2 and PGs in rats with acute hypoxic pulmonary hypertension[J]. J Gannan Med Univ (赣南医学院学报), 2000, 21: 208-211. |
| [13] |
Meng H, Zhang DR, Song M, et al. Research of expression of platelet-derived growth factor A, B in inhibitory process of tetrandrine on pulmonary hypertenison in rats[J]. J China Med Univ (中国药科大学学报), 2000, 45: 10-12. |
| [14] |
Chen WB, Yan H, Mo XN. Effect of tetrandrine on expression of bFGF in lung tissue of rat with chronic hypoxic pulmonary hypertension[J]. J West China Univ Med Sci (华西医科大学学报), 2001, 16: 12-14. |
| [15] |
Wang X, Yang Y, Yang D, et al. Tetrandrine prevents monocrotaline-induced pulmonary arterial hypertension in rats through regulation of the protein expression of inducible nitric oxide synthase and cyclic guanosine monophosphate-dependent protein kinase type 1[J]. J Vasc Surg, 2016, 64: 1468-1477. DOI:10.1016/j.jvs.2015.09.016 |
| [16] |
Xi Y, Zhang HJ, Ye ZG, et al. Research development on modern pharmacological effect of tetrandrine[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 20-28. |
| [17] |
Luan F, He X, Zeng N. Tetrandrine: a review of its anticancer potentials, clinical settings, pharmacokinetics and drug delivery systems[J]. J Pharm Pharmacol, 2020, 72: 1491-1512. DOI:10.1111/jphp.13339 |
| [18] |
Gao LS. Clinical study of tetrandrine combined with low dose radiotherapy for 97 cases of lung cancer[J]. J Tradit Chin Med (中医杂志), 1980, 26: 37-39. |
| [19] |
Cheng Y, Liu WC, Shi HJ, et al. Randomized controlled clinical trial on tetrandrine combined with GP regimen in the treatment of advanced non-small cell lung cancer[J]. J Mod Oncol (现代肿瘤医学), 2010, 18: 910-914. |
| [20] |
Chen Z, Zhao L, Zhao F, et al. Tetrandrine suppresses lung cancer growth and induces apoptosis, potentially via the VEGF/HIF-1α/ICAM-1 signaling pathway[J]. Oncol Lett, 2018, 15: 7433-7437. |
| [21] |
Ling J, Meng X, Luo XH, et al. Stephania tetrandra and ginseng-containing Chinese herbal formulation NSENL reverses cisplatin resistance in lung cancer xenografts[J]. Am J Chin Med, 2017, 45: 385-401. DOI:10.1142/S0192415X17500240 |
| [22] |
Dong MX. Effect evaluation of fordostein and whole lung mass lavage combined with tetrandrine in the treatment of Ⅱ stage pneumoconiosis[J]. Contemp Med Symp (当代医药论丛), 2019, 17: 162-163. |
| [23] |
Hou BW, Li BP, Sun ZP, et al. Clinical effect of tetrandrine tablets combined with large-volume whole lung lavage on pneumoconiosis[J]. Occup Health (职业与健康), 2020, 36: 2164-2167. |
| [24] |
Li JF. Clinical observation of tetrandrine tablet and bailing capsule combined with compound danshen tablet in the treatment of pneumoconiosis[J]. China Naturop (中国民间疗法), 2020, 28: 70-71. |
| [25] |
Sun SY. Observation on treating coal worker's pneumoconiosis with the Bufei Huoxue capsule plus tetrandrine tablets[J]. Clin J Chin Med (中医临床研究), 2019, 11: 17-19. |
| [26] |
Gong YJ. Effect of budesonide powder inhaler and tetrandropin tablet in the treatment of pneumoconiosis[J]. Contemp Med Symp (当代医药论丛), 2019, 17: 141-142. |
| [27] |
Li Y, Zhao DF. Clinical observation of tetrandrine improving pulmonary ventilation function in patients with pneumoconiosis[J]. Occup Health Damage (职业卫生与病伤), 2013, 28: 59-60. |
| [28] |
Li Z. Effect of tetrandrine combined with acetylcysteine effervescent tablets on prognosis and serum levels of TGF-β1 and PDGF in patients with pneumoconiosis[J]. J Med Theory Pract (医学理论与实践), 2020, 33: 3384-3386. |
| [29] |
Luo XF, Lin LY. Effect of Shenmai injection combined with tetrandrine on pulmonary fibrosis in pneumoconiosis[J]. Shenzhen J Integr Tradit Chin West Med (深圳中西医结合杂志), 2018, 28: 46-48. |
| [30] |
Peng ZN. Analysis of curative effect of tetrandrine on pneumoconiosis[J]. Med Diet Health (医学食疗与健康), 2019, 18: 105. |
| [31] |
Chen L, Leng XM, Lin J. Clinical effect of tetrandrine on silicosis[J]. Strait J Prev Med (海峡预防医学杂志), 2015, 21: 106-107. |
| [32] |
Chen N, Rong XH, Zhao J. Clinical observation of tetrandrine combined with ursolic acid in the treatment of silicosis[J]. Ind Health Occup Dis (工业卫生与职业病), 2018, 44: 454-456. |
| [33] |
Ding JH, Bai J, Wang JF. Effects of tetrandrine on pulmonary fibrosis in silicosis patients[J]. Guide China Med (中国医药指南), 2018, 16: 12-13. |
| [34] |
Zhou ZS, Wang FY, Hu YB, et al. The long-term effects of combination therapy with tetrandrine and PVNO in silicosis patients[J]. J Environ Occup Med (环境与职业医学), 2002, 19: 116-119. |
| [35] |
Zou WM, Ge XM, Ye SS, et al. Efficacy of high purity tetrandrine in the treatment of 44 cases of silicosis[J]. J Appl Prev Med (应用预防医学), 2008, 14: 300-301. |
| [36] |
Liang JX, Yang JK, Zheng GJ. Efficacy and safety of tetrandrine combined with 125I seed implantation in treatment of locally advanced non-small-cell lung cancer[J]. Shandong Med J (山东医药), 2014, 54: 16-18. |
| [37] |
Bai YJ, Shen HB, Jiang DX, et al. Clinical observation of tetrandrine in treating pulmonary interstitial fibrosis caused by connective tissue disease[J]. Chin J Med (中国医刊), 2017, 52: 39-42. |
| [38] |
Li Y, Chen M, Han LZ. Clinical efficacy of tetrandrine in the adjunctive treatment of interstitial lung disease associated with connective tissue[J]. J Clin Pulm Med (临床肺科杂志), 2018, 23: 1447-1450. |
| [39] |
Wang QY, Kang J, Yu RJ, et al. Short-term effect of tetrandrine on pulmonary hypertension in COPD patients[J]. J China Med Univ (中国医科大学学报), 1996, 25: 260-263. |
| [40] |
Huang XY. Anticancer pharmacological study and clinical application of tetrandrine abroad[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 1979, 13: 44-45. |
| [41] |
Liu YY, Zhang XF, Wang JP, et al. The safety of tetrandrine[J]. Chin J Hosp Pharm (中国医院药学杂志), 1990, 10: 14-15. |
| [42] |
Li TL, Hu TY, Zou CQ, et al. Studies of the chronic toxicity of tetrandrine in dogs: an inhibitor of silicosis[J]. Ecotoxicol Environ Saf, 1982, 6: 528-534. DOI:10.1016/0147-6513(82)90034-3 |
| [43] |
Yuan SY, Yang CR, Cheng CL, et al. Comparative nephrotoxicity of aristolochic acid and tetrandrine in vitro and in vivo[J]. Int J Toxicol, 2011, 30: 35-46. DOI:10.1177/1091581810387164 |
| [44] |
Rosenkranz HS, Klopman G. Novel structural concepts in elucidating the potential genotoxicity and carcinogenicity of tetrandrine, a traditional herbal drug[J]. Mutat Res, 1990, 244: 265-271. DOI:10.1016/0165-7992(90)90071-Q |
| [45] |
Liu C, Lv L, Guo W, et al. Self-nanoemulsifyingdrug delivery system of tetrandrine for improved bioavailability: physicochemical characterization and pharmacokinetic study[J]. Biomed Res Int, 2018, 2018: 1-10. |
| [46] |
Su W, Liang Y, Meng Z, et al. Inhalation of tetrandrine-hydroxypropyl-beta-cyclodextrin inclusion complexes for pulmonary fibrosis treatment[J]. Mol Pharm, 2020, 17: 1596-1607. DOI:10.1021/acs.molpharmaceut.0c00026 |
| [47] |
Song N, Zhang S, Li Q, et al. Establishment of a liquid chromatographic/mass spectrometry method for quantification of tetrandrine in rat plasma and its application to pharmacokinetic study[J]. J Pharm Biomed Anal, 2008, 48: 974-979. DOI:10.1016/j.jpba.2008.06.002 |
| [48] |
Yang G, Zhang C, Hu P, et al. An UPLC-MS/MS method for quantifying tetrandrine and its metabolite berbamine in human blood: application to a human pharmacokinetic study[J]. J Chromatogr B Analyt Technol Biomed Life Sci, 2017, 1070: 92-96. DOI:10.1016/j.jchromb.2017.10.048 |
| [49] |
Dong QK. Study on the pharmacokinetics of tetrandrine tablets in healthy volunteers[J]. J Clin Med Pract (实用临床医药杂志), 2011, 15: 83-85. |
| [50] |
Ju AX, Kang YH, Xue QD, et al. Pharmacokinetics, tissue distribution and excretion study of tetrandrine in rats[J]. J Chin Pharm Sci (中国药学), 2015, 24: 557-562. |
| [51] |
Tang W, Chen J, Zhou J, et al. Quantitative MALDI imaging of spatial distributions and dynamic changes of tetrandrine in multiple organs of rats[J]. Theranostics, 2019, 9: 932-944. DOI:10.7150/thno.30408 |
| [52] |
Li D, Cao Z, Liao X, et al. The development of a quantitative and qualitative method based on UHPLC-QTOF MS/MS for evaluation paclitaxel-tetrandrine interaction and its application to a pharmacokinetic study[J]. Talanta, 2016, 160: 256-267. DOI:10.1016/j.talanta.2016.07.022 |
| [53] |
Tian Y, Shen S, Jiang Y, et al. CYP3A5 mediates bioactivation and cytotoxicity of tetrandrine[J]. Arch Toxicol, 2016, 90: 1737-1748. DOI:10.1007/s00204-015-1584-8 |
| [54] |
Jin H, Li L, Zhong D, et al. Pulmonary toxicity and metabolic activation of tetrandrine in CD-1 mice[J]. Chem Res Toxicol, 2011, 24: 2142-2152. DOI:10.1021/tx200290s |
| [55] |
Jiang XH. Study on Pharmacokinetics and Anti-Tumor Properties of Tetrandrine (汉防己碱的药代动力学和抗肿瘤特性研究)[D]. Chongqing: Chongqing Medical University, 2011.
|
| [56] |
Dai CL, Xiong HY, Tang LF, et al. Tetrandrine achieved plasma concentrations capable of reversing MDR in vitro and had no apparent effect on doxorubicin pharmacokinetics in mice[J]. Cancer Chemother Pharmacol, 2007, 60: 741-750. DOI:10.1007/s00280-007-0420-0 |
| [57] |
Shan YQ, Zhu YP, Pang J, et al. Tetrandrine potentiates the hypoglycemic efficacy of berberine by inhibiting P-glycoprotein function[J]. Biol Pharm Bull, 2013, 36: 1562-1569. DOI:10.1248/bpb.b13-00272 |
| [58] |
Yu Q, Cao P, Qu ZY, et al. Mechanism of tetrandrine inhibiting P-glycoprotein function and regulating drug absorption in rat intestine[J]. J Xuzhou Med Univ (徐州医科大学学报), 2021, 40: 10-13. |
| [59] |
Liu JT, Chen ZY, Ho LJ, et al. Differential effects of triptolide and tetrandrine on activation of COX-2, NF-κB, and AP-1 and virus production in dengue virus-infected human lung cells[J]. Eur J Pharmacol, 2008, 589: 288-298. DOI:10.1016/j.ejphar.2008.04.056 |
| [60] |
Hu S, Dutt J, Zhao T, et al. Tetrandrine potently inhibits herpes simplex virus type-1-induced keratitis in BALB/c mice[J]. Ocul Immunol Inflamm, 1997, 5: 173-180. DOI:10.3109/09273949709116892 |
| [61] |
Grimm C, Tang R. Could an endo-lysosomal ion channel be the Achilles heel of SARS-CoV2?[J]. Cell Calcium, 2020, 88: 1-3. |
| [62] |
Kim DE, Min JS, Jang MS, et al. Naturalbis-benzylisoquinoline alkaloids-tetrandrine, fangchinoline, and cepharanthine, inhibit human coronavirus OC43 infection of mrc-5 human lung cells[J]. Biomolecules, 2019, 9: 696-711. DOI:10.3390/biom9110696 |
| [63] |
Ou X, Liu Y, Lei X, et al. Characterization of spike glycoprotein of SARS-CoV-2 on virus entry and its immune cross-reactivity with SARS-CoV[J]. Nat Commun, 2020, 11: 1620-1631. DOI:10.1038/s41467-020-15562-9 |
| [64] |
Gunaratne GS, Yang Y, Li F, et al. NAADP-dependent Ca2+ signaling regulates Middle East respiratory syndrome-coronavirus pseudovirus translocation through the endolysosomal system[J]. Cell Calcium, 2018, 75: 30-41. DOI:10.1016/j.ceca.2018.08.003 |
| [65] |
Huang YT, Hong CY. Tetrandrine[J]. Cardiovasc Drug Rev, 1998, 16: 1-15. DOI:10.1111/j.1527-3466.1998.tb00341.x |
| [66] |
Liang LX, Pan HD, Huang YF, et al. The scientific foundation of chinese herbal medicine against COVID-19[J]. Engineering (工程), 2020, 6: 94-112. |
| [67] |
Yang L, Wang HQ, Li YH. Research progress on therapeutic drugs for corona virus disease 2019[J]. Acta Pharm Sin (药学学报), 2020, 55: 1081-1090. |
| [68] |
Li RF, Hou YL, Huang JC, et al. Lianhuaqingwen exerts antiviral and anti-inflammatory activity against novel coronavirus (SARS-CoV-2)[J]. Pharmacol Res, 2020, 156: 104761. DOI:10.1016/j.phrs.2020.104761 |
 2021, Vol. 56
2021, Vol. 56


