葡萄糖醛酸转移酶(UDP-glucuronosyltransferases, UGTs) 是人体内主要Ⅱ相代谢酶, 可催化葡萄糖醛酸基团从其供体转移到药物的官能团(-OH、-COOH、-NH2、-SH等) 上, 形成极性增大的葡萄糖醛酸苷。葡萄糖醛酸化代谢能促进药物或其他外源物质通过肾脏或胆汁的排泄, 在体内代谢、解毒和清除中发挥重要作用[1]。迄今为止, 已知的人源UGT有四大家族, 22个亚型, 其中19个以尿苷-5'-二磷酸葡萄糖醛酸(UDP-glucuronic acid, UDPGA) 为糖基供体, 与药物代谢关系密切[2]。在肝脏表达的UGT亚型中, UGT1A1、1A3、1A4、1A6、1A9、2B7和2B15这7个亚型参与了大部分药物的葡萄糖醛酸化, 在药物代谢中最为重要[3, 4]。药物葡萄糖醛酸化代谢主要发生在肝脏中, 其次在肾脏和肠道中[5]。药物代谢体外评价往往采用人组织微粒体来进行, 但人组织微粒体来源困难, 酶系复杂, 酶亚型归属困难, 且存在伦理问题, 应用受限。
重组人源UGTs因可克服上述问题得到国际上广泛关注和应用[1]。利用重组人源UGT体外模型, 研究人员可精准评估不同UGT亚型对药物代谢的贡献, 研究UGT酶的结构功能、催化机制和代谢性药物-药物相互作用, 以及制备葡萄糖醛酸化代谢产物供进一步药效、毒性评价等[6, 7], 在新药研发中发挥重要作用。因人源UGTs为膜蛋白, 定位于核膜和内质网膜上[3], 故常用于表达人源UGTs的系统包括哺乳动物细胞(非洲绿猴肾成纤维细胞COS、中国仓鼠肺成纤维细胞V79、人胚胎肾细胞HEK293)[1, 8-11]、昆虫细胞(草地贪夜蛾卵巢细胞Sf9和粉纹夜蛾胚胎细胞BTI-TN5B1-4)[12-15]和酵母细胞[16, 17]。哺乳动物细胞与人类细胞同源性较高, 作为宿主可以稳定表达活性人源UGTs, 但其蛋白表达量低且培养要求较高, 不利于大批量制备。酵母具有较为完整的亚细胞结构, 表达的重组UGTs蛋白量和催化活性较高, 且成本低, 遗传操作简单, 可进行大规模培养。如在酵母细胞中表达人源UGT1A6以用于蛋白结构研究[16], 或利用酵母细胞共表达人源UGT2B17和UGDH (UDP-glucose dehydrogenase) 进行全细胞催化合成带同位素标记的睾酮葡萄糖醛酸苷[17]。昆虫细胞蛋白加工和修饰与哺乳动物细胞相似, 表达的UGT活性与人体接近, 蛋白表达水平高, 可用来进行小规模的制备[18]。Alonen等[12]利用杆状病毒侵染的昆虫细胞Sf9表达重组人源UGTs, 以UDPGA为供体, 实现了三种沙坦类药物相应葡萄糖醛酸化代谢物毫克级规模的制备。因此, 建立一种高活性和高表达量的重组人源UGT系统, 不仅可作为新药体外代谢预测平台, 还可实现对药物葡萄糖醛酸化代谢产物的规模化制备, 以供新药研发过程中毒理学及药代动力学等研究。
本研究选择人肝脏来源的UGT1A1、1A3、1A4、1A6、1A9和2B7这6个高活性UGT亚型, 采用酵母表达系统和杆状病毒侵染的昆虫粉纹夜蛾Trichopolusia ni胚胎细胞系BTI-TN5B1-4 (High Five) 表达系统对其进行外源表达。选取11个包含4种不同结构类型的人源UGT底物[8-11]及各UGT亚型参与代谢的药物[4, 19-22]对重组UGT进行酶活性验证, 并尝试对其葡萄糖醛酸化代谢物进行毫克级规模制备, 为其应用于新药研发早期阶段的体外代谢评价奠定基础。
材料与方法材料 人肝脏总RNA (Human Liver Total RNA) 购自TaKaRa公司, 所用的克隆大肠杆菌(Escherichia coli) Transl-T1购自北京全式金生物技术有限公司, 酵母表达载体pESC-HIS质粒和酿酒酵母INVSc1菌株由实验室传代保存, 大肠杆菌DH10Bac、pFastBac1质粒购自艾柏森生物科技有限公司。培养酵母细胞所用培养基为SD-H (0.67%YNB, 0.13% SD-H Amino Acids Mix, 2% dextrose, pH 6.0) 和SG-H诱导培养基(0.67% YNB, 0.13% SD-H Amino Acids Mix, 2% galactose, pH 6.0); 昆虫细胞Sf9、High Five及所用培养基Sf9、High Five培养基购自艾柏森生物科技有限公司。
试剂 RNA反转录试剂盒为PrimeScriptTM RT-PCR Kit (TaKaRa), 高保真DNA聚合酶使用KOD-Plus-Neo (Toyobo), 限制性内切酶购自TaKaRa, DNA回收试剂盒、质粒提取试剂盒及引物合成来自上海捷瑞生物工程有限公司, 同源重组试剂盒ClonExpress®Ⅱ One Step Cloning Kit来自南京诺唯赞生物科技有限公司, 酵母转化试剂盒Frozen-EZ Yeast Transformation ⅡTM购自Zymo Research, 昆虫转染试剂LipoInsectTM Transfection Reagent和bacmid提取试剂盒Bacmid Miniprep Kit购自碧云天生物技术有限公司。基因片段测序由北京擎科新业生物技术有限公司完成。UDPGA购自Sigma公司, UGT底物均购自北京伊诺凯科技有限公司。色谱甲醇购自Thermo Fisher公司。实验涉及的引物序列见表 1。
| Table 1 Primers used for PCR in this study |
人源UGT基因的克隆 将购得的人源肝脏总RNA反转录为肝脏cDNA, 根据NCBI数据库中已报道的人UGT基因序列, 选择参与药物代谢的6个主要UGT亚型基因(UGT1A1、1A3、1A4、1A6、1A9和2B7) 作为克隆目标。针对目的UGT基因片段, 设计带有pESC-HIS或pFastBac1插入位点两端各15~20 bp同源臂的PCR引物(表 1), 由于人体内编码UGT1A家族C端结构域的外显子是相同的, 故对UGT1A家族(UGT1A1、1A3、1A4、1A6及1A9) 基因进行克隆时使用同一个反向引物(pESC-HIS-UGT1A-R或pFastBac1-UGT1A-R)。以人源肝脏cDNA为模板用高保真酶对6条UGT基因进行PCR扩增。PCR产物经胶回收纯化后, 用琼脂糖凝胶电泳检测, 用于后续外源表达系统的构建。
重组人源UGT酿酒酵母表达系统的构建 按照ClonExpress®Ⅱ One Step Cloning Kit说明书, 将人源UGT基因片段整合到pESC-HIS载体上, 转化到大肠杆菌Transl-T1中, 挑取转化子经菌落PCR检测后进行测序确认。挑取测序正确的转化子提取重组质粒pESC-HIS-UGTs, 利用酵母转化试剂盒Frozen-EZ Yeast Transformation ⅡTM将重组质粒转入到酿酒酵母表达宿主INVSc1中, 同时转入空载质粒作为阴性对照。挑取经SD-H平板筛选并提取质粒进行PCR验证的阳性酵母转化子接种于适量SD-H液体培养基中, 于30 ℃、220 r·min-1条件下培养24 h, 于1 000 ×g下离心6 min收集细胞。将收集的细胞用无菌水洗涤3次, 重悬于SG-H培养基使OD600在0.6~0.8之间, 于30 ℃、220 r·min-1下诱导培养。细胞培养24 h后于4 000 ×g下离心6 min收集菌体, 用纯水清洗菌体后, 悬浮于缓冲液(pH 7.4 100 mmol·L-1 Na2HPO4-NaH2PO4, 1 mmol·L-1苯甲基磺酰氯) 中。取与菌体等体积玻璃珠进行细胞破碎(剧烈涡旋30 s, 冰浴30 s, 重复10次), 细胞破碎液于4 ℃、12 000 ×g下离心30 min。离心后的菌体及碎片按照上述步骤进行二次破碎。将两次破碎后离心所得的上清液合并进行超高速离心(160 000 × g, 90 min), 沉淀即重组酵母微粒体重悬于反应缓冲液(pH 7.4 100 mmol·L-1 Tris-HCl, 10%甘油) 中, Bradford法测定蛋白含量, 分装后置-80 ℃保存。
重组人源UGT昆虫细胞表达体系的构建 按照ClonExpress®Ⅱ One Step Cloning Kit说明书, 构建pFastBac1-UGTs重组质粒, 提取测序正确的重组质粒转化DH10Bac感受态细胞, 以pFastBac1空载质粒转化的细胞为对照组。经蓝白斑筛选后, 挑取白色单克隆用M13(+)、M13(-) 两条引物进行PCR验证: 正确重组子的PCR产物大小为3 900 bp, pFastBac1空载发生转座的PCR产物大小为2 300 bp。提取重组bacmid-UGTs, 应用脂质体转染法将重组bacmid-UGTs转染Sf9细胞, 5~6天后观察细胞发生病变后收集P1代病毒, 再次感染新鲜Sf9细胞获得P2代病毒, 如此进行三代病毒扩增以获得高滴度P3代病毒。用适量P3代病毒感染High Five细胞(每毫升2×106个) 后, 于27 ℃、135 r·min-1条件下培养3~4天进行目的蛋白的表达。2 000 ×g下离心6 min收集细胞, 用RT-PCR (reverse transcription PCR)方法在mRNA分子水平上验证人源UGT转录情况。细胞用PBS缓冲液(NaCl 8.0 g·L-1, KCl 0.2 g·L-1, Na2HPO4 1.44 g·L-1, KH2PO4 0.24 g·L-1, pH 7.4) 洗涤后重悬, 以输出功率60 W、冰浴上超声5 s停顿20 s, 破碎12~15次。Bradford法测定超声后的细胞破碎液蛋白含量, 分装后置-80 ℃保存。
重组人源UGT体外酶活性测试 酶促反应体系如下: 总体积100 μL, 其中含0.1或0.5 mmol·L-1苷元底物、2 mmol·L-1 UDPGA、6 mg·mL-1的重组人源UGT酵母微粒体或1 mg·mL-1重组人源UGT昆虫细胞匀浆液、5 mmol·L-1 MgCl2, 用pH 7.4的100 mmol·L-1 Tris-HCl补足至100 μL。以转入对应空质粒的酵母INVSc1微粒体或High Five细胞匀浆液作为阴性对照。反应液混匀后在37 ℃水浴中孵育12 h后加入200 μL无水甲醇终止反应, 涡旋混匀, 15 000 × g下离心30 min, 取上清液进行HPLC-UV-MS分析。选用多种结构类型底物(1~11) 以及各UGT亚型的特异性底物(药物12~17) 对重组人源UGT进行活性鉴定。各苷元底物的酶促反应HPLC分析条件如表 2, 其中仪器设备及参数为: Agilent1260高效液相色谱仪系统串联装备电喷雾电离(ESI) 源的Thermo LCQ Fleet离子阱质谱仪; 色谱柱: Shiseido capcell pak C18 MG Ⅲ column (250 mm×4.6 mm i.d., 5 μm); 流动相: 甲醇(B相) - 0.1%甲酸溶液(A相); 流速: 1 mL·min-1; 进样体积: 20 μL; 柱温: 30 ℃。
| Table 2 HPLC analytical conditions for human UGT assays |
pH值及温度对人源UGT酶活性的影响 为确定重组人源UGTs催化合成药物葡萄糖醛酸苷最佳反应条件, 考察pH值及温度因素对酶活性的影响。酶促反应体系: 总体积100 μL, 其中含0.5 mmol·L-1底物(12~17)、1.5 mmol·L-1 UDPGA、0.2~1.2 mg·mL-1重组人源UGT昆虫细胞匀浆液、5 mmol·L-1 MgCl2, 分别在不同pH的缓冲液(pH 5.0~6.0, 100 mmol·L-1 citric acid-sodium citrate buffer; pH 6.0~8.0, 100 mmol·L-1 Na2HPO4-NaH2PO4 buffer; pH 7.0~9.0, 100 mmol·L-1 Tris-HCl buffer; pH 9.0~10.0, 100 mmol·L-1 Na2CO3-NaHCO3 buffer) 中进行反应。同样地, 在各UGT亚型催化对应底物的最适pH缓冲液中, 考察不同的孵育温度(30、35、40、45、50、55 ℃) 对人源UGT催化活性的影响。每组实验设3个平行。
药物葡萄糖醛酸苷产物的酶法合成 酶促反应体系在最适反应条件下等比例放大至制备体积(表 3), 60 r·min-1振荡水浴中反应24 h。10 000 ×g下离心30 min, 收集的上清液用AmberliteXAD16大孔吸附树脂柱吸附, 依次用50% (v/v)、100% (v/v) 乙醇洗脱, 经HPLC分析合并含目标产物流分, 减压浓缩, 用1 mL甲醇溶出。进一步利用反相HPLC分离纯化酶促反应产物。葡萄糖醛酸苷产物结构经MS、1H NMR、13C NMR、HSQC及HMBC进行鉴定。所用的核磁共振波谱仪为Bruker AVIIIHD 400 MHz和500 MHz (Bruker, USA)。
| Table 3 Reaction conditions for the synthesis of glucuronides |
以反转录得到的人源肝脏cDNA为模板, 用带线性质粒两端同源臂的引物(表 1), 对人源UGT基因进行PCR扩增, PCR产物的琼脂糖凝胶电泳结果显示与已报道的基因ORF长度一致(图 1)。进一步对UGT基因进行测序确认, 共克隆获得UGT1A1、1A3、1A4、1A6、1A9和2B7六条基因, 对应的基因长度和GenBank登录号见表 4。TMHMM 2.0跨膜区预测表明, 该6个人源UGT均为膜蛋白。
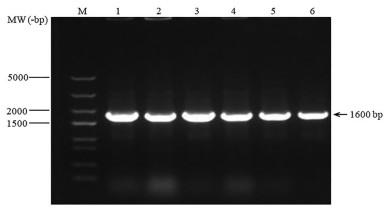
|
Figure 1 Agarose gel electrophoresis analysis of cloned UGT genes. M: DNA marker; 1: PCR product of UGT1A1; 2: PCR product of UGT1A3; 3: PCR product of UGT1A4; 4: PCR product of UGT1A6; 5: PCR product of UGT1A9; 6: PCR product of UGT2B7 |
| Table 4 Cloned UGTs gene length and GenBank accession numbers |
酿酒酵母不仅具有人源UGT表达所需的膜系统, 同时还具有生长周期短、蛋白表达水平高、容易进行大规模培养及遗传操作简单等优势。选取酿酒酵母INVSc1为表达宿主, pESC-HIS为表达载体, 对扩增得到的人源UGT进行外源表达。首先选取了香豆素类(1、2)、蒽醌类(3、4)、黄酮类(5~8) 以及简单酚类(9~11) 化合物对5个人源UGTs (INV-UGT1A1、1A3、1A6、1A9和2B7) 的催化活性进行测试。以化合物1~11作为底物时, 4个人源UGTs (INV-UGT1A1、1A3、1A6和1A9) 表现出了葡萄糖醛酸化活性(图 2): 其中UGT1A1和1A3对蒽醌类(3、4) 及黄酮类化合物(5~8) 活性较强; UGT1A6对香豆素类(1、2) 和结构简单的酚类(9~11) 活性较强; UGT1A9显示出较宽的底物谱, 且对香豆素类、蒽醌类、酚类和黄酮类化合物(1~11) 均有较强的活性; INV-UGT2B7对(1~11) 均无活性。UGT1A4主要催化N-葡萄糖醛酸化, 故选取其特异性底物三氟拉嗪(trifluoperazine, 14) 对INV-UGT1A4进行活性验证[4]; 另外, 用UGT1A1、1A3、1A6、1A9和2B7各自的特异性底物β-雌二醇(β-estradiol, 12)、依替米贝(ezetimibe, 13)、5-羟色醇(5-hydroxytryptophol, 15)、霉酚酸(mycophenolic acid, 16) 和吉非罗奇(gemfibrozil, 17)[19-22]进一步对5个重组UGT酵母微粒体(INV-UGT1A1、1A3、1A6、1A9和2B7) 进行活性测试。结果显示仅INV-UGT1A9对霉酚酸表现出葡萄糖醛酸化活性, 且活性低, 其余5个均无活性。
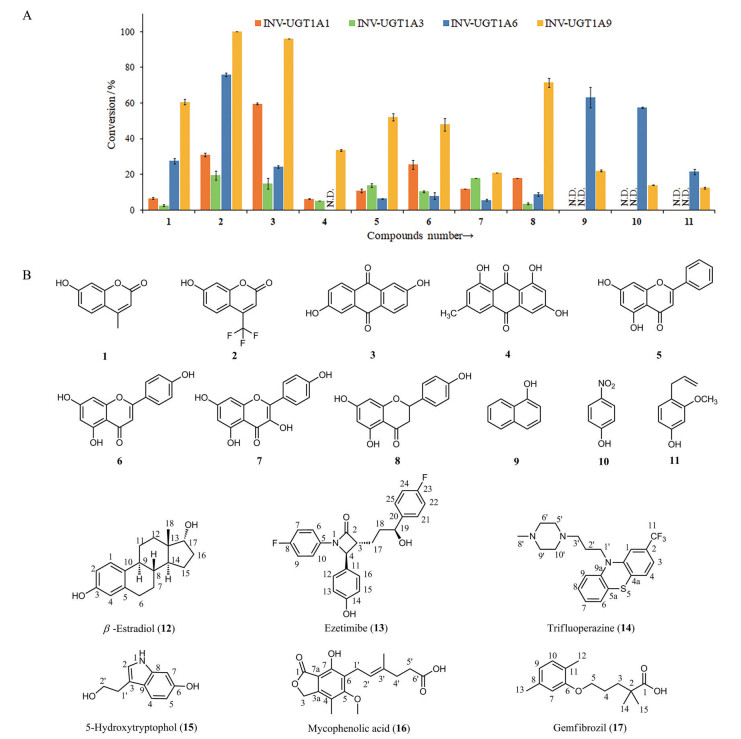
|
Figure 2 Glucuronidation of drugs and xenobiotics by recombinant human UGTs expressed in S. cerevisiae system. (A) The conversion of compounds 1-11 (0.1 mmol·L-1) by INV-UGTs. Conversion values represent the mean ± s.d. of three independent replicates. N.D.: Activity not detected in the enzymatic assay; (B) Chemical structures of substrates (1-17) |
利用酵母表达系统成功表达了4个人源UGTs, 对香豆素类、蒽醌类、黄酮类以及简单酚类化合物表现出葡萄糖醛酸化活性, 但对一些药物或药物类似物活性低或无活性, 可能原因是人源UGT在酿酒酵母INVSc1中表达量较低或酵母的蛋白翻译后加工修饰与哺乳动物细胞不同。因此, 要建立更高效的药物代谢体外评价模型还需优化或构建其他表达系统来获得高活性重组人源UGTs。
3 重组人源UGT昆虫细胞表达体系的构建有研究显示, 当表达兔源UGT时, 杆状病毒侵染的昆虫细胞Sf9与通过瞬时转染的哺乳动物细胞COS-1相比, 蛋白量是后者的50~100倍, 表达的UGTs高达细胞蛋白总量的5%~10%[18]。此外, 昆虫细胞具有近似哺乳动物细胞的蛋白后修饰系统, 被认为是人源UGT的良好表达宿主, 具有良好的应用前景[1, 18]。目前用于人源UGT表达的昆虫细胞系大多为Sf9[12-15], 本研究尝试使用蛋白表达量更高的High Five细胞系, 期望获得高表达的功能性重组人源UGTs。
重组人源UGT杆状病毒感染High Five细胞后, RT-PCR法验证UGT基因在昆虫细胞High Five中成功转录, 表明此表达系统构建成功。首先以4-甲基伞形酮(4-MU, 1) 为底物, 利用HPLC-UV对昆虫细胞High Five (Hi5) 表达的5个重组人源UGTs (Hi5-UGT1A1、1A3、1A6、1A9和2B7) 进行葡萄糖醛酸化反应活性测定, 并且与重组酵母微粒体INV-UGTs活性进行比较(图 3): Hi5-UGT1A1、1A3、1A6和1A9对于4-MU的转化率分别是INV-UGTs的2~34倍(其中Hi5-UGT1A3活性为INV-UGT1A3的34倍)。此外, 如前所述, INV-UGT2B7对4-MU无催化活性, 而Hi5-UGT2B7对4-MU具有较高催化活性(转化率32%)。用各亚型的特异性底物(药物12~17) 对6个Hi5-UGTs的活性进行进一步评价(图 4, 表 5): 不同于INV-UGTs, Hi5-UGT1A1、1A3、1A4、1A6和2B7可分别催化各自底物β-雌二醇(12)、依替米贝(13)、三氟拉嗪(14)、5-羟色醇(15) 和吉非罗奇(17) 发生葡萄糖醛酸化反应(其中UGT1A4催化三氟拉嗪的N-葡萄糖醛酸化, 其余均为O-葡萄糖醛酸化); Hi5-UGT1A9对霉酚酸(16) 的活性显著高于INV-UGT1A9。

|
Figure 3 Comparison of glucuronidation activities of INV-UGTs and Hi5-UGTs with 4-MU (0.5 mmol·L-1) as an acceptor substrate. Conversion values represent the mean ± s.d. of three independent replicates. N.D.: Activity not detected in the enzymatic assay |
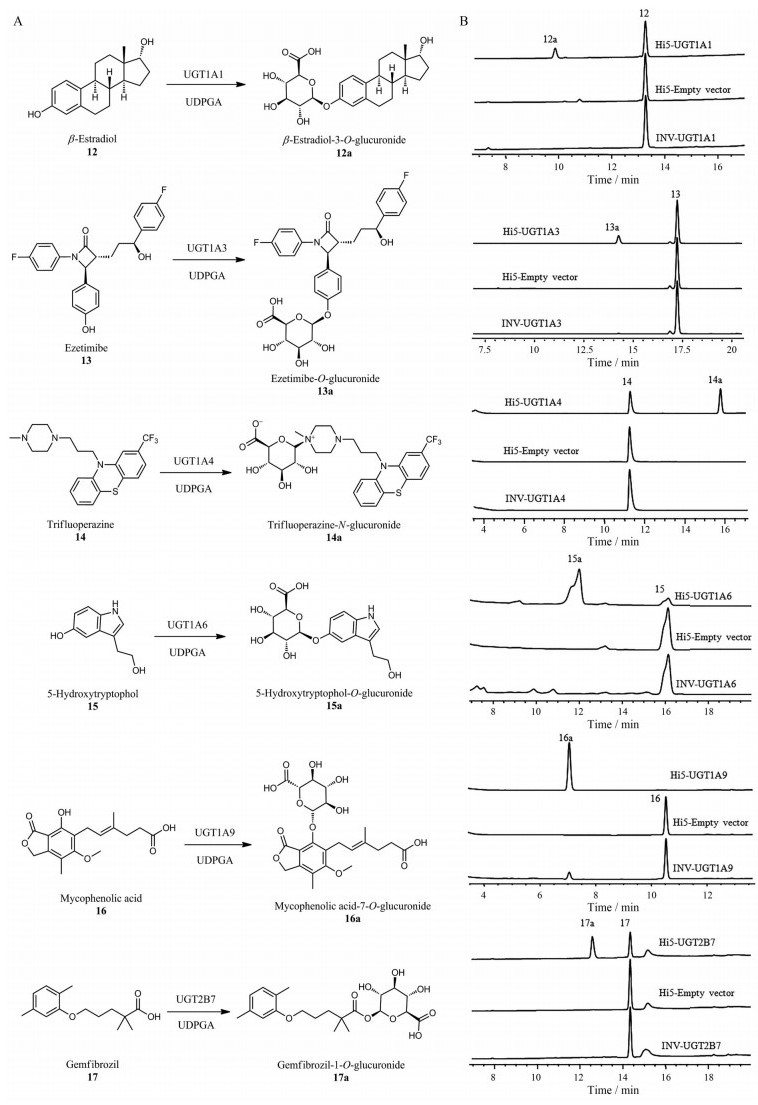
|
Figure 4 Glucuronidation of drugs by recombinant human UGTs expressed in baculovirus-infected insect cells. (A) Glucuronidation reactions of 12-17 by Hi5-UGTs; (B) HPLC analyses of the glucuronidation activities of Hi5-UGTs with 12-17 (0.5 mmol·L-1) as substrates |
| Table 5 HPLC-MS data of substrates (12-17) and their corresponding products (12a-17a) in enzymatic reactions with Hi5-UGTs. aRTS: The retention time of substrates (12-17); bRTG: The retention time of glucuronides (12a-17a) |
利用杆状病毒侵染的昆虫细胞系统成功表达了6个人源UGTs, 对小分子通用底物4-MU及药物12~17均具有高活性, 可作为人源UGT的良好体外模型; 另外, 重组UGT蛋白的高催化活性可用于药物12~17葡萄糖醛酸化代谢产物的酶法制备。
4 pH值及温度对人源UGT酶活性的影响为确定昆虫细胞High Five重组人源UGTs对药物12~17葡萄糖醛酸化的最佳反应条件从而高效合成代谢产物, 考察了pH值及温度对人源UGT酶活性的影响。结果表明各UGT亚型在Tris-HCl缓冲液中的催化活性均高于其他缓冲液; UGTs催化对应底物的最适pH均在7.0~8.5之间(图 5)。其中UGT1A1催化β-雌二醇的最适pH为8.0 (图 5A), UGT1A3催化依替米贝的最适pH为7.5 (图 5B), UGT1A4催化叔胺类底物三氟拉嗪的最适pH为8.4 (图 5C), UGT1A6催化5-羟色醇的最适pH为8.0 (图 5D), UGT1A9催化霉酚酸和UGT2B7催化吉非罗奇的最适pH均为7.0 (图 5E、5F)。
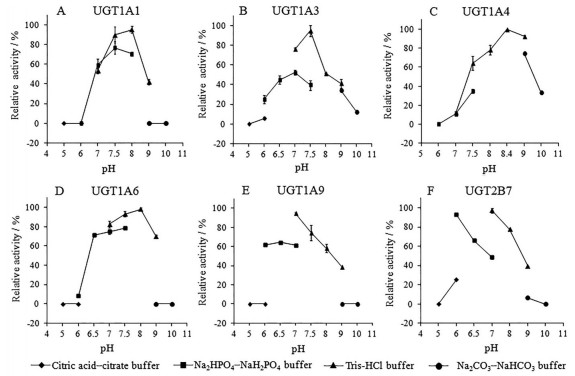
|
Figure 5 The effects of pH values on enzyme activity of recombinant human UGTs. (A) The glucuronidation of β-estradiol by UGT1A1; (B) The glucuronidation of ezetimibe by UGT1A3; (C) The glucuronidation of trifluoperazine by UGT1A4; (D) The glucuronidation of 5-hydroxytrptophol by UGT1A6; (E) The glucuronidation of mycophenolic acid by UGT1A9; (F) The glucuronidation of gemfibrozil by UGT2B7. Relative activity values represent the mean ± s.d. of three independent replicates |
同时考察了不同温度对重组人源UGTs活性的影响, 结果显示其最适反应温度在40~50 ℃之间(图 6)。其中UGT1A1催化β-雌二醇(图 6A)、UGT1A3催化依替米贝(图 6B)、UGT1A4催化三氟拉嗪(图 6C) 的最适温度均为45 ℃, UGT1A6催化5-羟色醇的最适温度为40 ℃ (图 6D), UGT1A9催化霉酚酸的最适温度为50 ℃ (图 6E), UGT2B7催化吉非罗奇(图 6F) 的最适温度为45 ℃。

|
Figure 6 The effects of temperature on enzyme activity of recombinant human UGTs. (A) The glucuronidation of β-estradiol by UGT1A1; (B) The glucuronidation of ezetimibe by UGT1A3; (C) The glucuronidation of trifluoperazine by UGT1A4; (D) The glucuronidation of 5-hydroxytrptophol by UGT1A6; (E) The glucuronidation of mycophenolic acid by UGT1A9; (F) The glucuronidation of gemfibrozil by UGT2B7. Relative activity values are the mean ± s.d. of three independent replicates |
药物体外代谢研究中通常利用人或动物的肝脏微粒体来制备药物葡萄糖醛酸苷, 但肝脏微粒体的来源相对稀少、批次之间存在差异且产率较低, 高活性的重组人源UGT则是良好的替代手段。因此, 本研究利用上述昆虫细胞High Five表达的重组人源UGTs, 在最适pH和温度条件下(表 3) 对药物12~17进行放大酶促反应, 分离纯化葡萄糖醛酸苷产物, 并利用ESI-MS、1H NMR、13C NMR、HSQC和HMBC对产物结构进行鉴定。
β-雌二醇(12, 6.8 mg) 经重组人源UGT1A1催化, 分离纯化获得产物12a (4.7 mg, 产率42%), MS及NMR数据为: ESI-MS m/z 447.19 [M-H]-; 1H NMR (methanol-d4, 400 MHz) δH: 7.19 (1H, d, J = 8.6 Hz, H-1), 6.84 (1H, dd, J = 8.6, 2.5 Hz, H-2), 6.78 (1H, d, J = 2.5 Hz, H-4), 4.89 (obscured by H2O, H-1'), 3.90 (1H, d, J = 9.6 Hz, H-5'), 3.66 (1H, t, J = 8.6 Hz, H-17), 3.57~3.62 (1H, m, H-4'), 3.47~3.49 (2H, m, H-2', 3'), 2.81~2.84 (2H, m, H-6), 2.30~2.34 (1H, m, H-11), 2.14~2.20 (1H, m, H-9), 2.01~2.08 (1H, m, H-16), 1.94~1.99 (1H, m, H-12), 1.87~1.90 (1H, m, H-7), 1.66~1.74 (1H, m, H-15), 1.50~1.54 (1H, m, H-16), 1.42~1.48 (1H, m, H-8), 1.37~1.41 (1H, m, H-11), 1.33~1.36 (1H, m, H-15), 1.27~1.30 (1H, m, H-12), 1.24~1.27 (1H, m, H-7), 1.16~1.21 (1H, m, H-14), 0.78 (3H, s, H-18); 13C NMR (methanol-d4, 100 MHz) δC: 173.0 (C-6'), 156.8 (C-3), 139.0 (C-5), 135.9 (C-10), 127.25 (C-1), 118.0 (C-4), 115.4 (C-2), 102.8 (C-1'), 82.5 (C-17), 77.4 (C-3'), 76.6 (C-5'), 74.7 (C-2'), 73.1 (C-4'), 51.3 (C-14), 45.5 (C-9), 44.4 (C-13), 40.4 (C-8), 38.0 (C-12), 30.8 (C-16), 30.6 (C-6), 28.4 (C-7), 27.5 (C-11), 24.0 (C-15), 11.7 (C-18)。以上数据与文献[23]报道的化合物β-estradiol-3-O-β-D-glucuronide一致, 故化合物的结构确定为β-estradiol-3-O-β-D-glucuronide。
依替米贝(13, 14.3 mg) 经重组人源UGT1A3催化, 分离纯化获得产物13a (6.9 mg, 产率34%), MS及NMR数据为: ESI-MS m/z 584.03 [M-H]-; 1H NMR (methanol-d4, 400 MHz) δH: 7.31~7.34 (2H, m, H-12, 16), 7.28~7.31 (2H, m, H-21, 25), 7.25~7.28 (2H, m, H-6, 10), 7.10 (2H, d, J = 8.6 Hz, H-13, 15), 7.01~7.05 (2H, m, H-22, 24), 6.97~7.01 (2H, m, H-7, 9), 4.96 (1H, d, J = 7.6 Hz, H-1'), 4.81 (1H, d, J = 2.1 Hz, H-4), 4.60 (1H, t, J = 6.7 Hz, H-19), 3.97 (1H, d, J = 9.7 Hz, H-5'), 3.58~3.61 (1H, m, H-4'), 3.48~3.50 (2H, m, H-2', 3'), 3.10~3.11 (1H, m, H-3), 1.83~1.97 (4H, m, H-17, 18); 13C NMR (methanol-d4, 100 MHz) δC: 172.6 (C-6'), 169.7 (C-2), 162.3 (C-23), 159.3 (C-8), 159.0 (C-14), 142.2 (C-20), 135.2 (C-5), 128.8 (C-21, 25), 128.6 (C-12, 16), 119.9 (C-6, 10), 118.5 (C-13, 15), 116.8 (C-7, 9), 116.0 (C-22, 24), 102.2 (C-1'), 77.3 (C-3'), 76.5 (C-5'), 74.5 (C-2'), 73.7 (C-19), 73.0 (C-4'), 62.0 (C-4), 61.2 (C-3), 37.5 (C-18), 26.1 (C-17)。以上数据与文献[24]报道的化合物ezetimibe-O-β-D-glucuronide一致, 故化合物13a的结构确定为ezetimibe-O-β-D-glucuronide。
三氟拉嗪(14, 10.2 mg) 经重组人源UGT1A4催化, 分离纯化获得产物14a (1.9 mg, 产率13%), MS数据为: ESI-MS m/z 584.21 [M+H]+, 与文献[25]报道的化合物trifluoperazine-N-β-D-glucuronide一致, 经NMR进一步确定14a结构为trifluoperazine-N-β-D-glucuronide, 其NMR数据为: 1H NMR (methanol-d4, 400 MHz) δH: 7.28 (1H, d, J = 7.8 Hz, H-3), 7.25 (1H, dd, J = 8.2, 1.5 Hz, H-8), 7.22 (1H, d, J = 7.8 Hz, H-4), 7.19 (1H, brs, H-1), 7.13 (1H, dd, J = 7.7, 1.5 Hz, H-6), 7.06 (1H, dd, J = 8.2, 1.1 Hz, H-9), 6.98 (1H, dd, J = 7.7, 1.1 Hz, H-7), 4.72 (1H, d, J = 8.8 Hz, H-1''), 4.07 (2H, t, J = 6.3 Hz, H-1'), 3.79~3.83 (1H, m, H-6'), 3.76~3.79 (1H, m, H-5''), 3.73~3.76 (1H, m, H-2''), 3.68~3.72 (1H, m, H-6'), 3.63~3.68 (1H, m, H-9'), 3.50~3.53 (1H, m, H-3''), 3.47~3.50 (1H, m, H-9'), 3.42~3.46 (1H, m, H-4''), 3.14 (3H, s, H-8'), 2.81~2.88 (2H, m, H-5'), 2.67~2.73 (2H, m, H-10'), 2.62 (2H, t, J = 6.6 Hz, H-3'), 1.89~1.96 (2H, m, H-2'); 13C NMR (methanol-d4, 100 MHz) δC: 175.0 (C-5''), 147.4 (C-10a), 145.9 (C-9a), 132.0 (C-2), 130.6 (C-4a), 129.0 (C-4), 128.7 (C-8), 128.5 (C-6), 125.5 (C-5a), 124.4 (C-7), 120.2 (C-3), 117.7 (C-9), 113.3 (C-1), 95.1 (C-1''), 79.2 (C-5''), 78.6 (C-3''), 72.7 (C-4''), 71.5 (C-2''), 61.5 (C-6'), 60.8 (C-9'), 54.8 (C-3'), 47.5 (C-10'), 47.3 (C-5'), 45.6 (C-1'), 43.1 (C-8'), 24.9 (C-2')。
5-羟色醇(15, 4.2 mg) 经重组人源UGT1A6催化, 分离纯化获得产物15a (2.4 mg, 产率29%), MS及NMR数据为: ESI-MS m/z 352.07 [M-H]-; 1H NMR (methanol-d4, 500 MHz) δH: 7.30 (1H, d, J = 2.1 Hz, H-4), 7.23 (1H, d, J = 8.7 Hz, H-7), 7.07 (1H, s, H-2), 6.96 (1H, dd, J = 8.7, 2.1 Hz, H-6), 4.87 (1H, d, J = 7.3 Hz, H-1''), 3.88 (1H, d, J = 9.6 Hz, H-5''), 3.79 (2H, t, J = 7.2 Hz, H-2'), 3.60~3.63 (1H, m, H-4''), 3.54~3.46 (2H, m, H-2'', 3''), 2.93 (2H, t, J = 7.2 Hz, H-1'); 13C NMR (methanol-d4, 125 MHz) δC: 173.9 (C-6"), 152.7 (C-5), 134.7 (C-8), 129.2 (C-9), 124.8 (C-2), 114.5 (C-6), 112.8 (C-3), 112.5 (C-7), 107.4 (C-4), 104.8 (C-1"), 77.5 (C-3"), 76.7 (C-5"), 74.8 (C-2"), 73.3 (C-4"), 63.5 (C-2'), 29.8 (C-1')。以上数据与文献[4]报道的化合物5-hydroxytrptophol-O-β-D-glucuronide一致, 故化合物15a的结构确定为5-hydroxytrptophol-O-β-D-glucuronide。
霉酚酸(16, 4.0 mg) 经重组人源UGT1A9催化, 分离纯化获得产物16a (4.1 mg, 产率66%), MS及NMR数据为: ESI-MS m/z 495.28 [M-H]-; 1H NMR (methanol-d4, 400 MHz) δH: 5.34 (1H, d, J = 7.6 Hz, H-1"), 5.32~5.26 (3H, m, H-3, 2'), 3.82 (3H, s, 5-OCH3), 3.76 (1H, dd, J = 14.4, 7.1 Hz, H-1'), 3.63~3.52 (4H, m, H-2", 3", 4", 5"), 3.49 (1H, dd, J = 14.4, 7.1 Hz, H-1'), 2.34~2.39 (2H, m, H-5'), 2.28~2.31 (2H, m, H-4'), 2.24 (3H, s, 4-CH3), 1.84 (3H, s, 3'-CH3); 13C NMR (methanol-d4, 100 MHz) δC: 176.0 (C-6"), 172.3 (C-6'), 164.7 (C-1), 154.1 (C-7), 148.7 (C-5), 135.0 (C-3'), 132.2 (C-7a), 124.7 (C-6), 124.7 (C-2'), 122.7 (C-3a), 113.0 (C-4), 105.9 (C-1"), 78.2 (C-5"), 77.2 (C-3"), 75.7 (C-2"), 73.4 (C-4"), 70.2 (C-3), 61.6 (-OCH3), 36.2 (C-5'), 33.1 (C-4'), 25.1 (C-1'), 16.7 (3'-CH3), 11.6 (4-CH3)。以上数据与文献[26]报道的化合物mycophenolic acid-7-O-β-D-glucuronide一致, 故化合物16a的结构确定为mycophenolic acid-7-O-β-D-glucuronide。
吉非罗奇(17, 13.2 mg) 经重组人源UGT2B7催化, 分离纯化获得产物17a (8.1 mg, 产率36%), MS及NMR数据为: ESI-MS m/z 424.82 [M-H]-; 1H NMR (methanol-d4, 400 MHz) δH: 6.73 (1H, d, J = 7.3 Hz, H-10), 6.42 (1H, d, J = 7.3 Hz, H-9), 6.41 (1H, s, H-7), 5.54 (1H, d, J = 7.5 Hz, H-1'), 4.05 (1H, d, J = 7.9 Hz, H-5), 3.64~3.55 (4H, m, H-2', 3', 4', 5'), 2.06 (3H, s, H-12), 1.97 (3H, s, H-13), 1.50 (4H, s, H-3, 4), 1.08 (6H, s, H-14, 15); 13C NMR (methanol-d4, 100 MHz) δC: 177.8 (C-1), 171.7 (C-6'), 156.6 (C-6), 136.3 (C-8), 130.3 (C-10), 123.2 (C-9), 121.0 (C-11), 112.5 (C-7), 93.7 (C-1'), 75.3 (C-5'), 75.3 (C-3'), 71.8 (C-2'), 71.1 (C-4'), 68.0 (C-5), 41.9 (C-2), 36.3 (C-3), 24.5 (C-4), 24.3 (C-14, 15), 20.9 (C-13), 15.5 (C-12)。以上数据与文献[27]报道的化合物gemfibrozil-1-O-β-D-glucuronide一致, 故化合物17a的结构确定为gemfibrozil-1-O-β-D-glucuronide。
讨论人体UGT催化葡萄糖醛酸化反应是药物的主要解毒和清除机制之一。临床上发现, 患者UGT基因的多态性往往会导致个体用药的差异, 药物对UGT的抑制可引发药物-药物相互作用[6], 并且某些药物的葡萄糖醛酸化代谢产物具有更高的活性或更强的不良反应[28], 因此, 新药研发中的葡萄糖醛酸化代谢研究十分重要。建立一个具有应用价值的重组人源UGTs表达系统不仅可作为新药代谢体外预测的平台, 还可实现对药物葡萄糖醛酸化代谢产物的规模化制备, 对新药研发中药代动力学、毒理学等研究具有重要作用。
本研究从人源肝脏cDNA中扩增得到6条UGT基因(UGT1A1、1A3、1A4、1A6、1A9和2B7), 分别构建了酿酒酵母表达系统和杆状病毒侵染的昆虫细胞表达系统。在酿酒酵母INVSc1中成功表达了4个重组人源UGTs (UGT1A1、1A3、1A6和1A9), 对多种简单结构类型化合物表现出葡萄糖醛酸化活性, 对结构较复杂的药物则无活性。为建立更高效的药物代谢体外评价模型, 或可对酵母表达系统进行相应的优化, 如添加人体细胞内蛋白翻译后修饰酶等元件或更换高表达酵母宿主菌株, 以得到更高活性的重组人源UGT; 本研究则进一步构建了杆状病毒侵染的昆虫细胞表达系统, 选用蛋白表达量高于Sf9的High Five细胞成功表达了6个高活性人源UGTs, 相比于酵母表达的UGTs, 其对于4-MU的活性最多提高了34倍, 并且能高效催化各亚型特异性底物的葡萄糖醛酸化。本研究构建的两种表达系统均能表达活性重组人源UGTs, 但因不同的蛋白翻译后修饰或蛋白表达量而导致活性存在差异。酵母表达系统操作简便、细胞培养时间短、大批量培养成本低, 然而表达的重组UGT活性较低, 可用于高通量筛选中代谢稳定性差的候选药物的筛出或构建全细胞催化体系制备药物代谢产物以供药理和安全性评价; 杆状病毒侵染的昆虫细胞表达系统操作较复杂, 细胞培养周期较长, 但表达的重组UGT活性高, 适用于绝大多数药物的体外代谢评价及药物葡萄糖醛酸化代谢产物的毫克级制备。本研究利用昆虫细胞表达的重组人源UGTs实现了药物葡萄糖醛酸化代谢产物(毫克级) 的酶法制备, 产率为13%~66%; 而之前这些代谢物均采用化学合成[24, 26]、动物组织微粒体[4, 23]或是受试者排泄物分离纯化[27]的方法得到。本研究第一次采用重组人源UGT酶法合成这些代谢物, 相比之前的方法, 具有反应条件温和、操作步骤简单且无伦理问题等优点。
综上所述, 本研究利用酿酒酵母和杆状病毒侵染的昆虫细胞表达的重组人源UGTs不仅可用于进行新药临床前体外代谢研究, 而且为药物葡萄糖醛酸化代谢产物便捷高效的合成提供了新方法。人源UGTs具有催化效率高及底物谱宽泛等特点, 还可用于多种天然或非天然化合物的葡萄糖醛酸化结构修饰, 增加其结构多样性, 改善其药理活性, 发现新药。此外, 本研究构建的两种表达系统还可用于其他重要药物代谢酶的重组表达, 如人细胞色素P450、黄素单氧化酶、谷胱甘肽S-转移酶等[6, 29], 从而建立完善的药物代谢酶模型体系用于药物的体外代谢研究。
作者贡献: 陈赟负责人源葡萄糖醛酸转移酶基因的获得、酵母及昆虫细胞外源表达、产物制备、数据整理及稿件撰写与修改等; 解可波负责及指导人源葡萄糖醛酸转移酶基因昆虫细胞外源表达、稿件撰写与修改; 陈日道、陈大伟、刘继梅、韩耀天及刘雨雨参与部分基因的克隆、外源表达及产物制备、实验讨论与稿件撰写等; 戴均贵负责整个工作的设计、数据整理及稿件撰写与修改等。
利益冲突: 本研究无利益冲突。
| [1] |
Radominska-Pandya A, Bratton S, Little JM. A historical overview of the heterologous expression of mammalian UDP-glucuronosyltransferase isoforms over the past twenty years[J]. Curr Drug Metab, 2005, 6: 141-160. DOI:10.2174/1389200053586127 |
| [2] |
Meech R, Hu DG, McKinnon RA, et al. The UDP-glycosyltransferase (UGT) superfamily: new members, new functions, and novel paradigms[J]. Physiol Rev, 2019, 99: 1153-1222. DOI:10.1152/physrev.00058.2017 |
| [3] |
Rowland A, Miners JO, Mackenzie PI. The UDP-glucuronosyltransferases: their role in drug metabolism and detoxication[J]. Int J Biochem Cell B, 2013, 45: 1121-1132. DOI:10.1016/j.biocel.2013.02.019 |
| [4] |
Walsky RL, Bauman JN, Bourcier K, et al. Optimized assays for human UDP-glucuronosyltransferase (UGT) activities: altered alamethicin concentration and utility to screen for UGT inhibitors[J]. Drug Metab Dispos, 2012, 40: 1051-1065. DOI:10.1124/dmd.111.043117 |
| [5] |
Court MH, Zhang XL, Ding XX, et al. Quantitative distribution of mRNAs encoding the 19 human UDP-glucuronosyltransferase enzymes in 26 adult and 3 fetal tissues[J]. Xenobiotica, 2012, 42: 266-277. DOI:10.3109/00498254.2011.618954 |
| [6] |
Wu H, Peng Y, Sun JG, et al. Application and development of in vitro metabolism study at early drug discovery stage[J]. Acta Pharm Sin (药学学报), 2013, 48: 1071-1079. |
| [7] |
Chen L, Qian W, Yang CQ. Application of recombinant human metabolic enzyme yeast system in metabolic research of new drug in vitro[J]. Chin J New Drugs (中国新药杂志), 2016, 25: 277-282. |
| [8] |
Senafi SB, Clarke DJ, Burchell B. Investigation of the substrate specificity of a cloned expressed human bilirubin UDP-glucuronosyltransferase: UDP-sugar specificity and involvement in steroid and xenobiotic glucuronidation[J]. Biochem J, 1994, 303: 233-240. DOI:10.1042/bj3030233 |
| [9] |
Green MD, King CD, Mojarrabi B, et al. Glucuronidation of amines and other xenobiotics catalyzed by expressed human UDP-glucuronosyltransferase 1A3[J]. Drug Metab Dispos, 1998, 26: 507-512. |
| [10] |
Ebner T, Burchell B. Substrate specificities of two stably expressed human liver UDP-glucuronosyltransferases of the UGT1 gene family[J]. Drug Metab Dispos, 1993, 21: 50-55. |
| [11] |
Radominska-Pandya A, Little JM, Czernik PJ. Human UDP-glucuronosyltransferase 2B7[J]. Curr Drug Metab, 2001, 2: 283-298. DOI:10.2174/1389200013338379 |
| [12] |
Alonen A, Jansson J, Kallonen S, et al. Enzyme-assisted synthesis and structure characterization of glucuronic acid conjugates of losartan, candesartan, and zolarsartan[J]. Bioorg Chem, 2008, 36: 148-155. DOI:10.1016/j.bioorg.2008.02.004 |
| [13] |
Kahma H, Filppula AM, Neuvonen M, et al. Clopidogrel carboxylic acid glucuronidation is mediated mainly by UGT2B7, UGT2B4 and UGT2B17: implications for pharmacogenetics and drug-drug interactions[J]. Drug Metab Dispos, 2017, 46: 141-150. |
| [14] |
Troberg J, Järvinen E, Ge GB, et al. UGT1A10 is a high activity and important extrahepatic enzyme: why has its role in intestinal glucuronidation been frequently underestimated[J]. Mol Pharm, 2016, 14: 2875-2883. |
| [15] |
Chau N, Kaya L, Lewis BC, et al. Drug and chemical glucosidation by control supersomes and membranes from Spodoptera frugiperda (Sf) 9 cells: implications for the apparent glucuronidation of xenobiotics by UDP-glucuronosyltransferase 1A5[J]. Drug Metab Dispos, 2019, 47: 271-278. DOI:10.1124/dmd.118.084947 |
| [16] |
Ouzzine M, Magdalou J, Burchell B, et al. An internal signal sequence mediates the targeting and retention of the human UDP-glucuronosyltransferase 1A6 to the endoplasmic reticulum[J]. J Biol Chem, 1999, 274: 31401-31409. DOI:10.1074/jbc.274.44.31401 |
| [17] |
Drăgan CA, Buchheit D, Bischoff D, et al. Glucuronide production by whole-cell biotransformation using genetically engineered fission yeast Schizosaccharomyces pombe[J]. Drug Metab Dispos, 2010, 38: 509-515. DOI:10.1124/dmd.109.030965 |
| [18] |
Nguyen N, Tukey RH. Baculovirus-directed expression of rabbit UDP-glucuronosyltransferases in Spodoptera frugiperda cells[J]. Drug Metab Dispos, 1997, 25: 745-749. |
| [19] |
Miners JO, Mackenzie PI, Knights KM. The prediction of drug-glucuronidation parameters in humans: UDP-glucuronosyltransferase enzyme-selective substrate and inhibitor probes for reaction phenotyping and in vitro-in vivo extrapolation of drug clearance and drug-drug interaction potential[J]. Drug Metab Rev, 2010, 42: 1117-1124. |
| [20] |
Ghosal A, Hapangama N, Yuan Y, et al. Identification of human UDP-glucuronosyltransferase enzyme(s) responsible for the glucuronidation of ezetimibe[J]. Drug Metab Dispos, 2004, 32: 314-320. DOI:10.1124/dmd.32.3.314 |
| [21] |
Picard N, Ratanasavanh D, Prémaud A, et al. Identification of the UDP-glucuronosyltransferase isoforms involved in mycophenolic acid phase Ⅱ metabolism[J]. Drug Metab Dispos, 2005, 33: 139-146. DOI:10.1124/dmd.104.001651 |
| [22] |
Mano Y, Usui T, Kamimura H. The UDP-glucuronosyltransferase 2B7 isozyme is responsible for gemfibrozil glucuronidation in the human liver[J]. Drug Metab Dispos, 2007, 35: 2040-2044. DOI:10.1124/dmd.107.017269 |
| [23] |
Kashima Y, Kitade T, Kashima Y, et al. Development of an automated synthesis system for preparation of glucuronides using a solid-phase extraction column loaded with microsomes[J]. Chem Pharm Bull, 2010, 58: 354-358. DOI:10.1248/cpb.58.354 |
| [24] |
Vaccaro WD, Davis Jr HR. Sugar-substituted 2-azetidinone cholesterol absorption inhibitors: enhanced potency by modification of the sugar[J]. Bioorg Med Chem Lett, 1998, 8: 313-318. DOI:10.1016/S0960-894X(98)00008-0 |
| [25] |
Cheng YQ, Zhou J, Wang ML, et al. Single-shot multi-reaction monitoring of intact marker conjugates for quantitative profiling of human major microsomal glucuronidations and its utility to screen inhibitors from medicinal herbs[J]. Anal Bioanal Chem, 2016, 408: 8117-8132. DOI:10.1007/s00216-016-9915-z |
| [26] |
Jones AE, Wilson HK, Meath P, et al. Convenient syntheses of the in vivo carbohydrate metabolites of mycophenolic acid: reactivity of the acyl glucuronide[J]. Tetrahedron Lett, 2009, 50: 4973-4977. DOI:10.1016/j.tetlet.2009.06.060 |
| [27] |
Shackleford DM, Prankerd RJ, Scanlon MJ, et al. Self-micellization of gemfibrozil 1-O-β acyl glucuronide in aqueous solution[J]. Pharm Res, 2003, 20: 465-470. DOI:10.1023/A:1022672608657 |
| [28] |
Stachulski AV, Meng XL. Glucuronides from metabolites to medicines: a survey of the in vivo generation, chemical synthesis and properties of glucuronides[J]. Nat Prod Rep, 2013, 30: 806-848. DOI:10.1039/c3np70003h |
| [29] |
Yang YK, Sheng L, Li Y. Role of FMOs in drug metabolism and development[J]. Acta Pharm Sin (药学学报), 2017, 52: 1485-1495. |
 2021, Vol. 56
2021, Vol. 56


