2. 北京中医药大学中药学院, 北京 102488
2. School of Chinese Pharmacy, Beijing University of Chinese Medicine, Beijing 102488, China
甘草是我国最常用的大宗药材之一, 始载于《神农本草经》, 素有“十方九草”之美誉。甘草酸是反映甘草药材质量的指标性成分之一, 2020版《中华人民共和国药典》[1]规定其含量不得低于2.0%。现代药理学研究表明甘草酸是甘草发挥抗癌[2]、抗炎[3]、抗糖尿病[4]等药理活性的主要有效成分。然而, 本课题组前期对我国药材市场的甘草药材进行质量调查, 发现近50%的甘草样品中甘草酸含量未达到国家药典的基本要求[5]。因此, 如何提高栽培甘草中甘草酸的含量已成为影响甘草药效的关键问题。
甘草酸为五环三萜类化合物, 是经由甲羟戊酸(mevalonic acid, MVA) 代谢途径合成的。然而, 高等植物体内代谢网络复杂, 各通路彼此联通又相互制约。为了构建甘草酸生物合成的分子调控网络, 本课题组前期开展了转录组学研究, 发现: 甘草酸的生物合成受糖代谢、植物激素信号转导、泛醌和萜类旁路途径、苯丙烷类代谢途径以及植物昼夜节律等通路的显著影响。在进一步筛选的15个关键功能基因中, 阿魏酸5-羟化酶(ferulate 5-hydroxylase, F5H) 基因的表达水平与甘草酸的含量呈负相关[6]。F5H作为苯丙烷代谢途径上的关键酶, 可催化阿魏酸、松柏醇以及针叶醛5'位置的羟基化, 是丁香基木质素合成途径的必要环节[7]。为了进一步明确F5H对甘草酸生物合成的调控作用, 本论文拟采用反向遗传学策略, 从基因过表达和沉默两个方面开展研究。
自1996年于拟南芥(Arabidopsis thaliana L.) 中首次克隆得到F5H基因以来[8], 已从白杨(Populus tremula × alba)[9]、洋麻(Hibiscus cannabinus L.)[10]、苜蓿(Medicago sativa L.)[11]、玉米(Zea mays L.)[12]等多种植物中克隆得到该基因。目前, GenBank数据库中已注册180多条植物F5H基因的cDNA序列。但F5H基因的研究多集中于木质素生物合成途径, 如: F5H基因下调可导致苜蓿中丁香基木质素大量减少[13]; 在苎麻(Boehmeria nivea) 生长的不同时期, 木质素含量与F5H基因的表达呈显著正相关[14]。而F5H基因对三萜生物合成的影响研究则尚未见报道。
毛状根, 又称发根, 是植株受到发根农杆菌(Agrobaeterium rhizogenes) 感染而产生的一种病理现象。由于具有生长迅速、可合成植物次生代谢产物等优点, 毛状根已成为研究药用植物次生代谢的理想材料, 如: 在罂粟(Papaver somniferum L.) 毛状根中过表达salutaridinol 7-O-乙酰基转移酶(salutaridinol 7-O-acetyltransferase, SalAT) 基因可提高吗啡类生物碱的含量[15]; 在朝鲜当归(Angelica gigas) 毛状根中过表达肉桂酸4-羟化酶(A. gigas cinnamate 4-hydroxylase, AgC4H) 基因可明显增强地高辛醇的生物合成[16]。本课题组前期利用甘草毛状根过表达查尔酮异构酶(chalcone isomerase, CHI) 基因, 也发现黄酮类化合物的含量显著提高[17]。因此, 本文也将利用毛状根培养体系解析F5H基因对甘草酸生物合成的调控作用, 为进一步构建甘草酸生物合成的分子调控网络奠定基础。
材料与方法试剂与耗材 植物双元表达载体pCAMBIA1305.1购于北京华越洋生物科技有限公司; 沉默载体pHSE401由北京中医药大学生命科学学院王志标老师提供; 大肠杆菌DH5α感受态细胞、大肠杆菌TOP 10感受态细胞、Golden View、BM无缝克隆试剂盒、琼脂糖凝胶纯化回收试剂盒、高纯质粒小量快速提取试剂盒均购于北京博迈德科技发展有限公司; 氨苄青霉素(ampicillin, Amp)、潮霉素(hygromycin, Hyg)、头孢噻肟钠(cefotaxime sodium, Cef) 和Oligo (dT) 购于北京拜尔迪生物技术有限公司; 卡那霉素(kanamycin, Kan) 购于Genview公司; T4 DNA连接酶和限制性内切酶Bsa Ⅰ均购于NEB公司; pMD-19T载体、LA Taq DNA聚合酶、限制性内切酶Bgl Ⅱ、Spe Ⅰ均购于TaKaRa公司; 一站式DNA/RNA/蛋白提取试剂盒(B618003)、M-MLV第一链cDNA合成试剂盒(BS249) 均购于生工生物工程(上海) 股份有限公司; 甲醇(分析纯)、乙腈(色谱纯) 均购于鼎国昌盛生物科技有限公司; 甘草酸单铵盐(MUST-16011310) 购于成都曼斯特生物科技有限公司, 纯度为98.86%。
仪器 1-13000型离心机(美国Sigma公司); DYY-8型稳压稳流电泳仪(上海琪特分析仪器有限公司); A300型PCR扩增仪(杭州朗基科学仪器有限公司); 凝胶成像系统(北京百晶生物技术有限公司); 恒温震荡培养箱(北京东联哈尔滨仪器制造有限公司); Gene PulserMXcell穿孔仪(美国BIO-RAD公司)。
PCR引物及程序 由于本文在多个环节均用到PCR方法, 为方便起见, 将文中所有PCR引物列于表 1中, 将所有PCR程序列于表 2中。本文全部引物合成及测序均由上海生工生物工程有限公司完成。
| Table 1 Primer pairs used in this study |
| Table 2 PCR programs used in this study |
甘草F5H基因克隆 采用一站式DNA/RNA/蛋白提取试剂盒从新鲜甘草根样中提取总RNA, 采用M-MLV第一链cDNA合成试剂盒逆转录获得cDNA。根据基因组文件http://ngs-data-archive.psc.riken.jp/Gur-genome/download.pl, 利用NCBI在线工具Primer-BLAST设计引物对PP1 (表 1), 采用PCR程序1 (表 2) 对F5H基因进行扩增。对PCR产物进行胶回收纯化, 连入pMD-19T载体, 16 ℃反应过夜。连接产物转化大肠杆菌DH5α感受态细胞, 在LB (含Amp 50 mg·L-1) 平板上筛选阳性克隆, 分别进行PCR验证和测序验证。
F5H基因过表达载体的构建 图 1为F5H基因过表达载体的构建策略, 以pCAMBIA1305.1为载体骨架, 采用基因融合法, 在Spe Ⅰ和Bgl Ⅱ位点插入F5H基因。根据BM无缝克隆试剂盒设计引物对PP2 (表 1), 采用PCR反应程序2 (表 2), 扩增带有Spe Ⅰ和Bgl Ⅱ位点序列及载体同源序列的F5H基因, 对PCR产物进行胶回收纯化。同时, 使用限制性内切酶Spe Ⅰ和Bgl Ⅱ在37 ℃对pCAMBIA1305.1双酶切1 h, 对载体片段进行胶回收纯化。使用BM无缝克隆试剂盒, 在50 ℃将线性化载体片段与PCR产物(摩尔比1∶3) 连接30 min, 将连接产物转化大肠杆菌Top 10感受态细胞, 在含有Kan (50 mg·L-1) 和Hyg (20 mg·L-1) 的LB平板上筛选阳性克隆, 并进行PCR验证及测序验证, 将验证正确的质粒命名为pCA-F5H。
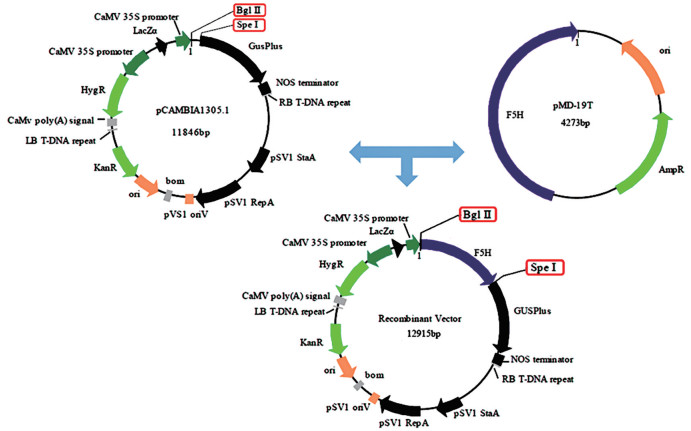
|
Figure 1 Construction of the recombinant vector pCA-F5H |
F5H基因沉默载体的构建 图 2为F5H基因编辑CRISPR/Cas9载体的构建策略, 以pHSE401为载体骨架, 在两个Bsa Ⅰ酶切位点之间插入F5H基因sgRNA片段。使用Benchling在线软件, 根据F5H基因的第一外显子设计sgRNA前导序列sgRNA-F (5'-3'): ATTGATCGCTGCGATAGCGAATAT和sgRNA-R (5'-3'): AAACATATTCGCTATCGCAGCGAT。将sgRNA在95 ℃退火5 min成双链, 并自然冷却至室温。同时, 采用限制性内切酶Bsa Ⅰ在37 ℃对pHSE401酶切1 h, 将线性化载体胶回收纯化。采用T4 DNA连接酶, 在25 ℃将线性化载体与退火后的sgRNA连接10 min, 将连接产物转化大肠杆菌Top 10感受态细胞, 在含有Kan (50 mg·L-1) 的LB平板上筛选阳性克隆。在酶切位点Bsa Ⅰ的前后各200 bp设计引物对PP3 (表 1), 采用PCR反应程序3 (表 2) 对基因沉默载体进行PCR验证, 并进一步进行测序验证, 将验证正确的质粒命名为pHSE-F5H。
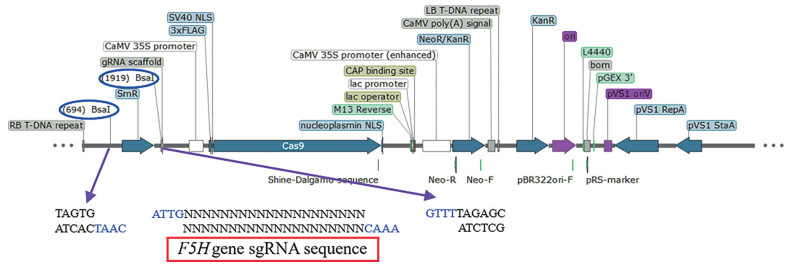
|
Figure 2 Construction of the recombinant vector pHSE-F5H |
重组质粒转化发根农杆菌ATCC15834 采用电转法(C: 25 μF, PC: 200 Ω, U: 2 400 V) 将重组质粒pCA-F5H和pHSE-F5H导入发根农杆菌ATCC15834感受态细胞, 在含Kan (50 mg·L-1) 的TY平板上筛选阳性克隆。采用引物对PP4 (表 1) 和PCR程序4 (表 2), 对携带重组质粒pCA-F5H的发根农杆菌工程菌进行PCR验证。采用引物对PP3 (表 1) 和PCR程序3 (表 2) 对携带重组质粒pHSE-F5H的发根农杆菌工程菌进行验证。将PCR产物送测序。将验证正确的工程菌于TY液体培养基中震荡培养(180 r·min-1, 25 ℃) 至对数生长期, 离心后重悬于6, 7-V液体培养基中。
甘草毛状根的诱导及培养 对甘草种子进行表面灭菌, 接种于MS固体培养基中, 自然光照培养7~10天可获得甘草无菌苗。无菌条件下, 切取无菌苗胚轴, 用刀轻划出多个伤口, 浸泡于上述6, 7-V重悬菌液中, 侵染30 min后转接于6, 7-V平板, 黑暗条件下共培养2天。用浓度为500 mg·L-1的Cef水溶液浸泡外植体5 min, 重新接种于含500 mg·L-1 Cef的6, 7-V平板上。同时, 采用发根农杆菌ATCC15834诱导野生型甘草毛状根, 采用携带pCAMBIA1305.1和pHSE401空质粒的发根农杆菌诱导阴性对照组甘草毛状根。每7天转接继代除菌, 逐代降低Cef的浓度直至除净。
甘草毛状根的验证 提取各甘草毛状根系DNA, 采用引物对PP5 (表 1)和PCR程序5 (表 2), 对所有毛状根样品的rolC基因进行PCR验证, 并进一步进行测序验证。采用引物对PP4 (表 1) 和PCR程序4 (表 2), 对过表达F5H基因甘草毛状根样品进行PCR验证, 并进一步测序验证。采用引物对PP6 (表 1) 和PCR程序6 (表 2) 对F5H基因沉默甘草毛状根样品中F5H基因的第一外显子进行扩增, 将PCR产物T连接后转化大肠杆菌Top10感受态细胞, 在含有Amp 50 mg·L-1的LB平板上筛选阳性克隆, 挑取多个单克隆送测序, 采用软件DNAMAN 6.0.3.99对基因编辑情况进行比对分析。将验证正确的毛状根系转接到6, 7-V液体培养基中, 于25 ℃、110 r·min-1条件下震荡培养。
UPLC法测定甘草毛状根中甘草酸含量 毛状根液体培养: 在无菌条件下称取各毛状根样品2.0 g, 每个样品3个重复, 传代于6, 7-V液体培养基中, 置于25 ℃、110 r·min-1条件下培养21天。UPLC供试品制备: 将毛状根洗净、60 ℃烘干至恒重、打粉、过60目筛; 精密称取各甘草毛状根样品粉末0.1 g, 置于50 mL容量瓶中, 用50%甲醇水溶液超声提取30 min (频率40 kHz, 功率500 W), 放冷, 用50 %甲醇水溶液补至刻度线, 过0.45 μm微孔滤膜, 取续滤液作为UPLC供试品。对照品及线性: 精密称取对照品甘草酸单铵盐4.34 mg, 用50%甲醇水溶液溶解, 配成质量浓度为0.085 8 mg‧mL-1的贮备液, 用50%甲醇水溶液稀释成以下浓度的梯度溶液: 0.085 8、0.068 6、0.051 5、0.042 9、0.017 2、0.008 58、0.004 3 mg‧mL-1。UPLC测定: 采用UPLC法对各毛状根样品中的甘草酸进行含量测定[18], 采用配备UPLC ACQUITY PDA eλ检测器的Waters UPLC ACQUITY色谱系统, 采用ACQUITY UPLC BEH C18色谱柱(2.1 mm×100 mm, 1.7 μm), 以乙腈(A) - 0.05%磷酸液(B) 为流动相, 梯度洗脱, 洗脱程序见表 3, 柱温为40 ℃、流速为0.3 mL·min-1、进样量为1 μL, 于250 nm波长检测甘草酸。
| Table 3 UPLC gradient elution program |
由图 3a可知, PCR扩增得到了长度约为1 800 bp的特异性条带, 测序结果显示该序列与豆科植物大豆Glycine max (Linn.) Merr.的F5H基因一致性为82.6%, 表明扩增序列为甘草F5H基因序列, 将其在GenBank上注册, 序列注册号为: MK882511。图 3b为重组质粒pCA-F5H的PCR验证结果, 获得了长度与F5H序列一致的扩增片段, 测序结果表明此片段与F5H (GenBank注册号: MK882511) 具有100%的一致性, 表明重组质粒pCA-F5H构建正确。图 3c为重组质粒pHSE-F5H的PCR验证结果, 所得条带长度约为500 bp, 符合引物对PP3的扩增预期, 且测序结果表明该扩增片段中含有正确的sgRNA序列(一致性为100%), 表明重组质粒pHSE-F5H构建正确。
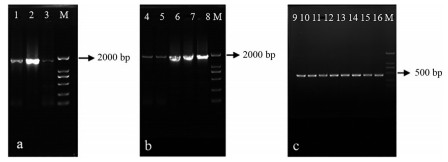
|
Figure 3 PCR verification results of F5H and recombinant vectors. a: The F5H (Lane 1-3) cloned from Glycyrrhiza glabra L. b: The F5H (Lane 4-8) amplified from pCA-F5H. c: 490 bp-fragments containing sgRNA sequences amplified from pHSE-F5H (Lane 9-16). M is the DNA marker |
图 4是诱导10、20和40天后各甘草毛状根系的生长情况, 由图可见: 野生型(wild type, WT) 毛状根、含空载体pCAMBIA1305.1的阴性对照毛状根(NC-PCA)、含空载体pHSE401的阴性对照毛状根(NC-PHSE)、过表达F5H基因的毛状根(F5H+) 以及F5H基因沉默的毛状根(F5H-) 均长势良好。
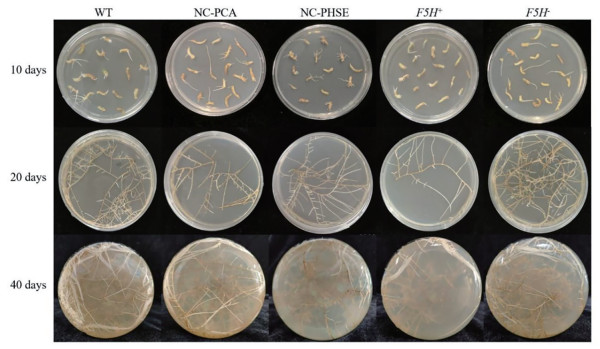
|
Figure 4 Licorice hairy roots after induction and culturing for 10, 20, and 40 d. WT: Wild type hairy root line; NC-PCA: Negative control hairy root line containing empty pCAMBIA1305.1; NC-PHSE: Negative control hairy root line containing empty pHSE401; F5H+: Hairy root lines overexpressing F5H; F5H-: Hairy root lines knocking out F5H |
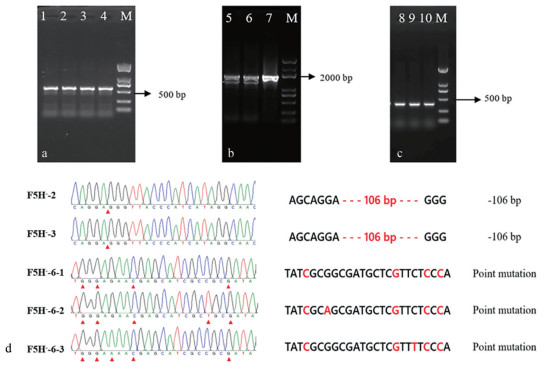
图 5a为甘草毛状根中rolC基因的PCR扩增结果, 获得了长度约为600 bp的特异性条带, 测序结果显示其与rolC (GenBank登录号: DQ160187.1) 的一致性为100%。图 5b为F5H基因过表达毛状根系的PCR验证结果, 扩增得到长度约为1 800 bp的条带, 与目标基因F5H长度一致, 测序结果显示其与F5H原序列(MK882511) 一致性为100%, 表明所得根系为F5H基因过表达甘草毛状根系。图 5c为F5H基因沉默毛状根系中F5H基因第一外显子的PCR扩增结果, 获得了长度约为400 bp的特异性条带, 产物长度正确, 清晰明亮。对扩增获得的片段进行克隆测序, 发现检测的7个毛状根系中有3个发生了F5H基因编辑, 基因编辑率为42.9%, 具体编辑情况如图 5d所示: F5H--2和F5H--3发生纯合突变, 且基因编辑情况相同, 均剪除106个碱基, 发生移码突变; F5H--6为杂合突变体, 其编辑效果为错义点突变, 31位的异亮氨酸突变为缬氨酸, 33位的亮氨酸突变为苯丙氨酸。最终, 经过PCR验证及测序验证, 共获得WT (1样品)、NC-PCA (1样品)、NC-PHSE (1样品)、F5H+ (11样品)、F5H-毛状根(3样品), 用于后续UPLC分析。
|
Figure 5 PCR and sequencing results. a: rolC amplified from each hairy root line (Lane 1-4); b: The F5H amplified from F5H+ lines (Lane 5-7); c: The first exon of F5H amplified from F5H- lines (Lane 8-10); d: The editing sites of F5H in F5H- lines. M is the DNA marker |
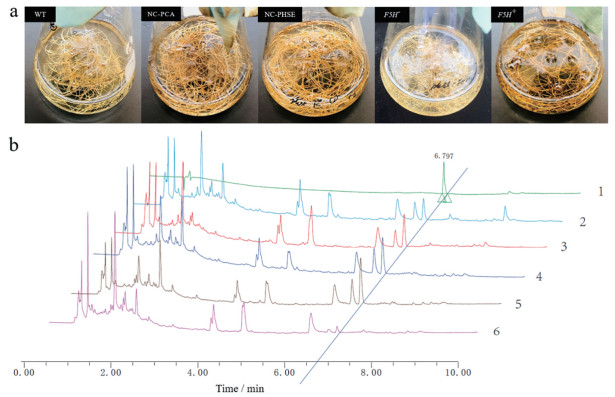
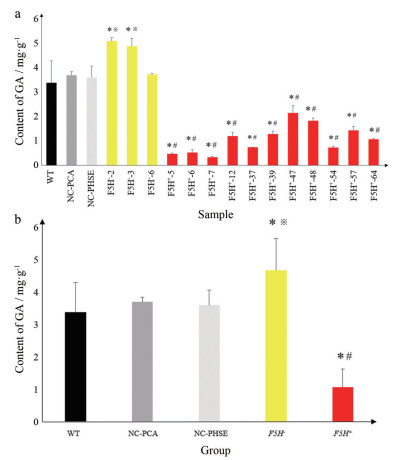
液体培养21天后的各甘草毛状根系如图 6a所示, 根系生长迅速、状态良好。对各甘草毛状根系进行UPLC检测, 色谱图如图 6b所示, 峰图 1为甘草酸对照品色谱图, 显示甘草酸保留时间为6.797 min; 峰图 2~6依次为WT、NC-PCA、NC-PHSE、F5H-、F5H+毛状根样品的色谱图。甘草酸标准曲线为Y = 2 792 995.69 X - 931.23 (R2 = 1), 线性范围为0.004 3~0.085 8 μg·mL-1。图 7a为各甘草毛状根样品中甘草酸含量的柱状图, 运用SAS 8.0软件对甘草酸含量进行样品间非参数检验, 结果显示: 在F5H-样品中, 纯合突变样品F5H--2和F5H--3的甘草酸含量显著高于WT和NC-PHSE样品, 杂合突变样品F5H--6的甘草酸含量与WT和NC-PHSE无显著差异; 所有F5H+样品中甘草酸含量均显著低于WT和NC-PCA样品。图 7b为甘草酸含量的组间比较分析, 运用SAS 8.0软件对甘草酸含量进行组间非参数检验, 结果显示: F5H+组的甘草酸含量显著低于WT组和NC-PCA组, F5H-组的甘草酸含量显著高于WT组和NC-PHSE组, 且F5H+组的甘草酸含量仅为F5H-组的1/4。
|
Figure 6 UPLC sample preparation and GA content assay. a: Hairy root samples culturing in liquid 6, 7-V medium for 3 weeks; b: UPLC chromatograms, line 1 is UPLC chromatogram of GA reference substance, line 2-6 are UPLC chromatograms of sample WT, NC-PCA, NC-PHSE, F5H-, and F5H+ |
|
Figure 7 GA content analysis in licorice hairy roots. a: The GA content in each hairy root sample. b: The GA content in different groups. *P < 0.05 vs WT; ※P < 0.05 vs NC-PHSE; #P < 0.05 vs NC-PCA |
本文构建了F5H基因过表达载体pCA-F5H和基因沉默载体pHSE-F5H, 经由发根农杆菌ATCC15834介导法, 分别诱导产生了F5H基因过表达及沉默的甘草毛状根系F5H+和F5H-。同时建立了野生型甘草毛状根系WT和阴性对照毛状根系(NC-PCA和NC-PHSE)。UPLC含量测定结果显示: F5H+组甘草酸含量显著低于WT及NC-PCA, 而F5H-组甘草酸含量则显著高于WT及NC-PHSE, 表明F5H基因表达水平与甘草酸含量呈负相关, 其表达量升高时甘草酸含量大幅下降, 而表达沉默时甘草酸含量明显上升, 同样也证实了课题组前期转录组研究的结果。
F5H是苯丙烷代谢途径上的关键酶, 而苯丙烷代谢途径和产生甘草酸的MVA途径均通过消耗糖酵解产物来激活[19]。因此, 推测F5H基因表达量升高会致使流向萜类途径的糖酵解产物减少, 从而导致甘草酸含量降低。此外, 有研究表明F5H基因表达量的改变会影响植物中木质素的组成, 进而影响植物次生代谢[14]。同时, 木质素表达量和组成的变化也会影响植物的理化性质, 当丁香基木质素与愈创基木质素含量比值变化较大时会改变植物中诱导子和防御基因的诱导水平[20], 而萜类化合物在甘草防御应激过程中发挥着重要作用[21]。因此, 这也可能是F5H基因表达量变化导致甘草酸含量变化的潜在原因。
在F5H-体系中, 基因编辑情况相同的纯合突变样品F5H--2和F5H--3中甘草酸的含量均显著高于WT和NC-PHSE; 而杂合突变样品F5H--6中甘草酸的含量则与WT及NC-PHSE无显著差异。对其原因进行分析, 认为杂合突变样品F5H--6发生突变的两个位点位于酶的催化结构域以外, 对F5H基因编码蛋白的活性影响较小, 因此未引起甘草酸含量的显著变化; 而纯合突变样品F5H--2和F5H--3均剪除了106 bp的长片段, 基因发生了移码突变, 致使F5H基因丧失了原有功能, 从而对甘草的次生代谢产生影响, 并导致甘草酸含量的升高。
今后将继续以甘草毛状根为实验材料, 通过逆向遗传学策略进一步分析其他影响甘草酸生物合成的关键基因的功能, 为全面构建甘草酸生物合成的分子调控网络奠定基础。
作者贡献: 张智新撰写了论文; 刘颖构思并设计了实验方案; 张智新、汪逗逗和杨林完成了实验; 田少凯分析了相关实验数据; 所有作者均阅读并参与修改了这篇文章。
利益冲突: 本文作者均没有利益冲突。
| [1] |
Chinese Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典一部)[S]. Part 1. Beijing: China Medical Science Press, 2015: 86-87.
|
| [2] |
Huang RY, Chu YL, Jiang ZB, et al. Glycyrrhizin suppresses lung adenocarcinoma cell growth through inhibition of thromboxane synthase[J]. Cell Physiol Biochem, 2014, 33: 375-388. DOI:10.1159/000356677 |
| [3] |
Qu L, Chen C, He W, et al. Glycyrrhizic acid ameliorates LPS-induced acute lung injury by regulating autophagy through the PI3K/AKT/mTOR pathway[J]. Am J Transl Res, 2019, 11: 2042-2055. |
| [4] |
Li Y, Yao N, Zhang T, et al. Ability of post-treatment glycyrrhizic acid to mitigate cerebral ischemia/reperfusion injury in diabetic mice[J]. Med Sci Monit, 2020, 26: e926551. |
| [5] |
Yang R, Li WD, Ma YS, et al. The molecular identification of licorice species and the quality evaluation of licorice slices[J]. Acta Pharm Sin (药学学报), 2017, 52: 318-326. |
| [6] |
Gao ZQ, Tian SK, Hou JM, et al. RNA-Seq based transcriptome analysis reveals the molecular mechanism of triterpenoid biosynthesis in Glycyrrhiza glabra[J]. Bioorg Med Chem Lett, 2020, 30: 127102. DOI:10.1016/j.bmcl.2020.127102 |
| [7] |
Guo XY, Hu SL, Cao Y, et al. Research progress on the F5H1 gene regulating S lignin biosynthesis and its genetic improvement on bamboo in the future[J]. J Fujian Forest Sci Technol (福建林业科技), 2007, 34: 234-237, 243. |
| [8] |
Meyer K, Cusumano JC, Somerville C, et al. Ferulate-5-hydroxylase from Arabidopsis thaliana defines a new family of cytochrome P450-dependent monooxygenases[J]. Proc Natl Acad Sci U S A, 1996, 93: 6869-6874. DOI:10.1073/pnas.93.14.6869 |
| [9] |
Stewart JJ, Akiyama T, Chapple C, et al. The effects on lignin structure of overexpression of ferulate 5-hydroxylase in hybrid poplar[J]. Plant Physiol, 2009, 150: 621-635. DOI:10.1104/pp.109.137059 |
| [10] |
Kim J, Choi B, Park YH, et al. Molecular characterization of ferulate 5-hydroxylase gene from kenaf (Hibiscus cannabinus L.)[J]. Sci World J, 2013, 2013: 421578. |
| [11] |
Sakiroglu M, Sherman-Broyles S, Story A, et al. Patterns of linkage disequilibrium and association mapping in diploid alfalfa (M. sativa L.)[J]. Theor Appl Genet, 2012, 125: 577-590. DOI:10.1007/s00122-012-1854-2 |
| [12] |
Andersen JR, Zein I, Wenzel G, et al. Characterization of phenylpropanoid pathway genes within European maize (Zea mays L.) inbreds[J]. BMC Plant Biol, 2008, 8: 2. DOI:10.1186/1471-2229-8-2 |
| [13] |
Reddy MS, Chen F, Shadle G, et al. Targeted down-regulation of cytochrome P450 enzymes for forage quality improvement in alfalfa (Medicago sativa L.)[J]. Proc Natl Acad Sci U S A, 2005, 105: 16573-16578. |
| [14] |
Tang YH, Liu F, Xing HC, et al. Correlation analysis of lignin accumulation and expression of key genes involved in lignin biosynthesis of Ramie (Boehmeria nivea)[J]. Genes (Basel), 2019, 10: 389. DOI:10.3390/genes10050389 |
| [15] |
Sharafi A, Hashemi Sohi H, Mousavi A, et al. Enhanced morphinan alkaloid production in hairy root cultures of Papaver bracteatum by over-expression of salutaridinol 7-O-acetyltransferase gene via Agrobacterium rhizogenes mediated transformation[J]. World J Microbiol Biotechnol, 2013, 29: 2125-2131. DOI:10.1007/s11274-013-1377-2 |
| [16] |
Park NI, Park JH, Park SU. Overexpression of cinnamate 4-hydroxylase gene enhances biosynthesis of decursinol angelate in Angelica gigas hairy roots[J]. Mol Biotechnol, 2012, 50: 114-120. DOI:10.1007/s12033-011-9420-8 |
| [17] |
Hou JM, Yin YC, Tian SK, et al. Overexpressing of chalcone isomerase (CHI) gene enhances flavonoid accumulation in Glycyrrhiza uralensis hairy roots[J]. Acta Pharm Sin (药学学报), 2021, 56: 319-327. |
| [18] |
Hu T, Gao ZQ, Yin YC, et al. Determination of seven flavonoids in Glycyrrhiza uralensis Fisch. and Glycyrrhiza glabra L. by UPLC[J]. Chin J Pharm Anal (药物分析杂志), 2019, 39: 763-771. |
| [19] |
Wang L, Shi LL, Zhang YX, et al. Biosynthesis and regulation of the secondary metabolites in plants[J]. J Wuhan Bot Res (武汉植物学研究), 2007, 28: 500-508. |
| [20] |
Gallego-Giraldo L, Pose S, Pattathil S, et al. Elicitors and defense gene induction in plants with altered lignin compositions[J]. New Phytol, 2018, 219: 1235-1251. DOI:10.1111/nph.15258 |
| [21] |
Shirazi Z, Aalami A, Tohidfar M, et al. Triterpenoid gene expression and phytochemical content in Iranian licorice under salinity stress[J]. Protoplasma, 2019, 256: 827-837. DOI:10.1007/s00709-018-01340-4 |
 2021, Vol. 56
2021, Vol. 56


