2. 江西中医药大学, 现代中药制剂教育部重点实验室, 江西 南昌 330004;
3. 广东省食品药品职业技术学校, 广东 广州 510663
2. Key laboratory of Modern Preparation Chinese Materia Medica of Ministry of Education, Jiangxi University of Chinese Medicine, Nanchang 330004, China;
3. Guangdong Food and Drug Vocational-Technical School, Guangzhou 510663, China
疟疾是由单细胞寄生虫——疟原虫引起的严重危害人类生命健康的虫媒传染病, 其破坏性强、传播性广。虽然WHO已实施全球疟疾规划战略, 疟疾发病率和病死率已明显下降, 但其在非洲、东南亚等地仍广泛流行, 目前仍被列为严重危害人类健康和生命的三大全球性公共卫生问题之一。2018年, 全球疟疾死亡人数约40.5万人, 其中67%的受害者为5岁以下儿童, 全球疟疾防治工作虽取得了一些进展, 但进展缓慢[1], 以青蒿素为基础的联合疗法是目前治疗恶性疟疾的最有效武器。与喹啉衍生物甲氟喹相比, 青蒿素的衍生物青蒿琥酯、蒿甲醚、蒿乙醚和双氢青蒿素可大大减少疟原虫性配子体的繁殖与运输[2-4], 在疟疾防治中发挥了重要作用。
蒿甲醚(artemether, ARM) 是红细胞内疟原虫杀灭剂, 其抗疟效果是青蒿素的10~20倍[5]。与双氢青蒿素和青蒿琥酯相比, ARM在重组悬浮液实验中具有更好的稳定性[6], 生物利用度高于双氢青蒿素[1]。但ARM溶解度低, 在临床上的给药形式主要以固体片剂和胶囊剂为主, 供注射给药的剂型以肌肉注射的油溶液(Larither®) 为主。注射用油溶液多为大豆、芝麻和茶籽等植物提取的油溶剂, 不能静脉注射, 存在注射疼痛、吸收缓慢和不稳定等缺点[7]。目前尚未研制出可供静脉输注的ARM溶液[8], 故ARM的水溶性注射制剂的开发与研究将具有重要临床意义。
由于ARM的分子结构疏水, 不适合成盐, 多使用表面活性剂对其进行增溶, 如ARM与羟丙基-β-环糊精(HP-β-CD) 形成包合物[9]或制备成脂质体[10]。ARM在ARM/HP-β-CD体系中的溶解度可达到7.16 mg·mL-1, 且溶解度随着HP-β-CD浓度的增加呈线性增加, 但由于HP-β-CD生物相容性低, 用量不宜过高, 这极大地限制了HP-β-CD的应用。对于脂质体, 单一磷脂或磷脂衍生物形成的双层脂质体结构增溶的能力有限, 当辅料总质量浓度为300 mg·mL-1时, ARM的溶解度仅为1.5 mg·mL-1。磷脂在特定条件下与适当的亲水性表面活性剂结合形成的混合胶束(如胆盐/磷脂混合胶束, BS-PC-MM) 具有粒径小(通常小于60 nm)[11]、外部亲水性好、内部有较大的疏水核等特点, 形成的混合圆盘型结构[12]可将难溶性药物包裹在内部疏水核, 极大地增加了难溶性药物的溶解度, 是目前临床上已有应用的一种新型的药物载体。BS-PC-MM不仅可以增加不溶性活性成分(如维生素K1[12]) 的体内释放, 且具有良好的生理相容性和增溶能力, 已被证明是水飞蓟宾[13, 14]、尼莫地平[15]、布洛芬[16]、氯硝西泮[17, 18]和四氢西泮[18, 19]等药物的良性增溶剂。
据文献[20]报道, ARM在胶束体系中的溶解度虽然提高了3~15倍, 但15天后出现浑浊, ARM降解率达14.3%, 且需在0 ℃储存。目前胆酸盐及脂类对ARM增溶作用的研究[21]探究了食物及肠道环境对ARM溶解度的影响, 且证实肠道中的胆酸盐的确能够增加ARM的溶解度, 但尚未解决ARM只有以油溶液注射的问题。
本研究以制备ARM的水溶性注射剂为目的, 选用可供注射用的甘氨胆酸钠(sodium glycocholate, SGC) 与大豆磷脂(soybean lecithin, SL) 制备MM, 考察其对ARM的增溶效果。其中, 主要考察了辅料配比及总浓度对ARM溶解度增加的影响, 同时考察了MM的物理稳定性及MM中ARM的化学稳定性, 由此验证可供肌肉或静脉注射给药的ARM水溶性制剂的可行性。
材料与方法仪器 1260型HPLC液相色谱仪(安捷伦科技有限公司); 粒度测定仪(英国马尔文仪器公司)。
药品与试剂 ARM (纯度> 90%, 天津太平洋化学制药有限公司, 批号: HJ100705); 大豆磷脂(磷脂酰胆碱> 95%)、蛋黄磷脂(egg lecithin, EL, 磷脂酰胆碱> 75%) (上海太伟药业); 甘氨胆酸[海南卫康制药(潜山) 有限公司]; 氢氧化钠(湖南尔康制药); 脱氧胆酸钠(sodium deoxycholate, SDC)、胆酸钠(sodium cholate, SC)、磷酸二氢钾、磷酸氢二钾、磷酸氢二钠、磷酸二氢钠、乙腈(色谱级)、无水乙醇(分析纯) (国药集团化学试剂有限公司); 纯化水(上海雀巢饮用水有限公司)。
色谱条件 色谱柱: Phenomenex C18色谱柱(150 mm×4.6 mm, 5 μm); 流动相: 乙腈-水(62∶38); 流速: 1.0 mL·min-1; 柱温: 25 ℃; 进样量: 20 μL; 检测波长: 216 nm。测定时将MM溶于5倍量的乙腈溶液中, 12 000 r·min-1离心10 min后取上清液, 用流动相稀释一定倍数后进样测定。
混合胶束的制备 将处方量的辅料及过量的ARM溶于一定量的无水乙醇中, 于40 ℃水浴减压旋蒸(100 r·min-1, 0.09 MPa) 30 min, 待有机溶剂完全蒸发后形成薄膜, 加入处方量的分散介质, 超声水化, 储存于密封EP管中, 室温下静置12 h以沉淀过量ARM, 将已形成稳定MM的上清液经0.22 μm滤膜过滤, 于4 ℃和25 ℃保存备用。
甘氨胆酸钠/大豆磷脂的配比考察 胆盐对磷脂具有增溶作用, 故胆盐将磷脂分子包裹于内部形成混合圆盘型结构, 但其增溶能力有限, 包裹磷脂分子的数量在一定范围内存在临界值。空白胶束为澄清透明溶液时透光率100%, 当其出现乳光现象时, 透光率下降, 表明SGC对SL的增溶能力达到了极限。本研究设计不同SL/(SGC+SL) 质量比[15], 在660 nm条件下测定空白MM的透光率, 以考察MM中大豆磷脂的最大质量配比。
分散介质的选择 MM中药物的溶解度、胶束的粒径和形状等均受分散介质的影响[14], 因此, 根据SGC对SL的增溶效果, 本研究固定SL/(SGC+SL) 的质量比为0.5, SGC和SL的总浓度为10.0%, 以超纯水和磷酸盐缓冲液(PBS, pH 5.8、6.8和7.4, 0.05 mol·L-1) 为分散介质制备ARM的MM。
ARM原料药溶解度测定 精密称取过量ARM于相同体积(10 mL) 不同pH值(5.8、6.8和7.4, 0.05 mol·L-1) 的PBS以及超纯水中, 于25 ℃摇床中振摇72 h, 0.22 μm滤膜过滤后, HPLC法测定ARM溶解度。
ARM在混合胶束中的溶解度测定 采用单因素分析法设计处方: ①固定SL和SGC的总浓度为10.0%, 考察SL和SGC质量比; ②固定SL和SGC的质量比为0.5[22], 考察SL和SGC的总浓度, 平行3次。通过HPLC法测定ARM在MM中的浓度, 计算载药量(drug loading, DL):
| $ {\rm{DL}}\left( \% \right) = \frac{{{M_{{\rm{drug}}}}}}{{{M_{{\rm{drug}}}} + {M_{{\rm{surfactant}}}}}} \times 100\% $ | (1) |
其中, Mdrug为胶束样品中药物的量(mg); Msurfactant为表面活性剂(SGC和SL) 的量(mg)。
原料药化学稳定性研究 配制母液(精密称取ARM原料药20.11 mg, 乙腈溶解并定容于10 mL量瓶), 分别用纯水、pH 5.8 PBS及pH 7.4 PBS稀释至质量浓度约为500 μg·mL-1, 于37 ℃或60 ℃水浴, 在0、0.5、2、4、6及8 h取样, 置于0 ℃冰水浴中终止反应, HPLC测定不同时间样品中ARM浓度。
混合胶束物理稳定性研究 在临界胶束浓度(CMC) 以上的某个范围内, 表面活性剂以囊泡和胶束的形式共同存在; 而在高于这一浓度范围时, 则以胶束的形式独立存在[23, 24]。由于SGC-SL-MM的临界胶束浓度非常小, ARM-SGC-SL-MM稀释一定倍数仍可能以囊泡或胶束的形式存在, 由此推测其在人体漏槽条件下可能具有良好的物理稳定性。故以5%葡萄糖溶液和0.9%氯化钠溶液为稀释剂, 分别将载药胶束稀释10、50及100倍, 测定稀释后载药胶束粒径分布及多分散系数(PDI), 以考察物理稳定性。
混合胶束中的化学稳定性研究 本研究测得ARM在纯水中的溶解度为120.4 μg·mL-1, 由于溶解度过小, 无法配制出与MM中ARM浓度相近的ARM水溶液。另一方面, 随着热稳定实验中ARM的降解, ARM的浓度过低会影响HPLC测定结果的准确性; 且MM中辅料浓度过高也易影响ARM的测定结果。因此, 为保证ARM水溶液和MM溶液的浓度一致性, 本实验采用ARM质量浓度为500 μg·mL-1的乙腈-PBS (pH 7.4) (1∶7, v/v) 溶液和经过稀释8倍至相近浓度的SGC-SL-MM溶液。
为加速考察ARM-MM在储存中的化学稳定性, 将ARM-MM的样品置于离心管中, 然后分别放置在37 ℃和60 ℃的水浴中, 于0、2、4、6、8以及24 h取样, 置于0 ℃冰水浴中终止反应, HPLC法测定不同时间点ARM的含量。根据已有文献[18, 22]报道, 不同的胆盐与磷脂复配形成的MM对同一药物的增溶效果无明显差异; 结合前期对载药胶束中ARM溶解度的考察, 结果证实不同胆盐和磷脂制备的MM对ARM的增溶效果确实无明显差异。因此, 在辅料配比及总浓度考察时, 胆盐和磷脂的选择优先考虑使用已上市产品维生素K1胶束制剂(Konakion® MM 10 mg) 的辅料——SGC和SL。由于不同胆盐或磷脂的分子结构不同, 所形成的胶束可能对所载药物的稳定性有影响, 因此, 为了对比不同胆盐或磷脂制备的MM对ARM稳定性的影响, 制备ARM的甘氨胆酸钠/蛋黄磷脂MM (SGC-EL-MM)、脱氧胆酸钠/大豆磷脂MM (SDC-SL-MM) 和胆酸钠/大豆磷脂MM (SC-SL-MM), 于相同条件下考察MM中ARM的化学稳定性。
阿伦尼乌斯(Arrhenius)参数及储存稳定性计算 当ARM降解遵循一级降解动力学时, 符合C = C0e–kt (C是ARM在t时刻的浓度, C0是起始浓度, k是降解速率常数)方程。通过ARM在37 ℃和60 ℃的条件下浓度随时间变化的结果, 绘制一级降解动力学C = C0e–kt的对数曲线, 分别算出对应的降解速率常数。然后运用Arrhenius方程ln k = ln A - Ea/RT(k是降解速率常数, A是指前因子, Ea是活化能, R是气体常数, T是华氏温度) 计算得出Arrhenius参数, 采用Arrhenius参数推算ARM-MM在4 ℃及25 ℃的半衰期, 以预测其储存稳定性。
结果与讨论 1 甘氨胆酸钠/大豆磷脂的配比考察单一磷脂在溶液中主要以双分子层的脂质体形式存在, 粒径一般比胶束溶液大, 通常情况下存在乳光现象; 而由胆盐和磷脂形成的混合胶束为混合圆盘模型, 胆盐分子不仅可以将磷脂分子包裹于内部, 也可镶嵌于磷脂分子中, 所形成的胶束溶液粒径较小, 为澄清透明溶液。但胆盐分子所能包裹的磷脂分子数量是有限的, 因此胆盐与磷脂的配比存在临界值。若SL的质量比大于最大质量比时, SL分子数量增多, 难以形成混合圆盘模型, 一部分SL分子趋向于形成粒径增大的磷脂双分子层脂质体, 溶液出现乳光或浑浊, 透光率下降, 影响胶束的结构及其对药物的增溶。
若要形成透明的MM溶液, 透光率急剧下降的拐点对应SL在SGC溶液中的最大质量比(图 1), 即SL/(SGC+SL) 质量比为0.6。因此, 本研究以SL/(SGC+SL) 质量比0.6作为SL最大用量。

|
Figure 1 Transmittance of mixed micelles (MM) prepared with different soybean lecithin (SL) mass ratio |
在离子强度相同的情况下, 分散介质的pH值对ARM的溶解度及粒径分布影响较小, 结果见表 1。
| Table 1 Effects of dispersion media on artemether (ARM) solubility in mixed micelles (MM) and size distribution of MM (total concentration was 10.0%, w/w) at 25 ℃. PDI: Polydispersity index; PBS: Phosphate buffer solution; DL: Drug loading. n= 3, x± s |
在上述4种介质中, 以水为介质得到的胶束粒径分布存在多个粒径峰, 说明形成的胶束具有一定的分散性; 而经PBS水化得到的MM的粒径分布呈单峰, 说明形成的胶束粒径比较均匀; 其中, PBS (pH 7.4) 溶液水化得到的MM在粒径分布上不仅呈单峰(图 2) 且具有较低的PDI值(0.16)。根据体外代谢动力学研究表明, ARM在pH 7.4的弱碱环境中比在pH 1.0的酸性环境中更稳定[25]。因此, 在后续SL质量比及辅料总浓度的筛选中, 采用pH 7.4的PBS溶液作为水化的分散介质。

|
Figure 2 The particle size distribution of ARM-loaded MM |
ARM在纯水、PBS (pH 5.8、6.8及7.4) 中的溶解度分别为120.4、101.6、98.9及102.4 μg·mL-1, 可见分散介质的pH值对ARM溶解度影响较小。
ARM在SGC-SL-MM中的溶解度受SL用量的影响。当SGC和SL总浓度为10.0%, SL/(SGC+SL) 的质量比分别为0、0.2、0.4、0.5和0.6, pH 7.4 PBS为分散介质时, ARM在MM中的溶解度与SL/(SGC+SL) 质量比呈正相关(图 3)。由图 1可知, 空白胶束SGC和SL总浓度为10.0%, SL/(SGC+SL) 质量比由0.6变成0.7时, 溶液的透光率显著下降, 出现乳光甚至浑浊, 说明若想得到澄清透明的胶束溶液, SL/(SGC+SL) 质量比0.6已接近临界值。为了避免ARM的加入影响胶束的结构甚至溶液的澄清度, 在ARM-SGC-SL-MM的后续研究中, 选择SL/(SGC+SL) 质量比为0.5进行考察, 既能较大程度增加ARM的溶解度, 又不影响溶液的澄清度。

|
Figure 3 Effect of SL mass ratio on ARM solubility in different MM at 25 ℃ [total concentration of 10.0 % (w/w) in PBS, pH 7.4, 0.05 mol·L-1]. n= 3, x± s |
当SL质量比为0.5, 辅料总浓度由1.0%增加到30.0% (w/w) 时, ARM在SGC-SL-MM体系中的溶解度随SGC和SL总浓度的增加呈线性增加: 由0.64 mg·mL-1显著增加到13.7 mg·mL-1, ARM在水中的溶解度提高了5~114倍(图 4)。由图可见, 在辅料总浓度大于3.0%时, 随着SGC和SL总浓度的增加, ARM在MM中的载药量相对恒定(约3.8%), 且优于ARM/HP-β-CD体系(载药量为2.5%)[9]; 与此同时, 若继续增加辅料总浓度, ARM的溶解度也会继续增加。

|
Figure 4 Solubility and DL of ARM in different total concentrations of SGC and SL at 25 ℃ (PBS, pH 7.4, 0.05 mol·L-1). n= 3, x± s |
胶束在一定浓度范围内稀释后是稳定的[23, 24], SL/(SGC+SL) 比例为0.5, 辅料总浓度为10.0%时, MM经稀释后均为澄清透明的溶液。ARM-SGC-SL-MM经5%葡萄糖溶液稀释10倍、50倍和100倍后, 平均粒径及PDI值变化较大, 经稀释100倍后, 胶束溶液的PDI值为1.00, 具有高度的分散性; 但用0.9%氯化钠溶液和PBS (pH 7.4) 稀释相同倍数后, 平均粒径及PDI值无显著差异(表 2)。由此可见, 相比于葡萄糖分子不能电离, MM在动态的氯化钠和PBS电解质溶液环境下更稳定, 而0.9%氯化钠溶液和PBS (pH 7.4) 与人体生理环境相似, 说明MM在生理条件下具有较好的稀释稳定性。
| Table 2 Stability of ARM-SGC-SL-MM diluted by 0.9% sodium chloride solution, 5% glucose solution or PBS (pH 7.4, 0.05 mol·L-1). *10:Diluted for 10 fold; *50:Diluted for 50 fold; *100:Diluted for 100 fold. n= 3, x± s |
已有的研究结果表明, 由表面活性剂复配形成的胶束将难溶性药物包裹于胶束的内核或栅栏层中, 能够增加药物的稳定性[26]; 且有四氢西泮在BS/SL-MM体系中的稳定性增加的报道[19], 说明BS/SL-MM体系也能在一定程度上增加被包裹药物的稳定性。已知在25 ℃条件下, 初始质量浓度为900 μg·mL-1时, ARM在氢氧化钠制备的pH 7.4溶液中半衰期约为4.8 h[25]; 本研究结果表明, 在37 ℃条件下, 初始质量浓度为500 μg·mL-1的乙腈-PBS (pH 7.4) (1∶7, v/v) 溶液中, ARM的半衰期大于8 h; 同样情况下, ARM-SGC-SL-MM经过稀释8倍的溶液中ARM又比在PBS (pH 7.4) 中更稳定。但60 ℃条件下, ARM在MM中的稳定性明显下降, 药物降解迅速(图 5)。导致上述结果的原因可能与ARM在SGC-SL-MM溶液中的降解动力学有关, 化学反应的进行需要达到一定的能量, 只有在达到这一能量后反应才能进行, 这一能量称为活化能, 且在达到活化能后反应的速度会加快, 而在低于这一反应活化能的条件下, 物质不会发生化学反应, 而反应的能量与物质所处的环境温度密切相关。因此, 可以根据Arrhenius方程理论和一级降解动力学来计算ARM降解所需要的活化能, 通过计算推测室温或冷藏条件下ARM在MM的化学稳定性, 并通过实验结果进行验证。
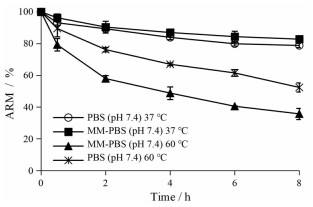
|
Figure 5 Stability of ARM in acetonitrile-PBS (pH 7.4) at 500 μg·mL-1 and ARM in MM hydrated by PBS (pH 7.4) with the same concentration at 37 ℃ and 60 ℃. n= 3, x± s |
在37 ℃和60 ℃条件下, 直接考察不经稀释的MM中ARM的稳定性, 结果表明37 ℃时ARM在MM中的稳定性顺序为PBS (pH 7.4) > PBS (pH 5.8) ≈ PBS (pH 6.8) >水(图 6A), 而在60 ℃时没有显著差异(图 6B)。与此同时, 以PBS (pH 7.4) 作为分散介质水化, 考察不同BS和PC制备的MM体系中ARM的稳定性, 结果表明37 ℃时不同MM中ARM的降解无明显差异(图 6C), 而在60 ℃时, 除了SDC-SL-MM中ARM降解速率较快, 其余无明显差异(图 6D)。

|
Figure 6 Stabilities of ARM in SGC-SL-MM hydrated by different dispersion media and BS-PC-MM systems prepared from different bile salts (sodium deoxycholate, SDC; sodium cholate, SC) and lecithin (egg lecithin, EL) at 37 ℃ (A, C) and 60 ℃ (B, D). n= 3, x± s |
综上所述, 低温条件下, ARM在MM中的稳定性较好。且在室温条件下考察SL/(SGC+SL) 质量比的过程中发现, ARM在由SGC单一表面活性剂组成的胶束溶液中存放2个月后易出现颜色变化; 而在SL/(SGC+SL) 质量比大于0.2的MM中则几乎无颜色变化。这可能是由于SL中正电荷的存在, 促使胆盐在氧化反应过渡态中产生的负电荷去极化, 而ARM与SL具有较好的亲和力, 被包裹在MM中的疏水区域, 阻止了ARM与外界的反应。
4.4 Arrhenius参数及储存稳定性计算Arrhenius方程和一级降解动力学的计算结果表明(表 3), 无论是37 ℃还是60 ℃, MM中ARM的降解速率常数均比其在乙腈-PBS (pH 7.4) 溶液中的小; 与此同时, 在37 ℃条件下, 将PBS (pH 7.4) 制备的MM稀释至与ARM的乙腈-PBS (pH 7.4) 溶液相近浓度(约500 μg·mL-1) 时, ARM的降解速率常数也更小。由此可见, MM可极大改善ARM稳定性; 根据公式计算在25 ℃条件下, ARM-SGC-SL-MM体系在PBS (pH 7.4) 中稳定性最佳, 不同胆盐或磷脂制备的MM体系中的储存稳定性顺序为: SDC-SL-MM >SGC-SL-MM > SGC-EL-MM > SC-SL-MM。
| Table 3 Arrhenius parameters and shelf stability of ARM in different mixed micellar systems. A: Frequency factor; Ea: Activation energy |
采用PBS (pH 7.4) 制备的ARM-SGC-SL-MM, 25 ℃室温条件下储存2个月未见浑浊, 粒径测定结果也显示, 粒径分布变化不大, 说明其具有良好的物理稳定性。且ARM的平均浓度从第1天的3.95±0.22 mg·mL-1到2个月后的3.74±0.14 mg·mL-1, 降解率小于7.0%, 结果比通过Arrhenius方程推算所得的储存稳定性更好, 原因可能在于ARM的热分解不是单一的反应机制[27, 28]。Arrhenius方程计算的活化能是理想条件下的常数, 但因为ARM被包裹在胶束的疏水区, 减少分子间的碰撞; 且胶束的结构受温度的影响而发生改变, 导致反应活化能的改变。虽然通过Arrhenius方程计算的活化能是一个表观值, 只能推测药物的储存稳定性, 但对于相同的体系来说, 其计算结果具有一定的参考性与应用价值。
结论从药学研究的角度来说, MM能同时提高抗疟药物ARM的溶解度和稳定性。SGC-SL-MM显著增加了ARM的水溶性: 随着辅料总浓度的增加, ARM的溶解度从0.64±0.04 mg·mL-1显著增加到13.7±0.13 mg·mL-1。Arrhenius方程和一级降解动力学的计算结果亦表明, 无论在37 ℃或60 ℃下, ARM在MM中的稳定性均比其水溶液好; MM漏槽条件下被稀释后具有较好的物理稳定性, 且37 ℃时MM中ARM的稳定性还比初始浓度相近的水溶液好。此外, PBS (pH 7.4) 制备的ARM-SGC-SL-MM在室温下储存2个月后外观澄清, 粒径分布均匀, 含量稳定性良好(降解小于7.0%)。与此同时, 计算所得ARM在4 ℃及25 ℃的储存稳定性均优于其水溶液。
综上所述, SGC-SL-MM有效地提高了ARM的溶解度和稳定性, 一方面可以证实肠道环境中的胆盐确实可以增加ARM口服制剂的溶解度与稳定性; 另一方面, 也为ARM制备成可供肌肉或静脉注射给药的水溶性制剂创造了可能, 这对于青蒿素类药物的抗疟实践具有积极意义。
作者贡献: 肖光清负责文献查阅、实验设计和实施、数据分析、论文初稿撰写及根据编辑部修改意见进行修改; 张继稳和李海燕负责实验指导、实验设计、样品采集和指导论文撰写与修改; 伍丽和熊婷参与实验设计、样品采集、文章图表格式处理及论文修改; 朱卫丰和李东勳参与理论指导、实验设计、论文修改及论文定稿。
利益冲突: 本文所有作者均同意发表, 所有的作者之间不存在利益冲突。
| [1] |
WHO. Factsheet on the World Malaria Report 2019[D]. World Health Organization, 2019.
|
| [2] |
Ansari MT, Saify ZS, Sultana N, et al. Malaria and artemisinin derivatives: an updated review[J]. Mini Rev Med Chem, 2013, 13: 1879-1902. DOI:10.2174/13895575113136660097 |
| [3] |
Egan TJ. Haemozoin (malaria pigment): a unique crystalline drug target[J]. Targets, 2003, 2: 115-124. DOI:10.1016/S1477-3627(03)02310-9 |
| [4] |
Price RN, Nosten F, Luxemburger C, et al. Effects of artemisinin derivatives on malaria transmissibility[J]. Lancet, 1996, 347: 1654-1658. DOI:10.1016/S0140-6736(96)91488-9 |
| [5] |
Liu YX, Wu W, Liang YJ, et al. New uses for old drugs: the tale of artemisinin derivatives in the elimination of schistosomiasis japonica in China[J]. Molecules, 2014, 19: 15058-15074. DOI:10.3390/molecules190915058 |
| [6] |
Gabri ls M, Plaizier-Vercammen J. Experimental designed optimisation and stability evaluation of dry suspensions with artemisinin derivatives for paediatric use[J]. Int J Pharm, 2004, 283: 19-34. DOI:10.1016/j.ijpharm.2004.05.033 |
| [7] |
Zhang YH, Wang LJ, Gan LL, et al. Research progress of the clinical application of artemether and its preparations[J]. Chongqing Med (重庆医学), 2014, 43: 3967-3970. |
| [8] |
Gabri ls M, Plaizier-Vercammen J. Design of a dissolution system for the evaluation of the release rate characteristics of artemether and dihydroartemisinin from tablets[J]. Int J Pharm, 2004, 274: 245-260. DOI:10.1016/j.ijpharm.2004.01.022 |
| [9] |
Yang B, Lin J, Chen Y, et al. Artemether /hydroxypropyl-β-cyclodextrin host-guest system: characterization, phase-solubility and inclusion mode[J]. Bioorg Med Chem Lett, 2009, 17: 6311-6317. DOI:10.1016/j.bmc.2009.07.060 |
| [10] |
Chimanuka B, Gabri ls M, Detaevernier MR, et al. Preparation of β-artemether liposomes, their HPLC-UV evaluation and relevance for clearing recrudescent parasitaemia in Plasmodium chabaudi malaria infected mice[J]. J Pharm Biomed Anal, 2002, 28: 13-22. DOI:10.1016/S0731-7085(01)00611-2 |
| [11] |
Rupp C, Steckel H, Müller BW. Mixed micelle formation with phosphatidylcholines: the influence of surfactants with different molecule structures[J]. Int J Pharm, 2010, 387: 120-128. DOI:10.1016/j.ijpharm.2009.12.018 |
| [12] |
Nagata M, Yotsuyanagi T, Ikeda K. Solubilization of vitamin K1 by bile salts and phosphatidylcholine-bile salts mixed micelles[J]. J Pharm Pharmacol, 1988, 40: 85-88. |
| [13] |
Duan RL, Sun X, Liu J, et al. Mixed micelles loaded with silybin-polyene phosphatidylcholine complex improve drug solubility[J]. Acta Pharmacol Sin, 2011, 32: 108-115. DOI:10.1038/aps.2010.192 |
| [14] |
Yu J, Zhu Y, Wang L, et al. Enhancement of oral bioavailability of the poorly water - soluble drug silybin by sodium cholate/phospholipid-mixed micelles[J]. Acta Pharmacol Sin, 2010, 31: 759-764. DOI:10.1038/aps.2010.55 |
| [15] |
Song X, Jiang Y, Ren CJ, et al. Nimodipine-loaded mixed micelles: formulation, compatibility, pharmacokinetics, and vascular irritability study[J]. Int J Nanomed, 2012, 7: 3689. |
| [16] |
Prakash P, Sayyed-Ahmad A, Zhou Y, et al. Aggregation behavior of ibuprofen, cholic acid and dodecylphosphocholine micelles[J]. Biochim Biophys Acta, 2012, 1818: 3040-3047. DOI:10.1016/j.bbamem.2012.07.029 |
| [17] |
Hammad MA, Müller BW. Solubility and stability of clonazepam in mixed micelles[J]. Int J Pharm, 1998, 169: 55-64. DOI:10.1016/S0378-5173(98)00117-3 |
| [18] |
Hammad MA, Müller BW. Increasing drug solubility by means of bile salt-phosphatidylcholine based mixed micelles[J]. Eur J Pharm Biopharm, 1998, 46: 361-367. DOI:10.1016/S0939-6411(98)00037-X |
| [19] |
Hammad MA, Müller BW. Solubility and stability of tetrazepam in mixed micelles[J]. Int J Pharm, 1998, 7: 49-55. |
| [20] |
Bhadra D, Bhadra S, Jain NK. Pegylated lysine based copolymeric dendritic micelles for solubilization and delivery of artemether[J]. J Pharm Pharmacol, 2005, 8: 467-482. |
| [21] |
Wu FZ, Yang LJ. Solubilization of cholate and lipid in intestinal tract on the insoluble drug artemether[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2016, 22: 6-9. |
| [22] |
Zughaid H, Forbes B, Martin GP, et al. Bile salt composition is secondary to bile salt concentration in determining hydrocortisone and progesterone solubility in intestinal mimetic fluids[J]. Int J Pharm, 2012, 422: 295-301. DOI:10.1016/j.ijpharm.2011.11.012 |
| [23] |
Sakai T, Miyaki M, Tajima H, et al. Precipitate deposition around CMC and vesicle-to-micelle transition of monopotassium monododecyl phosphate in water[J]. J Phys Chem B, 2012, 116: 11225-11233. DOI:10.1021/jp307070e |
| [24] |
Sakai T, Ikoshi R, Toshida N, et al. Thermodynamically stable vesicle formation and vesicle-to-micelle transition of single-tailed anionic surfactant in water[J]. J Phys Chem B, 2013, 117: 5081-5089. DOI:10.1021/jp402314f |
| [25] |
Chen YG, Yu BY. Pharmacokinetic studies on artemether under conditions simulated in vivo[J]. Chin J Chromatogr (色谱), 2002, 20: 37-39. |
| [26] |
Liu TT, Yang BX, Guo YY, et al. Solubilization and protection of curcumin by compound surfactant[J]. Acta Pharm Sin (药学学报), 2019, 54: 8-13. |
| [27] |
Blessborn D, Sköld K, Zeeberg D, et al. Heat stabilization of blood spot samples for determination of metabolically unstable drug compounds[J]. Bioanalysis, 2013, 5: 31-39. DOI:10.4155/bio.12.294 |
| [28] |
Gao H, Chen L, Chen W, et al. Thermal stability evaluation of β-artemether by DSC and ARC[J]. Thermochim Acta, 2013, 569: 134-138. DOI:10.1016/j.tca.2013.07.017 |
 2021, Vol. 56
2021, Vol. 56


