脂质制剂(lipid formulation) 由油相、亲油性表面活性剂、亲水性表面活性剂和助表面活性剂中的一种或几种组成。对脂溶性较高的难溶性药物, 脂质制剂是一种提高口服生物利用度的有效手段[1]。
脂质制剂进入胃肠道后, 首先在胃部形成1~100 μm的粗乳, 随之被排入小肠, 刺激胆囊分泌胆盐、磷脂和胆固醇, 这些成分吸附在粗乳的表面; 与此同时, 脂质制剂中的油相(以甘油三酯为主成分) 在胰腺分泌的胰脂肪酶及辅酶作用下, 被消化为单甘脂和脂肪酸等, 这些消化产物作为良好的乳化剂, 会促进粗乳分散成粒径更小的微乳。随着甘油三酯不断被消化, 肠道中单甘酯和脂肪酸的含量增加, 作为良好的乳化剂会结合在微乳表面, 自发地催化脂解过程进行[2]。在整个过程中, 内源性胆盐等与脂质制剂的消化产物在肠道内形成单层囊泡、多层囊泡和混合胶束等结构, 药物被增溶在这些结构中, 由此形成较高的浓度梯度, 进而通过扩散运动穿过肠道的不流动水层, 被小肠上皮细胞吸收[3]。
Pouton[4, 5]将脂质制剂分成Ⅰ、Ⅱ、Ⅲ和Ⅳ型。Ⅰ型和Ⅱ型以油相和亲油性表面活性剂为主, Ⅲ型和Ⅳ型则更多含有亲水性表面活性剂与助表面活性剂。Ⅲ型脂质制剂由油相、亲水性表面活性剂和助表面活性剂组成, 根据含油量的高低将Ⅲ型脂质制剂区分为含油量较高的ⅢA型和含油量较低的ⅢB型。Ⅲ型脂质制剂与水溶液接触后会产生自乳化现象, 其中ⅢA型脂质制剂一般会形成粒径约为100~250 nm的亚微乳, 而ⅢB型脂质制剂因为亲水性表面活性剂和助表面活性剂含量更高, 具有更快的分散速度, 可以形成粒径小于100 nm的微乳[4]。
目前已有较多Ⅲ型脂质制剂上市, 较为典型的药物有环孢素、环丙沙星和替拉那韦等, 其优势在于: 除油相的消化产物与内源性物质形成囊泡、混合胶束发挥增溶作用以外, 处方中的亲水性表面活性剂与助表面活性剂具有极好的自乳化作用, 可以形成更小的乳滴, 帮助加快分散和消化油相, 同时发挥药物增溶作用[6]。但也有文献[7]指出, 因Ⅲ型脂质制剂与其他脂质制剂相比含有较多亲水性辅料, 在自乳化的过程中, 部分亲水性表面活性剂和助表面活性剂会从油相中扩散出去, 这种相分离可能会导致Ⅲ型脂质制剂对药物的增溶能力降低, 使药物沉淀。辅料的亲水性程度越高, 越容易导致药物沉淀, 这意味着ⅢB型脂质制剂, 因具有更高比例的水溶性表面活性剂和助溶剂, 产生药物沉淀的风险比ⅢA型脂质制剂更大。
由于脂质制剂在胃肠道发生了较为复杂的变化, 因此常用的口服固体制剂溶出度试验方法无法很好地评价脂质制剂, 目前常用脂解模型对脂质制剂进行体外评价[8-10]。
脂溶性药物十一酸睾酮(testosterone undecanoate, TU) 为BCS Ⅱ类药物, 不溶于水, 口服生物利用度极低, 在较长一段时间内仅通过肌肉注射的方式给药, 随后荷兰欧加农公司开发了商品名为Andriol®的软胶囊, 是一种采用油酸溶解药物的脂质制剂, 并在此基础上开发了Andriol Testocaps®, 该制剂在室温下的储存时间可稳定储藏长达3年。除上述市售制剂以外, 十一酸睾酮的自微乳制剂和固体自乳化制剂等新型制剂都有了较大的研究进展, 例如默沙东公司开发了一种TU自微乳制剂, 在较低剂量即可起效, 并且减少了食物效应。在此背景下, 本研究选择TU为模型药物, 分别制备ⅢA型和ⅢB型脂质制剂。利用体外脂解模型研究各制剂的体外消化情况, 考察含油量和表面活性剂对药物增溶的影响, 并进一步探究各脂质制剂体外脂解消化的机制, 以期通过体外脂解模型解释影响脂质制剂消化的原因。
材料与方法试剂与仪器 TU(浙江仙琚制药股份有限公司); 蓖麻油(上海凌峰化学试剂有限公司); 玉米油、4-溴苯硼酸(4-bromophenylboronic acid, 4-BPB) (上海阿拉丁生化科技股份有限公司); 中链甘油三酯(Labrafac Lipophile WL 1349)、辛酸癸酸聚乙二醇甘油酯(Labrasol)、二乙二醇单乙基醚(Transcutol HP) (法国Gattefossé公司); 聚氧乙烯蓖麻油(Cremophor EL, 德国BASF公司); Tween 80、1, 2-丙二醇(propylene glycol, PG) (南京化学试剂股份有限公司); 聚乙二醇400 (polyethylene glycol 400, PEG400, 上海凌峰化学试剂有限公司); 三羟基甲氨甲烷-马来酸盐(tris-maleate, 美国Acros公司); 卵磷脂(phosphatidylcholine, PC, 来自大豆卵磷脂, PC含量95%, 艾伟拓医药科技有限公司); 牛磺脱氧胆酸钠(sodium taurodeoxycholate, NaTDC, 萨恩化学技术有限公司); 猪胰脂肪酶(pancreatin, 8×USP, 美国Sigma公司); 其他化学试剂均为分析纯。
高效液相色谱仪(LC-20AT高压泵、SPD-20A紫外检测器, 日本岛津公司); 低温冷冻离心机(SL16R, 美国Thermo Fisher公司); 金相显微镜(BA310Met-T, 厦门麦克奥迪实业集团有限公司); 电导率仪(DDSJ-308A, 上海仪电科学仪器股份有限公司)。
TU的含量测定 高效液相色谱法(HPLC) 色谱条件: Sepax GP-C18反相色谱柱(5 μm, 250 mm×4.6 mm); 流动相为乙腈-异丙醇-水(43∶43∶14, v/v/v); 检测波长为240 nm; 柱温为40 ℃; 流速为1.0 mL·min-1; 进样量为10 μL。在该色谱条件下理论塔板数按TU峰计算应不低于4 000。通过标准曲线的建立、专属性、精密度、回收率和稳定性进行方法学验证, 建立TU的HPLC含量测定方法。
Ⅲ型脂质制剂的制备 取适量油相、亲水性表面活性剂和助表面活性剂, 于37 ℃、200 r·min-1条件下搅拌5 min, 混合均匀, 加入适量TU, 继续搅拌30 min使药物完全溶解, 即得Ⅲ型脂质制剂。
体外脂解试验溶液配制[11]
消化液 将50 mmol·L-1 Tris-maleate、150 mmol·L-1 NaCl和5 mmol·L-1 CaCl2·2H2O溶于蒸馏水中, 滴加1 mmol·L-1 NaOH溶液调节pH值为7.5, 混匀即得。
NaTDC/PC溶液 取一定量PC溶于装有适量三氯甲烷的圆底烧瓶中, 减压蒸发除去三氯甲烷, 得到淡黄色卵磷脂薄膜。加入一定量的NaTDC和消化液, 于37 ℃、500 r·min-1条件下持续搅拌12 h, 得澄清淡黄色溶液, 即为NaTDC/PC溶液。模拟非禁食条件下胃肠道环境时, PC和NaTDC的浓度分别为5 mmol·L-1和20 mmol·L-1, 按照前述方法制备得到非禁食条件下的NaTDC/PC溶液; 模拟禁食条件下胃肠道环境时PC和NaTDC的浓度分别为1.25 mmol·L-1和5 mmol·L-1, 按照前述方法制备得到禁食条件下NaTDC/PC溶液。
胰脂肪酶提取液 称取猪胰脂肪酶1 g溶于5 mL前述消化液中, 5 ℃下搅拌15 min使充分混合, 4 000 r·min-1、5 ℃下离心15 min, 取上清液即得, 每1 mL相当于含有10 000三丁酸甘油酯单位(Tributyrin units, TBU, 1 TBU相当于每分钟能分解三丁酸甘油酯产生1 μmol脂肪酸所需的酶量)的胰脂肪酶活性。
体外脂解实验[12] 取50 mg‧mL-1的脂质制剂250 μL, 分散于9 mL NaTDC/PC溶液中, 在37 ℃、100 r·min-1下搅拌10 min, 加入胰脂肪酶提取液1 mL, 开始脂解实验。实验过程中, 持续滴加0.2 mol·L-1 NaOH溶液以中和脂解过程中产生的脂肪酸, 维持整个体系的pH值为7.5 ± 0.1。30 min后, 加入4-溴苯硼酸溶液(9 μL·mL-1) 终止反应(图 1)。将NaOH消耗量对时间进行线性回归, 斜率K即为脂解速率。脂解实验结束后, 将全部消化混合物以10 000 r·min-1离心30 min, 分离出水相、油相和沉淀相, 分别测定各相中药物含量, 考察脂解程度。
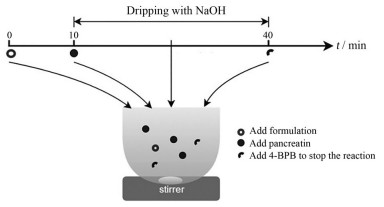
|
Figure 1 Lipid digestion models for in vitro assessment of lipid formulations |
平衡溶解度的测定 将过量TU加入5 mL各辅料中, 涡旋10 min使药物和溶液充分混合, 于37 ℃、100 r·min-1气浴恒温振荡器中平衡48 h。然后将混合物于10 000 r·min-1的条件下离心10 min, 取上清液, 用流动相稀释后经0.22 μm微孔滤膜过滤, 得供试品溶液。取10 μL进样, 根据含量测定方法确定TU在各辅料中的平衡溶解度。
测定TU在消化液、NaTDC/PC溶液、空白粗乳(取250 μL未载药空白脂质制剂, 分散于9 mL NaTDC/PC溶液中, 在37 ℃、100 r·min-1下混合10 min, 作为空白粗乳)、消化后空白水相(取250 μL未载药空白脂质制剂, 进行脂解, 分离消化后得到的空白水相) 中的平衡溶解度。在禁食和非禁食条件下分别进行测定。
光学显微镜结构观察[12] 在各脂质制剂脂解过程(禁食条件下) 的第0、2、10、30 min取100 μL消化液置于光学显微镜下观察, 并即时向实验体系中补加相同体积和相同温度的空白消化液。
电导率测定[12] 使用电导率仪测定脂解过程(禁食条件下) 中的电导率变化, 并绘制电导率随时间的变化曲线。
统计学方法 利用Excel中t检验对两组实验数据进行统计学分析。P < 0.05表示两组数据有显著性差异。
结果 1 TU的含量测定TU的HPLC含量测定方法在5~60 μg·mL-1内线性良好, 线性回归方程为A=21 889C-13 220 (R2=0.999 9); 方法专属性好; 日内及日间精密度的RSD均低于2%;回收率均在98%~102%之间, 且各组RSD小于2%; TU在室温下放置8 h稳定性良好。本研究建立的方法可以较为准确地检测TU的含量。
2 各辅料中药物的平衡溶解度首先筛选对TU有较大溶解度的辅料。根据前期初筛结果, 进一步考察TU在几种油相、亲水性表面活性剂和助表面活性剂中的溶解度。由表 1测定结果可知, 蓖麻油和Transcutol HP是本品较为适宜的油相和助表面活性剂; 而3种亲水性表面活性剂(Tween 80、Cremophor EL和Labrasol) 对TU的平衡溶解度非常相近且均较低, 需通过进一步实验进行比较。
| Table 1 Equilibrium solubility of testosterone undecanoate (TU) in different ingredients. n=3, x ± s |
首先以Cremophor EL为表面活性剂, Transcutol HP为助表面活性剂, 两者比例固定在3∶1, 分别制备蓖麻油含量不同的Ⅲ型脂质制剂(表 2), 考察油相含量对脂质制剂消化的影响。
| Table 2 Composition (%, w/w) of type Ⅲ lipid formulations with different percentage of oil |
其次分别制备含油量为50%和20%的ⅢA和ⅢB型脂质制剂, 并选择3种不同的亲水性表面活性剂(表 3), 考察表面活性剂种类对脂质制剂消化的影响(仍以Transcutol HP为助表面活性剂, 且表面活性剂与助表面活性剂的比例为3∶1)。
| Table 3 Composition (%, w/w) of type Ⅲ lipid formulations with different surfactants |
各处方载药量均固定为50 mg·mL-1, 分别进行非禁食条件下的脂解实验。
3.1 脂质制剂的脂解速率比较考察的各脂质制剂均表现出0~4 min的快速消化期和4~30 min的慢速消化期[13]。脂解速率测定结果见表 4。
| Table 4 Lipolysis rate (K) of the type Ⅲ lipid formulations at fed state. n=3 |
对不同油相含量的处方, 脂解速率排序为A1>A2>B1>B2 (图 2A), 即油相含量越低, 脂解速率越慢。这是因为在酶促反应中, 底物浓度较低时, 反应速率与底物浓度成正比, 即高含油量的A系列处方脂解速率快于低含油量的B系列处方。有研究表明, 当处方中表面活性剂比例增加至50%以上时, 可观察到有凝胶状结构形成, 影响处方的自乳化效率[13], 进而可能影响胰脂肪酶对油相的接触和消化, 导致脂解速率降低。

|
Figure 2 The amount of fatty acids in in vitro digestion at fed state for type Ⅲ lipid formulations. A: In four type Ⅲ lipid formulations with different oil phase contents; B: In three type ⅢB lipid formulations with different surfactants; C: In three type ⅢA lipid formulations with different surfactants. n=3 |
对较低含油量的ⅢB型系列脂质制剂(图 2B), 在快速和慢速消化期, 脂解速率的排序均为B4>B3>B1, 但差异不明显。有研究表明, 当油相种类和含量一定时, 胰脂肪酶对油相的消化可能与表面活性剂的消化作用有关[7, 14]。Labrasol、Tween 80及Cremophor EL均含有甘油酯结构, 能被胰脂肪酶消化。其中Labrasol为辛酸癸酸甘油酯, 碳链最短, 易被消化; 而Tween 80虽然碳链较长, 但含有不饱和键, 比Cremophor EL更易被消化。因为胰脂肪酶仅能消化油水界面处的油相, 所以在乳化状态下被表面活性剂包裹的油相暴露的越多, 消化速率就越快。表面活性剂Labrasol最易被胰脂肪酶消化, 从而暴露出的油相也更多, 因此处方B4的脂解速率最高, 而Tween 80与Cremophor EL被胰脂肪酶消化的难度依次增加, 造成脂解速率略微减慢[14]。
而对于较高含油量的ⅢA型系列脂质制剂(图 2C), 快速消化期脂解速率排序为A4>A3>A1, 与ⅢB型脂质制剂呈现相同的结果。但在慢速消化期, 脂解速率排序变为A1 ≫ A3≈A4 (表 4)。推测是因为在慢速消化期, ⅢA型脂质制剂中部分脂滴被消化, 胰脂肪酶逐渐被消耗, 此时油相和表面活性剂对胰脂肪酶的竞争凸显, 易被消化的表面活性剂Labrasol反而限制了油相的脂解速率, 从而表现出与快速消化期不同的结果。
而ⅢB型脂质制剂由于油相比例仅有20%, 明显低于ⅢA型的50%, 所以在快速消化期脂质制剂即基本被消化, 并未在慢速消化期出现ⅢA型处方的竞争环境。
3.2 脂质制剂消化后药物的分配行为脂质制剂的脂解程度及药物在各相中的分配行为见图 3。
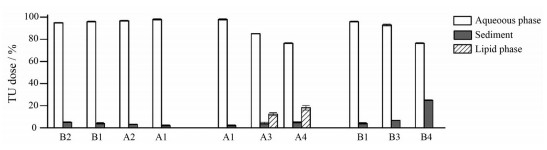
|
Figure 3 Distribution of TU in type Ⅲ lipid formulations after the in vitro lipolysis test at fed state. n=3 |
在A1、A2、B1和B2系列处方(表面活性剂和助表面活性剂种类固定) 中, 所有处方的油相在30 min时均可被完全消化。此外, 随着油相含量增加, 水相中药物略微增加, 沉淀相中药物有所减少。分析认为, 处方中油相含量增加, 脂解速率增加, 油相被快速消化后可产生更多单甘脂和脂肪酸, 同时由于亲水性成分较B系列处方少, 不易发生相分离, 因此更有利于药物的增溶。B系列处方含油量较低, 消化产生的单甘脂等乳化剂较少, 且部分表面活性剂在脂解过程中会被胰脂肪酶消化, 但因其处方中表面活性剂含量非常高, 因此仍具有良好的增溶效果。综合考虑各因素, B系列处方仍可对难溶性药物发挥增溶作用, 仅略低于A系列。
在含油量为20%的ⅢB型系列处方中, 油相含量低, 所有处方30 min时均已被完全消化, 但处方B4相比其他两组有更多药物沉淀。可能是由于B4中的Labrasol更容易被胰脂肪酶消化, 再加上本系列处方含油量低, 产生的单甘脂等乳化剂较少, 因而丧失了对药物的增溶能力, 导致产生大量药物沉淀。
在含油量为50%的ⅢA型系列处方中, 脂解30 min时, 处方A1中的油相已被完全消化, 而处方A3和A4仍有部分油相未被消化, 且药物沉淀较多。因各处方中亲水性辅料比例相同且亲水程度类似, 所以推测药物增溶差异主要与胰脂肪酶对表面活性剂的消化作用有关。与A1中表面活性剂Cremophor EL相比, 后两者的表面活性剂Tween 80和Labrasol更容易成为胰脂肪酶的底物, 与油相竞争胰脂肪酶, 导致高含量的油相无法在30 min时被完全消化, 同时油相的蓄积阻碍了脂溶性药物进入水性分散相[8]。并且由于处方A3和A4中的Tween 80及Labrasol更易被胰脂肪酶消化, 导致制剂本身对药物的增溶能力下降。因而, 与处方A1相比, 处方A3和A4的脂解程度更低, 产生了更多的药物沉淀。
4 体外脂解机制研究 4.1 TU在消化介质和各空白水相中的平衡溶解度选择典型处方A1和B1, 进一步探究不同脂质制剂体外消化差异产生的原因。TU在各溶液中的溶解度测定结果见表 5。
| Table 5 Equilibrium solubility of TU at fed or fasted state in digestion buffer pH 7.5, in digestion buffer containing sodium taurodeoxycholate (NaTDC) and phosphatidylcholine (PC), in blank macroemulsion, and in blank aqueous phases obtained from drug-free lipid formulation digestion. n=3, x±s. ***P < 0.001 vs blank macroemulsion |
TU在pH 7.5消化液中完全不溶解, 但在NaTDC/PC溶液中溶解度有所增加, 禁食和非禁食条件下分别约为272和336 μg·mL-1, 说明胆盐和磷脂均为表面活性剂, 可以通过形成胶束增加TU在消化液中的溶解度。禁食条件下溶解度更低, 是因为胆盐和磷脂浓度低于非禁食条件。
在禁食和非禁食条件下, TU在空白粗乳中的溶解度相较于NaTDC/PC溶液中提高5~7倍, 这是因为在表面活性剂胆盐和磷脂的作用下, 通过搅拌乳化油相, 形成乳剂, 脂溶性药物TU增溶在其中。
而在加入胰脂肪酶消化后, TU的溶解度又有显著增加(P < 0.001), 但B1的各溶解度均低于A1。这进一步说明, 油相中的甘油三酯在胰脂肪酶的消化作用下, 产生单甘酯和脂肪酸等消化产物, 与内源性胆盐及磷脂共同作用, 形成混合胶束, 从而增加药物在肠道模拟液中的溶解度, 且油相比例越高, 脂解的消化产物越多, 产生的混合胶束就越多, 对药物的增溶作用就越明显[15], 胰脂肪酶对于脂质制剂的消化作用直接影响药物在体内的吸收。
4.2 脂质制剂脂解过程中的形态变化通过光学显微镜观察(图 4), 可以看出各脂质制剂在脂解过程中出现了多个中间相, 这关系到药物在消化液中的溶解状态, 可能对脂质制剂的脂解速率和程度产生较为重要的影响[16]。脂解实验开始时, 处方A1中可见明显脂滴, 随着胰脂肪酶对脂质制剂的消化, 脂滴粒径有所减小。2 min时, 处方B1在显微镜下可观察到典型的液晶相形态, 即钝锯齿状液滴[17]; A1中未观察到液晶相, 而是出现了黏性各向同性相[18]。10 min时, 在B1中观察到了黏性各向同性相。30 min脂解实验结束时, 各型脂质制剂均已基本消化完毕。

|
Figure 4 The optical micrographs of the different lipid formulations lipolysis in the in vitro lipolysis model at different time points. White arrow: Lipid droplet; Thin black arrow: Liquid crystalline; Thick black arrow: Viscous isotropic. Scale bars (black line in A1 0 min and B1 0 min): 50 μm |
在脂解过程中, 首先出现的是液晶相, 且处方B1中液晶相形成量大于A1, 说明液晶相的形成可能是影响药物释放和分布的重要因素之一。液晶相主要是由脂解模型中的钙离子和脂质制剂消化产生的离子化的脂肪酸组成[17], 脂肪酸附着在脂滴表面, 从而促进液晶相在脂滴表面形成。液晶相在脂解过程中逐渐变厚并最终破裂, 释放出未水解的脂滴[16, 17]。因此液晶相的形成量越多, 维持的时间越长, 则越阻碍脂质制剂的进一步消化。此外, 也有研究表明液晶相的有序结构也可能有引起药物沉淀的倾向[12]。随着脂解实验的进行, 各脂质制剂均出现了黏性各向同性相, 是单层囊泡、多层囊泡和胶束的混合物, 可与药物相互作用, 促进药物增溶[19]。
4.3 脂质制剂脂解过程中的电导率变化在快速消化期, 因为游离脂肪酸的释放, 在短时间内有大量氢氧化钠滴入消化液中, 使得脂质制剂在前几分钟内电导率均快速提升[12], 但处方B1的电导率较A1相比出现了一段先上升后下降再上升的波动过程(图 5), 与光学显微镜下观察到的液晶相出现时间一致, 可以推测这一波动的产生和液晶相的形成有关。进入慢速消化期后, 随着脂质制剂的消化产物和胆盐、磷脂等内源性表面活性剂的共同作用, 电导率缓慢下降趋于稳定。研究表明, 脂滴表面的液晶相聚集有钙离子和离子化的脂肪酸[17], 因此液晶相的形成降低了消化液中离子浓度, 且使得油水接触面的黏度增大, 阻碍了离子运动, 同样使得电导率下降[20]。随着液晶相消失, 脂质制剂继续消化, 氢氧化钠的滴入进一步提高了电导率。进入慢速消化期后, 消化产生的单层囊泡、多层囊泡和胶束等黏性各向同性相增加了溶液的黏度, 使得电导率缓慢下降。而处方A1没有形成液晶相, 所以电导率仅呈现出快速消化期的快速上升和慢速消化期缓慢下降的趋势。脂质制剂在脂解消化过程中的电导率的测定结果进一步证实了液晶相的形成是脂质制剂消化过程中的一个重要环节, 决定了各型脂质制剂的消化情况。
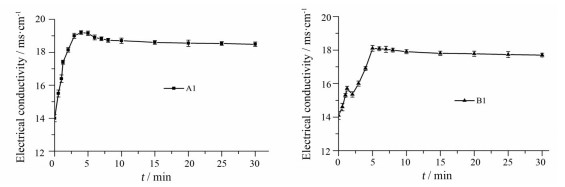
|
Figure 5 The electrical curves of the different lipid formulations in the in vitro digestion period. n=3 |
以十一酸睾酮为模型药物, 蓖麻油为油相, Transcutol HP为助表面活性剂, 分别选择Cremophor EL、Tween 80和Labrasol为水溶性表面活性剂, 制备ⅢA型和ⅢB型脂质制剂, 利用体外脂解模型研究各处方体外脂解过程及机制。结果表明, Ⅲ型脂质制剂体外脂解过程与处方中油相的种类和用量以及表面活性剂的种类和用量有关。因本研究中油相种类已固定, 故主要讨论其他三个因素, 即处方中油相用量、表面活性剂种类和表面活性剂用量。
脂解速率的研究结果表明, 在一定范围内, 由于酶促反应的特点, 因而油相含量高有利于加快脂解; 而表面活性剂含量过高, 可能导致液晶相的形成, 影响制剂的自乳化效率, 减少胰脂肪酶与油相的接触, 降低脂解速率。易被胰脂肪酶消化的表面活性剂, 因更快地暴露出油相, 有利于加快脂解速率。但同时要注意到, 因表面活性剂与油相竞争胰脂肪酶, 也可能导致胰脂肪酶的消耗从而降低脂解速率。因此脂质制剂的脂解速率是上述多因素共同作用的结果。
脂解程度的研究结果表明, 在一定范围内, 油相含量高可以产生更多的消化产物, 有利于药物增溶; 表面活性剂含量高时, 也可很好发挥增溶作用, 但要注意其对胰脂肪酶的竞争作用可能会降低胰脂肪酶对油相的消化, 从而影响脂解程度, 即表面活性剂和油相的含量对脂解程度是互相牵制、彼此权衡的过程。此外, 含有甘油酯结构的表面活性剂会被胰脂肪酶消化, 表面活性剂的种类直接影响脂解程度, 更易被消化的表面活性剂容易丧失对药物的增溶能力。
研究结果提示, Ⅲ型脂质制剂在体内发生了一系列的变化, 其吸收是一个较为复杂的过程, 对于Ⅲ型脂质制剂的开发需要综合考虑合适的油相及表面活性剂的种类与比例, 体外脂解模型可以成为脂质制剂处方开发的有效评价手段。
作者贡献: 王雅蒙和邹丹璐负责文献调研、实验设计、数据分析、文章撰写及文章修改; 李钰负责实验材料准备、数据处理及图表制作; 柯学负责实验设计核实及文章修改。
利益冲突: 作者声明本文无利益冲突。
| [1] |
Zhang Y, Cui T, Li SX, et al. Improving oral absorption of BCS Ⅱ drugs by increasing solubility: frequently overlooked permeability[J]. Acta Pharm Sin (药学学报), 2019, 54: 1-7. |
| [2] |
Beck LW. Intermediates formed during the digestion of trigly-cerides[J]. J Nutrit, 1952, 48: 335-344. |
| [3] |
Carrière F. Impact of gastrointestinal lipolysis on oral lipid-based formulations and bioavailability of lipophilic drugs[J]. Biochimie, 2016, 125: 297-305. DOI:10.1016/j.biochi.2015.11.016 |
| [4] |
Pouton CW. Lipid formulations for oral administration of drugs: non-emulsifying, self-emulsifying and 'self-microemulsifying' drug delivery systems[J]. Eur J Pharm Sci, 2000, 11: S93-S98. DOI:10.1016/S0928-0987(00)00167-6 |
| [5] |
Pouton CW. Formulation of poorly water-soluble drugs for oral administration physicochemical and physiological issues and the lipid formulation classification system[J]. Eur J Pharm Sci, 2006, 29: 278-287. DOI:10.1016/j.ejps.2006.04.016 |
| [6] |
Thomas N, Müllertz A, Graf A, et al. Influence of lipid composition and drug load on the in vitro performance of self-nanoemulsifying drug delivery systems[J]. J Pharm Sci, 2012, 101: 1721-1731. DOI:10.1002/jps.23054 |
| [7] |
Porter CJ, Pouton CW, Cuine JF, et al. Enhancing intestinal drug solubilisation using lipid-based delivery systems[J]. Adv Drug Deliv Rev, 2008, 60: 673-691. DOI:10.1016/j.addr.2007.10.014 |
| [8] |
Liu Y, Yi T, Huan D, et al. Use of an in vitro lipolysis model to evaluate type Ⅰ lipid formulations[J]. Acta Pharm Sin (药学学报), 2010, 45: 1307-1311. |
| [9] |
Christensen JO, Schultz K, Mollgaard B, et al. Solubilisation of poorly water-soluble drugs during in vitro lipolysis of medium-chain and long-chain triacylglycerols[J]. Eur J Pharm Sci, 2004, 23: 287-296. DOI:10.1016/j.ejps.2004.08.003 |
| [10] |
Porter CJH, Kaukonen AM, Taillardat-Bertschinger A, et al. Use of in vitro lipid digestion data to explain the in vivo performance of triglyceride-based oral lipid formulations of poorly water-soluble drugs: studies with halofantrine[J]. J Pharm Sci, 2004, 93: 1110-1121. DOI:10.1002/jps.20039 |
| [11] |
Dahan A, Hoffman A. Rationalizing the selection of oral lipid based drug delivery systems by an in vitro dynamic lipolysis model for improved oral bioavailability of poorly water soluble drugs[J]. J Control Release, 2008, 129: 1-10. DOI:10.1016/j.jconrel.2008.03.021 |
| [12] |
Xiao L, Yi T, Liu Y, et al. The in vitro lipolysis of lipid-based drug delivery systems: a newly identified relationship between drug release and liquid crystalline phase[J]. Biomed Res Int, 2016, 2016: 2364317. |
| [13] |
Cuiné JF, Charman WN, Pouton CW, et al. Increasing the proportional content of surfactant (Cremophor EL) relative to lipid in self-emulsifying lipid-based formulations of danazol reduces oral bioavailability in Beagle dogs[J]. Pharm Res, 2007, 24: 748-757. DOI:10.1007/s11095-006-9194-z |
| [14] |
Cuiné JF, Mcevoy CL, Charman WN, et al. Evaluation of the impact of surfactant digestion on the bioavailability of danazol after oral administration of lipidic self-emulsifying formulations to dogs[J]. J Pharm Sci, 2008, 97: 995-1012. DOI:10.1002/jps.21246 |
| [15] |
Kossena GA, Charman WN, Wilson CG, et al. Low dose lipid formulations: effects on gastric emptying and biliary secretion[J]. Pharm Res, 2007, 24: 2084-2096. DOI:10.1007/s11095-007-9363-8 |
| [16] |
Mullertz A, Fatouros DG, Smith JR, et al. Insights into intermediate phases of human intestinal fluids visualized by atomic force microscopy and cryo-transmission electron microscopy ex vivo[J]. Mol Pharm, 2012, 9: 237-247. DOI:10.1021/mp200286x |
| [17] |
Patton J, Carey M. Watching fat digestion[J]. Science, 1979, 204: 145-148. DOI:10.1126/science.432636 |
| [18] |
Fatouros DG, Walrand I, Bergenstahl B, et al. Colloidal structures in media simulating intestinal fed state conditions with and without lipolysis products[J]. Pharm Res, 2008, 26: 361. |
| [19] |
Fatouros DG, Bergenstahl B, Mullertz A. Morphological observations on a lipid-based drug delivery system during in vitro digestion[J]. Eur J Pharm Sci, 2007, 31: 85-94. DOI:10.1016/j.ejps.2007.02.009 |
| [20] |
Mun S, Decker EA, Park Y, et al. Influence of interfacial composition on in vitro digestibility of emulsified lipids: potential mechanism for chitosan's ability to inhibit fat digestion[J]. Food Biophys, 2006, 1: 21-29. DOI:10.1007/s11483-005-9001-0 |
 2021, Vol. 56
2021, Vol. 56


