理中汤始载于汉代《伤寒论》[1], 由干姜、人参、白术和炙甘草四味中药相伍组成, 具有温中祛寒、益气健脾的功效, 可祛除中焦寒湿, 恢复脾胃阳气, 在中医临床上主要用于脾胃虚寒型慢性胃炎、胃窦炎、溃疡性结肠炎、胃下垂、慢性肝炎等疾病的治疗, 应用历史悠久, 临床疗效显著[2-5]。现代研究表明, 理中汤中姜酚、人参皂苷、甘草酸、白术内酯等主要有效成分具有显著的抗炎、抗氧化、抗肿瘤等药理活性[6-13]。本课题组前期对理中汤的药理活性、药代动力学及作用机制等进行了深入研究, 结果显示: 理中汤可显著增强肠道屏障功能, 具有较强的抗炎作用, 显著改善溃疡性结肠炎模型动物的病理症状。药代动力学研究结果提示: 姜酚、人参皂苷、甘草酸、白术内酯等成分均在30 min内达到最高血药浓度, 药-时曲线呈现快速吸收、缓慢消除的特征, 但各成分药动学参数存在明显的差异性, 推测其原因与各个成分自身结构及其吸收过程密切相关[14, 15]。
吸收是药物产生药效及不良反应的前提和关键, 而肠道是大多数药物吸收的主要场所[16]。肠细胞膜上的多种转运体是影响药物吸收的主要因素, 深入研究中药主要有效成分在体肠吸收过程, 是中药制剂现代化和提高中药口服给药生物利用度的基础。因此, 本研究通过建立大鼠在体单向肠灌流模型[17-23], 以6-姜酚、人参皂苷Rb1、白术内酯-Ⅰ、甘草酸和异甘草素为指标, 分析理中汤提取物中主要有效成分在大鼠不同肠段的吸收特征, 确定其最佳吸收部位, 以期揭示理中汤的肠道吸收机制, 为该方配伍规律的研究及临床合理用药、新剂型开发提供科学依据。
材料与方法仪器 ACQUITY UPLCTM超高效液相色谱仪-Xevo TQ-S电喷雾串联四极杆质谱仪(美国Waters公司); BT01-100蠕动泵(保定兰格恒流泵有限公司); EPED型超纯水器(南京易普易达科技发展有限公司); BT125型电子分析天平(德国赛多利斯科学仪器有限公司); TDL-240B型离心机(上海安亭科学仪器有限公司)。
药品与试剂 6-姜酚(批号SG8180, 纯度≥ 98%)、人参皂苷Rb1 (批号SG8260, 纯度≥ 98%)、白术内酯-Ⅰ (批号SA8650, 纯度≥ 98%)、甘草酸(批号SG8600, 纯度≥ 98%)、异甘草素(批号SI8220, 纯度≥ 98%) 均购自北京索莱宝生物科技有限公司。干姜(批号19040301)、人参(批号190801)、白术(批号190801)、炙甘草(批号1910009) 均购自安徽嘉佑中药饮片有限公司, 经南京中医药大学严辉副教授鉴定为相应药材。乙腈和甲醇均为色谱纯, 购自德国默克公司, 其余试剂均为分析纯。
动物 SPF级雄性SD大鼠, 体重(240 ± 10) g, 由南京青龙山实验动物有限责任公司提供, 合格证号: SCXK2019-0010。动物自然昼夜节律光照, 适应性喂养1周后进行实验。动物福利和实验过程均遵循南京中医药大学动物伦理委员会的规定(批准号: 202009A016)。
Kreb-Ringer's (K-R)缓冲液的配制 参照文献[24]方法配制。K-R缓冲液每1 L含氯化钠7.8 g、氯化钾0.35 g、无水氯化钙0.37 g、碳酸氢钠1.37 g、磷酸二氢钠0.32 g、无水氯化镁0.02 g、无水葡萄糖1.4 g。
理中汤水提物的制备 参照文献[1]方法, 取干姜、人参、白术和炙甘草药材各50 g, 用6倍量水浸泡20 min, 加热回流30 min, 收集滤液; 残渣再用4倍量水加热回流20 min, 收集滤液。合并两次滤液, 用旋转蒸发仪挥去水分浓缩至1.0 g·mL-1。
理中汤提取物供试液的配制 精密移取理中汤提取物适量, 用K-R缓冲液稀释并定容, 配制成质量浓度为90.0 mg·mL-1的理中汤提取物灌流供试液。
对照品和内标溶液制备 精密称取6-姜酚、人参皂苷Rb1、白术内酯-Ⅰ、甘草酸、异甘草素对照品适量, 分别用甲醇溶解, 摇匀, 得质量浓度为1.0 mg·mL-1的单一成分贮备液; 取上述贮备液各适量, 混合, 用K-R缓冲液逐级稀释成系列浓度混合标准溶液, 置-20 ℃冰箱中保存, 备用。
精密称取克拉霉素适量, 用甲醇溶解, 摇匀, 得质量浓度为20 μg·mL-1的内标溶液, 置-20 ℃冰箱中保存, 备用。
空白大鼠肠灌流液的制备 将K-R缓冲液置于37 ℃水浴锅中孵育至恒温后, 按“大鼠在体单向肠灌流实验”方法进行灌流, 收集流出液, 即得。
肠灌流液分析样品的制备 精密移取肠灌流液100 μL, 加入内标40 μL和甲醇1 400 μL, 涡旋混匀, 以13 000 r·min-1离心10 min, 取上清液进样分析。
色谱条件 色谱分离采用ACQUITY UPLC BEH C18 (100 mm×2.1 mm, 1.7 μm) 色谱柱; 流动相为0.1%甲酸水溶液(A)-乙腈(B), 梯度洗脱(0~3 min, 10%~25% B; 3~4 min, 25%~30% B; 4~6 min, 30%~45% B; 6~10 min, 45%~80% B; 10~11 min, 80% B; 11~12 min, 80%~10% B); 流速: 0.4 mL·min-1; 柱温: 30 ℃; 进样量: 2 μL。
质谱条件 采用电喷雾离子源(ESI), 多反应监测(MRM) 模式进行正、负离子同时扫描。离子源温度: 120 ℃; 毛细管电压: 3 kV; 脱溶剂气温度: 350 ℃; 锥孔电压: 30 V; 锥孔气流量: 50 L·h-1; 脱溶剂气流量: 600 L·h-1。用于定量分析的6-姜酚、人参皂苷Rb1、白术内酯-Ⅰ、甘草酸、异甘草素和克拉霉素检测离子对分别为m/z 295.30→177.16、m/z 1 131.95→365.24、m/z 231.14→156.98、m/z 823.68→453.50、m/z 257.20→137.09、m/z 748.59→158.11。
专属性考察 按照上述条件测定大鼠空白肠灌流液、大鼠肠灌流理中汤提取物的灌流样品及大鼠空白灌流液加入指标性成分制备的肠吸收QC样品, 观察和比较空白组、样品组及对照品组中白术内酯-Ⅰ、人参皂苷Rb1、异甘草素、甘草酸、6-姜酚和克拉霉素的色谱行为。
标准曲线及线性范围 移取适量混合对照品溶液, 用K-R缓冲液稀释至不同浓度对照品系列溶液(甘草酸: 4.69~300.00 ng·mL-1, 异甘草素: 21.88~1 400.00 ng·mL-1, 6-姜酚: 15.62~1 000.00 ng·mL-1, 人参皂苷Rb1: 29.69~1 900.00 ng·mL-1, 白术内酯-Ⅰ: 1.88~120.00 ng·mL-1), 按照上述色谱和质谱条件测定, 以各成分浓度(X) 为横坐标, 待测物与内标峰面积的比值(Y) 为纵坐标, 进行回归计算。
精密度和准确度考察 用空白灌流液配制甘草酸(9.38、37.50、225.00 ng·mL-1), 异甘草素(43.75、175.00、1 050.00 ng·mL-1), 6-姜酚(31.25、125.00、750.00 ng·mL-1), 人参皂苷Rb1 (59.38、237.50、1 425.00 ng·mL-1), 白术内酯-Ⅰ (3.75、15.00、90.00 ng·mL-1) 低、中、高3个质量浓度的质控溶液。按照上述色谱和质谱条件对每个质量浓度进行6个样本测定, 考察日内准确度与精密度; 连续测定3天, 考察日间准确度与精密度。精密度以相对标准偏差RSD%来评价, 准确度由相对标准误RE%来评价。
加样回收率实验 精密移取甘草酸、异甘草素、6-姜酚、人参皂苷Rb1和白术内酯-Ⅰ混合对照品溶液, 用空白灌流液配制成高、中、低3个质量浓度的质控溶液, 每1个质量浓度平行3份。按照上述色谱和质谱条件测定, 记录峰面积, 代入回归方程, 计算质量浓度, 将所得质量浓度与实际质量浓度的比值作为方法回收率。
稳定性考察 精密移取甘草酸、异甘草素、6-姜酚、人参皂苷Rb1和白术内酯-Ⅰ混合对照品溶液, 用空白灌流液配制成高、中、低3个质量浓度的质控溶液。置于恒温水浴中, 37 ℃孵育2 h, 分别于0、60和120 min取样, 按照上述色谱和质谱条件测定, 计算指标成分峰面积的RSD。
大鼠在体单向肠灌流实验 取SD大鼠24只, 随机分成4组, 分别为十二指肠、空肠、回肠和结肠不同肠段组, 每组6只。实验前大鼠均禁食、不禁水12 h, 腹腔注射10%水合氯醛(3 mL·kg-1) 进行麻醉后, 固定于37 ℃恒温手术台上, 沿腹部中线剪开腹腔(切口约3~4 cm), 选取需要考察的肠段约10 cm, 于所选肠段两端切口, 插入PEG医用硅胶管, 结扎两端并固定, 与蠕动泵相连接。用浸有生理盐水的脱脂棉覆盖伤口保湿, 采用手术灯照射大鼠腹部保温。将灌流液与生理盐水放置于37 ℃恒温水浴中, 打开蠕动泵, 用生理盐水冲净肠段, 再将生理盐水排空。用空白K-R灌流液以1.0 mL·min-1的流速灌流, 待肠段内全部充满液体时, 将流速降至0.2 mL·min-1, 灌流平衡30 min后开始计时, 于出口端放置已知质量的小瓶, 每隔15 min收集流出液1次, 同时记录供试液小瓶与收集液小瓶的质量, 共收集6份。灌流结束后将大鼠处死, 将灌流的肠段取出, 冲洗干净后剪开, 置于坐标纸上, 测量其长度和内径。
各肠段区间: 十二指肠段自幽门1 cm处开始往下10 cm止; 空肠段自幽门15 cm起往下10 cm止; 回肠段自盲肠上行20 cm开始往下10 cm止; 结肠段从盲肠后端开始往下10 cm止。
吸收参数的计算与数据处理 本实验采用重量法对灌流液流入和流出体积进行校正, 从而消除灌流过程中肠道吸收水分导致灌流液体积变化对结果的影响。精密量取灌入液1.0 mL, 放入已称重的干净玻璃瓶中, 称取液体质量, 按下式(1) 计算灌入液校正密度ρin。从流出液样品中取1.0 mL, 放入已称重的干净玻璃瓶中, 称取液体的质量, 按下式(2) 计算接收液校正密度ρout。按下式(3) 和(4) 分别计算药物吸收速率常数Ka和药物有效渗透系数Peff。
| $ {V_{{\rm{in }}}} = \frac{{{M_{{\rm{in }}}}}}{{{\rho _{{\rm{in }}}}}} $ | (1) |
| $ {V_{{\rm{out }}}} = \frac{{{M_{{\rm{out }}}}}}{{{\rho _{{\rm{out }}}}}} $ | (2) |
| $ {K_{\rm{a}}} = \frac{{{Q_{{\rm{in }}}}\left( {1 - \frac{{{C_{{\rm{out }}}}}}{{{C_{{\rm{in }}}}}} \times \frac{{{V_{{\rm{out }}}}}}{{{V_{{\rm{in }}}}}}} \right)}}{{\pi {r^2}l}} $ | (3) |
| $ {P_{{\rm{eff }}}} = \frac{{ - {Q_{{\rm{in }}}}\ln \left( {\frac{{{C_{{\rm{out }}}}}}{{{C_{{\rm{in }}}}}} \times \frac{{{V_{{\rm{out }}}}}}{{{V_{{\rm{in }}}}}}} \right)}}{{2\pi rl}} $ | (4) |
其中, Min和Mout分别表示一定时间内进出肠道中灌流液的质量(g); Vin和Vout分别为灌入液和收集液的体积(mL); Cin和Cout分别为肠道输入端和输出端灌流液中药物的质量浓度(mg·mL-1); Qin为肠道灌流液灌流速度(0.2 mL·min-1); r和l分别为待考察肠段的内径半径(cm) 和长度(cm)。
采用SPSS 16.0软件对数据进行分析, 各组间数据比较采用单因素方差分析(oneway ANOVA), 结果以x ± s表示, 经最小显著差法(LSD) 进行两两比较, 判据为当P < 0.05时, 结果具有显著性差异。
结果 1 分析方法建立和验证 1.1 专属性考察大鼠空白肠灌流液、大鼠肠灌流理中汤提取物的灌流样品及大鼠空白灌流液加入指标性成分制备的肠吸收QC样品的色谱图见图 1。结果发现6种待测物的保留时间分别为5.08、5.62、6.04、6.37、7.12和6.05 min, 各待测成分的分离度良好, 且肠道内容物中的内源性物质对各指标成分无干扰, 表明本方法的专属性强。
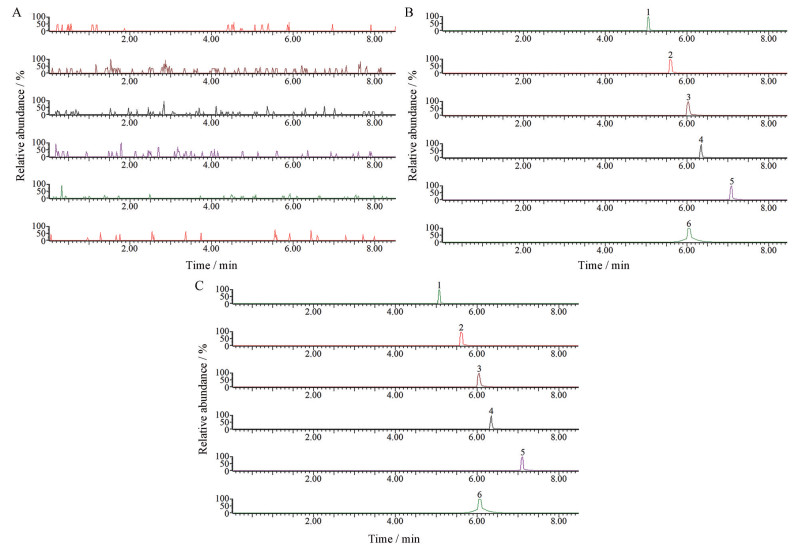
|
Figure 1 Typical MRM chromatograms of each component in intestine perfusate. A: Blank intestine perfusate; B: Intestine perfusate of Lizhong decoction (LZD) extract; C: Perfusate solution spiked with reference substances. 1: Atractylode-Ⅰ; 2: Ginsenoside Rb1; 3: Isoliquiritigenin; 4: Glycyrrhizic acid; 5: 6-Gingerol; 6: Clarithromycin |
理中汤提取物中5个指标成分的标准曲线见表 1, 所有分析物的线性相关系数R2 >0.999 0, 表明各分析物在其相应的浓度范围内具有良好的线性关系。在LLOQ浓度下, 各对照品色谱峰的信噪比(S/N) >10, 准确度RE均在± 10.2%, 精密度RSD均小于9.7%, 表明最低定量限适合本实验的定量检测。
| Table 1 Linear regression data of determined components |
精密度与准确度结果见表 2, 理中汤提取物中5个指标成分高、中、低3个浓度的准确度RE范围为-7.5%~9.5%, 日间及日内精密度RSD均小于7.9%。结果显示所有测量值均在可接受的限值范围内, 表明所建立的方法精密度和准确度良好, 可用于样品的分析。
| Table 2 Precision and accuracy data of determined components |
理中汤提取物中5个指标成分的高、中、低3个浓度的加样回收率在90.00%~106.60%之间, RSD均小于5.0%, 满足测定要求。
1.5 稳定性考察甘草酸、异甘草素、6-姜酚、人参皂苷Rb1和白术内酯-Ⅰ各成分峰面积的RSD分别为2.2%~3.3%、2.2%~5.5%、3.3%~3.6%、3.3%~5.1%和2.9%~4.8%, 提示各指标成分在灌流液中至少可以稳定2 h。
2 活性成分的在体肠吸收特征研究理中汤提取物中各成分在大鼠不同肠段的灌流吸收情况见表 3, 结果显示, 不同成分在不同肠段的吸收存在差异。吸收参数中Ka代表药物吸收的快慢, Peff反映药物在肠道内的渗透能力。甘草酸的Ka依次为: 回肠>十二指肠>空肠>结肠, 其中回肠Ka与结肠存在显著性差异(P < 0.05), 提示甘草酸的主要吸收部位在回肠; 异甘草素和6-姜酚在十二指肠与结肠的Ka值存在显著性差异(P < 0.05), 其中异甘草素的Ka依次为: 结肠>空肠>回肠>十二指肠, 提示异甘草素主要吸收部位在结肠; 6-姜酚的Ka依次为: 十二指肠>回肠>空肠>结肠, 提示6-姜酚主要吸收部位在十二指肠。人参皂苷Rb1和白术内酯-Ⅰ表现出相同的趋势, Ka依次为: 空肠>回肠>十二指肠>结肠, 但在不同肠段的Ka无显著性差异(P >0.05), 提示此两种活性成分在大鼠全肠段均有吸收, 没有特异的吸收部位。一般认为大鼠全肠段的Peff < 1.8×10-4 cm·min-1或Peff > 1.2×10-3 cm·min-1时, 表明药物很难吸收或完全吸收[25]。理中汤主要有效成分Peff值均>1.0×10-3 cm·min-1, 提示各成分在大鼠全肠段的吸收较好。通过比较不同活性成分的吸收参数, 结果表明, 异甘草素与其他各成分之间存在显著性差异(P < 0.05), 且异甘草素的吸收参数大于其他各成分, 吸收顺序依次为: 异甘草素>人参皂苷Rb1 >甘草酸>白术内酯-Ⅰ >6-姜酚。
| Table 3 Absorption parameters of active components from LZD extract in different intestinal segments (n= 6, x ± s. *P < 0.05 vs colon group) |
液质联用技术充分结合了色谱的高分离能力, 质谱的高选择性、高灵敏度及能够提供相对分子质量与结构信息的优点, 近年来在医药领域得到了广泛应用。本实验采用UPLC-TQ-MS技术测定不同肠段灌流液中理中汤提取物5种有效成分的含量, 结果表明: 该方法专属性强, 线性范围宽, 精密度、稳定性良好, 且各成分回收率较高, 可用于探讨理中汤在大鼠肠道中的吸收动力学特征, 以期为后续口服给药研究提供参考。同时, 本实验采用“单向在体肠灌流法”模拟人体给药后体内真实吸收的状态, 能够较好地反映理中汤提取物中主要活性成分在肠道的吸收情况[26-28]; 采用重量法进行灌流液体积的校正, 增加了测定结果的准确性[29]。
理中汤由干姜、人参、白术和炙甘草四味中药相伍组成, 本课题组前期根据2015年版药典要求, 采用HPLC分别测定了四味药材及理中汤水提物中的主要有效成分含量, 结果均符合药典规定, 表明本实验所采用的各药材及理中汤提取物质量均符合药典要求, 从而确保了后续研究结果的可靠与稳定[14]。本实验研究表明, 理中汤主要有效成分在各肠段中均有吸收, 以异甘草素的吸收最佳, 验证了前期药代动力学的实验结果, 异甘草素在体内吸收与消除均较快(tmax为0.33 h, t1/2为2.7 h)[15]。人参皂苷Rb1和白术内酯-Ⅰ在大鼠全肠段吸收不受吸收部位影响, 没有特异的吸收窗口。结合前期药代动力学结果, 发现白术内酯-Ⅰ (t1/2为2.49 h) 远大于人参皂苷Rb1的消除速率(t1/2为17.9 h), 提示白术内酯-Ⅰ可以制成缓释制剂或脂质体来提高其生物利用度[30]。甘草酸的最佳吸收部位为回肠, 推测是由于小肠吸收表面微环境比肠内pH低, 且回肠中有丰富的血流, 吸收面积较十二指肠表面积大等原因所致[31]。甘草酸的药动学结果提示其吸收迅速(tmax为0.08 h), 可能是由于甘草酸被肠道菌群分泌的糖苷酶水解为甘草次酸, 而甘草次酸可迅速吸收入血, 从而发挥药效[32]。6-姜酚的Ka偏低, 但在十二指肠的吸收相对较好, 推测是由于该肠段的绒毛较多, 可将其截留, 延长其滞留时间, 增加吸收量。因此考虑通过设计可以延长6-姜酚在肠道中滞留时间的制剂, 如具有生物勃附性的片剂、胶囊、微球等, 以达到增加其吸收, 提高生物利用度的目的[33]。有研究发现6-姜酚在体内呈现快吸收快消除的特点[34], 结合课题组前期药动学和此次体肠吸收实验, 发现理中汤中6-姜酚的吸收和消除速率均降低(t1/2为36.7 h), 可能由于方剂中不同中药的配伍效应延长了6-姜酚在体内的存留时间。
本实验考察了理中汤提取物中5种主要成分的肠道吸收特性, 以肠吸收谱为切入点, 避免了血清谱复杂的体内分布、代谢过程带来的难题, 且验证了前期药代动力学实验结果, 从肠吸收角度揭示了各成分药动学参数存在差异的原因。研究药物口服后肠道的吸收情况对评价药物的生物利用度、改进药物的剂型、提高疗效具有非常重要的意义[35], 实验结果表明5种成分在全肠段吸收均较好, 提示: 理中汤适于制备缓控释或肠溶制剂从而提高疗效, 为理中汤口服给药剂型的改进和进一步开发提供了一定的科学依据。但本研究也具有一定的局限性: 本实验采用“单向在体肠灌流法”仅评价了肠壁对理中汤提取物中主要活性成分吸收的影响(冲洗了肠道内容物), 未考虑肠道菌群对活性成分肠吸收的作用, 而肠道菌群的代谢作用可能会影响药物的活性, 为了更好地阐明理中汤提取物活性成分的肠吸收机制, 肠道菌群对药物吸收的影响有待进一步研究。
作者贡献: 江曙负责实验设计与构思; 万悦和申雨檬负责实验的实施与论文的撰写; 陈孟君和张智苗参与了动物实验; 万悦、申雨檬和邹俊凤进行了数据处理与分析; 钱大玮负责仪器分析的指导; 段金廒负责研究思路和技术路线的指导。
利益冲突: 本文无任何利益冲突。
| [1] |
Zhang ZJ. Shang Han Lun (伤寒论)[M]. Beijing: People's Medical Publishing House, 2012: 252.
|
| [2] |
Ma SH, Gu SS. Reinterpretation of lizhong decoction from fuyang medicine[J]. Inner Mong J Tradit Chin Med (内蒙古中医药), 2020, 39: 151-152. |
| [3] |
Han YY, Duan YQ, Wang MN, et al. Talking about the nine chapters of "major illnesses to the stomach" thought from the lizhong decoction joint fang group[J]. Hubei J Tradit Chin Med (湖北中医药), 2020, 42: 43-45. |
| [4] |
Fei ZY. Lizhong Decoction Prescription and Clinical Research (理中汤方证和临床研究)[D]. Beijing: Beijing University of Chinese Medicine, 2011.
|
| [5] |
Lv J. Randomized parallel controlled study of lizhong decoction combined with western medicine in the treatment of gastric ulcer (Piwei Xuhan)[J]. J Pract Tradit Chin Med (实用中医内科杂志), 2019, 33: 23-26. |
| [6] |
Farombi EO, Ajayi BO, Adedara IA. 6-Gingerol delays tumorigenesis in benzo[a]pyrene and dextran sulphate sodium-induced colorectal cancer in mice-sciencedirect[J]. Food Chem Toxicol, 2020, 142: 111483. DOI:10.1016/j.fct.2020.111483 |
| [7] |
Han X, Liu P, Liu M, et al. [6]-Gingerol ameliorates ISO-induced myocardial fibrosis by reducing oxidative stress, inflammation, and apoptosis through inhibition of TLR4/MAPKs/NF-κB pathway[J]. Mol Nutr Food Res, 2020, 64: e2000003.. DOI:10.1002/mnfr.202000003 |
| [8] |
Tian M, Ma P, Zhang Y, et al. Ginsenoside Rk3 alleviated DSS-induced ulcerative colitis by protecting colon barrier and inhibiting NLRP3 inflammasome pathway-sciencedirect[J]. Int Immunopharmacol, 2019, 85: 106645. |
| [9] |
Yu HS, Song XB, Ma BP. Advances in the study of derivatization of ginsenosides and their anti-tumor structure-activity relationship[J]. Acta Pharm Sin (药学学报), 2012, 47: 836-843. |
| [10] |
Bailly C. Atractylenolides, essential components of atractylodes-based traditional herbal medicines: antioxidant, anti-inflammatory and anticancer properties[J]. Eur J Pharmacol, 2021, 891: 173735. DOI:10.1016/j.ejphar.2020.173735 |
| [11] |
Wang J, Feng W, Zhang S, et al. Ameliorative effect of atractylodes macrocephala essential oil combined with Panax ginseng total saponins on 5-fluorouracil induced diarrhea is associated with gut microbial modulation[J]. J Ethnopharmacol, 2019, 238: 111887. DOI:10.1016/j.jep.2019.111887 |
| [12] |
Huang M, Li K, Jin SY, et al. Design, synthesis and antiproliferative activity in cancer cells of novel 18β-glycyrrhetinic acid derivatives[J]. Acta Pharm Sin (药学学报), 2015, 50: 1263-1271. |
| [13] |
Man Q, Deng Y, Li P, et al. Licorice ameliorates cisplatin-induced hepatotoxicity through antiapoptosis, antioxidative stress, anti-inflammation, and acceleration of metabolism[J]. Front Pharmacol, 2020, 11: 563750. DOI:10.3389/fphar.2020.563750 |
| [14] |
Shen Y, Zou J, Zhang Z, et al. Protective effects of lizhong decoction on ulcerative colitis mice by suppressing inflammation and ameliorating gut barrier[J]. J Ethnopharmacol, 2020, 259: 112919. DOI:10.1016/j.jep.2020.112919 |
| [15] |
Shen Y, Cui X, Jiang S, et al. Comparative pharmacokinetics of nine major bioactive components in normal and ulcerative colitis rats after oral administration of lizhong decoction extracts by UPLC-TQ-MS/MS[J]. Biomed Chromatogr, 2019, 33: e4521. DOI:10.1002/bmc.4521 |
| [16] |
Zhang SQ, Wang JX. Biopharmaceuticals and Pharmacokinetics (生物药剂学与药代动力学)[M]. Beijing: China Medical Science Press, 2016: 17.
|
| [17] |
Chen Y, Xin R, Wang JY, et al. Multiple analysis of the difference in intestinal absorption between the main components and the extract of Glycyrrhiza uralensis[J]. Acta Pharm Sin (药学学报), 2012, 47: 657-663. |
| [18] |
Guo YY, Sun S, Yang DY, et al. In vivo absorption characteristics of 5 saponins from the extract of Caulophyllum robustum Maxim by one-way perfusion[J]. Res Pract Chin Med (现代中药研究与实践), 2020, 34: 11-17, 22. |
| [19] |
Gou J, Tian YL, Yang DY, et al. Intestinal absorption characteristics of baicalin in huangqin decoction in rats[J]. Drugs Clin (现代药物与临床), 2020, 35: 438-441. |
| [20] |
Bai JQ, Wang PF, Wang XP, et al. Intestinal transit characteristics study of danshen-honghua drug pairs through in vivo single-pass intestinal perfusion rat model[J]. Pharmacol Clin Chin Mater Clin Med (中药药理与临床), 2020, 36: 149-153. |
| [21] |
Dezani TM, Dezani AB, Silva MMC, et al. In situ intestinal perfusion in rodents: future perspectives for application on absorption studies and classification of drugs[J]. Mini Rev Med Chem, 2017, 17: 746-757. DOI:10.2174/1389557516666160921145613 |
| [22] |
Yang H, Hao Q, Cheng J, et al. Exploring the compatibility mechanism of shengdiguang decoction based on the in situ single-pass intestinal perfusion model[J]. Biopharm Drug Dispos, 2020, 41: 44-53. DOI:10.1002/bdd.2211 |
| [23] |
Liu Y, Zhang X, Shi XJ, et al. Applicability analysis and evaluation of aglycones in single-pass intestinal perfusion technique based on PBPK model[J]. China J Chin Mate Med (中国中药杂志), 2019, 44: 3645-3652. |
| [24] |
Wang XY, Lian H, Lu XY, et al. Intestinal absorption of phenolic acids in Rhus chinensis extracts by in situ single-pass perfusion model in rats[J]. China J Chin Mate Med (中国中药杂志), 2019, 44: 2373-2378. |
| [25] |
Xu HJ, Liu YX, Liu XG, et al. Comparison study of baicalin magnesium salt and baicalein on intestinal absorption kinetics[J]. Chin Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 78-83. |
| [26] |
Sun HY, Chen H, Mei CY, et al. Study on intestinal absorption characteristics of 5 active components in ethanol extract from Bletilla striata[J]. Chin Pharm (中国药房), 2019, 30: 757-764. |
| [27] |
Cai LY, Wu LL, Yu XM, et al. The absorption and metabolism of oxymatrine in rat intestine[J]. Acta Pharm Sin (药学学报), 2015, 50: 1336-1341. |
| [28] |
Shi YJ, Wang RL, Zhang YF, et al. Intestinal absorption in situ of diclofenac sodium in rat[J]. Guide Chin Med (中国医药指南), 2019, 15: 4-6. |
| [29] |
He S, Lin MX, Jiang YN, et al. Intestinal absorption model of component of Chinese medicinal: its research progress and reflection[J]. Acta Chin Med Pharm, 2018, 46: 121-124. |
| [30] |
Ma YH, Fang Y, Bao Y, et al. Research progress in lipid-drug conjugates[J]. Acta Pharm Sin (药学学报), 2020, 55: 2281-2290. |
| [31] |
Yu X, Chi SS, Jiao QS, et al. Intestinal absorption of iridoid glycosides in Simiao Yong'an Tang with different compatibility[J]. J Beijing Univ Tradit Chin Med (北京中医药大学学报), 2019, 42: 592-601. |
| [32] |
Wang Y, Jiang JD. A new research mode of drug PK-PD mediated by the gut microbiota: insights into the pharmacokinetics of berberine[J]. Acta Pharm Sin (药学学报), 2018, 53: 659-666. |
| [33] |
Liu QY. Research progress on preparation technologies of improving oral bioavailability of Chinese medicine[J]. Guangzhou Chem Ind (广州化工), 2018, 46: 28-30. |
| [34] |
Geng T, Wu XL, Wang ZW. Research progress of pharmacokinetics study on 6-gingerol, an active component in ginger[J]. J Pharm Res (药学研究), 2017, 36: 231-235. |
| [35] |
Cheng YY. Recent advance in predicting oral bioavailability[J]. Acta Pharm Sin (药学学报), 2006, 41: 917-920. |
 2021, Vol. 56
2021, Vol. 56


